La exploración de las pupilas constituye una parte fundamental de la exploración neurológica. El tamaño y la reactividad a la luz de ambas pupilas deben registrarse de forma individual y periódica, dado que una alteración en estos parámetros puede constituir el único signo detectable de deterioro neurológico en determinados pacientes. Sin embargo, existe una gran variabilidad intra-observadores e inter-observadores al analizar estos parámetros, debido a la influencia de una serie de factores tales como la variabilidad en la luz ambiental, la agudeza visual y experiencia del propio observador, intensidad del estímulo luminoso y el método utilizado para dirigir este estímulo.
En los últimos años las cámaras digitales han incorporado dispositivos de infrarrojos que han permitido desarrollar equipos digitales portátiles y de fácil manejo, que permiten realizar estudios repetidos y no invasivos del tamaño y reactividad pupilar a la luz con un método objetivo, accesible y económico.
DesarrolloEl objetivo de esta revisión es describir los fundamentos de la pupilometría por infrarrojos y discutir sus posibles aplicaciones en la monitorización del paciente neurocrítico. En esta revisión también se incluyen una serie de recomendaciones metodológicas a considerar en la exploración de las pupilas.
ConclusionesLa posibilidad de evaluar los cambios en la reactividad pupilar de forma precoz, objetiva y quasi-continua aporta un nuevo método de monitorización no invasivo que podría mejorar el factor predictivo del deterioro neurológico y monitorizar el estado neurológico a la cabecera del paciente, evitando así exámenes innecesarios y permitiendo intervenciones terapéuticas precoces.
Pupil assessment is a fundamental part of the neurological examination. Size and reactivity to light of each pupil should be recorded periodically since changes in these parameters may represent the only detectable sign of neurological deterioration in some patients. However, there is great intraobserver and interobserver variability in pupil examination due to the influence of many factors, such as the difference in ambient lighting, the visual acuity and experience of the examiner, the intensity of the luminous stimulus, and the method used to direct this stimulus.
In recent years, digital cameras have incorporated infrared devices allowing the development of user-friendly portable devices that permit repeated, non-invasive examinations of pupil size and its reactivity to light with an objective, accessible and inexpensive method.
DevelopmentThe purpose of this review is to describe the fundamentals of infrared pupillometry and discuss potential applications in the monitoring of neurocritical patients. We also present some recommendations in the routine assessment of pupils in neurocritical patients.
ConclusionsThe possibility of evaluating the changes in pupil reactivity in an early, objective and almost continuous way provides a new non-invasive monitoring method. This method could improve the predictive factor of neurological deterioration and the bedside monitoring of the neurological state of the patient, avoiding unnecessary examinations and enabling early therapeutic intervention.
La exploración de las pupilas constituye una parte fundamental de la exploración neurológica. A pesar de los avances tecnológicos y de los cambios sustanciales en el conocimiento de la fisiopatología del sistema nervioso central (SNC), el examen rutinario de las pupilas mediante una fuente de luz convencional no se ha modificado de forma significativa en el último siglo. Este examen incluye el registro del tamaño, la simetría y la reactividad a la luz de ambas pupilas. Sin embargo, existe una gran variabilidad entre observadores al analizar estos parámetros, debido a la influencia de una serie de factores tales como la variabilidad en la luz ambiental, la agudeza visual y la experiencia del propio observador, la intensidad del estímulo luminoso y el método utilizado para dirigir este estímulo.
Para reducir las discrepancias entre observadores se han utilizado diferentes diagramas o esquemas que suelen incluirse en la documentación del paciente. Sin embargo, a pesar de disponer de métodos como la cartilla de Rosenbaum1, la valoración subjetiva del diámetro pupilar puede conducir a errores en la cuantificación del tamaño de las pupilas tanto en personas sanas2 como en pacientes con criterios de muerte cerebral, así como durante el uso de agentes anestésicos3 o en la valoración de la gravedad de un TCE4. Probablemente esto explica por qué el examen de la reactividad pupilar a la luz se considera un marcador en general tardío y poco sensible al deterioro neurológico5. En los pacientes con un TCE grave las guías de práctica clínica de la Brain Trauma Foundation reconocen que la evaluación del tamaño y la reactividad a la luz de las pupilas son elementos pronósticos precoces. Sin embargo, en estas guías también se afirma que: “La evaluación precisa del diámetro pupilar y de su respuesta a la luz no se ha llevado a cabo en pacientes con lesiones cerebrales traumáticas por carecer de procedimientos estandarizados para la misma”3.
En los últimos años las cámaras digitales han incorporado dispositivos de infrarrojos que han permitido desarrollar equipos digitales portátiles y de fácil manejo que permiten realizar estudios repetidos y no invasivos del tamaño y reactividad pupilar a la luz con un método objetivo, accesible y económico. La utilización de estos dispositivos abre un abanico de posibles aplicaciones como predecir el deterioro neurológico (neuroworsening) en ciertos pacientes, estimar la profundidad de la anestesia y monitorizar los efectos de distintos fármacos. Explorar las pupilas mediante estos dispositivos también permite distinguir un síndrome de Horner de una anisocoria fisiológica, obtener nueva información sobre la fisiología y fisiopatología de la respuesta pupilar y objetivar el resultado de las intervenciones terapéuticas a la cabecera del enfermo. En el futuro estos dispositivos podrían ser utilizados como una herramienta adicional en la neuro-monitorización no invasiva en los pacientes neurocríticos6.
El objetivo de esta revisión es describir los fundamentos de la pupilometría por infrarrojos y discutir sus posibles aplicaciones en la monitorización del paciente neurocrítico.
Conceptos básicos y fisiopatología de la respuesta pupilarEl tamaño pupilar y su respuesta a la luz (reflejo fotomotor) han sido tradicionalmente utilizados como un parámetro clínico válido para detectar herniaciones cerebrales y, en especial, la herniación transtentorial central y del uncus del hipocampo. En este contexto, las alteraciones pupilares actuarían como un signo localizador de procesos expansivos y como un indicador pronóstico en patología cerebral aguda y en situaciones de resucitación cardiorrespiratoria3,7–14. Por otra parte, la respuesta pupilar constituye el signo clínico más importante para diferenciar una situación de coma de origen estructural o metabólico, de aquí la importancia de realizar la valoración de las pupilas de forma correcta.
De la aplicación de un estímulo luminoso convencional a la pupilometría por infrarrojosLa manera estandarizada de explorar las pupilas supone su exposición a una fuente de luz de intensidad suficiente como para registrar su situación basal y desencadenar el reflejo fotomotor directo y una respuesta consensuada15. Cuando las pupilas se exploran en un paciente neurocrítico en coma debe recordarse que su respuesta a la luz suele ser más lenta y algo inferior a la respuesta normal. Por ello, las pupilas deberían explorarse en una situación de luz ambiental reducida y aplicando una fuente de luz adecuada (por ejemplo una luz alógena). La exposición a la luz debe prolongarse al menos 10 segundos, manteniendo los dos ojos del paciente abiertos. En casos difíciles se recomienda el uso del oftalmoscopio con una lente de aumento, que permite observar las pupilas bajo magnificación. Sin embargo, en algunos casos la respuesta pupilar sigue siendo difícil de etiquetar, lo que explica la necesidad de utilizar sistemas alternativos que permitan una exploración pupilar más objetiva.
En el año 1800 el científico alemán Frederick William Herschel descubrió los llamados “rayos caloríficos” mientras trabajaba con prismas de cristal. Los rayos caloríficos de Herschel son conocidos hoy como “rayos infrarrojos”. La radiación electromagnética infrarroja tiene una longitud de onda mayor que la de la luz visible (380nm - 780nm), pero inferior a la de las ondas de radio. El nombre de infrarrojos procede del latín infra- (por debajo) y de rojo, que es el espectro de la luz visible. Desde su descripción inicial, y especialmente a partir de la Segunda Guerra Mundial, los avances en esta área siguieron un ritmo vertiginoso. Las aplicaciones militares de las propiedades de luz infrarroja fueron un elemento clave para impulsar su desarrollo, ya que permitían crear sistemas de visión nocturna que emitían haces de luz de bajísimo poder lumínico, es decir, no visibles, que luego se trasformaban en rayos catódicos, permitiendo así reconstruir la imagen en una pantalla.
La aplicación de esta tecnología en la valoración pupilar data de la década de 1950. En 1958, Lowenstein y Loewenfeld publicaron el primer estudio donde describían una cámara por infrarrojos que permitía obtener imágenes pupilares, resaltando la posibilidad de utilizarla para investigaciones farmacológicas y fisiológicas, así como un método de cribaje masivo16. En la actualidad las aplicaciones clínicas de la pupilometría por infrarrojos (PI) son amplias, abarcando desde áreas de investigación en oftalmología (medición del diámetro pupilar en cirugía refractiva, valoración de la función visual) hasta su aplicación en la medicina del sueño, en el estudio de las propiedades de distintos fármacos sobre el sistema nervioso autónomo, en la evaluación de las neuropatías autonómicas17–19 y, recientemente, en la evaluación de pacientes neurocríticos20–23.
Alteraciones del reflejo fotomotor y origen de la dilatación pupilar patológicaEl III par craneal está íntimamente relacionado con las áreas del tronco cerebral que controlan la conciencia y con la parte medial del lóbulo temporal (uncus del hipocampo). Por tanto, una lesión a nivel del mesencefálico o de las fibras eferentes que forman el tercer par craneal por compresión del lóbulo temporal o por estructuras adyacentes produce una dilatación pupilar, habitualmente ipsilateral a la lesión. No obstante, existen casos documentados de dilatación paradójica de la pupila contralateral, constituyendo un falso signo localizador24–26. Cuando la compresión del III par es significativa, la pupila perderá primero su reactividad a la luz de forma parcial o completa y, posteriormente, se dilatará. Sin embargo no debemos olvidar que la pérdida de la respuesta pupilar a la luz no siempre está mediada por mecanismos compresivos sobre el III par y que la hipoperfusión de las estructuras del tronco del encéfalo puede provocar también este tipo de alteraciones27.
Esta progresión estereotipada de la alteración del tamaño pupilar y su reactividad a la luz permiten asumir que la detección precoz de estas anomalías es un parámetro clínico muy importante para valorar la evolución del paciente neurocrítico10,11,28. Teóricamente, la pérdida de la reactividad a la luz puede indicar un compromiso del II o del III par craneal. En este último caso sería el primer signo de compresión de estructuras vitales. Su detección precoz como signo de deterioro neurológico (neuroworsening) puede ser de gran ayuda para disminuir el intervalo de tiempo en que se inicia la compresión y aparece la lesión cerebral irreversible, lo que podría facilitar las maniobras terapéuticas y asociarse a una mejor evolución clínica29.
Efectos de los fármacos y ciertas maniobras terapéuticas sobre la función pupilarEn los pacientes neurocríticos que permanecen sedados y bajo los efectos de múltiples fármacos es primordial considerar los efectos que causan estos fármacos sobre la respuesta pupilar. Por ejemplo, los fármacos que bloquean los receptores muscarínicos en el iris, como la atropina, provocan un aumento en la latencia de la respuesta y reducen la amplitud de la contracción, mientras que los fármacos que reducen los impulsos del sistema nervioso simpático (como la clonidina) disminuyen la velocidad de relajación del esfínter pupilar25,30,31. Sin embargo, para muchas sustancias de uso habitual en estos pacientes es difícil establecer qué brazo del sistema nervioso autónomo es el más afectado. Consideraremos en esta revisión los fármacos, condiciones clínicas o aquellas maniobras terapéuticas que se aplican con más frecuencia en los pacientes neurocríticos y que pueden alterar el tamaño y la respuesta pupilar.
HipotermiaLarson et al, utilizando un pupilómetro por infrarrojos, evaluaron la respuesta pupilar en pacientes sometidos a hipotermia moderada (32,2±0,5°C) con y sin el uso de anestesia general con isoflurano. Sus observaciones confirmaron que la hipotermia moderada no altera el reflejo pupilar, mientras que el uso de anestésicos deprime la respuesta pupilar de forma dosis-dependiente, hasta en un 80%32. Sin embargo, la hipotermia profunda (< 28°C) puede ocasionar abolición completa de los reflejos pupilares y del tronco cerebral6,15,33–36.
HipertermiaLa hipertermia inducida en voluntarios sanos, asociada o no al uso de anestésicos inhalatorios (isofluorano, enfluorano y óxido nítrico), aumenta de forma significativa el diámetro pupilar y el porcentaje de contracción (variación entre el diámetro máximo y el diámetro mínimo), revirtiendo parcialmente la inhibición del reflejo fotomotor inducida por los anestésicos. Los tres anestésicos inhalatorios utilizados por estos investigadores disminuyeron ambos parámetros en forma significativa, pero no produjeron una abolición del reflejo fotomotor a las dosis utilizadas en la práctica clínica habitual37.
Relajantes muscularesGray et al evaluaron el efecto del vecuronio y pancuronio sobre la respuesta pupilar con dosis que provocaban bloqueo completo de la respuesta muscular a la estimulación periférica y no observaron cambios en la respuesta pupilar de los pacientes, valorada por pupilometría32.
Barbitúricos y benzodiacepinasLowenstein et al demostraron que las dosis elevadas de barbitúricos para el tratamiento del estatus epiléptico producen abolición completa de los reflejos de tronco cerebral a excepción del reflejo fotomotor38, aunque se han descrito casos de ausencia de reflejos pupilares simulando muerte encefálica39,40. En un estudio reciente Taylor et al observaron, utilizando PI, que el uso de barbitúricos producía una alteración de los parámetros de función pupilar hasta rangos considerados patológicos cuando se alcanzaba el patrón de salvas de supresión en el electroencefalograma22. El uso de propofol y midazolam, sin bien reducían la respuesta pupilar de forma significativa, no alcanzaban rangos considerados patológicos o sólo constituían alteraciones transitorias. De acuerdo con nuestra experiencia, el aumento de tamaño pupilar y la reducción de la respuesta de las pupilas al estímulo lumínico se aprecian con gran frecuencia en los pacientes en los que se administran barbitúricos como tratamiento de la hipertensión intracraneal.
Fármacos vasoactivosLa dopamina (agonista α-1 adrenérgico) administrada a altas dosis puede ocasionar una midriasis no reactiva durante la anestesia general41. En pacientes con feocromocitoma se han observado respuestas pupilares anómalas, que simulan la muerte cerebral, probablemente por una hiperestimulación adrenérgica del iris42.
Fármacos antidepresivosLos efectos de los antidepresivos tricíclicos sobre la cinética del reflejo pupilar han sido motivo de interés por parte de algunos investigadores. Es conocido que la mayoría de estos fármacos afectan tanto la respuesta simpática como la parasimpática. El efecto más común de los antidepresivos tricíclicos es potenciar el efecto simpático por bloqueo de la recaptación de noradrenalina en la sinapsis (receptores α-2), e inhibir el efecto parasimpático por bloqueo muscarínico postsináptico43. Se ha observado que el uso de dosis terapéuticas de desipramina y reboxetina prolonga los tiempos de latencia, reduce la amplitud de la contracción y reduce el tiempo de relajación pupilar43.
Podemos concluir, a modo de resumen, que los fármacos que con mayor frecuencia provocan una alteración de la respuesta pupilar y un aumento de tamaño de las pupilas, y que incluso pueden simular signos de muerte cerebral, son principalmente los barbitúricos, los antidepresivos tricíclicos a dosis elevadas y la hipotermia profunda (< 28°)41,44–48.
Definiciones y recomendaciones metodológicas para evaluar el reflejo fotomotorTanto en el paciente neurológico como en el neurocrítico, en el que la evaluación del tamaño pupilar y del reflejo fotomotor forman parte de la rutina asistencial diaria, es importante estandarizar la valoración del tamaño de las pupilas y su respuesta a la luz, para permitir una correcta evaluación y la comparación de resultados en la literatura. Las normas más claras han sido establecidas recientemente por las guías de práctica clínica para el manejo del paciente con un TCE publicadas por la Brain Trauma Foundation (BTF). Las definiciones y recomendaciones de la BTF para el examen pupilar son las siguientes3:
- 1.
La valoración pupilar debe realizarse siempre después de la reanimación cardiopulmonar.
- 2.
Antes de valorar las pupilas debería corregirse la hipotensión, la hipoxia y excluir la existencia de un trauma ocular directo.
- 3.
Deben revalorarse las pupilas después de la evacuación quirúrgica de hematomas intracraneales.
- 4.
El reflejo fotomotor en cada ojo debería ser usado como factor pronóstico, ya que su ausencia en forma bilateral tiene un valor predictivo positivo superior al 70% (evidencia clase I) como indicador de mal resultado neurológico (muerte, estado vegetativo o grave incapacidad).
- 5.
Una pupila midriática se define como aquella con un diámetro superior a 4mm.
- 6.
Una pupila fija o arreactiva se define como aquella que no presenta respuesta constrictora a la luz brillante.
- 7.
Debe documentarse la lateralidad en caso de pupilas anormales.
- 8.
La anisocoria patológica se define como una asimetría pupilar > 1mm.
Hay que destacar que las definiciones de pupila arreactiva y de anisocoria patológica se basan en la observación directa de la pupila y del reflejo fotomotor, y que por tanto podrían verse modificadas con la introducción de valoraciones automatizadas como la que se discute en esta revisión. En un estudio reciente dirigido a establecer un normograma de la respuesta pupilar en la edad pediátrica mediante el uso de un pupilómetro automatizado, los autores han objetivado que en la mayoría de los niños existe una asimetría pupilar de base, aunque esta no sobrepasa los 0,5mm49. La utilización de equipos automatizados permitiría además incluir otros parámetros en la exploración pupilar que no pueden ser apreciados mediante la observación directa:
Tiempo de latencia pupilar se define como el tiempo transcurrido desde la presentación del estímulo luminoso a la pupila y el inicio de la contracción del iris y se expresa en milisegundos.
Velocidad de contracción pupilar: es el número de milímetros de reducción del diámetro pupilar en función del tiempo transcurrido, desde el diámetro pupilar máximo hasta que la pupila alcanza su diámetro mínimo.
Amplitud de la contracción pupilar: se define como la variación entre el diámetro pupilar máximo preestímulo y el diámetro pupilar mínimo postestímulo luminoso.Velocidad de relajación pupilar: es la recuperación del diámetro pupilar basal en función del tiempo. También se cuantifica en milímetros por segundo.
Porcentaje de reducción del diámetro pupilar: se define como la variación porcentual en el diámetro pupilar tras la estimulación lumínica.
Cabe recordar que el tiempo de latencia y la amplitud de la contracción pupilar están determinados por la actividad del sistema nervioso parasimpático, mientras que la velocidad de relajación está determinada por el sistema nervioso simpático. Además, las velocidades de contracción y relajación pupilar también dependen del diámetro inicial de las pupilas49.
Exploración pupilar mediante el pupilómetro NeurOpticsTM ForSiteTodos los equipos de pupilometría desarrollados hasta el momento funcionan siguiendo los mismos principios básicos. Estos equipos están dotados de: a) una fuente de luz integrada e intensa para estimular la pupila; b) un sistema de captura de imágenes con cámara digital que funciona con tecnología de infrarrojos, lo que permite obtener un registro de la pupila durante todo el ciclo de exploración (diámetro pupilar en estado de reposo, durante la estimulación lumínica y al finalizar el estímulo), sin interferir en la respuesta pupilar al carecer de poder lumínico; y c) un procesador de datos para realizar los cálculos.
En el mercado podemos encontrar diferentes marcas de pupilómetros (Colvard, Procyon, Neuroptics…), estando dedicados la mayoría de ellos al campo de la oftalmología. El único pupilómetro portátil diseñado de forma específica para su uso en la valoración pupilar de pacientes neurocríticos (entre otras utilidades) es el pupilómetro de NeurOptics.
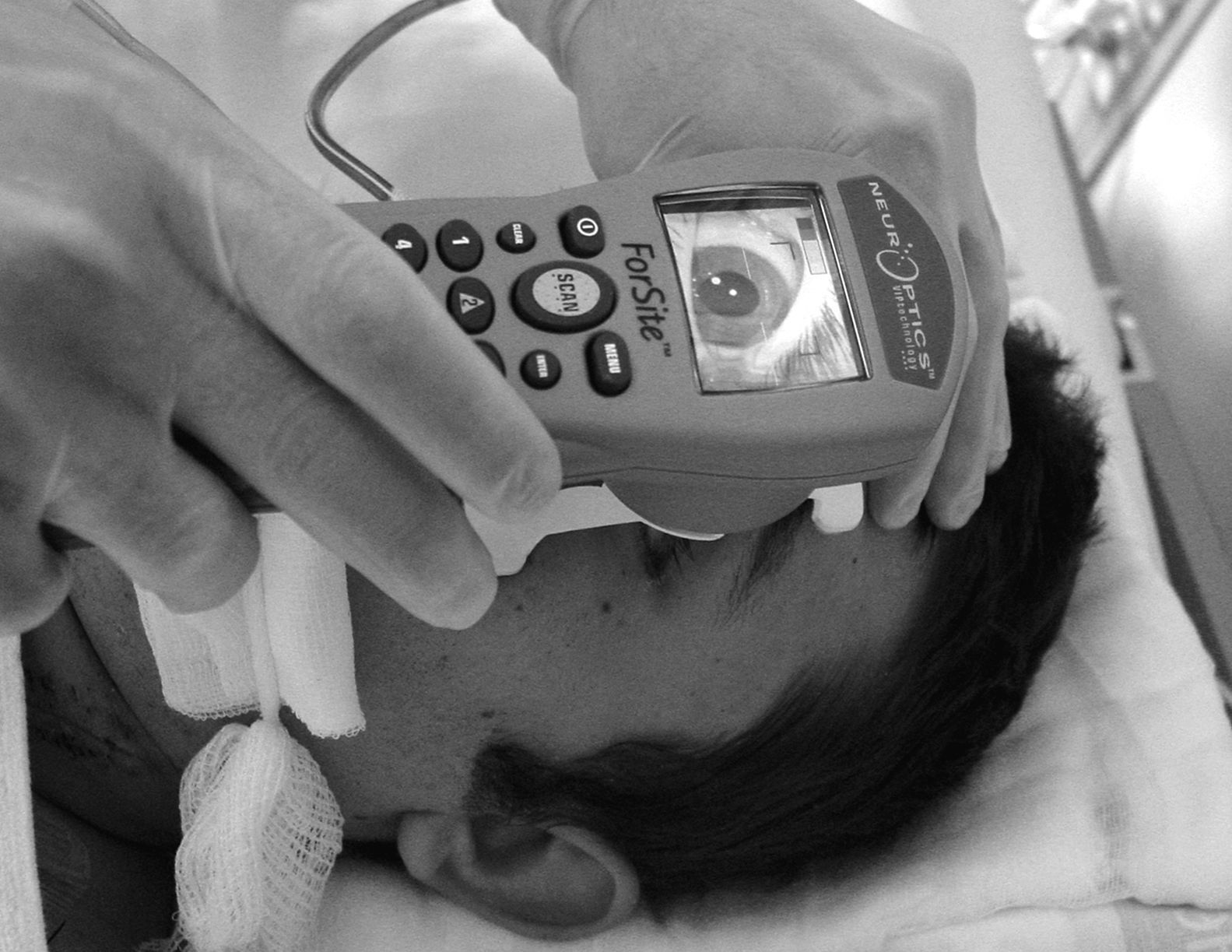
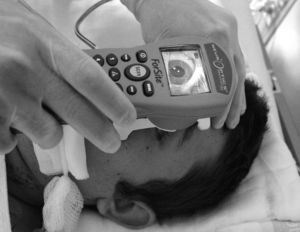
El pupilómetro NeurOpticsTM Forsite (NeurOptics Inc. Irvine, CA) es un instrumento portátil, alimentado por una batería recargable (fig. 1). El equipo consta de: a) un microprocesador incorporado, con pantalla color LCD en la cual se visualizan las mediciones realizadas tanto en forma gráfica como numérica; b) un teclado para la introducción de datos tales como la identificación del paciente, el uso de fármacos, los valores de presión intracraneal, etc.; c) una fuente de luz que emite un estímulo estandarizado y d) un sistema de captura de imágenes con cámara digital con tecnología de infrarrojos, lo cual permite obtener datos en entornos muy diferentes de luz ambiente, desde oscuridad total a luz brillante.
Además dispone de un reposacabezas desmontable, que permite colocar correctamente el pupilómetro delante del ojo del paciente durante el proceso de medición.
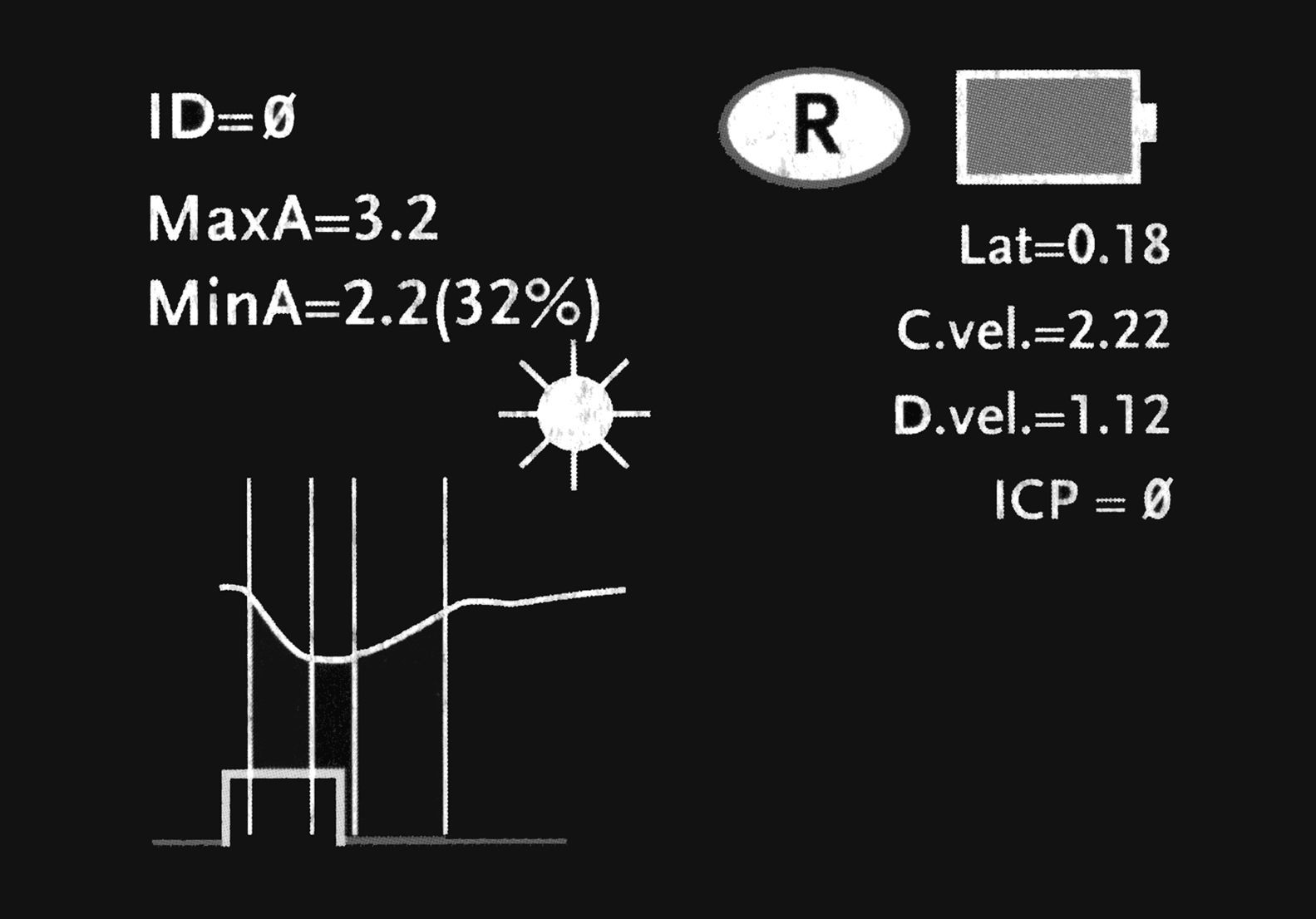
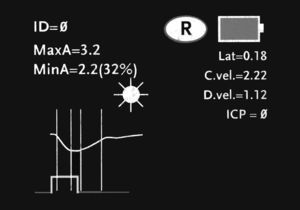
La secuencia de exploración del reflejo fotomotor con este sistema consta de tres pasos automatizados: a) una fase de búsqueda del objetivo que dura 3 segundos; esta se inicia tras posicionar el pupilómetro delante del ojo del paciente y presionar el botón de escaneado. Durante esta fase aparece en la pantalla una imagen de vídeo del ojo a explorar, lo que permite al operador el centrado correcto de la pupila; b) cuando el equipo detecta correctamente la imagen se inicia una fase de adquisición de imágenes que dura tres segundos, durante la cual se emite un estímulo luminoso en forma automática, de intensidad y duración fijas (0,8 segundos). Simultáneamente la cámara digital por infrarrojos registra imágenes de la pupila y, finalmente, c) una fase de análisis de 8 a 10 segundos, durante la cual todas las imágenes obtenidas de la pupila (39 imágenes por segundo) se analizan secuencialmente y la información recogida aparece representada en la pantalla del equipo, tanto de forma gráfica como numérica (fig. 2). El único contacto del sistema con el paciente se establece a través de un elemento de apoyo desechable que se coloca a una distancia que permite sostener correctamente el equipo durante la exploración (fig. 3).
Las variables que mide el equipo son el diámetro de apertura pupilar máxima en milímetros (basal o preestímulo); el diámetro de apertura pupilar mínima en milímetros (postestímulo); el porcentaje de variación entre ambas; el tiempo de latencia en milisegundos; la velocidad de constricción en milímetros por segundo y la velocidad de dilatación en milímetros por segundo. Estas fases se describen en el paciente que presentamos como caso ilustrativo. Todos los datos almacenados pueden ser enviados a través de un puerto de comunicaciones de infrarrojos a una impresora térmica, lo que permite guardar los registros gráficos para su posterior análisis20.
Limitaciones del pupilómetro NeurOpticsTM ForsiteEl método de NeurOptics™ es monocular, por lo que no tiene en cuenta la respuesta consensual, pudiendo pasar desapercibido un defecto pupilar aferente, como puede ocurrir en algunas lesiones del nervio óptico en pacientes con un TCE.
Otra limitación de este pupilómetro es que no es de utilidad en pacientes que hayan sufrido un traumatismo ocular o tengan antecedentes de cirugía o dismorfia del iris.
Aplicación de la pupilometría en la valoración del paciente neurocríticoLas aplicaciones clínicas de la pupilometría por infrarrojos han sido exploradas principalmente en el campo de la oftalmología, aportando datos relevantes en la evaluación de la cirugía refractiva, en estudios de sueño y en la valoración del efecto de distintos fármacos sobre el sistema nervioso central. También se ha utilizado para medir objetivamente la respuesta emocional en los desórdenes psiquiátricos y para establecer la respuesta autonómica en pacientes con neuropatía diabética19. Como herramienta de monitorización no invasiva en el paciente neurocrítico existen pocos estudios que, aunque preliminares, presentan unos resultados interesantes y alentadores20–22.
En 1995 Larson et al describen el análisis pupilométrico de una serie de pacientes con ausencia de reflejo pupilar a la observación directa, y concluyen que la pupilometría infrarroja puede revelar la presencia de compromiso mesencefálico, que de otro modo hubiera pasado desapercibido en pacientes paralizados farmacológicamente, al quedar abolidos en estas circunstancias las respuestas motoras de los restantes reflejos de tronco cerebral20. Posteriormente el mismo grupo evaluó la respuesta pupilar en tres pacientes con herniación del uncus del hipocampo establecida por TC cerebral y destacaron dos puntos de interés21. El primero es la preservación de la respuesta pupilar con el uso de opioides y el segundo el hecho de que la arreflexia pupilar puede ser intermitente durante la herniación uncal, explicando así algunas de las diferencias interobservador que a veces se han observado. Estos autores concluyen que la pupilometría podría ser un método de cribaje de bajo coste con respecto a la TC cerebral en el manejo de los pacientes con un TCE en su evaluación continua y en la detección precoz de herniaciones cerebrales21.
Sin embargo, en nuestra opinión, el estudio más importante hasta el momento es el de Taylor et al22. Estos autores realizaron mediciones pupilométricas en voluntarios sanos y en pacientes con un TCE y hemorragia subaracnoidea espontánea, haciendo algunas observaciones preliminares sobre las respuestas pupilares en condiciones variables de luz ambiental, uso concomitante de fármacos que podrían afectar la respuesta pupilar y valores de presión intracraneal (PIC). Además, compararon en un subgrupo de pacientes la valoración pupilar realizada por enfermería con la valoración realizada por pupilometría. Algunos de sus resultados se comentan a continuación22:
- 1.
Velocidad de contracción pupilar: según estos autores una reducción en las velocidades de contracción pupilar por debajo de 0,8mm/s se asocia a un incremento de la PIC. Estos valores son poco frecuentes en personas sanas. En su estudio los valores inferiores a 0,8mm/s fueron sólo del 1,35% de las mediciones en voluntarios sanos y las velocidades de contracción menores a 0,6mm/s se detectaron en sólo el 0,32% de los voluntarios. Sin embargo, en pacientes con un TCE y desviación de la línea media superior a 3mm en la TC cerebral observaron que las velocidades de contracción disminuyeron a valores menores de 0,6mm/s en el 53% de las mediciones cuando la PIC superó los 20 mmHg. En pacientes con un swelling cerebral difuso y sin desviación de la línea media, la velocidad de contracción pupilar no se alteró hasta que los valores de PIC fueron superiores a los 24 mmHg.
- 2.
Porcentaje de reducción del diámetro pupilar: los porcentajes de reducción del diámetro pupilar menores al 10% son excepcionales en personas sanas. En la serie de Taylor et al sólo se encontraron en el 0,04% de las mediciones. Lo mismo ocurre en pacientes con TCE y valores de PIC por debajo de 20 mmHg, en los cuales el valor medio obtenido fue superior al 15%. Sin embargo, en aquellos grupos de pacientes en los que los valores de PIC fueron mayores de 20 mmHg fue más frecuente observar porcentajes de reducción del diámetro pupilar menores del 10%.
- 3.
Latencia de la respuesta pupilar: la latencia está directamente relacionada con la edad, y raramente se prolonga por encima de valores mayores de 360ms cuando la PIC supera los 30 mmHg, por tanto sería un parámetro de escaso valor predictivo en el reconocimiento del deterioro neurológico.
- 4.
Simetría pupilar: una asimetría pupilar menor de 0,5mm es frecuente en voluntarios sanos y en pacientes sin patología intracraneal49,22, hecho que lleva a asumir que esta diferencia puede considerarse dentro de los límites de la normalidad. Sin embargo, en pacientes con patología intracraneal con lesiones focales y efecto de masa se encontraron asimetrías pupilares mayores de 0,5mm en un 81% de las mediciones cuando existía un incremento en los valores de PIC por encima de los 30 mmHg22. En el estudio comparativo con los resultados de enfermería, utilizando métodos convencionales, esta circunstancia sólo fue detectada en el 22% de los casos22.
- 5.
Pupilometría y fármacos: en el estudio de Taylor et al22 los resultados obtenidos en los parámetros pupilares con la administración de fármacos de uso habitual en las UCI confirman que el uso de barbitúricos a dosis elevadas, con las cuales se consigue aplanamiento del electroencefalograma (EEG) o patrón de “salvas de supresión” (paroxismo-supresión), afectan la respuesta pupilar de manera acentuada, provocando valores patológicos tanto en las velocidades de contracción (menores de 0,6mm/s) como en el porcentaje de variación del diámetro pupilar después de la estimulación lumínica (menor del 10%), aun cuando los valores de PIC son normales. El uso de morfina y midazolam combinados sólo afecta la respuesta pupilar de forma transitoria.
De este modo, del estudio de Taylor et al pueden obtenerse varias conclusiones. Quizás la más importante sea que la respuesta pupilar es consistentemente simétrica en personas sanas, por lo que mínimos cambios en la respuesta pupilar deben alertar al clínico sobre un posible deterioro. El porcentaje de reducción del diámetro pupilar después de la estimulación (<10%) puede ser considerado un criterio absoluto de compresión de tronco del encéfalo o del tercer par craneal, aun con valores de PIC normales. En presencia de swelling cerebral difuso bilateral las alteraciones de la respuesta pupilar ocurren con valores de PIC mayores de 30 mmHg, coincidiendo con observaciones previas que indican que la compresión del tronco y/o del tercer par craneal ocurre con valores más altos de PIC en estos pacientes que en aquellos que presentan una desviación de la línea media27. La posibilidad de estudiar en forma quasi-continua la dinámica pupilar y su relación con los procesos que provocan herniaciones cerebrales podría ayudarnos a predecir el deterioro neurológico8.
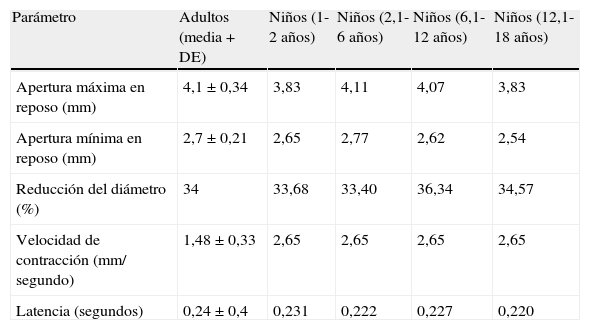
En la tabla 1 se reproducen los valores “normales” obtenidos por Taylor et al en 310 voluntarios sanos, utilizando PI22. Esta tabla también incluye los valores obtenidos por Boev et al en una serie de 90 niños sin patología neurológica ni oftalmológica49.
Valores pupilares normales
| Parámetro | Adultos (media+DE) | Niños (1-2 años) | Niños (2,1-6 años) | Niños (6,1-12 años) | Niños (12,1-18 años) |
| Apertura máxima en reposo (mm) | 4,1±0,34 | 3,83 | 4,11 | 4,07 | 3,83 |
| Apertura mínima en reposo (mm) | 2,7±0,21 | 2,65 | 2,77 | 2,62 | 2,54 |
| Reducción del diámetro (%) | 34 | 33,68 | 33,40 | 36,34 | 34,57 |
| Velocidad de contracción (mm/ segundo) | 1,48±0,33 | 2,65 | 2,65 | 2,65 | 2,65 |
| Latencia (segundos) | 0,24±0,4 | 0,231 | 0,222 | 0,227 | 0,220 |
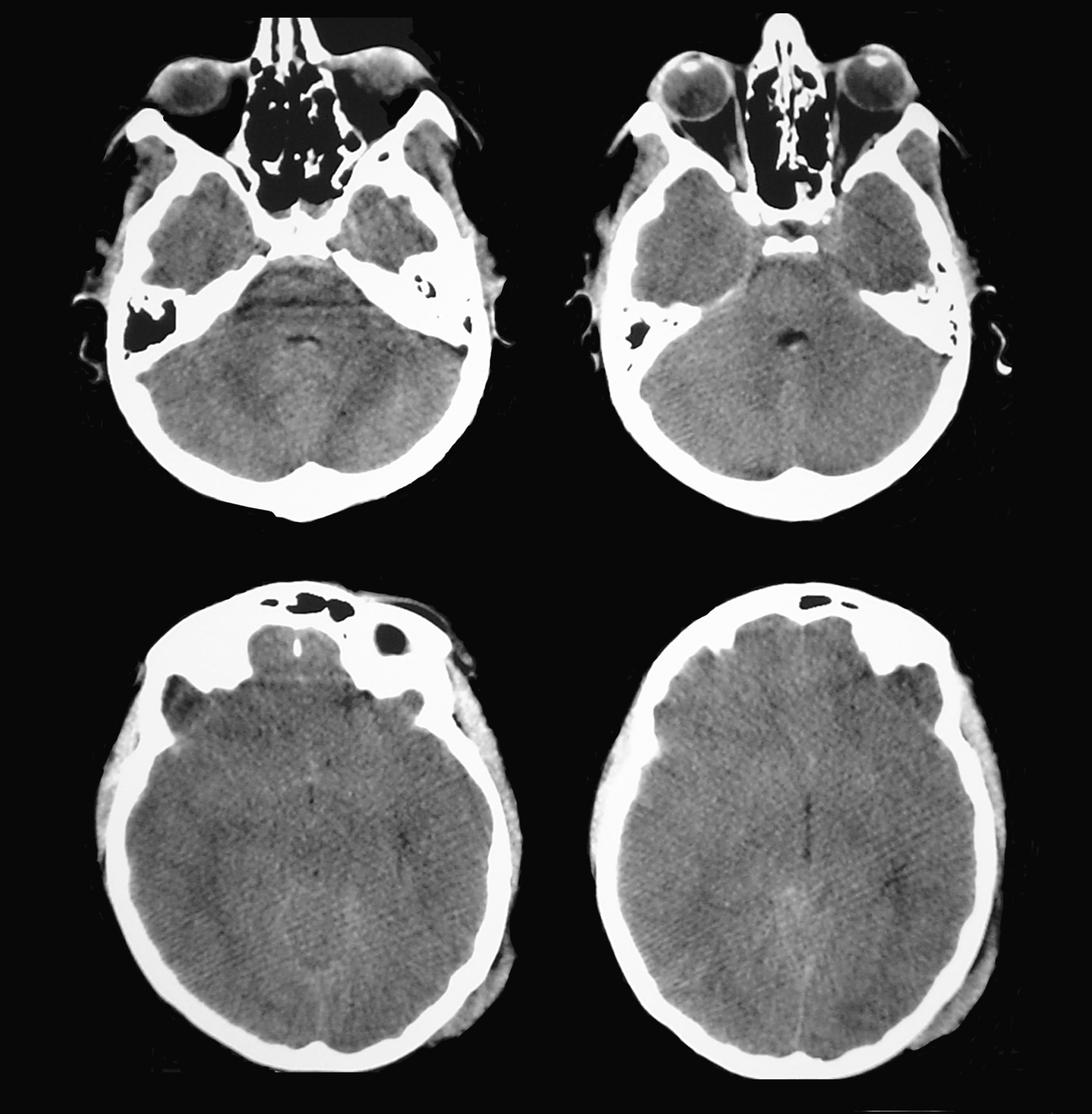
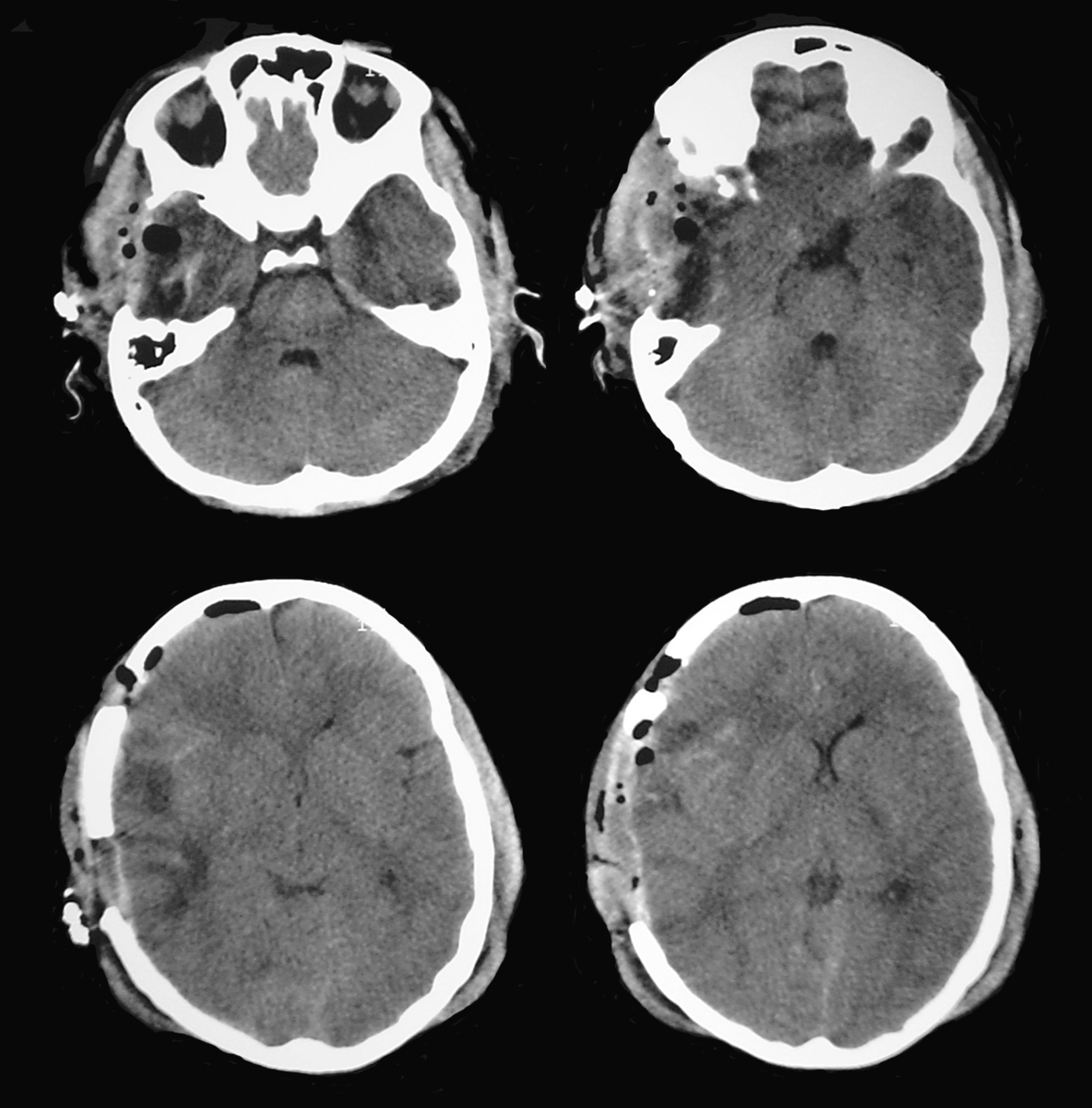
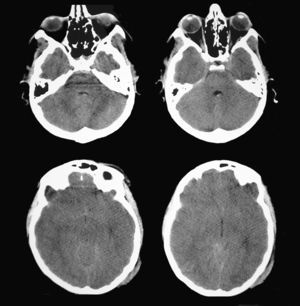
Paciente de 16 años de edad, sin antecedentes patológicos de interés que ingresó en la UCI de Neurotraumatología de nuestro centro después de presentar un TCE grave (puntuación de 8 en la escala de coma de Glasgow) como consecuencia de un accidente de moto. La TC cerebral a su ingreso mostró una contusión temporal derecha de 15 cc de volumen con la línea media centrada (fig. 4). El registro continuo de PIC mostró unos valores iniciales dentro del rango de la normalidad (inferiores a 15 mmHg), que se mantuvieron durante las primeras 24 horas de su ingreso. Al segundo día del ingreso, y manteniendo siempre valores de PIC en rangos normales, se detectó una anisocoria a la inspección pupilar directa, con una pupila izquierda de 4mm y pupila derecha de 2,6mm, ambas reactivas a la luz. Se interpretó que la pupila de mayor tamaño era la patológica, lo que motivó repetir la TC cerebral.
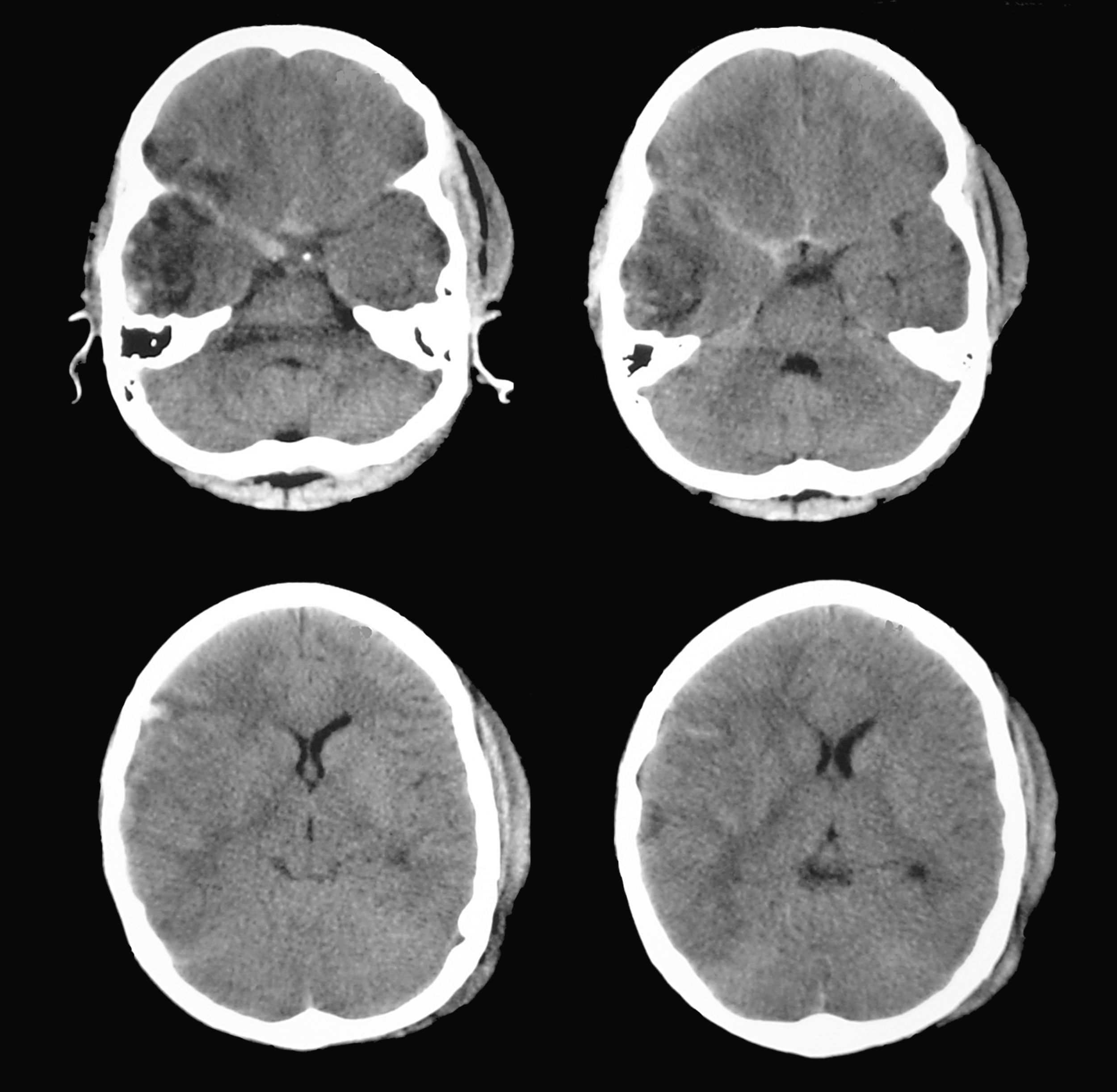
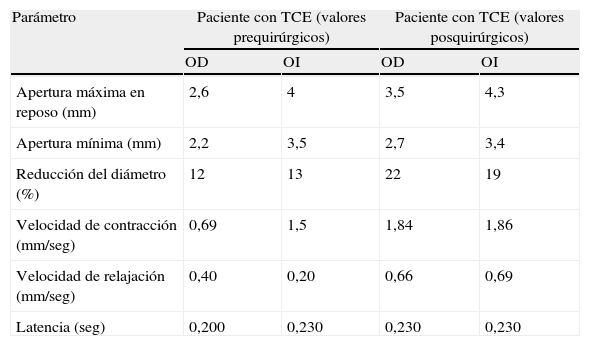
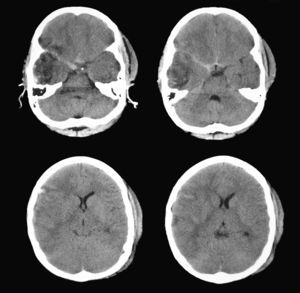
La nueva exploración demostró que la contusión temporal derecha aparecía mejor definida, no existían nuevas lesiones y la línea media aún permanecía centrada, aunque existían signos de borramiento de las cisternas perimesencefálicas ipsilaterales a la lesión temporal derecha, correspondiente a la pupila de menor tamaño considerada hasta ese momento como la pupila “normal” (fig. 5). Las mediciones de los reflejos pupilares realizadas con el pupilómetro (tabla 2) mostraron un claro compromiso de los valores en las velocidades de contracción de la pupila derecha, en rangos considerados patológicos según el trabajo de Taylor et al22.
Datos obtenidos por pupilometría en un paciente con un traumatismo craneoencefálico (TCE) grave
| Parámetro | Paciente con TCE (valores prequirúrgicos) | Paciente con TCE (valores posquirúrgicos) | ||
| OD | OI | OD | OI | |
| Apertura máxima en reposo (mm) | 2,6 | 4 | 3,5 | 4,3 |
| Apertura mínima (mm) | 2,2 | 3,5 | 2,7 | 3,4 |
| Reducción del diámetro (%) | 12 | 13 | 22 | 19 |
| Velocidad de contracción (mm/seg) | 0,69 | 1,5 | 1,84 | 1,86 |
| Velocidad de relajación (mm/seg) | 0,40 | 0,20 | 0,66 | 0,69 |
| Latencia (seg) | 0,200 | 0,230 | 0,230 | 0,230 |
Este paciente presentaba en la TC cerebral una contusión temporal derecha con mínimo efecto de masa y sin evidencia clara de compresión del tronco cerebral. La evaluación pupilar directa evidenciaba una pupila midriática, aunque reactiva del lado contralateral a la lesión, lo que se interpretó inicialmente como un fenómeno de Kernohan. Sin embargo, los datos obtenidos por pupilometría sugerían el compromiso de la función pupilar ipsilateral a la lesión y no de la pupila de mayor tamaño. Inmediatamente después de la intervención quirúrgica (craniectomía descompresiva y resección del polo temporal anterior) la función pupilar recuperó sus valores normales. OD: ojo derecho; OI: ojo izquierdo.
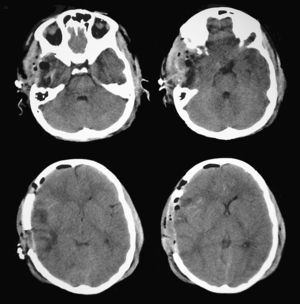
En función de los hallazgos de la TC cerebral de control, que sugerían la existencia de una herniación uncal incipiente, se procedió a realizar una craniectomía descompresiva con resección parcial de la zona de contusión temporal (fig. 6). Las mediciones pupilométricas posteriores a la cirugía mostraron una normalización de los valores de velocidad de contracción pupilar del lado derecho, equiparándose a los valores de la pupila izquierda. El paciente presentó posteriormente una evolución favorable sin nuevas alteraciones pupilares (tabla 2).
ConclusionesLa posibilidad de evaluar los cambios en la reactividad pupilar de forma precoz, objetiva y quasi-continua aporta un nuevo método de monitorización no invasivo que podría mejorar el factor predictivo del deterioro neurológico y monitorizar el estado neurológico a la cabecera del paciente, evitando así exámenes innecesarios y permitiendo intervenciones terapéuticas precoces.
La PI presenta ventajas claras con respecto a la observación directa de la respuesta pupilar, ya que fundamentalmente: a) permite estandarizar la intensidad del estímulo luminoso eliminando errores de medición; b) permite cuantificar la respuesta al estímulo luminoso; c) permite medir parámetros imposibles de valorar clínicamente como el porcentaje y la velocidad de constricción/dilatación y la latencia de respuesta, cuya importancia hoy por hoy desconocemos; d) pueden establecerse valores normales para permitir reconocer los estados patológicos; y e) tiene la posibilidad de registrar, archivar y procesar los datos en sistemas informatizados para su posterior comparación. Estas posibles aplicaciones dependerán de nuevos estudios que corroboren y amplíen los hallazgos observados hasta el momento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Esta revisión ha sido realizada en parte gracias a la beca FIS PI080480 otorgada al Dr. J. Sahuquillo. Agradecemos la colaboración en este estudio de los profesionales de enfermería de la UCI de Neurotraumatología, así como de T.J. Bernard, Marina Maciá e Iván Adrián Martínez Ricarte. Los autores agradecen a Medtronic la donación del equipo de pupilometría NeurOpticsTM a nuestro centro para la realización de este estudio. Sin embargo, no existen conflictos de intereses entre los autores y la compañía fabricante o distribuidora del equipo.