El manejo del tratamiento antitrombótico tras una hemorragia intracerebral (HIC) en pacientes anticoagulados no está bien definido. Analizamos los riesgos y beneficios de la antiagregación (AG) frente al reinicio de la anticoagulación con antagonistas de la vitamina K (AVK) en una serie de pacientes.
Material-métodosEstudio retrospectivo de HIC en pacientes anticoagulados. Se registraron datos demográficos, antecedentes de hipertensión arterial, tiempo de seguimiento y nuevo evento vascular cerebral (HIC, infarto cerebral [IC]).
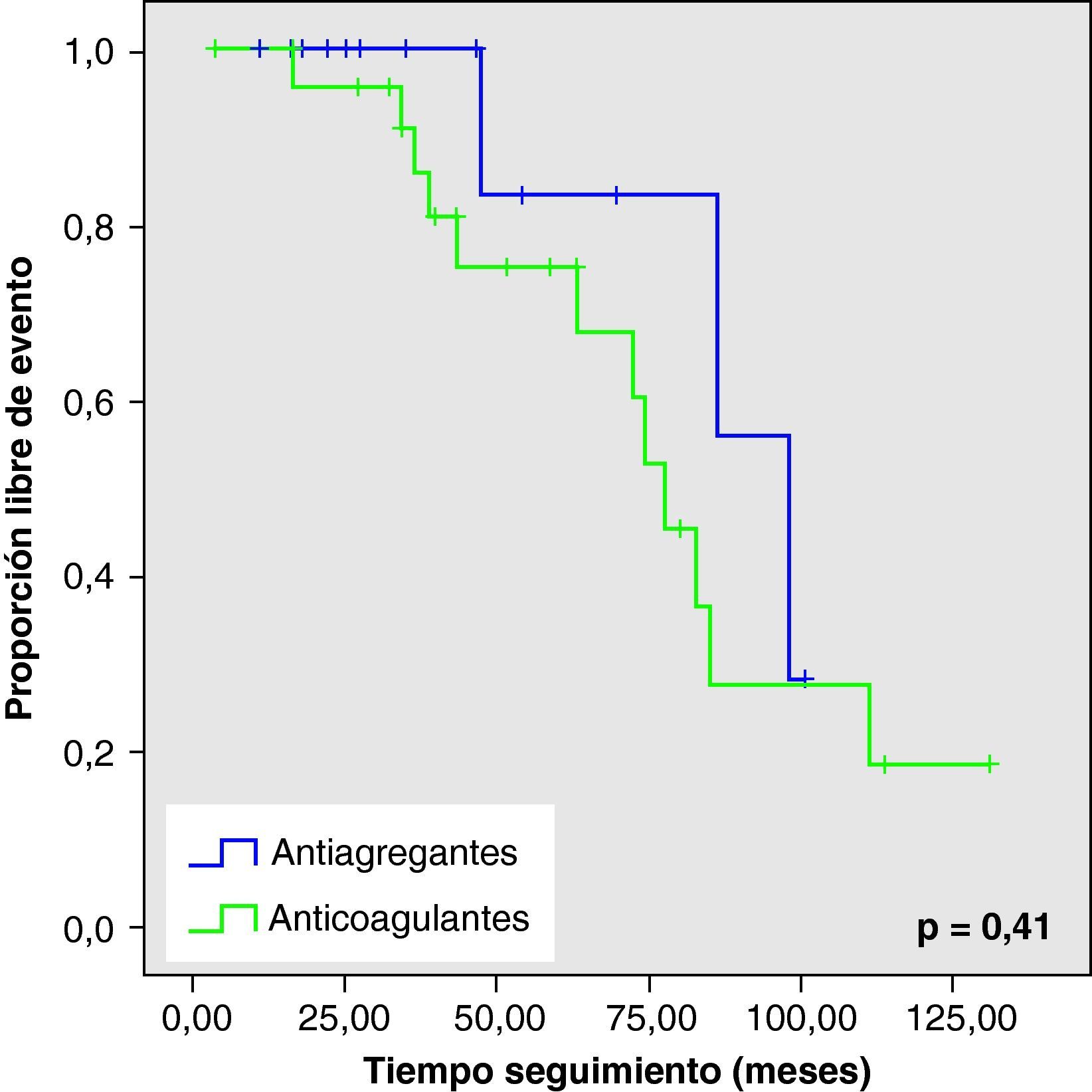
ResultadosSe evaluó a 88 pacientes, de edad media 69±9 años, 50% varones, 73% hipertensos. Durante la fase aguda fallecieron 18 pacientes y el seguimiento se perdió en 31. De los restantes (n=39), se reinició AVK en 25 y se cambió a AG en 14. Comparando las características de ambos grupos, el grupo anticoagulado era de menor edad (p=0,005) y las fuentes cardioembólicas eran con mayor frecuencia de alto riesgo (p=0,003). Tras un seguimiento promedio de 54±31 meses, la distribución de eventos fue: IC (grupo AVK 8%, grupo AG 14,3%, p=0,6); HIC (AVK 24%, AG 7.1%, p=0,38); IC o HIC (AVK 32%, AG 21,4%, p=0,48); muerte (AVK 29%, AG 7,1%, p=0,21). Esta tendencia de mayor riesgo de nuevos eventos en pacientes con AVK se confirmó mediante curvas de Kaplan-Meier, aunque sin significación estadística.
ConclusionesEl reinicio del tratamiento con AVK tras una HIC en pacientes anticoagulados podría aumentar el riesgo de nuevos eventos hemorrágicos y la mortalidad. Son necesarios estudios prospectivos, para definir mejor el tratamiento antitrombótico idóneo tras una HIC relacionada con la anticoagulación.
The management of antithrombotic therapy after intracerebral hemorrhage (ICH) in anticoagulated patients is not well defined. We analyzed the risks and benefits of antiplatelet therapy (AG) against the resumption of anticoagulation with vitamin K antagonists (AVK) in a series of patients.
Material and methodsRetrospective study of ICH in anticoagulated patients. We registered demographic data, history of hypertension (HT), time of follow-up and new cerebral vascular events (ICH, stroke [IC]).
ResultsWe evaluated 88 patients, mean age 69±9 years, 50% men, 73% hypertensive. During the acute phase 18 patients died and the follow-up was lost in 31. Of the remaining (n=39), AVKs were resumed in 25 and changed to AG in 14. Comparing the characteristics of both groups, the anticoagulated group was younger (P=.005) and the embolic sources were more often of higher risk (P=.003). After an average follow-up of 54±31 months, the distribution of events was: IC (AVKs 8%, AG 14.3%, P=.6), ICH (AVKs 24%, AG 7.1%, P=.38), IC or ICH (AVKs 32%, AG 21.4%, P=.48) and death (AVKs 29%, AG 7.1%, P=.21). This trend of increased risk of new events in patients with AVKs was confirmed by Kaplan-Meier curves, although without statistical differences.
ConclusionsRestarting AVK treatment after ICH in anticoagulated patients could increase the risk of new bleeding events and mortality. Prospective studies are needed to define a better and appropriate antithrombotic therapy after ICH related with anticoagulation.
Tras la publicación de los ensayos clínicos en los que se demostraba la eficacia de los antagonistas de la vitamina K (AVK)1 como tratamiento preventivo del ictus isquémico cardioembólico, el uso de los mismos se ha visto incrementado. A este hecho se tiene que añadir el aumento de la prevalencia de la fibrilación auricular (FA), asociada probablemente al envejecimiento de la población, lo que conlleva un incremento del uso del tratamiento anticoagulante2.
A pesar de su incuestionable beneficio en la prevención de un embolismo cerebral o sistémico, el tratamiento anticoagulante conlleva sus riesgos, destacando por su importante morbimortalidad la hemorragia intracerebral (HIC). Esta no sólo es más frecuente, sino que, cuando sucede, también es más grave que en los pacientes no anticoagulados3–6.
Una vez superada la fase aguda, se plantea a menudo el dilema terapéutico sobre si reiniciar la anticoagulación o no, o bien cambiar a un fármaco antiagregante (AG). Ambos tratamientos antitrombóticos han demostrado ser eficaces en la reducción de eventos isquémicos cerebrales en pacientes con enfermedades potencialmente cardioembólicas; sin embargo, en la prevención del ictus cardioembólico el tratamiento anticoagulante es más eficaz (reducción del riesgo relativo de cerca del 40%) que el tratamiento antiagregante1. A pesar de esta mayor protección, el tratamiento anticoagulante también conlleva mayor riesgo de recurrencia de HIC espontánea o postraumática.
En el presente estudio hemos realizado un análisis retrospectivo de los riesgos y beneficios de la antiagregación frente al reinicio de la anticoagulación en una serie de pacientes con HIC relacionada con el tratamiento con AVK.
Material y métodosRealizamos un estudio retrospectivo de pacientes que se encontraban en tratamiento con AVK y que sufrieron una HIC en el periodo entre 1997 y 2007. Los pacientes se identificaron a partir de la base de datos de la Unidad de Trombosis y Hemostasia del Hospital de la Santa Creu i Sant Pau.
Los datos de seguimiento fueron obtenidos mediante revisión de las historias clínicas de aquellos pacientes que fueron seguidos en el hospital.
El tiempo de seguimiento fue calculado en meses, desde el mes de la HIC hasta el mes en el que el paciente padeció un nuevo evento cerebrovascular, falleció o se realizó la última anotación clínica. Excluimos a los pacientes de los que no realizaron un seguimiento hospitalario tras el primer evento hemorrágico.
De cada paciente recogimos los siguientes datos clínico-demográficos tras el episodio de HIC: edad, sexo; factores de riesgo vascular (hipertensión arterial [HTA], diabetes mellitus, dislipemia [DLP] e historia de tabaquismo); antecedentes de embolismo previo (sistémico o cerebral); patología cardíaca que motivó el tratamiento con AVK (fibrilación auricular, sustitución valvular mecánica u otros); tiempo transcurrido desde el inicio de la anticoagulación hasta la HIC (meses); razón internacional normalizada (INR) en el momento del evento hemorrágico intracerebral y localización de la HIC (lobar vs. profunda —ganglios basales, tronco o cerebelo—).
Los pacientes fueron divididos en aquellos que reiniciaron el tratamiento con AVK y aquéllos a los que se cambió a tratamiento AG (ácido acetil-salicílico, clopidogrel, la combinación de ambos u otros antiagregantes). Se incluyó en el grupo de reinicio a todos aquellos pacientes a los que se les volvió a prescribir los AVK, bien durante la fase hospitalaria o bien durante el seguimiento ambulatorio.
Los eventos finales que se valoraron en el estudio fueron la recurrencia de un nuevo episodio de HIC y la aparición de un IC o AIT, demostrados ambos por tomografía computarizada o RM cerebral, o la muerte por cualquier causa.
Para el análisis estadístico comparativo de ambos grupos, utilizamos la prueba estadística de la t de Student para comparar las medias de muestras independientes de las variables continuas. Para el resto de las variables las dicotomizamos y utilizamos tablas de contingencia con la prueba estadística de la chi al cuadrado, definiendo como diferencia estadísticamente significativa una p<0,05. Utilizamos también las curvas de supervivencia de Kaplan-Meier para el estudio de la distribución de eventos en los diferentes grupos durante el seguimiento.
ResultadosEntre los años 1997 y 2007, 88 pacientes que estaban en tratamiento con AVK presentaron una HIC. La edad media de los pacientes fue de 69±9 años, y el 50% de los pacientes eran varones. La distribución de los factores de riesgo vascular fue la siguiente: el 73% de los pacientes eran hipertensos, el 36,5% diabéticos, el 28,4% dislipémicos y el 9,5% eran fumadores.
Durante la fase aguda fallecieron 18 pacientes (20,4%) y en 31 se perdió el seguimiento, por lo que el presente estudio analiza una cohorte de 39 pacientes. Las características basales fueron similares entre el grupo que se perdió durante el seguimiento y el que finalmente pudimos analizar, destacando tan sólo una mayor proporción de pacientes diabéticos en el grupo del que se perdió el seguimiento (48,7% vs. 22,9%, p=0,008).
En cuanto a las indicaciones del tratamiento con AVK, 23 pacientes (59%) lo estaban tomando como tratamiento preventivo primario, de éstos 11 pacientes (47,8%) tenían una FA y 9 (39,1%) eran portadores de una válvula mecánica. Los restantes 16 pacientes (41%) estaban recibiendo el tratamiento como prevención secundaria, 13 de ellos habían padecido un embolismo cerebral (IC o AIT) y 3 un embolismo sistémico. La mayoría de los pacientes que recibía los AVK como prevención secundaria tenían una FA (13 pacientes) y sólo 3 una válvula mecánica.
El tiempo transcurrido desde el inicio del tratamiento con AVK hasta el evento hemorrágico fue de 48,64±53,8 meses.
Una vez superada la fase aguda, se reiniciaron los AVK a 25 pacientes (64,1%) y se cambió a AG a 14 (35,9%). El tratamiento elegido se basó en la decisión del médico responsable, de acuerdo con la familia y el paciente, pero no fue una decisión aleatorizada ni protocolizada.
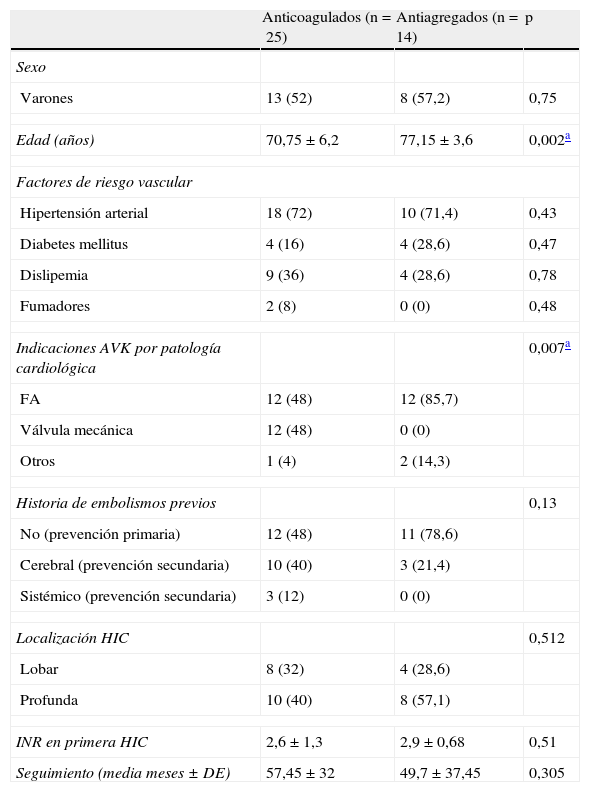
Tal como se observa en la tabla 1, los pacientes a los que se les reinició el tratamiento con AVK eran más jóvenes y la indicación del tratamiento con AVK (previa a la HIC) era principalmente por tener una fuente embolígena de alto riesgo (portadores de válvulas mecánicas en el 48% de los pacientes), o bien lo tomaban como prevención secundaria por haber padecido algún embolismo sistémico en el 52%.
Características clínicas de los grupos: reinicio anticoagulación vs. cambio a antiagregación
| Anticoagulados (n=25) | Antiagregados (n=14) | p | |
| Sexo | |||
| Varones | 13 (52) | 8 (57,2) | 0,75 |
| Edad (años) | 70,75±6,2 | 77,15±3,6 | 0,002a |
| Factores de riesgo vascular | |||
| Hipertensión arterial | 18 (72) | 10 (71,4) | 0,43 |
| Diabetes mellitus | 4 (16) | 4 (28,6) | 0,47 |
| Dislipemia | 9 (36) | 4 (28,6) | 0,78 |
| Fumadores | 2 (8) | 0 (0) | 0,48 |
| Indicaciones AVK por patología cardiológica | 0,007a | ||
| FA | 12 (48) | 12 (85,7) | |
| Válvula mecánica | 12 (48) | 0 (0) | |
| Otros | 1 (4) | 2 (14,3) | |
| Historia de embolismos previos | 0,13 | ||
| No (prevención primaria) | 12 (48) | 11 (78,6) | |
| Cerebral (prevención secundaria) | 10 (40) | 3 (21,4) | |
| Sistémico (prevención secundaria) | 3 (12) | 0 (0) | |
| Localización HIC | 0,512 | ||
| Lobar | 8 (32) | 4 (28,6) | |
| Profunda | 10 (40) | 8 (57,1) | |
| INR en primera HIC | 2,6±1,3 | 2,9±0,68 | 0,51 |
| Seguimiento (media meses ± DE) | 57,45±32 | 49,7±37,45 | 0,305 |
Datos expresados en número absoluto (porcentaje) o en media±desviación estándar.
No se encontraron diferencias en cuanto a la distribución de los factores de riesgo vascular ni la localización de la hemorragia intracerebral entre ambos grupos.
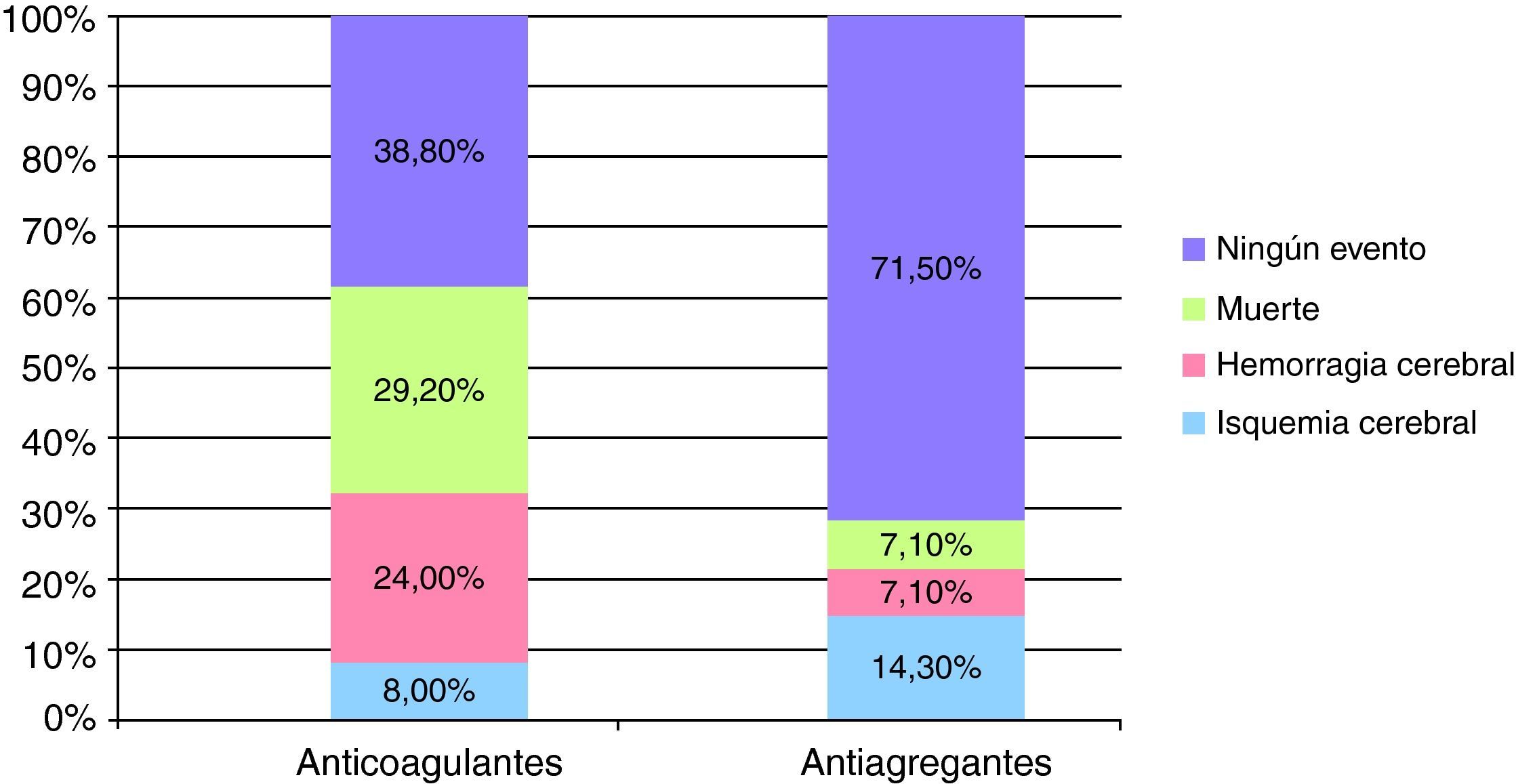
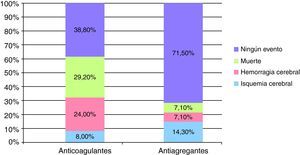
Tras un seguimiento promedio de ambos grupos de 53,8 meses (rango 4-131 meses), 2 de los 25 pacientes (8%) en los que se continuó con los AVK y 2 de los 14 pacientes (14,3%) en los que se cambió a tratamiento AG presentaron un evento isquémico cerebral. En cuanto a un nuevo episodio de HIC, la presentaron sólo 1/14 pacientes (7,1%) del grupo AG frente a los 6/25 pacientes (24%) del grupo con AVK. El valor de INR medio en el momento del resangrado cerebral fue de 3,5±1,7.
Durante el seguimiento fallecieron más pacientes en el grupo que continuó con los AVK (7/25 pacientes [29,2%] frente a 1/14 [7,1%] pacientes en el grupo AG). Las causas de la muerte en el grupo al que se reinició el tratamiento anticoagulante fueron las siguientes: 2 pacientes fallecieron durante la fase aguda de un nuevo evento cerebrovascular (uno por un nueva hemorragia cerebral y otro por una isquemia cerebral), los 5 restantes fallecieron por otras causas no relacionadas con el tratamiento antitrombótico. El fallecimiento que se produjo en el paciente al que se le cambió a antiagregantes fue durante la fase aguda de un episodio de IC.
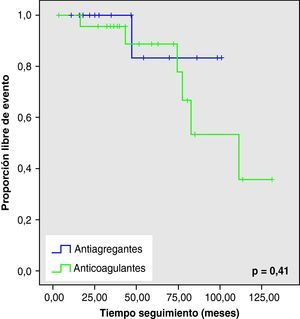
Ninguna de estas diferencias en los nuevos eventos vasculares cerebrales o muerte, resultaron estadísticamente significativas (fig. 1).
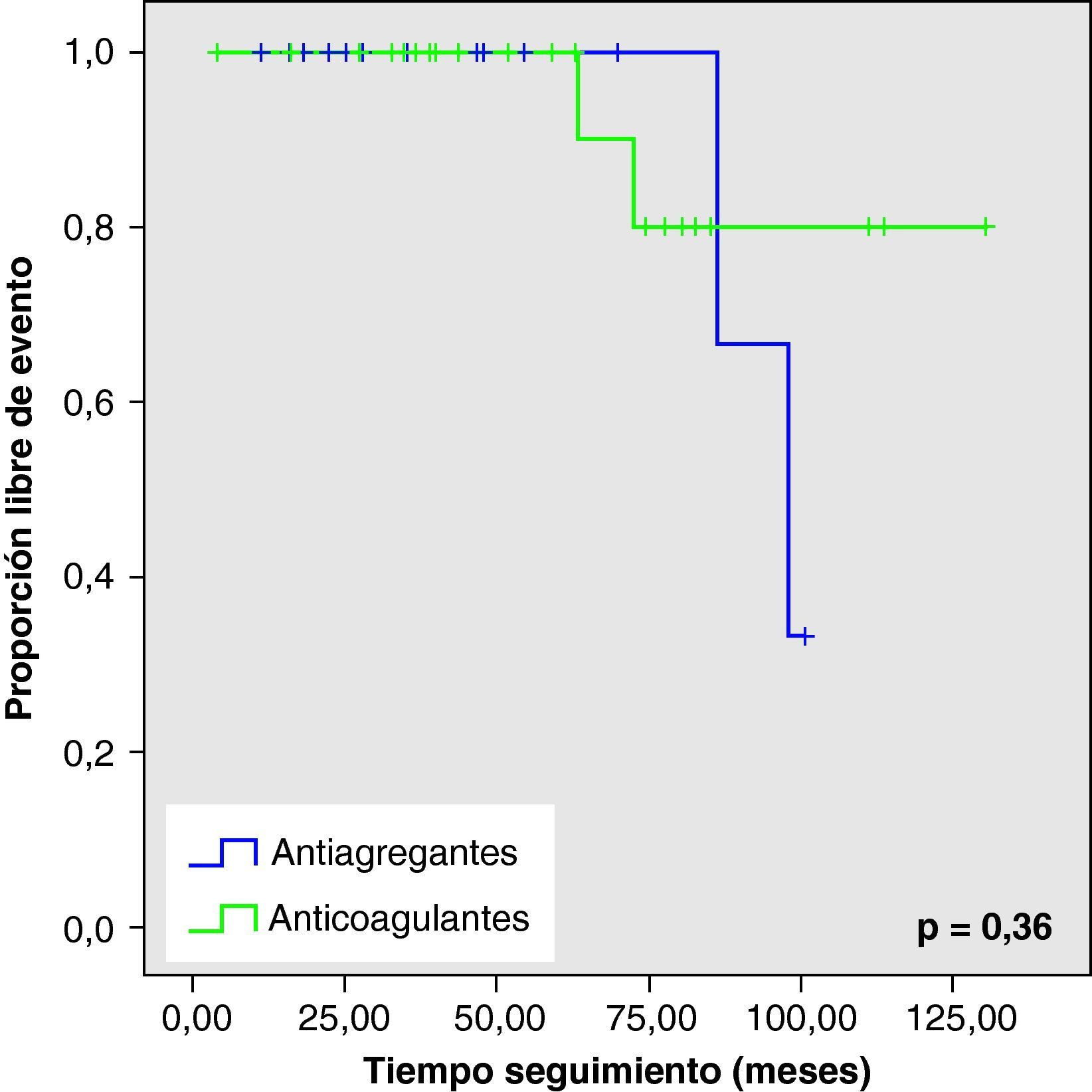
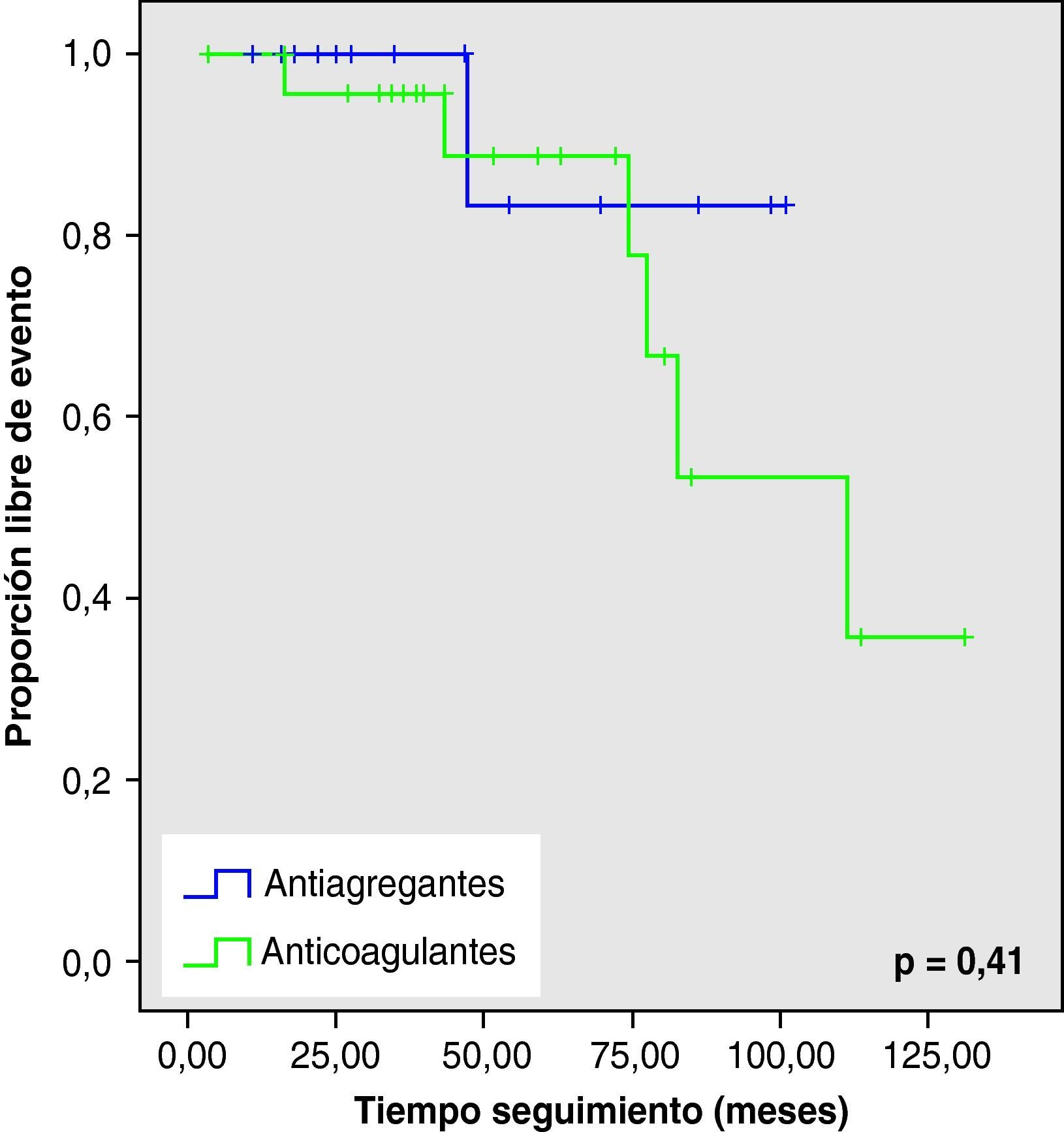
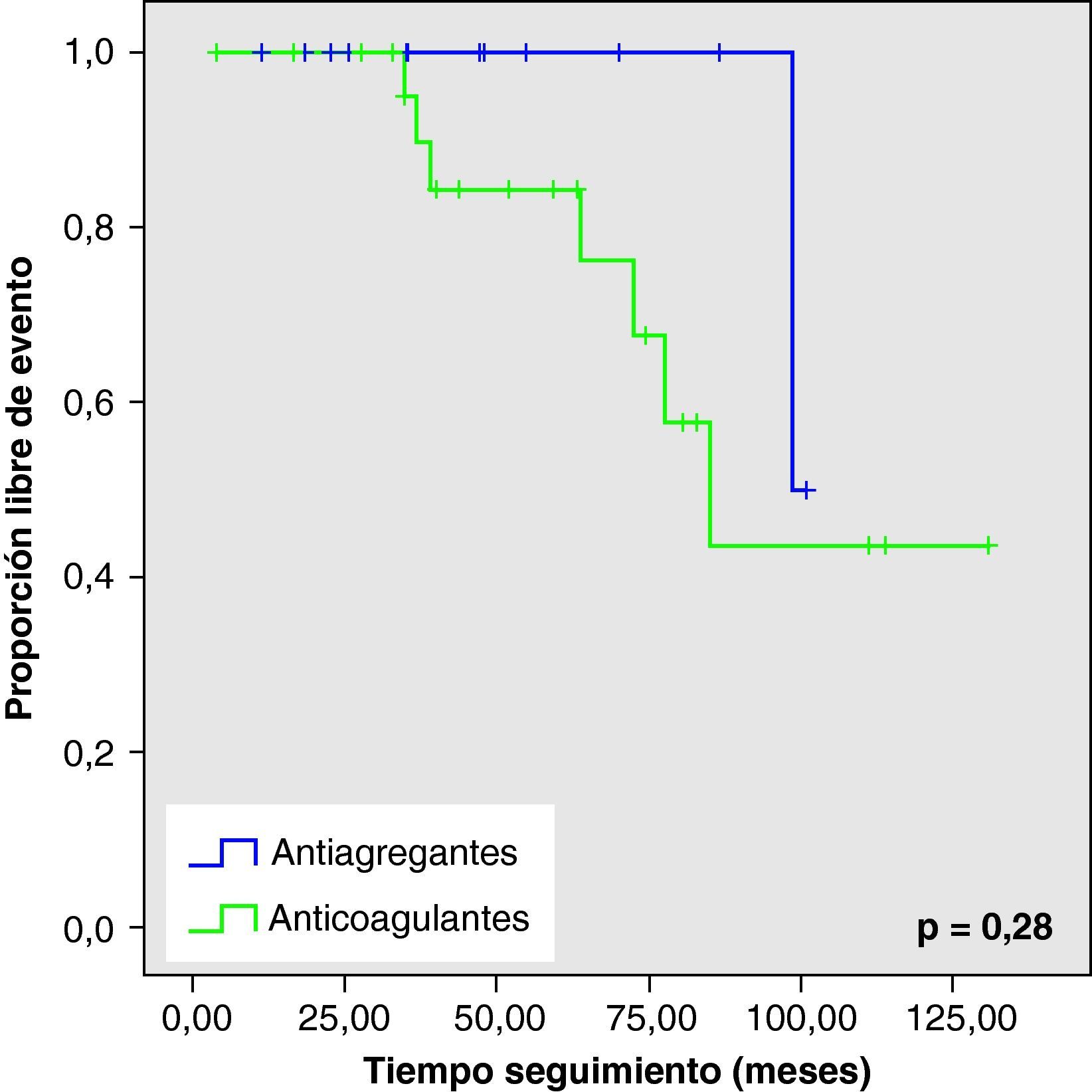
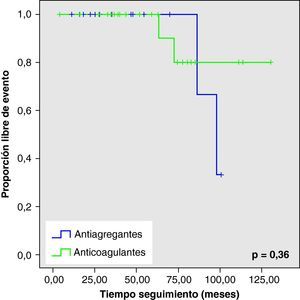
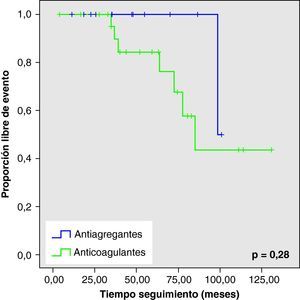
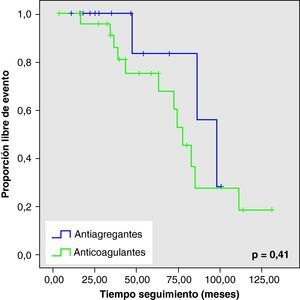
Al analizar las curvas de supervivencia de Kaplan-Meier se observa la misma tendencia a un mayor número de eventos hemorrágicos y muerte en el grupo con AVK, aunque sin llegar a la significación estadística (figs. 2–5).
DiscusiónLa mayoría de estudios sobre reinicio del tratamiento con AVK se centran en la fase aguda o en la seguridad a corto plazo del reinicio de dicho tratamiento, pero no en el pronóstico a largo plazo7–12.
Aunque se ha realizado algún estudio a largo plazo sobre la seguridad de reiniciar tratamiento antiagregante tras una hemorragia intracerebral13, éste es el segundo estudio de la literatura que compara el pronóstico a largo plazo de los pacientes a los que se reinicia el tratamiento con AVK frente a los que se cambia a AG tras una HIC. A pesar de que no encontramos diferencias estadísticamente significativas, nuestro estudio sugiere que el reinicio de los AVK, aunque seguro en la mayoría de los pacientes, conlleva un aumento del riesgo de recurrencia de HIC espontánea. Por el contrario, el inicio de AG se asocia a mayor frecuencia de eventos isquémicos.
En nuestro estudio, el 24% de pacientes a los que se reinició los AVK presentaron un nuevo evento hemorrágico cerebral tras un seguimiento superior a 4 años. Esta cifra es mayor a la descrita en el estudio realizado por Claassen et al14, en la que encontraron que tan sólo el 12,9% de los pacientes a los que se reinició el tratamiento padecieron una nueva HIC (teniendo en cuentas tanto las HIC espontáneas así como las traumáticas). En ambos estudios la duración del seguimiento fue similar (alrededor de 50 meses) y la distribución en cuanto a edad y porcentaje de pacientes HTA y de portadores de válvulas mecánicas, fue equivalente. La diferencia en el número de recurrencias podría explicarse por la metodología diferente que se empleó para obtener la información clínica. Así, en nuestro caso, el seguimiento fue realizado mediante la revisión de historias clínicas y seguimiento hospitalario, lo que puede llevarnos a una pérdida importante de aquellos pacientes asintomáticos que no requirieron nueva atención en urgencias o consultas especializadas. En cambio en el estudio de Claassen et al14 realizaron el seguimiento mediante revisión de historias clínicas y envíos de cuestionarios donde recogieron información detallada sobre la discapacidad actual, el uso de AVK o AG y la recurrencia de algún evento cerebral (HIC o IC) u otras complicaciones del tratamiento; consiguiendo así menores pérdidas durante el seguimiento.
En cuanto al grupo al que se cambió a AG se observó un mayor porcentaje de eventos isquémicos cerebrales que en el grupo con AVK (14,3% frente al 8%, respectivamente), siendo estas cifras similares a las descritas en la literatura14.
Al comparar ambos grupos (anticoagulados y antiagregados) destaca, de acuerdo con lo publicado hasta ahora14, que los pacientes a los que se reinició los AVK eran más jóvenes, tenían un alto riesgo embolígeno (válvulas mecánicas) o bien habían padecido algún evento embólico previo. Estas diferencias pueden atribuirse a que el médico que decidió el tratamiento antitrombótico a seguir aconsejara un tratamiento más eficaz (aunque con mayor riesgo) en aquellos pacientes más jóvenes, con una probable mejor recuperación funcional y una mayor esperanza de vida y prefiriese iniciar el tratamiento antiagregante a pacientes con secuelas discapacitantes. Por otra parte, también la decisión de anticoagular parece indudable si la fuente de émbolos es de alto riesgo, como sucede en las prótesis valvulares mecánicas. Asimismo, es muy probable también que se reiniciase la anticoagulación en aquellos pacientes que ya habían padecido un evento tromboembólico previo, al otorgar a estos pacientes un mayor riesgo de recurrencias15.
En los pacientes en tratamiento con AVK, el riesgo de HIC está relacionado con el INR. Sin embargo, en dos tercios de los pacientes, la HIC se produce encontrándose dentro del rango terapéutico16. El tratamiento con AVK conlleva un riesgo anual de HIC del 0,3-3,7% cuando se encuentran con una INR entre 2-4,5 unidades (consideradas en rango terapéutico) frente al 0,1% del placebo17. Al analizar el INR recogido en la HIC índice de nuestros pacientes, encontramos que la mayoría de los pacientes se encontraban dentro de su rango terapéutico (media 2,7±1,1).
El 73% de los pacientes incluidos en nuestro estudio eran hipertensos, un dato esperable pues se trata del factor de riesgo más importante para padecer una HIC17. El estudio PROGRESS18 demostró que con un control estricto de la presión arterial (PA) se reduce el riesgo de padecer un primer evento hemorrágico intracerebral hasta un 50% y parece también disminuir el riesgo de recurrencia de HIC. Por tanto, aunque no lo hayamos podido valorar con los datos obtenidos en nuestro estudio, sería lógico pensar que en aquellos pacientes con una HIC profunda de etiología hipertensiva, si conseguimos un buen control de la PA, será más seguro reiniciar el tratamiento anticoagulante19. Otro factor de riesgo altamente asociado a la recurrencia de HIC es la localización lobar del primer evento hemorrágico20, ya que se relaciona con la presencia de angiopatía amiloide cerebral. Por tanto, el reinicio de los AVK en estos pacientes debe ser valorado cuidadosamente17. En nuestro estudio, no encontramos diferencias en cuanto al reinicio del tratamiento o el cambio del mismo cuando lo analizamos en función de la localización de la HIC.
Además de la HTA, la localización de la HIC y la INR, se han descrito otros factores de riesgo como la edad, la presencia de una carga microangiopática —medida por la presencia de leucoaraiosis o microsangrados en la RM cerebral—, ser portador de portadores de los alelos ¿2 o ¿4 de la apolipoproteína E20. Todos estos factores, todavía en estudio muchos de ellos, nos permitirán en un futuro poder individualizar la decisión sobre el inicio, reinstauración o retirada del tratamiento anticoagulante.
Nuestro estudio tiene algunas limitaciones importantes. La primera de ellas es el bajo número de pacientes evaluados, lo cual hace más difícil poder alcanzar la significación estadística. Este bajo número muestral es debido a la importante pérdida de pacientes durante el seguimiento, tanto por la importante mortalidad inicial de dicha enfermedad como por la falta de controles hospitalarios posteriores al tratarse de un estudio retrospectivo. Otra limitación importante es que la decisión sobre el tratamiento antitrombótico no fue protocolizada. Dicha decisión podría estar influida (además de por lo mencionado anteriormente) por el estado clínico del paciente. Todas estas circunstancias podrían llevar a un sesgo de selección difícilmente corregible al tratarse de un estudio retrospectivo y por no tener recogido la puntuación en la escala de Rankin o en la escala NIHSS al alta.
A pesar de tratarse de una patología con una importante morbimortalidad asociada y de ser la complicación del tratamiento anticoagulante que genera la mayor mortalidad y discapacidad21, hasta la fecha los estudios realizados sobre la seguridad y el beneficio del reinicio de los AVK tras una HIC son contradictorios y se trata principalmente de estudios sobre la seguridad en la fase aguda o a corto plazo tras la HIC7–12. Para intentar resolver este dilema, algunos autores han intentado realizar una aproximación terapéutica mediante un modelo de decisión-análisis, indicando el reinicio o no de la anticoagulación en función de la localización de la hemorragia intracerebral, los factores de riesgo cardiovasculares y la indicación del tratamiento anticoagulante19. Sin embargo, estas recomendaciones deben tomarse con precaución, ya que no se basan en ensayos clínicos. En nuestro estudio encontramos un menor número de eventos embólicos cerebrales, pero una tendencia a un mayor riesgo de recurrencia de HIC y un aumento de la mortalidad en los pacientes a los que se reinicia los AVK, contrariamente a lo publicado hasta la fecha en la literatura14. Con la aparición de los nuevos inhibidores orales de la trombina que presentan una eficacia similar pero con un mejor perfil de seguridad que los AVK22, todos estos datos aquí expuestos se verán probablemente modificados en un futuro no muy lejano. Por el momento, esta decisión terapéutica debe realizarse de forma individualizada, teniendo en cuenta las características y el contexto clínico del paciente, valorando el riesgo-beneficio del tratamiento que se va a administrar o retirar. Excluidos los portadores de válvulas mecánicas, valvulopatías hemodinámicamente significativas y nefropatías graves en los que probablemente no exista otra opción terapéutica, es de vital importancia la realización de ensayos clínicos para aclarar la actitud terapéutica más apropiada a seguir en pacientes con HIC asociada a tratamiento anticoagulante y poder así basar las decisiones en argumentos sólidos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a Ignasi Gich su ayuda en el análisis estadístico.
El trabajo fue presentado como comunicación oral en la LX Reunión Anual de la Sociedad Española de Neurología.