La epilepsia es un conjunto de redes de estructuras cerebrales representadas bilateralmente, que están funcional y anatómicamente conectadas; en la epilepsia, la actividad de cualquier parte del cerebro afecta la actividad de las demás. Esto es relevante para el entendimiento de la fisiopatología, la etiología, el diagnóstico y la prognosis de esta enfermedad.
ObjetivoRevisar el estado del arte en cuanto al entendimiento de la visión neurofisiológica de la epilepsia como una enfermedad de redes neuronales.
ResultadosSe describen los principios básicos y avanzados de la epilepsia como enfermedad de redes neuronales usando distintos métodos clínicos y matemáticos con una visión neurofisiológica, indicando las limitaciones de estos hallazgos en el contexto clínico.
ConclusionesLa epilepsia es una enfermedad de redes neuronales complejas cuyo entendimiento permitirá mejorar los tratamientos disponibles y la certeza pronostica.
The brain is a series of networks of functionally and anatomically connected, bilaterally represented structures; in epilepsy, activity of any part of the brain affects activity in the other parts. This is relevant for understanding the pathophysiology, diagnosis, and prognosis of the disease.
ObjectiveIn this study, we present a state-of-the-art review of the neurophysiological view of epilepsy as a disease affecting neural networks.
ResultsWe describe the basic and advanced principles of epilepsy as a disease affecting neural networks, based on the use of different clinical and mathematical techniques from a neurophysiological perspective, and signal the limitations of these findings in the clinical context.
ConclusionsEpilepsy is a disease affecting complex neural networks. Understanding these will enable better management and prognostic confidence.
La epilepsia es una enfermedad crónica del sistema nervioso central que afecta a individuos de todas las edades y su distribución es global1. Estimados del 2016 del estudio de costo global por enfermedad, lesiones y factores de riesgo (del inglés Global Burden of Diseases [GBD]) sugieren que la epilepsia contribuye con un 0,5% de los años de vida ajustados a la discapacidad (del inglés, disability-adjusted life-years [DALY]) debido a todas las enfermedades y heridas, además de contribuir con un 5,0% de los DALY atribuibles a desórdenes neurológicos. De acuerdo con el estudio GBD, 45,9 millones (39,9-54,6) de pacientes tuvieron epilepsia (considerando a la epilepsia idiopática y secundaria)2.
Definiciones de epilepsia y crisis epilépticaLa epilepsia es un desorden del cerebro caracterizado por una predisposición duradera a generar crisis epilépticas y a las consecuencias neurobiológicas, cognitivas, psicosociales y sociales de esta condición3. Una crisis epiléptica es una ocurrencia transitoria de signos o síntomas debidos a la actividad excesiva o sincronizada de actividad neural en el cerebro3.
La epilepsia se manifiesta clínicamente como la enfermedad del cerebro definida por cualquiera de las siguientes condiciones: 1) al menos 2crisis epilépticas no provocadas (o reflejas) que ocurren en menos de 24 h; 2) una crisis epiléptica no provocada (o refleja) y la probabilidad de nuevas crisis epilépticas similares con un riesgo de recurrencia general (al menos 60%) después de 2crisis epilépticas no provocadas, dentro de los siguientes 10 años4.
La presente clasificación de epilepsias de la Liga Internacional Contra la Epilepsia (ILAE) ha sido actualizada para reflejar nuestra nueva comprensión de las epilepsias y sus mecanismos en concordancia con los últimos avances científicos5. Después del diagnóstico de un tipo de convulsión, el siguiente paso es el diagnóstico del tipo de epilepsia, incluyendo epilepsia focal, epilepsia generalizada, combinada (focal y generalizada), así como epilepsias desconocidas5. Esta división está basada en una red neural compleja elaborada de datos neurofisiológicos y neuroanatómicos de neuronas y áreas lobares y hemisféricas5.
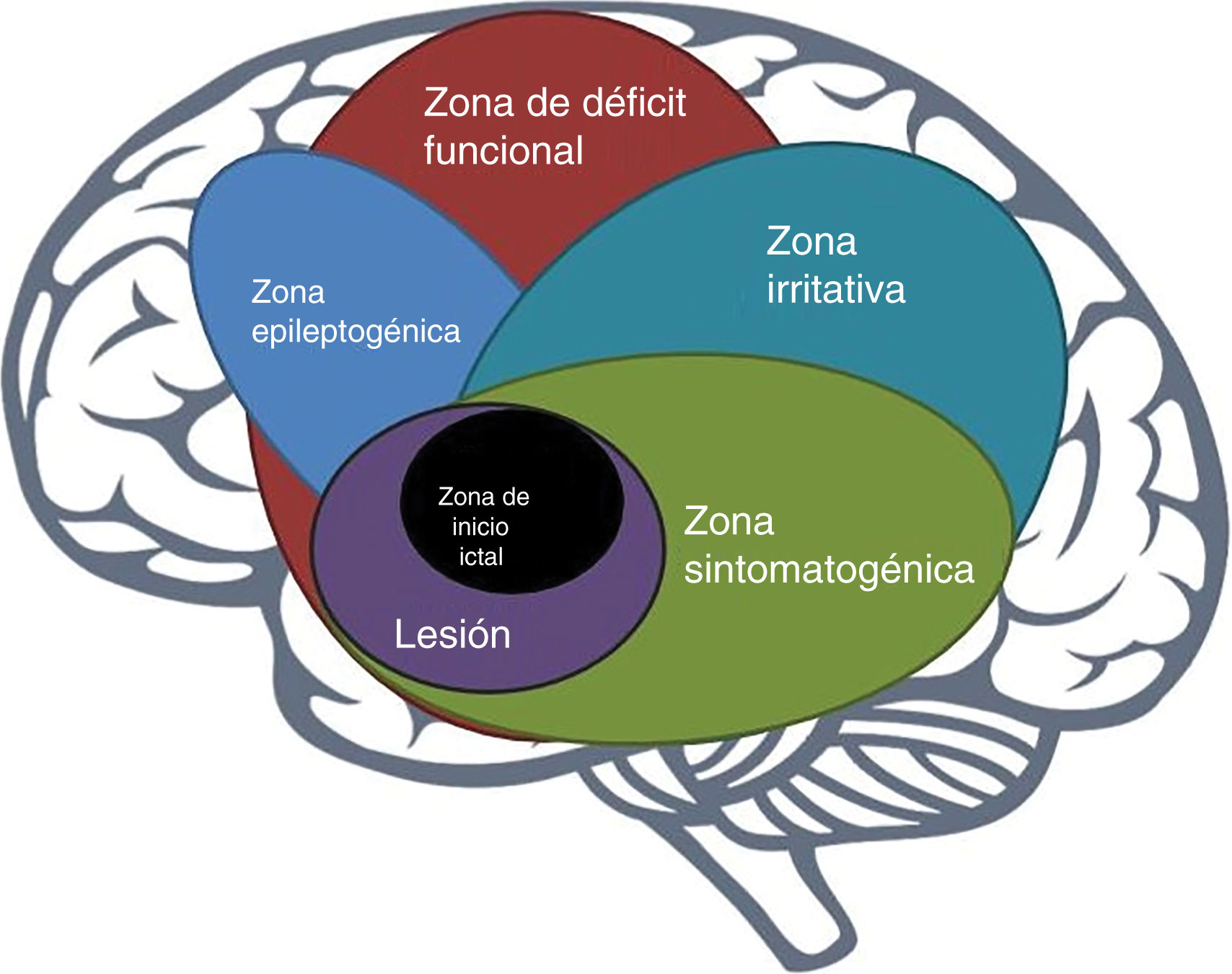
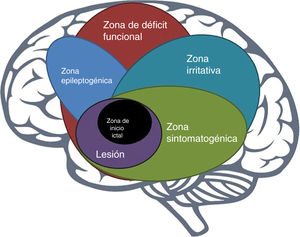
La zona epileptogénicaEn 1993, Lüders et al. definieron la zona epileptogénica (ZE) como «el área del córtex que es necesaria y suficiente para iniciar crisis epilépticas y cuya remoción (o desconexión) es necesaria para la completa cesación de crisis epilépticas»6 (fig. 1). El concepto de ZE de Lüders et al. se vuelve significativo solo cuando se ve en el contexto de la definición de 5zonas corticales propuestas para la evaluación prequirúrgica:
- 1.
zona irritativa: área de la corteza que genera grafoelementos epileptiformes interictales;
- 2.
área de inicio de crisis epilépticas: área de la corteza donde inician las crisis epilépticas clínicas;
- 3.
zona sintomatogénica: área de la corteza que, cuando se activa, produce los síntomas o signos iniciales ictales;
- 4.
lesión epileptogénica: lesión macroscópica que causa las crisis epilépticas dado a que la lesión en sí misma es epileptogénica o por hiperexcitabilidad secundaria y,
- 5.
zona de déficit funcional: área de la corteza que no está funcionando normalmente en el periodo interictal7.
Sin embargo, no existe una medida prequirúrgica directa de la ZE, su delineación es un ejercicio puramente conceptual que incorpora datos derivados de múltiples pruebas y varios componentes de una evaluación prequirúrgica7.
Epilepsia como red neuronal anormalEn 2002, Spencer definió la epilepsia como un desorden de redes neuronales funcional y anatómicamente conectadas, representadas bilateralmente, como un conjunto de estructuras corticales y subcorticales en el cual la actividad de cualquier parte afecta la actividad de las demás8. Este acercamiento es fundamental para algunas terapias de estimulación profunda del cerebro9, la estimulación del nervio vago (VNS)10 o la neuroestimulación responsiva cerebral11, en las cuales el tratamiento aplicado (dirigido a cualquier región de la red) debería teóricamente ser tan efectivo como aquellos tratamientos dirigidos al «foco» específico de actividad epiléptica8. De la misma manera, este es un factor clave en la identificación de la distribución anatómica de los procesos epileptogénicos, incluyendo la cirugía de epilepsia12.
En humanos, el estudio de la epilepsia como red está basado en estudios de neuroimagen (resonancia magnética, tomografía por emisión de fotón único o tomografía por emisión de positrones)13 y técnicas neurofisiológicas (electroencefalografía, estimulación magnética transcraneal o magnetoencefalografía) que cuentan con diversas resoluciones espaciales y temporales, limitaciones y ventajas del análisis estructural o funcional de las áreas del cerebro14. Algunas de ellas son invasivas (electrocorticografía intraoperatoria, estéreo-EEG o electrodos profundos) pero con una resolución espacial limitada15. Todos los estudios tienen como objetivo evaluar los estados ictales (crisis epilépticas) o interictales (entre crisis epilépticas) para delinear las áreas epileptogénicas involucradas en cada epilepsia16.
Métodos de grabación y análisis de redes epilépticas usando señales electroencefalográficasExisten varios métodos para delinear redes epilépticas utilizando análisis de frecuencia o tiempo-frecuencia de señales de EEG grabadas invasivamente17 y no invasivamente18, mapas de epileptogénesis19 o índices de epileptogenicidad20. Describimos algunos principios generales y sus aplicaciones en redes neurales relacionadas a epilepsia en las siguientes secciones.
Análisis de conectividadEste acercamiento está basado en la estimación matemática de la relación entre 2señales provenientes de diferentes partes del cerebro19,21,22. Con este análisis es posible analizar los datos de neuroimagen y neurofisiológicos durante los periodos ictales e interictales23. Por ejemplo, el acoplamiento dinámico entre la conectividad local de resonancia magnética funcional (fMRI) con EEG interictal en la epilepsia focal sugiere que hay una fuerte relación que varía en el tiempo entre la conectividad local fMRI y el poder en el EEG interictal en epilepsia focal23. Usualmente, este acoplamiento de técnicas identifica redes epilépticas más consistentes en comparación con la utilización de solo uno de sus componentes por separado23-25. Varios estadísticos lineales (coherencia, análisis de regresión lineal) o no lineales (información mutua, análisis de regresión no lineal, índices de similaridad basados en trayectorias espaciales de estado reconstruidas de señales observadas) han sido usados26,27. Algunos estudios muestran que los métodos no lineales (coeficiente de correlación no lineal, entropía de transferencia, sincronización de fase e información mutua) son más eficientes para medir la conectividad que los métodos lineales (como el coeficiente de correlación cruzada) en los grafoelementos epileptiformes interictales provenientes de datos de EEG-denso no invasivo26,28. Las correlaciones entre las series de tiempo pueden ser estimadas directamente en las series de tiempo, en el dominio de la frecuencia o en «wavelets», donde la resolución temporal puede ser adaptada como función de la frecuencia29,30.
Análisis de causalidadLas relaciones causales y la dirección del flujo de información dentro de una serie temporal multivariada han sido bien estudiadas bajo el concepto de causalidad grangiana31; este enfoque tiene importantes aplicaciones en neurociencia, incluyendo el estudio de la epilepsia32. La causalidad de Granger es un concepto estadístico basado en la predicción. De acuerdo con este concepto, si una señal X1 «causa de Granger» (o «G-causa») y una señal X2 existen, y los valores pasados de X1 contienen información que ayuda a predecir X2 más allá de la información de valores pasados de X2, entonces X1 actúa como causa de X2. La formulación matemática está basada en la regresión lineal de procesos estocásticos31. Por otro lado, la definición de causalidad de Granger ha sido extendida a casos no lineales en el dominio del tiempo y de la frecuencia, basados en estadísticos no paramétricos32. Dos de estas técnicas son la función de transferencia directa para estimar las relaciones de recorridos directos sobre recorridos indirectos33 y la frecuencia en la coherencia directa parcial32. La causalidad de Granger ayudó a localizar las redes ictales a partir de datos interictales, como fue demostrado en un trabajo publicado en 16 de 25 pacientes con epilepsia focal34.
Análisis basado en teoría de grafosEl campo de la teoría de grafos tiene sus inicios en 1735, cuando Leonhard Euler resolvió el mítico problema de los puentes de Königsberg. Este problema consistió en preguntar si los 7 puentes de Königsberg, una ciudad ahora llamada Kaliningrad, podían ser atravesados en un recorrido, de tal manera que se atravesará cada puente una y solo una vez, después de haber reformulado las masas de tierra como «nodos» y los puentes como «bordes»; probó que era posible. En teoría de grafos, una gráfica G es definida como un conjunto de vértices (nodos) y aristas que los conectan, por ejemplo, G=(V, E), donde V denota un conjunto finito de vértices y E denota un el conjunto de aristas entre ellos, con E siendo un subconjunto del producto cartesiano V×V de pares de distintos nodos. G es usado para representar las dependencias condicionales entre los nodos; específicamente, cada arista o conexión entre nodos representa dicha relación de dependencia condicional. Este enfoque permite el análisis estructural y funcional a diferentes niveles de complejidad. Dependiendo de la aplicación neurológica, se pueden construir redes que estén dirigidas o no dirigidas, pero usualmente se utilizan redes recíprocas (no dirigidas)35,36.
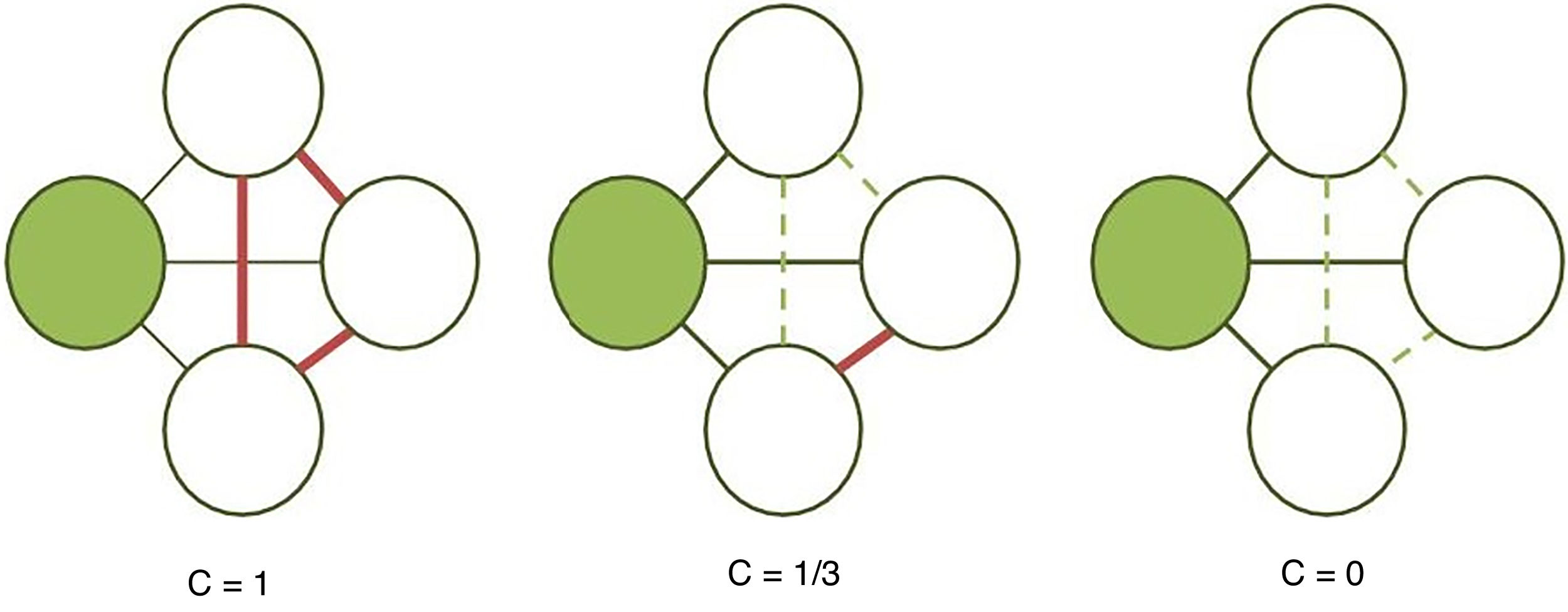
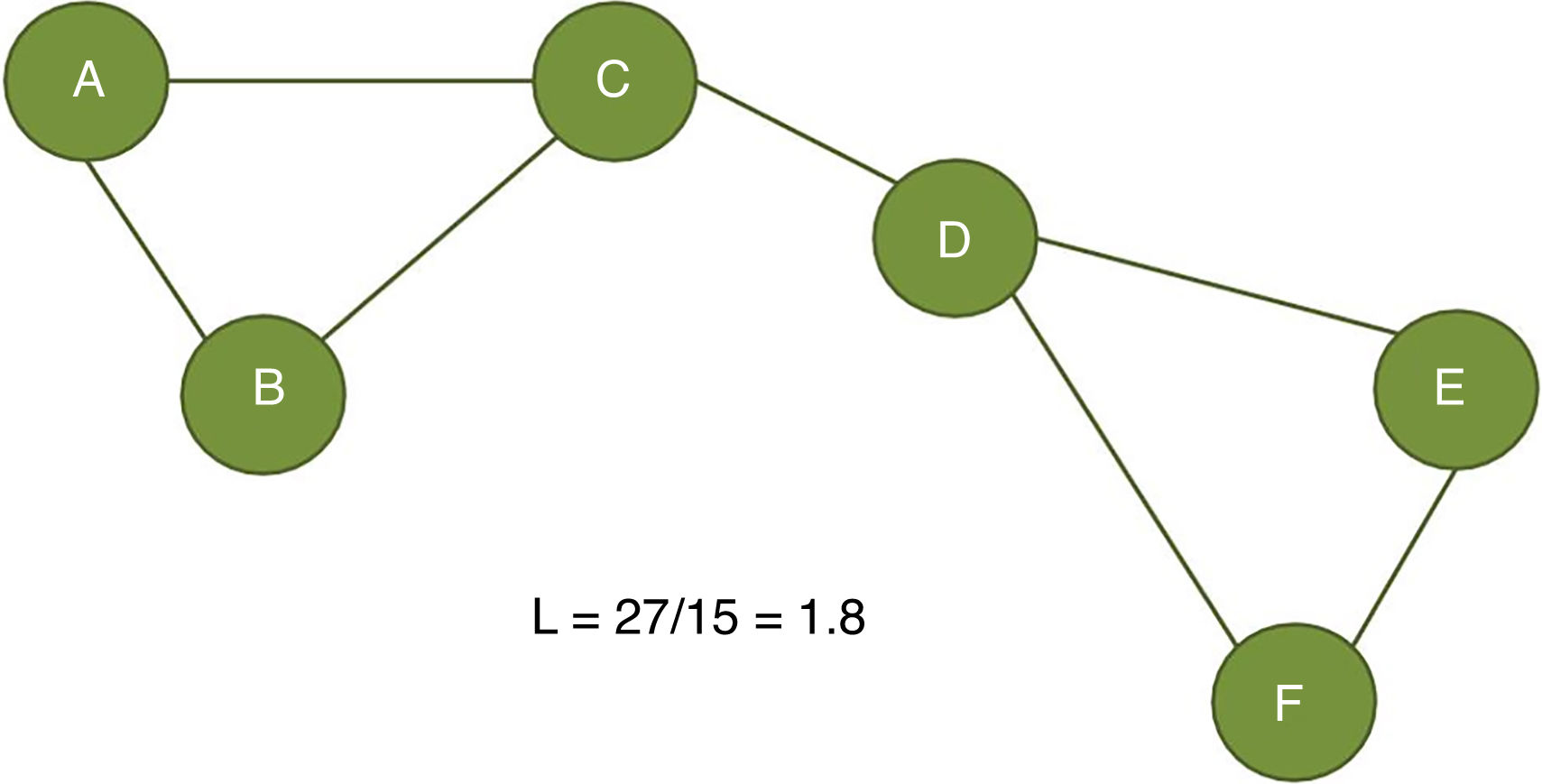
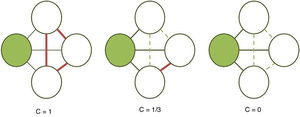
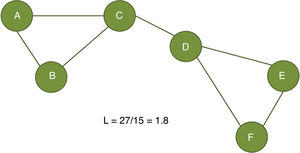
El coeficiente de agrupamiento (fig. 2) y la longitud media de trayectoria (fig. 3) están entre los parámetros más usados en la teoría de grafos. Para un nodo dado, las medidas de agrupamiento miden la densidad de conexión entre sus nodos vecinos; se relaciona la eficiencia local y cuantifica cuán robustamente una red compensaría la pérdida de un nodo dado37. El coeficiente de agrupamiento general es el promedio de todos los coeficientes de agrupamiento individuales de los nodos. El ejemplo contrasta un nodo con alto coeficiente de agrupamiento contra uno de bajo coeficiente. La longitud de la trayectoria característica cuantifica el valor promedio de la longitud de los caminos más pequeños entre todos los pares posibles de nodos para una red dada. Las redes con longitudes de camino más cortas son consideradas globalmente eficientes38. La interacción entre el agrupamiento y la longitud del camino pueden caracterizar la topología de una red. Las redes de enrejado regular tienen alto agrupamiento y longitud de camino; las redes aleatorias, por otro lado, tienen bajo agrupamiento y longitud de camino. Las redes tipo «pequeño-mundo» tienen altos índices de agrupamiento y baja longitud de camino y por ello combinan una organización local y global eficiente21,38. En una escala intermedia, se pueden evaluar comunidades de nodos; nodos dentro de un módulo están más densamente conectados entre ellos que a nodos de un módulo distinto39,40.
Cálculo del coeficiente de agrupamiento (C). Se calcula para un nodo sombreado dado como la proporción de conexiones (líneas continuas gruesas) entre sus vecinos (nodos blancos), siendo 1 en la primera red debido a que todas las conexiones posibles están establecidas, 1/3 en la segunda porque solo 1 de 3 posibles conexiones existe y 0 en la última ya que nos nodos blancos no están conectados (líneas discontinuas).
Estudios iniciales han recolectado evidencia de que las epilepsias focales están asociadas con alteraciones en la red topológica en el cerebro entero38. La teoría de grafos puede ser usada en el periodo interictal41, ictal42 y preictal43. Una de las mayores ventajas de la teoría de grafos es resumir las interacciones complejas de la información del cerebro provenientes de neuroimagen o test neurofisiológicos; sin embargo, aún existen limitaciones en la interpretación de resultados35,36,38.
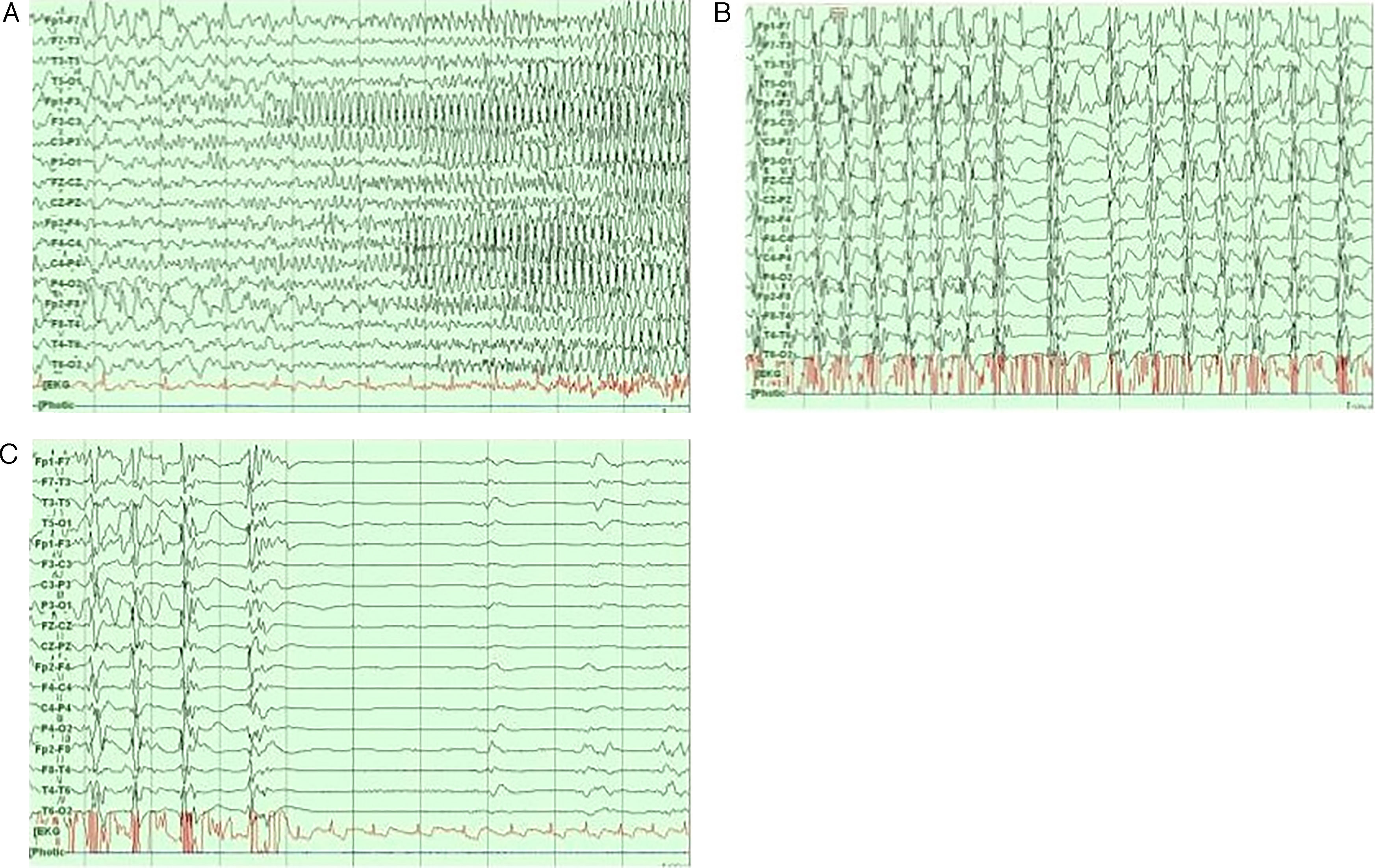
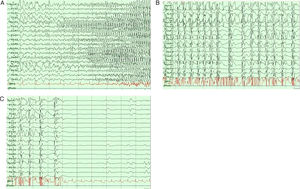
Redes neurofisiológicas en crisis epilépticasLa epilepsia focal y la generalizada tienen distintos patrones electroencefalográficos durante los periodos interictales e ictales44 (fig. 4). Recientemente, las investigaciones se han enfocado en grabaciones de EEG de banda ancha para medir las oscilaciones de alta frecuencia (HFO, por sus siglas en inglés) en el rango de 80 a 600Hz45,46. Este fenómeno está relacionado a muchas manifestaciones fisiológicas y patológicas, especialmente, las ondas rápidas (250-600Hz) parecen reflejar procesos patológicos relacionados con la epileptogenicidad46.
En el estudio de estéreo-EEG el patrón más común durante los eventos ictales fueron las descargas rápidas de bajo voltaje, que son frecuentemente precedidas por picos, trenes o complejos de onda lenta47. Las frecuencias de las descargas rápidas de bajo voltaje oscilan en el rango beta (15-30Hz, p. ej., en crisis epilépticas temporales mesiales) a frecuencias mayores (gamma, 30-100Hz en crisis epilépticas neocorticales)47,48. Durante el comienzo de la crisis epiléptica, usando estéreo-EEG, es posible utilizar el método del índice epileptogénico, que combina el análisis espectral y temporal, relacionado a la propensión de un área cerebral de generar descargas rápidas (12,4-97Hz) para predecir la primera zona de inicio de crisis epiléptica47,49. Al añadir datos de neuroimagen es posible realizar mapas estadísticos paramétricos de HFO al inicio de las crisis epilépticas, estos son llamados mapas epileptogénicos21. Por ejemplo, Aubert et al. (2009) usaron el cálculo original del índice epileptogénico en 36 pacientes con malformaciones debidas a displasia cortical mediante estéreo-EEG; encontraron que el 30% de ellos tuvieron una organización de ZE estrictamente focal, mientras que en el resto fueron halladas más de una región epileptogénica, revelando una red o una organización de zonas epileptogénicas bilaterales50. En otro estudio comparando a 15 pacientes con epilepsia mesial temporal bilateral (BTLE) y 15 pacientes con epilepsia mesial temporal unilateral (UTLE), los autores encontraron que los pacientes con UTLE presentaron más frecuentemente epileptogenicidad máxima en estructuras hipocampales, mientras los pacientes con BTLE tuvieron valores máximos en áreas subhipocampales (córtex entorrinal, polo temporal y córtex parahipocampal)51. En pacientes con epilepsia temporal neocortical y MRI negativa, el índice de epileptogenicidad es mayor comparado con pacientes con esclerosis hipocampal52. Esto es evidente también en otras epilepsias focales como la focal frontal53, parietal54 y occipital55.
El pronóstico posquirúrgico se encuentra relacionado con el número de zonas epileptogénicas en la epilepsia del lóbulo temporal, las epilepsias focales tienen mejores resultados50,52. El índice de epileptogenicidad puede ser usado también con señales MEG, por ejemplo, Bouet et al. (2017) estudiaron las relaciones espaciales entre el volumen de pico de MEG, la locación de la zona de inicio de crisis epiléptica determinada con el índice epileptogénico y el volumen lesional delineado del cerebro con MRI en 11 pacientes con displasia cortical. Exploraciones con estéreo-EEG demostraron correlaciones significativas entre la actividad de los grafoelementos epileptiformes en la MEG y el índice de epileptogenicidad en 8 de 11 pacientes; 7 de 8 con buenos resultados quirúrgicos56. Recientemente, la técnica de estéreo-EEG y sus índices han sido aplicados en la evaluación de fallos de cirugía de epilepsia57.
Actualmente, algunos modelos computacionales ofrecen un marco para investigar la influencia de las redes neuronales, así como las propiedades del tejido local y a explorar estrategias alternativas de resección58. Sin embargo, se necesita validar estos modelos computacionales in vivo en animales con epilepsia o en el ambiente clínico.
Conectividad funcional durante crisis epilépticasLa definición actual de crisis epiléptica está basada en la actividad neuronal excesiva o anormalmente sincronizada en el cerebro3. Al inicio de la crisis epiléptica se genera un dramático decremento de la sincronía entre las estructuras cerebrales59. Sin embargo, hay mayor sincronización durante la diseminación de la crisis epiléptica y su terminación37,60. Por otra parte, esta información se encuentra limitada principalmente a las epilepsias del lóbulo temporal pues es la indicación más común para la evaluación prequirúrgica14,48. Estos hallazgos han sido observados en otras epilepsias focales en los lóbulos frontal y occipital60 y se espera que sea más común que con la utilización de EEG estándares61.
Estudios en animales y humanos muestran evidencia de que la zona de inicio de crisis epiléptica está funcionalmente organizada en pequeños grupos neuronales que tienen un disparo sincrónico agrupado en pequeños microdominios (< 1mm de diámetro) presentes durante la epileptogénesis e ictogénesis59. No obstante, su papel preciso en la génesis y la propagación de las crisis epilépticas aún no está establecido. Por ejemplo, es posible que, en vez de expandirse hacia afuera desde un sitio cortical restringido, las crisis epilépticas se desarrollen a partir de uniones de microdominios espacialmente separados62.
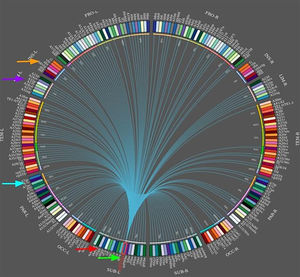
Durante las crisis epilépticas de lóbulo temporal hay una fuerte correlación entre el tálamo y las estructuras del lóbulo temporal, que se pueden manifestar clínicamente como posturas distónicas. Las redes neuronales predicen el resultado quirúrgico. En un estudio de casos y controles, de 26 pacientes prequirúrgicos con epilepsia mesial del lóbulo temporal (mTLE) y 44 controles sanos, se obtuvieron datos de MRI a 3T de conectividad funcional y estructural a lo largo de una red de 8 regiones de propagación de crisis epilépticas en mTLE, que incluyeron el hipocampo, la ínsula, el tálamo, el precúneo y el cingulado medio (fig. 5)63, los autores confirmaron que los patrones de propagación de la red entera eran consistentes con el modelo mTLE que predecía fallo quirúrgico64,65. Aún así, otros estudios en pacientes con mTLE mostraron que los ganglios basales no generan actividad epiléptica específica en los EEG. A pesar de la ausencia de grafoelementos epileptiformes, los ganglios basales reflejan cambios en la distribución de la actividad epiléptica ictal66.
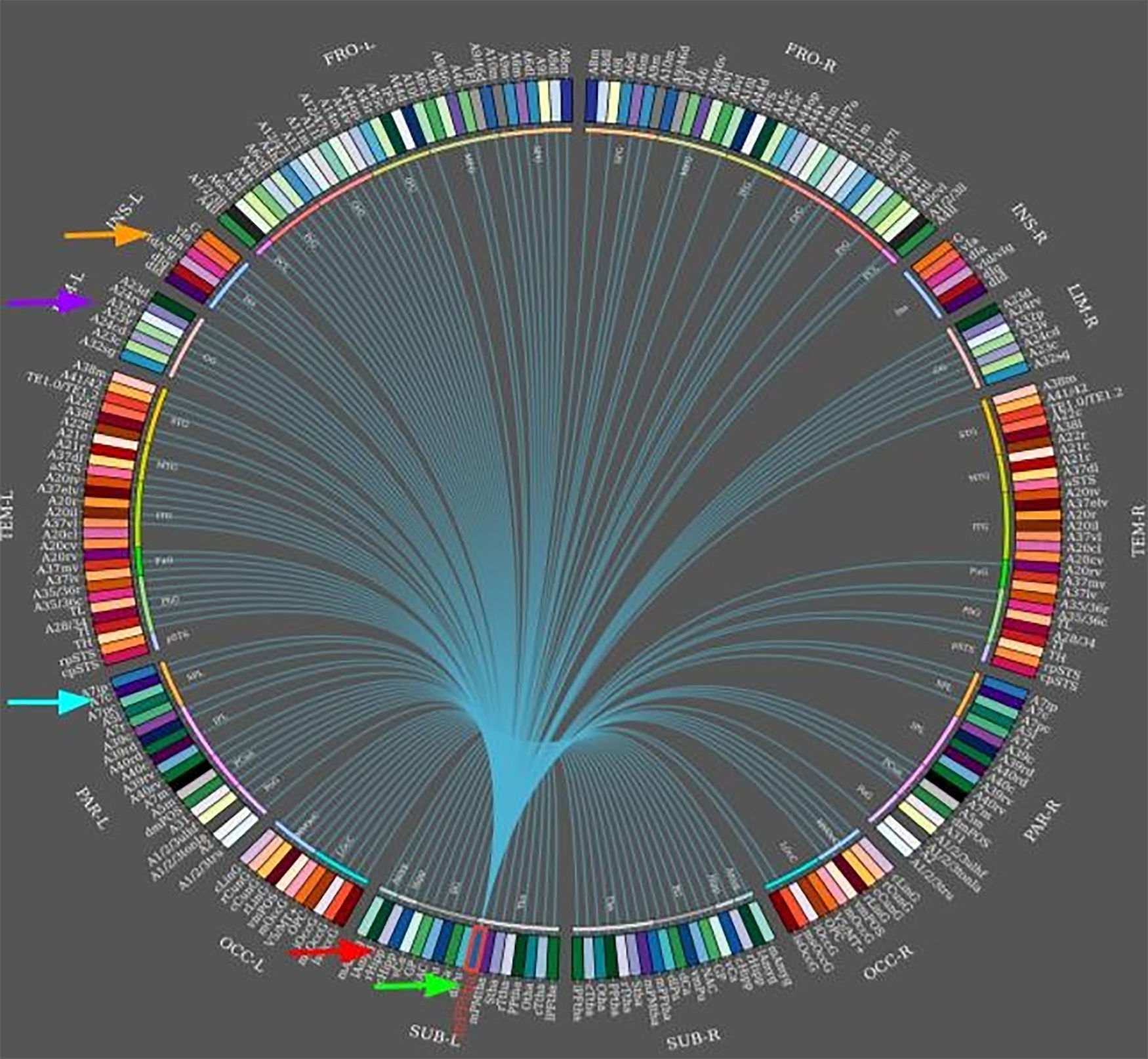
Conectoma del tálamo frontomedial izquierdo (flecha inferior). Se muestran enlaces hacia distintas áreas conectadas (en dirección de las manecillas del reloj, desde la flecha inferior): el hipocampo, el precúneo, el cingulado y la ínsula (flecha superior). Diagrama creado con software Brainnetome.
Las descargas interictales epileptiformes (DEI) son biomarcadores de epilepsia; usualmente se limitan a mostrar la zona irritativa, en ciertas ocasiones se sobreponen con la ZE y otras zonas descritas anteriormente7,67. Varios estudios de epilepsia en el lóbulo temporal68 y extratemporal69,70 muestran una distribución interictal compleja entre ambas cortezas mediales y laterales o entre zonas corticales y subcorticales70. Las regiones cerebrales que presentan DEI usualmente muestran un incremento de la sincronicidad interictal en estructuras dentro de la zona epileptiforme en pacientes con mTLE comparados con epilepsias neocorticales, y se encuentran relacionadas con la duración de la epilepsia71. Estos patrones de conectividad funcional a lo largo de las DEI pueden aplicarse para potencialmente comprender el mecanismo de las terapias de neuromodulación como la VNS72 o estimulación cerebral profunda. En un pequeño estudio que incluyó a 5 pacientes con epilepsia, quienes tuvieron estéreo-EEG durante la terapia VNS, donde la conectividad funcional fue analizada a partir de electrodos profundos, se encontró que la conectividad funcional disminuyó durante la terapia VNS y se relacionó la respuesta del paciente, sugiriendo que el impacto de esta terapia podría estar relacionado con este mecanismo. De otra manera, durante la estimulación cerebral profunda del núcleo anterior del tálamo en pacientes con epilepsia, los autores observaron que la terapia exitosa en pacientes producía un incremento de la conectividad en la red modo «reposo», para explicar lo anterior, la hipótesis de trabajo fue que esta red incrementa el punto de quiebre para la propagación de crisis epilépticas73.
Se debe tener precaución en extrapolar estos descubrimientos a todos los tipos de epilepsia o síndromes epilépticos. Varios patrones de inicio de crisis epilépticas con regiones específicas de inicio de epilepsia son conocidos, pero podrían tener mecanismos celulares, de redes y de sincronización diversos46,59. Por ejemplo, en la epilepsia mioclónica juvenil no medicada, un incremento en la conectividad funcional ha sido descrita a través de áreas corticales específicas. Esta anormalidad interictal incrementa en el estado preictal. Los estadísticos de gráficas de nodos mostraron una dinámica neuronal anormal en el área cortical, que es la zona de inicio ictal en este tipo de epilepsia generalizada74.
Actualmente, la relación compleja entre epilepsia, etiologías, agentes antiepilépticos y duración de la enfermedad es desconocida. Sin embargo, el análisis de redes de epilepsia podría ser más relevante en pacientes sin lesiones cerebrales75 o en condiciones críticas como el estatus epiléptico76.
AutoríaTodos los autores listados han hecho contribuciones sustanciales, directas e intelectuales al trabajo y lo aprueban para su publicación.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran que la investigación fue conducida en la ausencia de cualquier relación comercial o financiera que pudiera constituir un potencial conflicto de interés.
Ninguno.