El objetivo de este trabajo es presentar las características clínicas del dolor de miembro fantasma (DMF) en pacientes amputados.
MaterialSe presenta un estudio observacional transversal retrospectivo de pacientes con amputación de miembro inferior. Se incluyeron pacientes entre 18 y 80 años con amputación uni o bilateral entre los años 2015 y 2019. Se recogieron datos demográficos, antecedentes médicos, datos relacionados con la amputación y sensaciones anormales relacionadas.
ResultadosSe estudiaron 43 pacientes (34 varones) y 53 amputaciones, con una edad media de 62 años y con un tiempo trascurrido desde la amputación de 28 meses. La causa más frecuente de amputación fue la isquémica (70%). Veintitrés (60%) pacientes presentaba DMF, que se inició un mes tras la amputación. En 3 pacientes se encontró una resolución completa del DMF. El DMF presentaba una intensidad media de 3,9 en la escala EVA, con una frecuencia diaria en 15 pacientes. El 91% de los pacientes presentaba sensaciones no dolorosas en relación con el miembro fantasma. No se encontraron diferencias en el desarrollo del DMF entre la 1.ª y 2.ª amputación. Se encontró una asociación significativa entre el desarrollo de DMF y el dolor de miembro residual.
ConclusionesEl DMF es una afección prevalente entre pacientes amputados con tendencia a cronificarse, por lo que es imprescindible su atención multidisciplinar con participación neurológica activa. Se precisan estudios que profundicen en el conocimiento de los factores favorecedores del desarrollo del DMF para focalizar terapias precoces y dirigidas para prevenir la aparición de DMF.
The aim of this research is to present the clinical characteristics of Phantom Limb Pain (PLP) in patients with amputation.
MaterialA retrospective cross-sectional observational study of patients with lower limb amputation is presented. Patients between 18 and 80 years of age with unilateral or bilateral amputation between the years 2015 and 2019 were included. Demographic data, medical history, data related to the amputation, and related abnormal sensations were collected.
Results43 patients (34 men) and 53 amputees were studied, with a mean age of 62 years, with a time elapsed since amputation of 28 months. The most frequent cause of amputation was ischemic (70%). Twenty-three (60%) patients had PLP that began 1 month after amputation with a mean intensity of 3.9 on the VAS scale, in 15 patients the PLP was daily, three patients recognized the disappearance of PLP. 91% of the patients presented non-painful sensations in relation to the phantom limb. No differences were found in the development of the PLP between the 1st and 2nd amputation. A significant association was found between the development of PLP and residual limb pain.
ConclusionsPLP is a prevalent pathology among amputee patients, therefore multidisciplinary care with an active neurologic participation is essential. Studies are needed to deepen the knowledge of the factors that favour the development of PLP in order to focus early and targeted therapies to prevent the appearance of PLP.
El concepto de miembro fantasma fue sugerido por primera por el cirujano francés Ambrosie Pare en el siglo xvi, aunque se debe a Weir Mitchell, en 1872, la primera descripción detallada, cuando utiliza el término sensory ghost para designar estas sensaciones anormales1. Sin embargo, el término «miembro fantasma» fue acuñado por Bailey y Moersch en el año 19412, refiriéndose al desarrollo de sensaciones anormales en un miembro tras su amputación, denominado síndrome de miembro fantasma (SMF). De estas percepciones anormales en el miembro amputado, la presencia de dolor del miembro fantasma (DMF) es la sensación anormal que conlleva el mayor impacto físico, psíquico y económico, así como un influjo negativo en la calidad de vida del paciente3,4.
A pesar de los años transcurridos desde las primeras descripciones, todavía no existe consenso sobre los mecanismos subyacentes al DMF, ni sobre los enfoques terapéuticos adecuados para aliviar estas sensaciones dolorosas5. Schone et al. han abordado la singularidad de los estudios del dolor en casos de DMF6, puesto que deben abarcar los principales dominios del dolor, como son el sensorial, el emocional y el cognitivo. Además, por las peculiaridades del dolor, existen múltiples factores que modulan la percepción del DMF, como son los factores genéticos, psicológicos o socioculturales7,8. Los estudios de dolor en casos de DMF son de mayor complejidad, puesto que el dolor se origina en el miembro amputado y, por tanto, los circuitos neurosensoriales del dolor se han modificado de manera drástica tras la amputación. Otro factor de dificultad en el acercamiento al SMF es la aparición de otras sensaciones anormales que aparecen tras la amputación, como el dolor de miembro residual (dolor de muñón) (DMR) o las sensaciones fantasmas no dolorosas (SFND) que dificultan la identificación clínica del propio DMF6.
Los estudios desarrollados para conocer la frecuencia y factores de riesgo para desarrollar DMF tras una amputación muestran resultados muy dispares. Limakatso et al., en un metaanálisis reciente, concluyeron que la prevalencia estimada de DMF es del 64%, siendo menos frecuente su aparición en países en vías de desarrollo con respecto a países desarrollados. Por otro lado, los autores confirmaron que la presencia de dolor antes de la cirugía, amputación proximal, amputación del miembro inferior, y la presencia de DMR o SFND son factores de riesgo de aparición de DMF9.
Por todo ello, estudios sobre la frecuencia y características clínicas del DMF en diferentes entornos socioculturales y económicos son imprescindibles para su correcto conocimiento. El objetivo de este artículo es presentar la frecuencia, factores de riesgo y características clínicas para el desarrollo de DMF en una población española con amputación de miembro inferior.
Material y métodoSe trata de un estudio observacional transversal descriptivo retrospectivo de pacientes a los que se realizó una amputación de miembro inferior en un centro de tercer nivel, como es el Hospital Universitario Central de Asturias. Se incluyeron pacientes con edades comprendidas entre 18 y 80 años con amputación uni o bilateral de miembro inferior, cuya cirugía se realizó entre el 1 de enero de 2015 y el 31 de diciembre de 2019. En casos de pacientes con doble amputación se incorporando al estudio las primeras amputaciones realizadas con anterioridad al año 2015. Se excluyeron pacientes con amputación de miembro inferior a nivel interfalángico y pacientes con deterioro cognitivo que imposibilitaba la realización del cuestionario. Los pacientes amputados fueron localizados a través del servicio de documentación y, posteriormente, contactados de forma telefónica para invitarles a participar en el estudio. Las entrevistas tuvieron lugar entre noviembre de 2019 y febrero de 2020. Los cuestionarios se desarrollaron de forma presencial, en el ámbito hospitalario, excepto en 5 pacientes, que se realizaron en sus domicilios ante la imposibilidad para su desplazamiento al hospital.
El estudio recibió la aprobación del Comité de Ética de la Investigación del Principado de Asturias (n° 86/19). Todos los pacientes firmaron el consentimiento informado. En todo momento se garantizó la intimidad de la entrevista y confidencialidad de los datos, acorde a la Declaración de Helsinki y a la legislación española sobre la Protección de Datos (Ley Orgánica 3/2018, del 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales).
Para la evaluación del estudio se desarrolló un cuestionario ad hoc que constaba de los siguientes apartados:
- 1.
Datos demográficos y antecedentes médicos relacionados con la amputación3,10.
- 2.
Datos relacionados con la amputación, como edad y tiempo transcurrido desde la amputación. El nivel de amputación de miembro inferior se dividió en: desarticulación de la cadera, transfemoral, desarticulación de la rodilla, transtibial, desarticulación del tobillo o amputación parcial del pie11. La etiología de amputación se dividió en causa isquémica, traumática, infecciosa o tumoral10,12. También se valoró si el paciente era usuario de prótesis12.
- 3.
Datos clínicos de las sensaciones dolorosas o no dolorosas relacionadas con la amputación. El dolor prequirúrgico (DPE)3,6,9 se definió como la presencia de dolor del miembro a amputar previo a la cirugía. El dolor posquirúrgico (DPO)13 se definió como el dolor experimentado en los 7 días posteriores a la cirugía. El término SMF2,12,14 fue utilizado para designar al conjunto de sensaciones que asientan en la extremidad amputada. El DMF14 se definió como el conjunto de sensaciones dolorosas en la extremidad amputada. El DMR14 se definió como las sensaciones dolorosas de carácter crónico referidas por el paciente sobre el muñón. Las SFND12,14 se definieron como el conjunto de sensaciones no dolorosas localizadas en el miembro amputado. Se analizaron la presencia, duración, momento de aparición y frecuencia para cada sensación anormal. La intensidad de cada tipo de dolor se valoró según la escala visual analógica (EVA) que gradúa la intensidad del dolor desde 0, como ausencia del dolor, hasta 10, como el peor dolor que se pueda imaginar15. El DMF se caracterizó según el Cuestionario del dolor en español16, basado en la validación al castellano del cuestionario para el dolor de McGill17, utilizando descriptores del dolor agrupados en 3 categorías: sensorial, evaluativa y afectiva. Esta escala ayudó a los pacientes a identificar las sensaciones dolorosas que percibían y a describirlas con un lenguaje común. Basándose en las propias vivencias de los pacientes, se les preguntó acerca de factores externos desencadenantes de dolor12,18.
- 4.
Datos relacionados con la presencia de enfermedad psiquiátrica. La presencia de depresión se valoró según la escala de valoración de Hamilton19. Dicha escala consta de 22 ítems que el paciente debe evaluar con una gradación de 0-4, oscilando sus resultados entre 0-7 (no depresión), 8-13 (depresión ligera), 14-18 (depresión moderada), 19-22 (depresión severa) y 23-52 (depresión muy severa y con riesgo de suicidio). Para estimar la ansiedad se utilizó la escala de autoevaluación de Zung20. Consta de 20 enunciados con respuestas predeterminadas valoradas del 1 al 4, oscilando los resultados finales entre una puntuación 20-28 (ansiedad ausente), 29-41 (ansiedad leve), 42-53 (ansiedad moderada) y 53-80 (ansiedad grave).
- 5.
Datos relacionados con el tratamiento. Se recogió la utilización de medidas terapéuticas farmacológicas para el tratamiento sintomático del DMF5,9,21.
Se realizó un análisis descriptivo del total de la muestra, proporcionando media y desviación estándar para las variables numéricas y frecuencia absoluta y porcentual para las variables categóricas. Para los pacientes doblemente amputados se realizó un análisis descriptivo de las características de ambas amputaciones.
Se aplicaron modelos de regresión logística binaria univariable para comprobar la existencia de asociación entre la aparición de DMF y otros factores relacionados con la amputación, tales como DPE, DPO, DMR, uso de prótesis y depresión. Los resultados se presentan mediante odds ratio, su intervalo de confianza del 95% y valor de p. En el caso de un valor de p inferior a 0,05, la asociación se consideró estadísticamente significativa.
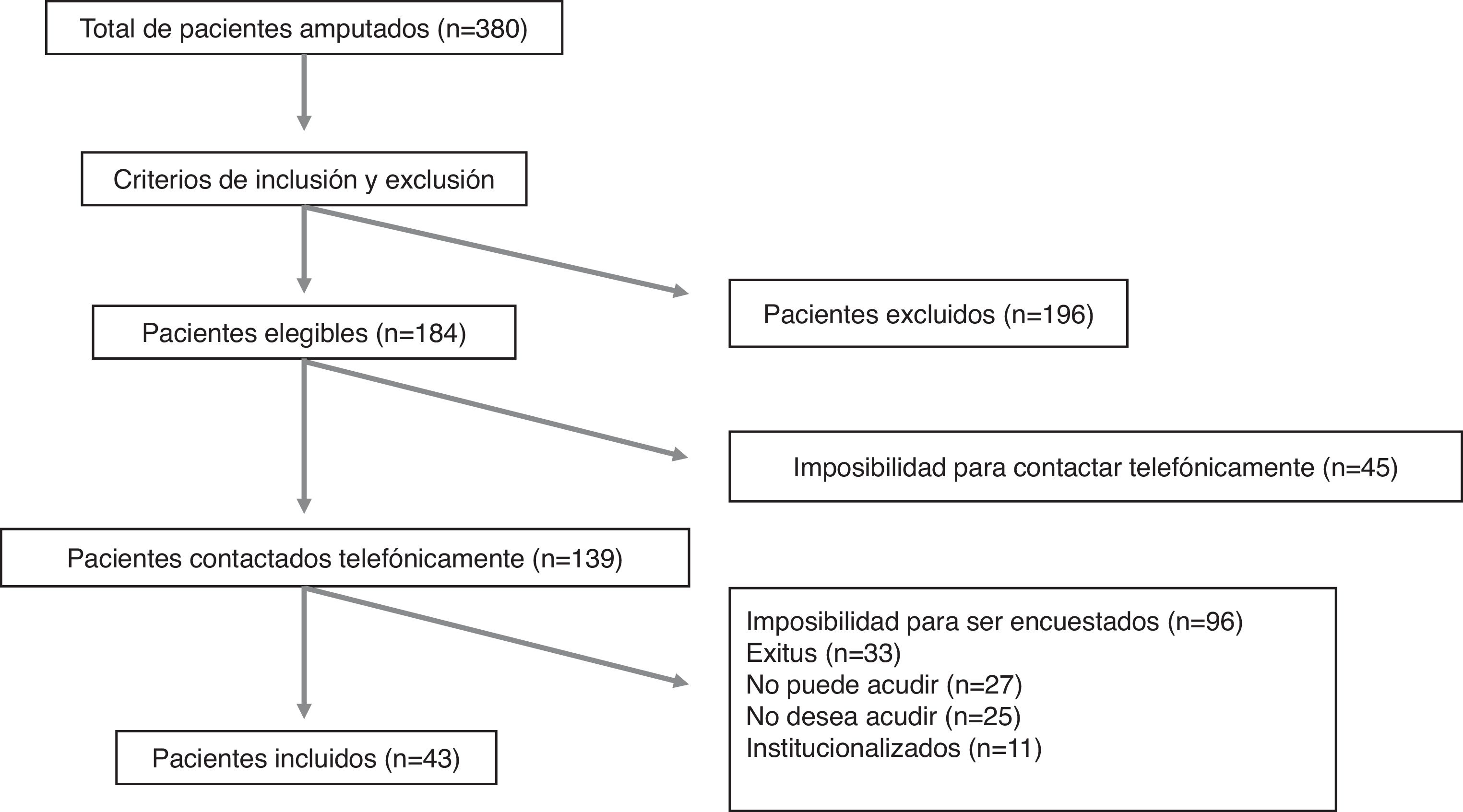
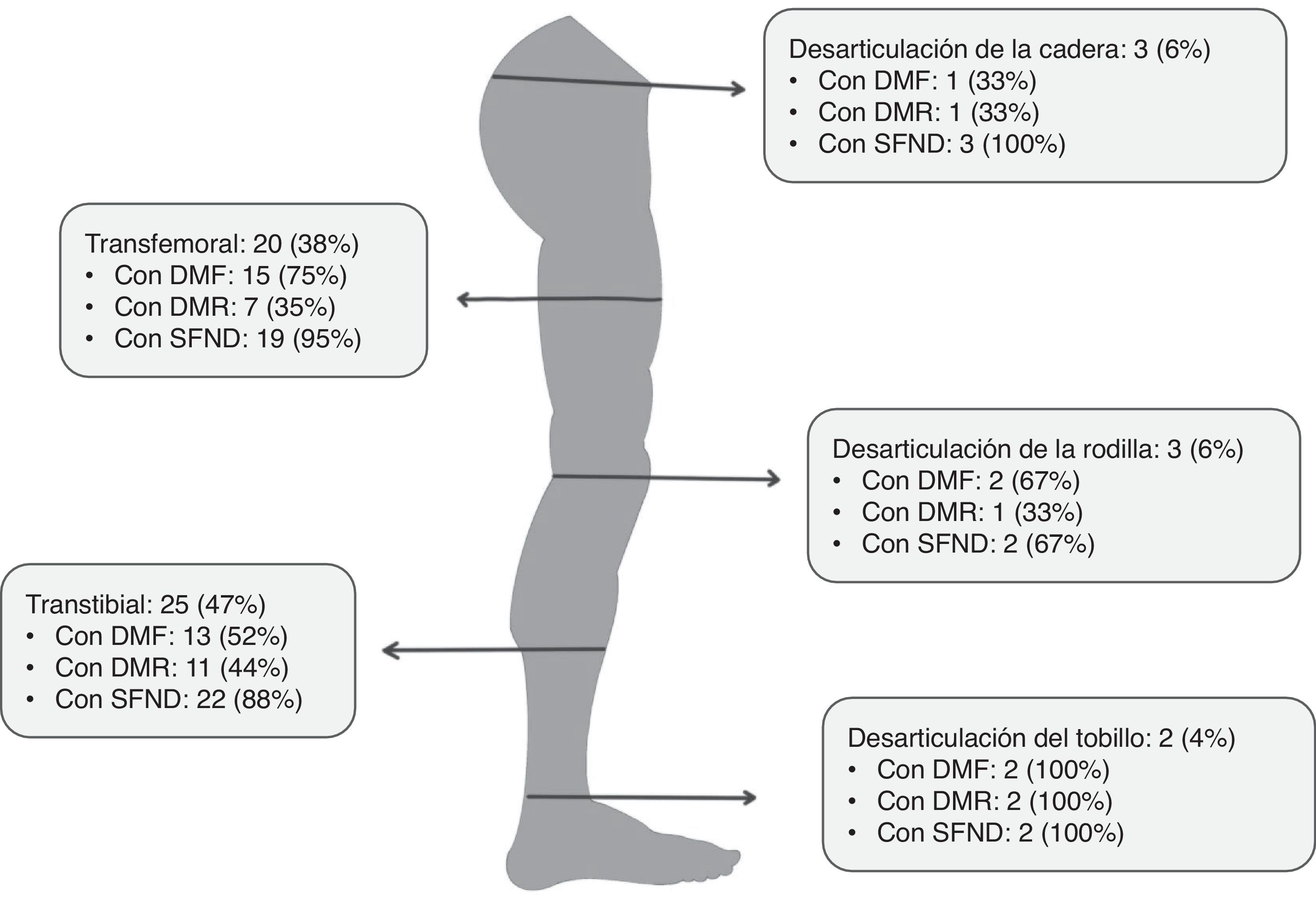
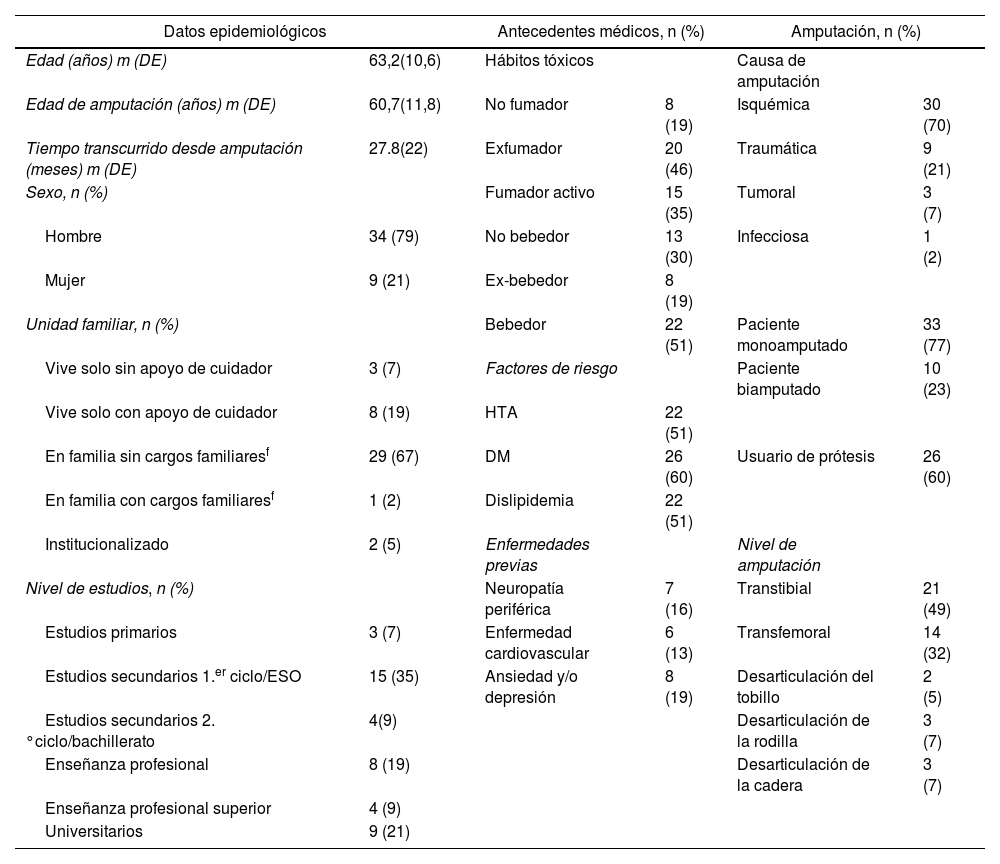
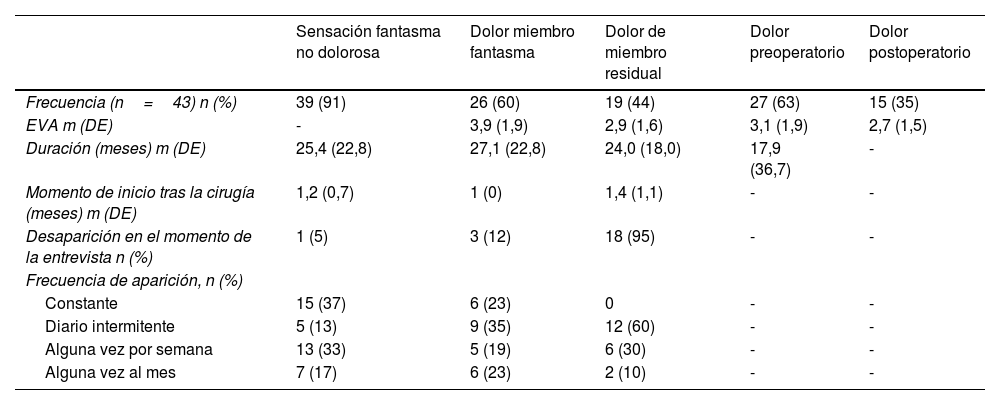
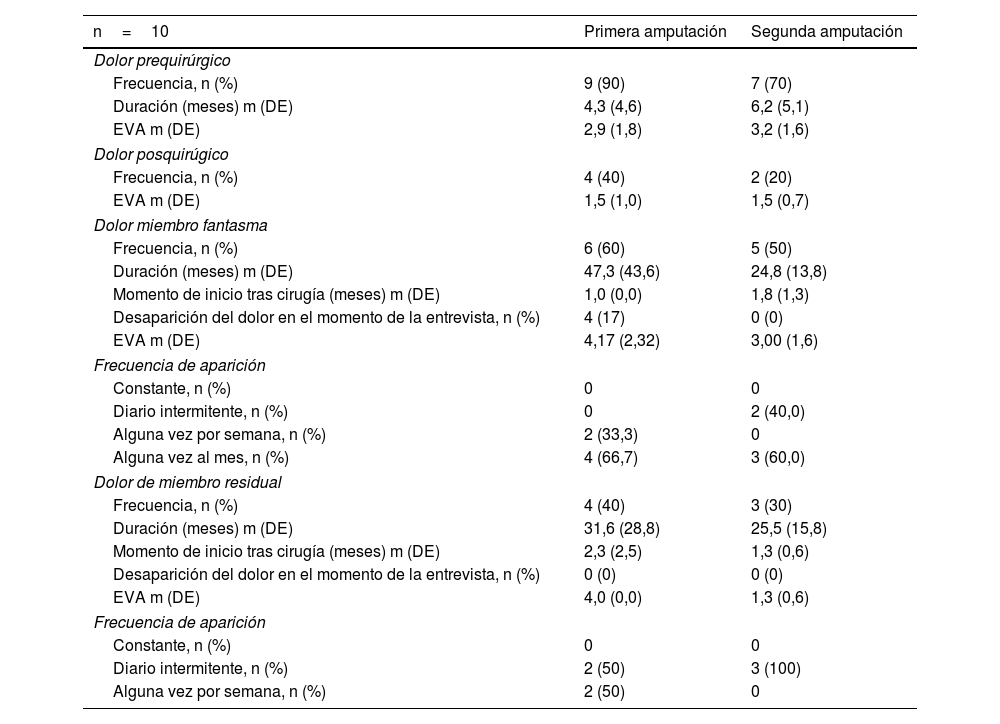
ResultadosSe registraron 380 pacientes con amputaciones de miembro inferior. En la figura 1 se aprecia el flujo de selección de pacientes. Se analizó una cohorte de 43 pacientes y 53 amputaciones, presentando 10 pacientes amputación de ambos miembros inferiores. Las dobles amputaciones se realizaron en actos quirúrgicos diferentes. En la tabla 1 se muestran los datos clínicos relacionados con la primera amputación de los 43 pacientes. Todos los pacientes presentaron algún tipo de clínica, dolorosa o no, relacionada con la amputación. El DMF fue referido por 26 (60%) pacientes, de los cuales solo 3 (12%) reconocían la desaparición completa del DMF. La tabla 2 muestra las características clínicas de la sintomatología asociada a la amputación. De los 10 pacientes doblemente amputados, 9 fueron hombres. El tiempo medio transcurrido entre ambas amputaciones fue de 25,7 (30,2) meses. En la tabla 3 se muestran las características de la primera y segunda amputación para los pacientes que sufrieron doble amputación. Tres de los pacientes doblemente amputados sufrieron la primera amputación previa a 2015. En la figura 2 se muestra la frecuencia de cada uno de los componentes del SMF según el nivel de amputación.
Características clínicas relacionadas con la primera amputación
| Datos epidemiológicos | Antecedentes médicos, n (%) | Amputación, n (%) | |||
|---|---|---|---|---|---|
| Edad (años) m (DE) | 63,2(10,6) | Hábitos tóxicos | Causa de amputación | ||
| Edad de amputación (años) m (DE) | 60,7(11,8) | No fumador | 8 (19) | Isquémica | 30 (70) |
| Tiempo transcurrido desde amputación (meses) m (DE) | 27.8(22) | Exfumador | 20 (46) | Traumática | 9 (21) |
| Sexo, n (%) | Fumador activo | 15 (35) | Tumoral | 3 (7) | |
| Hombre | 34 (79) | No bebedor | 13 (30) | Infecciosa | 1 (2) |
| Mujer | 9 (21) | Ex-bebedor | 8 (19) | ||
| Unidad familiar, n (%) | Bebedor | 22 (51) | Paciente monoamputado | 33 (77) | |
| Vive solo sin apoyo de cuidador | 3 (7) | Factores de riesgo | Paciente biamputado | 10 (23) | |
| Vive solo con apoyo de cuidador | 8 (19) | HTA | 22 (51) | ||
| En familia sin cargos familiaresf | 29 (67) | DM | 26 (60) | Usuario de prótesis | 26 (60) |
| En familia con cargos familiaresf | 1 (2) | Dislipidemia | 22 (51) | ||
| Institucionalizado | 2 (5) | Enfermedades previas | Nivel de amputación | ||
| Nivel de estudios, n (%) | Neuropatía periférica | 7 (16) | Transtibial | 21 (49) | |
| Estudios primarios | 3 (7) | Enfermedad cardiovascular | 6 (13) | Transfemoral | 14 (32) |
| Estudios secundarios 1.er ciclo/ESO | 15 (35) | Ansiedad y/o depresión | 8 (19) | Desarticulación del tobillo | 2 (5) |
| Estudios secundarios 2.°ciclo/bachillerato | 4(9) | Desarticulación de la rodilla | 3 (7) | ||
| Enseñanza profesional | 8 (19) | Desarticulación de la cadera | 3 (7) | ||
| Enseñanza profesional superior | 4 (9) | ||||
| Universitarios | 9 (21) | ||||
DE: desviación estándar; DM: diabetes mellitus; HTA: hipertensión arterial; M: media.
Características clínicas de la sintomatología asociada a la primera amputación
| Sensación fantasma no dolorosa | Dolor miembro fantasma | Dolor de miembro residual | Dolor preoperatorio | Dolor postoperatorio | |
|---|---|---|---|---|---|
| Frecuencia (n=43) n (%) | 39 (91) | 26 (60) | 19 (44) | 27 (63) | 15 (35) |
| EVA m (DE) | - | 3,9 (1,9) | 2,9 (1,6) | 3,1 (1,9) | 2,7 (1,5) |
| Duración (meses) m (DE) | 25,4 (22,8) | 27,1 (22,8) | 24,0 (18,0) | 17,9 (36,7) | - |
| Momento de inicio tras la cirugía (meses) m (DE) | 1,2 (0,7) | 1 (0) | 1,4 (1,1) | - | - |
| Desaparición en el momento de la entrevista n (%) | 1 (5) | 3 (12) | 18 (95) | - | - |
| Frecuencia de aparición, n (%) | |||||
| Constante | 15 (37) | 6 (23) | 0 | - | - |
| Diario intermitente | 5 (13) | 9 (35) | 12 (60) | - | - |
| Alguna vez por semana | 13 (33) | 5 (19) | 6 (30) | - | - |
| Alguna vez al mes | 7 (17) | 6 (23) | 2 (10) | - | - |
DE: desviación estándar; M: media.
Características clínicas de las sensaciones dolorosas relacionadas con la primera y segunda amputación para los pacientes que sufrieron doble amputación
| n=10 | Primera amputación | Segunda amputación |
|---|---|---|
| Dolor prequirúrgico | ||
| Frecuencia, n (%) | 9 (90) | 7 (70) |
| Duración (meses) m (DE) | 4,3 (4,6) | 6,2 (5,1) |
| EVA m (DE) | 2,9 (1,8) | 3,2 (1,6) |
| Dolor posquirúgico | ||
| Frecuencia, n (%) | 4 (40) | 2 (20) |
| EVA m (DE) | 1,5 (1,0) | 1,5 (0,7) |
| Dolor miembro fantasma | ||
| Frecuencia, n (%) | 6 (60) | 5 (50) |
| Duración (meses) m (DE) | 47,3 (43,6) | 24,8 (13,8) |
| Momento de inicio tras cirugía (meses) m (DE) | 1,0 (0,0) | 1,8 (1,3) |
| Desaparición del dolor en el momento de la entrevista, n (%) | 4 (17) | 0 (0) |
| EVA m (DE) | 4,17 (2,32) | 3,00 (1,6) |
| Frecuencia de aparición | ||
| Constante, n (%) | 0 | 0 |
| Diario intermitente, n (%) | 0 | 2 (40,0) |
| Alguna vez por semana, n (%) | 2 (33,3) | 0 |
| Alguna vez al mes, n (%) | 4 (66,7) | 3 (60,0) |
| Dolor de miembro residual | ||
| Frecuencia, n (%) | 4 (40) | 3 (30) |
| Duración (meses) m (DE) | 31,6 (28,8) | 25,5 (15,8) |
| Momento de inicio tras cirugía (meses) m (DE) | 2,3 (2,5) | 1,3 (0,6) |
| Desaparición del dolor en el momento de la entrevista, n (%) | 0 (0) | 0 (0) |
| EVA m (DE) | 4,0 (0,0) | 1,3 (0,6) |
| Frecuencia de aparición | ||
| Constante, n (%) | 0 | 0 |
| Diario intermitente, n (%) | 2 (50) | 3 (100) |
| Alguna vez por semana, n (%) | 2 (50) | 0 |
DE: desviación estándar; EVA: Escala visual analógica; M: media.
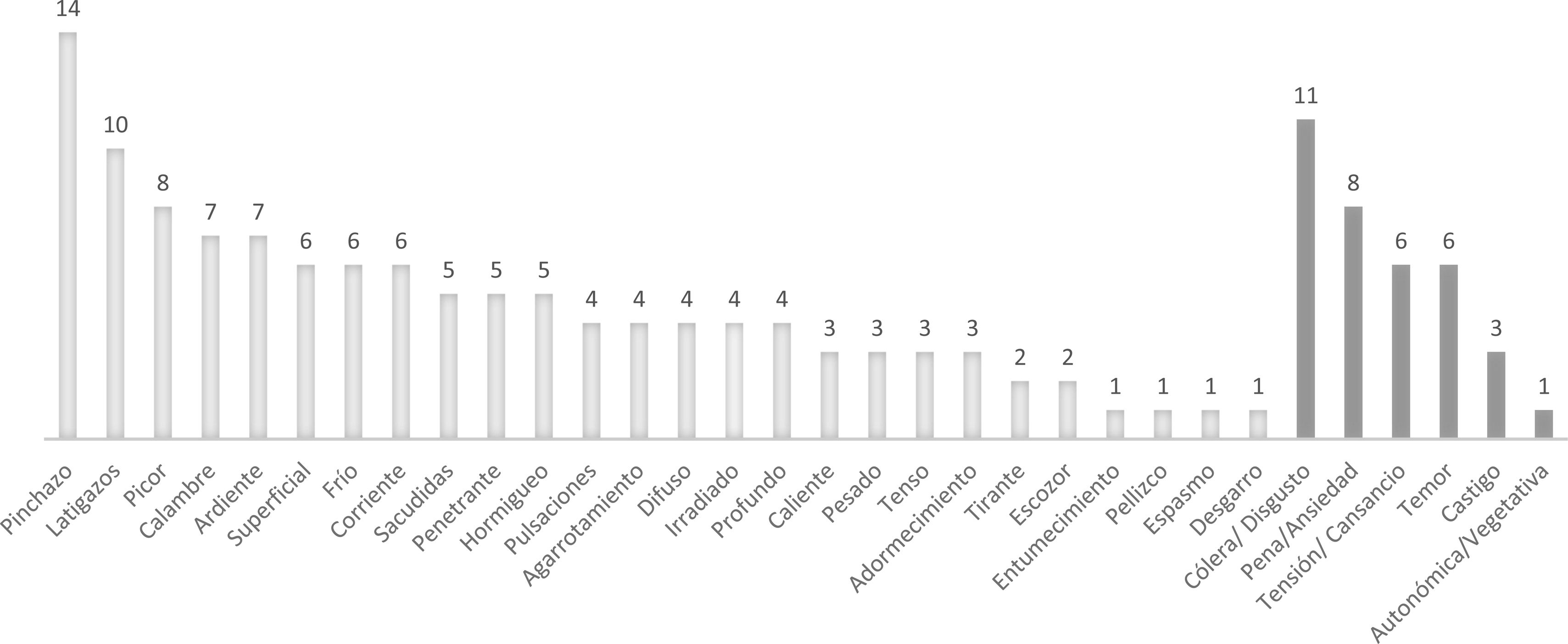
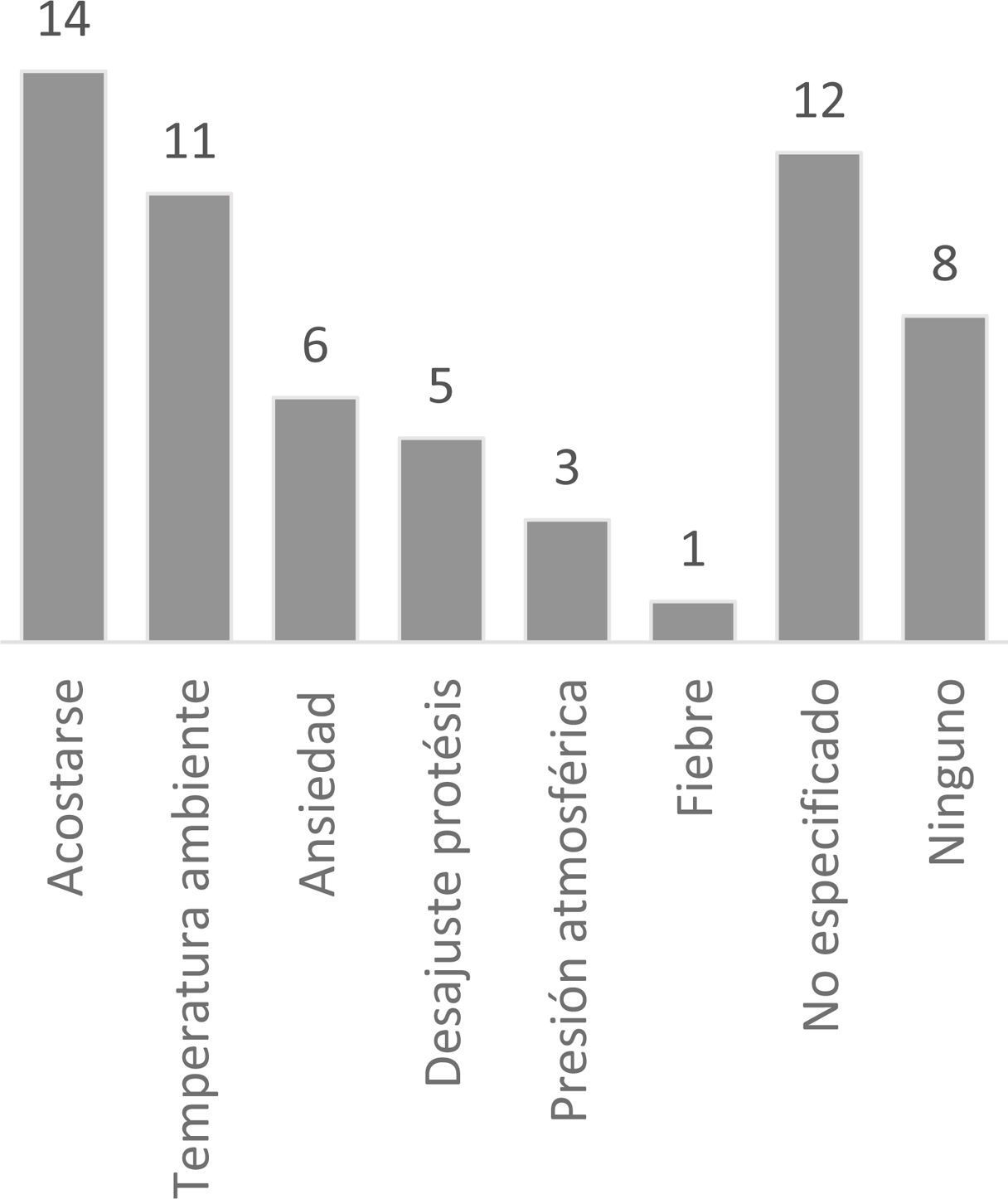
Las características clínicas del DMF según el Cuestionario del dolor en español, atendiendo a las dimensiones sensorial y afectiva/emocional, se muestran en la figura 3. En la figura 4 se muestran los factores agravantes más frecuentes del DMF.
Nueve (21%) pacientes amputados mostraban trastorno del estado de ánimo tipo depresión y un (2%) paciente presentaba ansiedad. Tanto los 9 pacientes con depresión como el paciente con ansiedad presentaban una sintomatología leve.
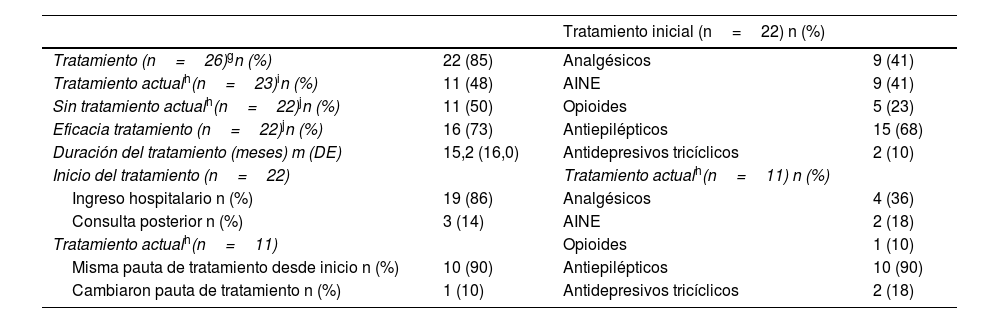
En la tabla 4 se exponen los datos de los tratamientos sintomáticos recibidos para el SMF.
Tratamiento farmacológico para el dolor de miembro fantasma
| Tratamiento inicial (n=22) n (%) | |||
|---|---|---|---|
| Tratamiento (n=26)gn (%) | 22 (85) | Analgésicos | 9 (41) |
| Tratamiento actualh(n=23)in (%) | 11 (48) | AINE | 9 (41) |
| Sin tratamiento actualh(n=22)jn (%) | 11 (50) | Opioides | 5 (23) |
| Eficacia tratamiento (n=22)jn (%) | 16 (73) | Antiepilépticos | 15 (68) |
| Duración del tratamiento (meses) m (DE) | 15,2 (16,0) | Antidepresivos tricíclicos | 2 (10) |
| Inicio del tratamiento (n=22) | Tratamiento actualh(n=11) n (%) | ||
| Ingreso hospitalario n (%) | 19 (86) | Analgésicos | 4 (36) |
| Consulta posterior n (%) | 3 (14) | AINE | 2 (18) |
| Tratamiento actualh(n=11) | Opioides | 1 (10) | |
| Misma pauta de tratamiento desde inicio n (%) | 10 (90) | Antiepilépticos | 10 (90) |
| Cambiaron pauta de tratamiento n (%) | 1 (10) | Antidepresivos tricíclicos | 2 (18) |
AINE: antiinflamatorios no esteroideos; DE: desviación estándar; M: media.
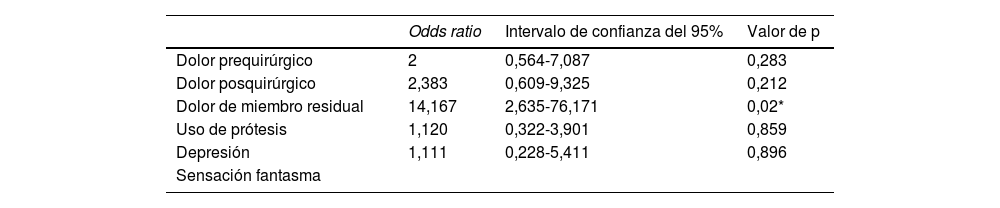
Se estudiaron todas las variables como posibles factores favorecedores o protectores del desarrollo de SMF. La única asociación estadísticamente significativa fue el desarrollo de DMF con más frecuencia en los pacientes que sufrían DMR (tabla 5). La relación entre sensación fantasma y DMF no se pudo estimar correctamente a través de un modelo de regresión logística debido a la ausencia de pacientes sin sensación fantasma ni DMF. No se hallaron diferencias estadísticamente significativas entre las características clínicas de la primera y la segunda amputación.
Modelos de regresión logística univariable para la relación entre la presencia de dolor de miembro fantasma y otros factores relacionados con la amputación
| Odds ratio | Intervalo de confianza del 95% | Valor de p | |
|---|---|---|---|
| Dolor prequirúrgico | 2 | 0,564-7,087 | 0,283 |
| Dolor posquirúrgico | 2,383 | 0,609-9,325 | 0,212 |
| Dolor de miembro residual | 14,167 | 2,635-76,171 | 0,02* |
| Uso de prótesis | 1,120 | 0,322-3,901 | 0,859 |
| Depresión | 1,111 | 0,228-5,411 | 0,896 |
| Sensación fantasma |
El interés de la neurología por el dolor crónico, y en particular por el dolor neuropático, se ha incrementado en los últimos años, hecho que ha supuesto una participación neurológica activa en la atención diagnóstica y terapéutica de pacientes que presentan dolor neuropático para mejorar su calidad de vida22.
El DMF, en el que se centra este estudio, forma parte del SMF, utilizado para designar al conjunto de sensaciones que asientan sobre una extremidad amputada2,12,14. El DMF suele clasificarse como dolor neuropático, puesto que los pacientes suelen describir el dolor con características típicamente asociadas al dolor neuropático, como ardor, punzada o pinchazo, aunque los pacientes también pueden describir características de dolor nociceptivo como presión en el pie o los dedos4. El DMF tiene una alta prevalencia y un carácter crónico, constituyendo una de las principales causas de demanda de atención sanitaria en las personas amputadas, que puede sufrir un deterioro de la calidad de vida relacionado con el dolor4,23,24.
Todavía no está aclarado el mecanismo subyacente a la aparición del DMF tras la amputación. La teoría más extendida es la denominada plasticidad neuronal maladaptativa25. Según esta teoría, cuando un miembro es amputado el área de la corteza cerebral con representación de la información sensitiva y motora de dicho miembro sufre una reorganización neuronal. En ausencia de señales procedentes del miembro ya inexistente, dicha área cortical pierde su actividad normal y experimenta una reorganización neuronal a favor de otras áreas y localizaciones corporales. De esta forma, pueden coexistir engramas y procesos de control previos a la amputación superpuestos al aprendizaje consciente e inconsciente de la nueva realidad tras la amputación, con un nuevo patrón de aferencias y aferentes visuales, sensoriales y motores. Cuando dicha reorganización es errónea se produce una sobreactivación del área cortical, provocando el conjunto de sensaciones englobadas en el SMF, principalmente el DMF25–27. Es importante mencionar el dolor nociplástico, descrito en 2016, como un nuevo tipo de dolor crónico diferente del dolor nociceptivo o neuropático. Se asocia a disfución de las vías sensitivas relacionadas con el dolor, del sistema nervioso central y/o periférico, favoreciendo la sensibilización central. Son precisos estudios que clarifiquen si el DMF puede tener un componente de dolor nociplástico añadido al dolor neuropático28.
En este estudio presentamos una serie de pacientes con amputación de miembro inferior que desarrollan SMF que, de acuerdo con nuestro conocimiento, es el primer estudio de DMF desarrollado en nuestro país. El 100% de los pacientes de nuestro estudio padecieron algún tipo de clínica relacionada con la amputación, a diferencia de otros estudios, con cifras de prevalencia del SMF que oscilan entre el 60% y el 80%9,29. El 60% de los pacientes amputados de miembro inferior de nuestra muestra reconocían la aparición de DMF. Este dato es acorde con datos previos de la bibliografía que apuntan que el DMF es una afección frecuente, aunque la diferencia de prevalencia entre estudios es marcada, oscilando desde el 2% al 85% dependiendo de la edad, la causa, el nivel de amputación o las comorbilidades asociadas2,9,18,30. El DMF se inicia de forma precoz tras la cirugía y se presenta como un dolor crónico, como lo demuestra que casi el 90% de los pacientes continuaban con dolor 2 años después de la amputación, dato que difiere de la mayoría de la literatura, que recoge una mejoría progresiva del DMF con el paso del tiempo29–31. Otro aspecto importante del DMF se demuestra en que más de la mitad de los pacientes lo contaban como un dolor constante o diario. Dentro de la clínica dolorosa asociada a la amputación, el DMF fue el dolor de mayor intensidad. Los pacientes refirieron una intensidad del dolor leve-moderada (EVA 4), a diferencia de otros estudios publicados donde hasta un 40% de los pacientes presentan dolor grave en relación con DMF31. Todas estas características del DMF lo convierten en una de las principales causas de demanda de atención especializada en el tratamiento del dolor en pacientes que sufren una amputación.
Nuestra muestra resultó muy homogénea, compuesta de varones en la década de los 60 año, con presencia de factores de riesgo cardiovascular y hábitos tóxicos, acorde con la enfermedad isquémica como la causa más frecuente de amputación en países desarrollados; en cambio, las causas traumáticas son las más frecuentes mundialmente30,32. La isquemia crónica de miembro inferior explica la mayor prevalencia de pacientes doblemente amputados en nuestra cohorte, con respecto a otros estudios con pacientes más jóvenes con causas de amputación no vascular33. Otras causas menos frecuentes encontradas en nuestro estudio fueron la etiología traumática o tumoral. Diferentes estudios coinciden en que las causas tumorales y traumáticas de amputación, producidas en una población joven, presentan con mayor frecuencia DMF, siendo mayor su intensidad30,34,35. No se conoce el motivo de una mayor frecuencia de aparición de DMF en estos casos; se postula que la menor prevalencia de factores de riesgo cardiovascular, como la diabetes mellitus, que afecta a las vías de transmisión del dolor, puede alterar la percepción del dolor en pacientes con amputación de causa vascular10,36. Aunque no fue el motivo de nuestro estudio, también se ha visto que pacientes con amputación de miembro superior tienden a desarrollar con mayor frecuencia DMF, dato que podría estar en relación con su mayor representación en el córtex somatosensorial25.
Los estudios coinciden en identificar la presencia de DPE, DPO, DMR y SFND como los principales factores asociados al desarrollo de DMF3,9,30. Así mismo, otros estudios demuestran la relación entre el desarrollo de DMF y la presencia de factores de riesgo cardiovascular35, hecho no confirmado en nuestra cohorte. En pacientes que presentan intenso dolor en la extremidad previo a la amputación está descrito que aparece con mayor frecuencia el DMF3,9,30. En cambio, en nuestro estudio, a pesar de que el DPE fue referido por el 70% de los pacientes, no se encontró relación con el desarrollo de DMF. Es importante destacar que hemos identificado el DMR como único factor favorecedor del desarrollo de DMF, dato que confirma estudios previos30. El DMF y el DMR comparten, al menos en parte, una patogenia común dependiente de la afectación neural periférica, con daño en las terminales nerviosas del miembro amputado, y la incorrecta adaptación cortical a los intensos estímulos dolorosos tras la amputación25. Por ello, no es sorprendente que factores agravantes de DMR lo sean también para el DMF8,30 y, al contrario, la aplicación de terapias sobre el muñón como masajes, calor, o vendajes compresivos puede mejorar la clínica dolorosa fantasma37,38. En cambio, no se encontró relación entre la presencia de DMF con el uso de prótesis, a pesar de la compresión directa ejercida por la prótesis sobre el muñón39. El conocimiento de los factores facilitadores de la aparición de DMF tiene una trascendente implicación clínica, una actuación sobre dichos factores de forma precoz disminuiría la frecuencia e intensidad del DMF.
De este modo, apoyando la teoría de reorganización cortical, actualmente se está estudiando la prevención del desarrollo del DMF con el uso preventivo de analgésicos durante el período periquirúrgico para disminuir el DPE y DPO y, posteriormente, sobre el DMR. Se cree que la disminución de los estímulos dolorosos desde el miembro a amputar y, posteriormente desde el muñón, podría evitar la reorganización del córtex sensitivo y evitar así la amplificación de los impulsos dolorosos procedentes de la región amputada37. En relación con estos datos, la analgesia preventiva, o el tratamiento del dolor en los días previos a la cirugía de amputación, es empíricamente importante, aunque su eficacia en disminuir la incidencia del DMF es controvertida. En cambio, en otros tipos de dolor parece claro que la utilización de terapia analgésica intensa previo a la cirugía puede disminuir la aparición de dolor agudo y crónico posquirúrgico3. Con respecto a las sensaciones no dolorosas, en nuestra cohorte casi todos los pacientes compartían DMF y SFND, sin observarse relación significativa entre ambas sensaciones. En otros estudios se apreció una mayor prevalencia de DMF entre los pacientes que referían SFND, explicado por una patogenia común de plasticidad neuronal maladaptativa12.
En el caso de pacientes doblemente amputados no se encuentran diferencias entre las características clínicas del SMF entre ambas extremidades amputadas, siendo la frecuencia e intensidad del DMF en pacientes con doble amputación comparables a las observadas en amputados de una sola extremidad. Este hecho sugiere que el desarrollo y mantenimiento del dolor fantasma puede estar determinado por una susceptibilidad individual que no se modifica tras una primera amputación31. Los estudios sensoriales cuantitativos podrían ser uno de los métodos para reconocer a los pacientes con susceptibilidad para desarrollar DMF tras una amputación40.
El cuidado de la salud mental de los pacientes amputados es primordial, ya que la falta de una extremidad supone una gran carga emocional. La bibliografía aporta que un 2040% de los pacientes amputados presentan síntomas depresivos4,24. En cambio, de forma sorprendente, en nuestra muestra la tasa de depresión fue baja y sin relación con el DMF. Aunque es un dato de difícil explicación, la edad avanzada y la alta incidencia de comorbilidades podría influir en una mejor adaptación a la amputación que otras poblaciones más jóvenes con otras causas de amputación2,24. Son necesarios más estudios para poder confirmar este dato.
Con respecto al tratamiento, la demanda de medicación antiálgica para el control de la sintomatología del DMF es alta en todos los estudios, entre el 60% y el 70% de los pacientes precisa de medicación18. La utilización de medicación sintomática en nuestra cohorte fue óptima al inicio del cuadro, pero fue disminuyendo con la cronificación del DMF. Otro aspecto que destaca en nuestro estudio es la escasa rotación de fármacos y el índice de abandono de tratamientos, datos que podrían estar en relación con la falta de eficacia sintomática, dada la intensidad leve-moderada del DMF, así como con un escaso seguimiento clínico. Según la bibliografía los fármacos más utilizados en el tratamiento del DMF son los antiepilépticos y los antidepresivos tricíclicos, a pesar de los resultados contradictorios de los ensayos clínicos sobre su eficacia9,18,37,41. En contraposición, en nuestra cohorte existe un uso generalizado de analgésicos y AINE como tratamiento tanto de inicio como crónico del DMF, fármacos inadecuados para el manejo del dolor neuropático36. El caso de los opiáceos como tratamiento del DMF merece especial mención, puesto que fueron más utilizados como medicación analgésica al inicio de la clínica de DMF, de acuerdo con la teoría de que pueden frenar la reorganización cortical somatosensorial implicada en la aparición del DMF, y menos utilizados a largo plazo para evitar su abuso, dada la actual «epidemia por sobretratamiento con opioides», especialmente en población de mayor edad42. Otras terapias parenterales utilizadas en las unidades del dolor en casos de dolor neuropático o sensibilización central, como la lidocaína o la ketamina endovenosa, tienen indicación en pacientes que sufren un DMF grave sin respuesta a otros tratamientos analgésicos. El número de pacientes con DMF subsidiarios de estas terapias de cuarto escalón sería pequeño porque, de acuerdo con nuestro estudio, la mayoría de los pacientes sufren dolor de intensidad moderada31.
En nuestra cohorte ninguno de los pacientes estudiados utilizó las nuevas terapias no farmacológicas, que están demostrando efectividad en el tratamiento del DMF, como la terapia en espejo43. Esta terapia consiste en estimular la correcta plasticidad y moldeamiento neuronal del área cortical somatosensorial encargada del miembro amputado mediante el movimiento y la fisioterapia del miembro contralateral reflejado en un espejo, dando la sensación óptica de que dichos movimientos y ejercicios se realizan sobre el miembro ausente44. Dado el mal control sintomático del DMF, es necesario un mejor seguimiento clínico de estos pacientes para un manejo sintomático más adecuado, así como la necesidad de actualizar, dirigir y controlar de forma ambulatoria la evolución del DMF en los pacientes amputados de una manera más precisa.
Este estudio presenta limitaciones, siendo su carácter retrospectivo una de las principales, así como las relacionadas con las características culturales de los pacientes y la ausencia de grupo de control. La discapacidad física de los pacientes amputados limitó la participación en el estudio. Los ítems reflejados en nuestra encuesta se apoyaron en estudios previos siguiendo las características clínicas y los factores de riesgo para la aparición de DMF, pero cabe recalcar que el cuestionario fue desarrollado ad hoc, sin tener una validación previa. La literatura no indica ningún instrumento específico para utilizar en la evaluación del DMF, el Cuestionario del dolor de McGill, a pesar de ser ampliamente utilizado en estudios sobre el dolor neuropático, no está validado para el DMF.
ConclusionesEl DMF es una afección muy prevalente entre los pacientes amputados con un difícil control sintomático. Es imprescindible una atención multidisciplinar en esta dolencia, donde la participación neurológica debe ser predominante y activa. Se precisan estudios que profundicen en el conocimiento de los factores favorecedores del desarrollo del DMF, para focalizar el esfuerzo terapéutico en terapias más dirigidas y de pronta incorporación para prevenir la aparición de DMF.
AutoríaTodos los autores han hecho contribuciones sustanciales en cada uno de los siguientes aspectos:
- 1)
La concepción y el diseño del estudio, o la adquisición de datos, o el análisis y la interpretación de los datos.
- 2)
El borrador del artículo o la revisión crítica del contenido intelectual.
- 3)
La aprobación definitiva de la versión que se presenta.
No se ha recibido financiación económica para la realización de la investigación.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.