El dolor del miembro fantasma (DMF) es un dolor de tipo neuropático que afecta al territorio de una extremidad amputada o a otras partes del cuerpo extirpadas quirúrgicamente. El 60-90% de los amputados sufren DMF durante el seguimiento. Se han descrito opciones terapéuticas para DMF, farmacológicas (gabapentina, amitriptilina, antidepresivos tricíclicos...) y no farmacológicas (TENS, hipnosis, acupuntura...). Una hipótesis predominante considera este fenómeno consecuencia de la reorganización cortical postamputación, y, tras investigaciones innovadoras de Ramachandran en los 90, se han desarrollado nuevos enfoques de tratamiento como la terapia de espejo (TE). En la presente revisión se analiza la evidencia actual publicada sobre la eficacia de la TE para el tratamiento del DMF.
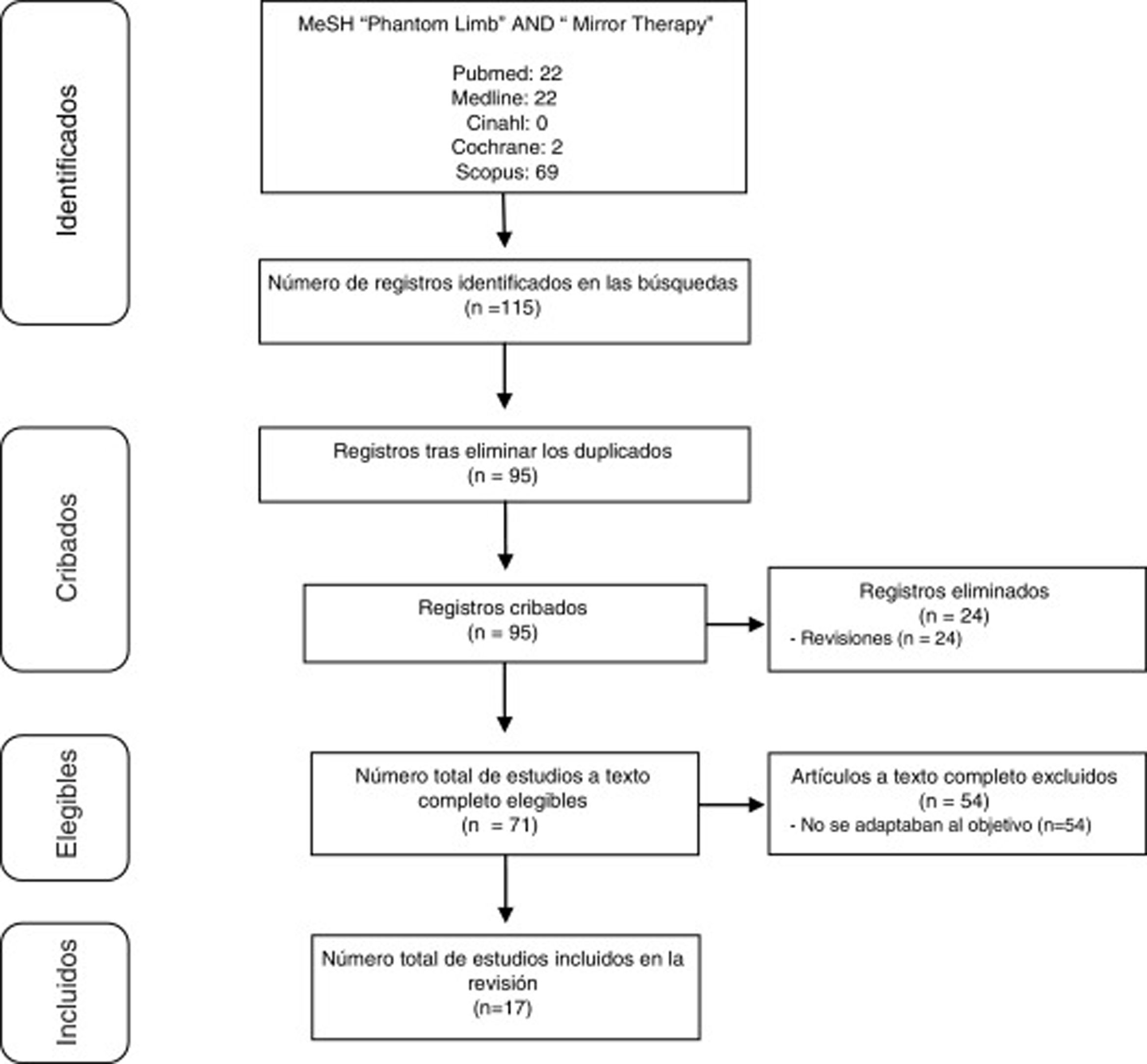
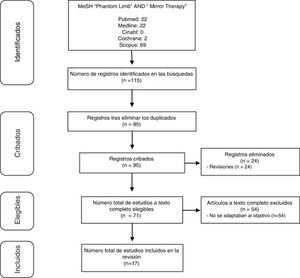
DesarrolloSe realizó una revisión bibliográfica, abarcando desde 2012 a 2017, de publicaciones registradas en las bases de datos Cinahl, Cochrane, Scopus y Pubmed (incluyendo Medline). Los descriptores utilizados para la búsqueda fueron los términos Phantom Limb y Mirror Therapy. Se identificaron 115 publicaciones que abordaban TE en DMF. De estas, 17 (15%) aportaban información útil para el análisis conjunto.
ConclusionesLa TE parece ser efectiva en el alivio del DMF, reduciendo la intensidad y duración de los episodios de dolor diarios. Por otra parte, constituye un método válido, sencillo y muy económico. La calidad metodológica de la mayoría de las publicaciones en este campo es muy limitada, destacando la necesidad de estudios adicionales de alta calidad para desarrollar protocolos clínicos que puedan maximizar los beneficios de TE en pacientes con DMF.
Phantom limb pain (PLP) is a type of neuropathic pain that affects the territory of an amputated limb or other surgically removed body parts. Between 60% and 90% of amputees suffer from PLP during follow-up. There are a range of therapeutic options for PLP, both pharmacological (gabapentin, amitriptyline, tricyclic antidepressants, etc) and non-pharmacological (transcutaneous electrical nerve stimulation, hypnosis, acupuncture, etc). A widely accepted hypothesis considers PLP to be the consequence of postamputation cortical reorganisation. New treatment approaches, such as mirror therapy (MT), have been developed as a result of Ramachandran's groundbreaking research in the 1990s. This review analyses the current evidence on the efficacy of MT for treating PLP.
DevelopmentWe performed a literature review of publications registered from 2012 to 2017 on the CINAHL, Cochrane, Scopus, and PubMed (including Medline) databases Using the descriptors “phantom limb‿ and “mirror therapy.‿ We identified 115 publications addressing MT in PLP. Of these, 17 (15%) contributed useful information for pooled analysis.
ConclusionsMT seems to be effective in relieving PLP, reducing the intensity and duration of daily pain episodes. It is a valid, simple, and inexpensive treatment for PLP. The methodological quality of most publications in this field is very limited, highlighting the need for additional, high-quality studies to develop clinical protocols that could maximise the benefits of MT for patients with PLP.
La primera referencia al miembro fantasma como entidad dolorosa la realiza el cirujano militar Ambrose Paré en el siglo xvi. Trescientos años después, el neurólogo Silas Weir Mitchell acuña el término «dolor de miembro fantasma» (DMF) y describe el síndrome de forma exhaustiva1.
El DMF es un tipo de dolor neuropático que se percibe, generalmente, en el territorio de la extremidad amputada, aunque también puede darse tras extirpación quirúrgica de otras partes del cuerpo2. El fenómeno de miembro fantasma incluye 3 elementos diferentes: DMF, sensaciones fantasmas y dolor de muñón. Estos elementos coexisten a menudo en cada paciente y pueden ser difíciles de separar3. Estas sensaciones pueden variar desde un calor agradable hasta una picazón intensa desagradable4, descritas como «ardor, calambres, trituración o laceración» y podrían ser intermitentes o permanentes5. Un fenómeno peculiar, el telescoping, ocurre cuando la parte distal del miembro es sentida gradualmente cada vez más cercana al miembro residual y puede acabar sintiéndose dentro del muñón6. A menudo el DMF afecta a la calidad de vida y aumenta las restricciones en la actividad causadas por la amputación, posiblemente comprometiendo la reintegración social y/o profesional7.
Según la literatura, entre el 60-90% de los amputados sufren DMF en algún momento de su vida y la incidencia es, generalmente, más alta después de una pérdida traumática o si existe dolor antes de la amputación8. También es mucho más baja en niños que en adultos8, no habiendo sido notificados generalmente casos en niños menores de 4 años6. Se han descrito opciones terapéuticas para el DMF farmacológicas: gabapentina, amitriptilina, antidepresivos tricíclicos, reparaciones basadas en morfina, ketamina…; o no farmacológicas: estimulación nerviosa eléctrica transcutánea, estimulación magnética transcraneal, estimulación de la médula espinal, uso de prótesis, hipnosis, acupuntura, etc.7.
El DMF sigue siendo un enigma y se necesita una mejor comprensión de sus mecanismos. Una hipótesis predominante sugiere que, después de la amputación de los miembros, la pérdida del aporte aferente permite la invasión de las regiones corticales vecinas en la zona de la anterior representación de la extremidad en la corteza sensitivo-motora primaria. Estos cambios desadaptativos se han mostrado como la base neural del DMF y esta visión ha generado nuevos enfoques de tratamiento, como la discriminación sensorial o la terapia de espejo9 (TE). La TE se lleva a cabo colocando un espejo parasagitalmente entre los brazos o las piernas y viendo los movimientos reflejados de la extremidad intacta mientras se intentan movimientos simultáneos con el fantasma. La intención es que el paciente perciba la reflexión en el espejo como su miembro amputado, lo que posiblemente aborda la incongruencia entre las entradas propioceptivas y visuales causada por la reorganización cortical10. La teoría de que la reorganización cortical se produce después de la amputación y contribuye al DMF se ha observado mediante estudios que utilizan la imagen por resonancia magnética funcional, así como que su reversión a un estado normal/preamputación coincide con el alivio del DMF11.
En los años 90, Ramachandran y Rogers-Ramachandran12 usaron por primera vez esta técnica con éxito para aliviar la parálisis y el espasmo en los miembros fantasmas de los amputados. Más tarde, Chan et al.13 realizaron un estudio donde todos los integrantes mejoraron.
Tras lo señalado, el objetivo de esta revisión es comprobar la efectividad de la TE en pacientes con DMF de cara a consolidarla como tratamiento conservador no farmacológico de elección.
DesarrolloPara recopilar información sobre la efectividad de la TE en el alivio del DMF se realizó una revisión de las bases de datos Cinahl, Cochrane, Scopus y Pubmed (incluyendo Medline). De cara a estudiar las aportaciones más novedosas sobre el tema, se limitó a las publicaciones de 2012 en adelante.
Ambos autores realizaron las búsqueda, selección y análisis de los trabajos de forma independiente, buscando un consenso en las discrepancias halladas una vez realizada la puesta en común.
Los descriptores utilizados para la búsqueda fueron los términos Phantom Limb y Mirror Therapy. Los términos fueron unidos por el operador booleano AND. Para establecer la selección de las publicaciones encontradas se establecieron como criterios de inclusión estudios desde 2012 y realizados en humanos, mientras que como exclusión se establecieron revisiones, repetidos y aquellos que no se ciñesen al objetivo establecido.
Selección de estudiosSe realizó tras una preselección a partir de los resúmenes y una selección definitiva tras el acceso completo a los trabajos. En la figura 1 se resume dicho proceso.
ResultadosDe los 115 estudios hallados, finalmente fueron válidos para dar respuesta al objetivo planteado 17. Los principales datos de los mismos se presentan en las tablas 1–3. La tabla 1 recoge todas las investigaciones halladas que son estudio de caso14–18 o estudio de casos1,3,19. Por su parte, la tabla 2 engloba el resto de los estudios8,20–27. Finalmente, la tabla 3 hace referencia a los protocolos de aplicación de la TE.
Principales datos de los estudios de caso analizados en la presente revisión
| Estudio (autor y año) | Objetivo | Muestra (género)Tipo de amputaciónEdad | Valoración realizada (temporalización) | Resultados |
|---|---|---|---|---|
| González García et al.12013 | Analizar la TE en la rehabilitación funcional de amputados en un servicio de geriatría | 3 pacientes (1♀, 2♂)AMI65 (♂), 80 (♂) y 67 (♀) años | EVAÿndice de Barthel(inicio, al alta hospitalaria tras 68, 95 y 68 sesiones respectivamente, y tras seguimiento de 16-22 meses) | - Disminución en la intensidad del dolor (EVA 6/1, 7/4 y 7/2 respectivamente) y descenso medio de analgésicos/paciente de 4,33 a 0,66- Disminución del número y duración de los episodios- Progreso a nivel funcional: ganancia media de 36,6 puntos en el índice de Barthel- Los efectos favorables se mantuvieron a largo plazo, tanto en el control del dolor como en la situación emocional y funcional |
| Kim y Kim142012 | Informar de la reducción exitosa del DMF con TE cuando otros métodos fracasaron | 1 paciente (1♂)AMS30 años | EVA(inicio, a la semana, al mes y a los 3 meses) | - El DMF descendió de 8 a 7/10 en la primera semana, a 5/10 al mes y a 4/10 tras 3 meses de terapia (terapias previas, farmacológicas y no farmacológicas, no habían conseguido controlar el DMF)- Permaneció la sensación eléctrica- Con TE, precisa menos dosis de tratamiento farmacológico |
| Clerici et al.152012 | Describir las ventajas de TE en paciente oncológico que padecía DMF | 1 paciente (1♂)AMI17 años | EVAZung test(inicio y cada semana hasta la semana 26) | - Reducción del DMF de forma gradual hasta llegar a ser estable y tolerable- Disminución del dolor medio entre las primeras 6 semanas, y las semanas 20 a 25 (p<0,05)- No se halló evidencia de depresión significativa mediante el Zung test- Los beneficios se mantenían a los 6 meses |
| Wosnitzka et al.162014 | Informar del uso de la TE en un paciente con amputación bilateral de miembros inferiores | 1 paciente (1♂)DAMI66 años | NRS(inicio y cada día hasta las 3 semanas) | - El uso de una prótesis también parece facilitar realizar la TE- Alivio del DMF durante semanas (8-9/10 a 2-4/10) tras pocas sesiones de TE- Disminución en los ataques de dolor por día en un 90%- Los beneficios se mantenían varios meses después |
| Datta y Dhar32015 | Confirmar si la TE podía actuar como apoyo al tratamiento farmacológico convencional en el DMF | 2 pacientes (2♂)AMI21 y 65 años | EVA(inicio, a la semana y a los 3 meses) | - Disminución del DMF inicial con control a una semana (6 a 4/10 y 5 a 2/10, respectivamente)- Disminución del DMF inicial con control a 3 meses (2-3/10 y 1-2/10, respectivamente)- Paciente joven no tenía buena respuesta al tratamiento farmacológico inicial |
| Thomas172015 | Evaluar la efectividad del tratamiento con TE, electromiofeedback y estimulación táctil para la disminución del DMF | 1 paciente (1♂)AMS48 años | NPRDASH(inicio, a las 4 y a las 8 semanas) | - Mejora significativa en el control muscular de pectoral mayor e infraespinoso a las 4 y a las 8 semanas- Mejora significativa en el DMF (9/10 a 6/10 a las 4 semanas y a 3/10 a las 8)- Mejora significativa en la puntuación DASH (del 80% al 65% de discapacidad a las 4 semanas y al 50% a las 8)- Reducción del edema (de 115 a 108cm a las 4 semanas y a 105cm a las 8) |
| Ramsey et al.182017 | Describir los efectos beneficiosos de la TE en combinación con farmacoterapia | 1 paciente (1♂)AMS7 años | Entrevista sobre la sintomatología al paciente y su familia(inicio y a las 2 semanas) | - Seguimiento a las 2 semanas con mejora significativa en la agitación psicomotora, estado de ánimo y calidad de sueño- DMF nulo excepto en saltos tras 2 semanas- Tratamiento farmacológico previo por sí solo no obtuviera buenos resultados |
| Toita et al.192017 | Informar de los resultados obtenidos después de aplicar TE o técnicas de discriminación sensorial sobre el muñón según las características del DMF | 2 pacientes (2♂)AMI y AMS50 años ambos | NRS(inicio, a la semana y a las 2 semanas) | - La TE se aplicó solo en el paciente con AMI- Mejoría en ambos del DMF |
♀: mujer; ♂: hombre; AMI: amputación miembro inferior; AMS: amputación miembro superior; DAMI: doble amputado miembro inferior; DASH: Disability of the Arm, Shoulder and Hand; DMF: dolor de miembro fantasma; EVA: escala visual analógica; NPR: Numeric Pain Rating; NRS: Numerical Rating Scale; TE: terapia de espejo.
Principales datos de los estudios que no eran de caso analizados en la presente revisión
| Estudio (autor y año) | ObjetivoDiseño del estudio | MuestraTipo de amputaciónEdad (rango) | Valoración realizada (temporalización) | Resultados |
|---|---|---|---|---|
| Darnall y Li202012 | Probar la viabilidad y eficacia de la TE domiciliaria autoadministrada para el DMF- EP | 31 pacientes (13♀, 18♂)AMI y AMS61 (32-74) | CES-DNRSDiario de TE(inicio, al mes y a los 2 meses) | - Reducción en la intensidad media de DMF de inicio respecto al 1.er mes (p<0,001)- Reducción en la intensidad media de DMF de inicio respecto al 2.o mes (p<0,001)- Reducción en la intensidad media de DMF de sujetos con estudios universitarios vs. estudios básicos (p=0,01)- 4/31 empeoraron DMF (2 aumento del dolor y 2 las sensaciones del DMF, aunque estos 2 mejoraron rápido) y 6/31 no reportaron cambios- Efectos adversos: aburrimiento (2/31), ser más conscientes de la amputación (2/31), aumento del DMF (2/31), aumento de sensación fantasma (2/31), sentirse deprimido (1/31) y calambres (2/31, que tras enlentecer los movimientos, se resolvieron)- No se pueden explicar los beneficios solo por la TE, pero sí que solo el tratamiento farmacológico no los consiguió |
| Foell et al.212014 | Evaluar los efectos de la TE sobre el DMF, comparar los cambios cerebrales pre- y posterapia e identificar predictores de éxito- EP | 13 pacientes (4♀, 9♂)AMS50,6±15,8 años (26-74) | EVA(diario durante 8 semanas: 2 semanas antes de iniciar tratamiento, 4 semanas de tratamiento y 2 semanas tras finalizar)IRMfMPI(pre- y postintervención) | - Reducción del DMF del 27%- Disminución en la media de dolor en la semana 7 vs. semana 2 (p<0,05), aunque no en todos los pacientes mejoró el dolor- Correlación positiva entre la reducción del DMF vs. reducción del cambio cortical en S1 (p<0,01)- Correlación positiva entre la reducción del DMF vs. disminución de la actividad en el córtex parietal inferior (p=0,001)- Correlación negativa entre telescoping vs. efecto de TE (p<0,01) |
| Schmalzl et al.222013 | Mostrar una alternativa a la TE tradicional y explorar si la ilusión visuotáctil podría aliviar el DMF- EP | 6 pacientes (4♀, 2♂)AMS55 años (39-80) | NRS(antes y después de cada sesión)Cuestionario sobre su percepción ilusoria de movimiento/sensibilidad en miembro fantasma(al final de la 8.a sesión) | - En resultados grupales, aumento del DMF en la sesión de movimiento (p=0,011) y descenso en la sesión de caricias con pincel sobre el muñón (p=0,011)- En resultados individuales:* 3 sujetos sin cambios y 3 con aumento del DMF (p<0,007, p<0,046 y p<0,039), en sesión de movimiento* 4 sujetos con descenso de DMF (p<0,038, p<0,010, p<0,010 y p<0,016) y 2 sin cambios, en sesión de caricias- La ilusión visuotáctil generada con las caricias con pincel sobre muñón podría ser una alternativa a la TE cuando esta aumenta el dolor en el DMF |
| Tilak et al.232016 | Evaluar y comparar la efectividad del TENS y de la TE en el manejo del DMF- ECA | 26 pacientes (13 GE1; 13 GE2)AMI y AMSGE1: TE, 13 (1♀, 12♂)42,62±10,69 añosGE2: TENS, 13 (2♀, 11♂)36,38±9,55 años | EVAUPS(pre- y postintervención) | - Mejoría en el DMF con TE (EVA, p=0,003; UPS, p=0,001)- Mejoría en el DMF con TENS (EVA, p=0,003; UPS, p=0,002)- TE vs. TENS sin diferencias significativas (EVA, p=0,223; UPS, p=0,956) |
| Houston y Dickerson242016 | Investigar la efectividad del Farabloc™ y un programa de TE para mejorar la funcionalidad en amputados vasculares- EC | 14 pacientes (9 GE1; 5 GE2)AMIGE1 (agudos): 9 (4♀, 5♂)58,2±11,2 años (48-78)GE2 (subagudos): 5 (2♀, 3♂)61,6±7,9 años (51-73) | PEQBPIRegistro diario(pre- y postintervención, y a las 4 semanas de esta) | - Mejoras significativas del GE1 postintervención y mantenimiento respecto a preintervención en cuanto a autocuidado, caminar, transferencia al coche, sueño, humor y calidad de vida- Mejoras del GE2 postintervención y mantenimiento respecto a preintervención en cuanto a sueño y satisfacción- El conjunto de los pacientes mejoró postintervención y mantenimiento respecto a preintervención, pero no hubo cambios entre postintervención y mantenimiento- 7/9 sujetos del GE1 se protetizaron a las 8 semanas (4 semanas antes que los protocolos normales)- Todos los pacientes del GE2 incrementaron la tolerancia a la prótesis (de 0-2 a 8-12h) |
| Anghelescu et al.82016 | Describir las diferencias entre pacientes pediátricos con DMF que recibieron terapia estándar combinada o no con TE- ER | 18 pacientes-GE: TE (n=9) (1♀, 8♂)-GC: no TE (n=9) (2♀, 7♂)AMI y AMS13 años (8-24) | NPS(inicio, a las semanas 1, 2, 3, 4, 8, 12, 16, 20 y 24, o hasta el alta del paciente en el servicio) | - Grupo TE tuvo una menor duración de DMF y menor incidencia de DMF en un año comparado con el grupo sin TE (246±200 vs. 541±363 días, p=0,08)- No hubo diferencia entre grupos con relación al grado de dolor- El uso de TE no se asoció a una disminución de marcadores de dolor ni a reducción de consumo de fármacos |
| Yildirim y Kanan252016 | Evaluar los efectos de la TE en el alivio del DMF- EQ | 15 pacientes (2♀, 13♂)AMI y AMS52,13±16,68 años | NPS(al inicio y cada semana durante 4 semanas) | - Disminución de las puntuaciones promedio de DMF cada semana y la total del mes (p<0,01)- 5/15 usaban prótesis (función estética)- Mayor beneficio en pacientes que no usaban prótesis (p<0,05), explicando el uso de la prótesis el 30,6% de los cambios pre-postintervención (p<0,05) |
| Griffin et al.262017 | Evaluar cómo funcionaba la TE según el grado de DMF para informar de los parámetros de tratamiento y facilitar un estándar de práctica clínica- ERC | 31 pacientes (2 cohortes: 21 y 10) (4♀, 27♂)AMI33,5 años (19-60) | EVASF-MPQ(al inicio y tras la 7.a, 14.a y 21.a sesión) | - En conjunto, la TE fue efectiva en el 87% de los sujetos, con disminución del DMF a lo largo del tiempo (p<0,0001) y mejoras en la mayoría de características del dolor de SF-MPQ- El dolor disminuyó básicamente en las primeras 7 sesiones y de la 14.a en adelante- Niveles de dolor bajo al inicio (EVA≤30mm) se reducen significativamente tras 7 sesiones, dolor medio inicial (EVA=31-60mm) tras 14 y dolor medio alto (EVA>61mm) a las 21 |
| Finn et al.272017 | Evaluar la eficacia de la TE en el alivio del DMF en amputados unilaterales de extremidad superior- ECA | 15 pacientes (15♂)GE1 (9): TEGE2 (6): visualización mental o TE con espejo cubiertoAMS(19-68 años) | EVAFrecuencia y duración DMF(diaria, a lo largo de la intervención) | - Solo hubo mejoras en el GE1- GE1: 8/9 mejoraron su DMF (p=0,001)- GE1: descenso tiempo total diario con DMF (p=0,003)- GE1: en 6/9 la respuesta a la TE en las primeras 5 sesiones fue predictiva de la respuesta a las 4 semanas; 3/9 a las 10 sesiones- GE2: 5/6 pasaron antes de finalizar o tras terminar su intervención a recibir TE; los 5 mejoraron, entonces, DMF y tiempo total diario con dolor |
♀: mujer; ♂: hombre; AMI: amputado miembro inferior; AMS: amputado miembro superior; BPI: Brief Pain Inventory; CES-D: Centers for Epidemiologic Studies Depression subscale; DMF: dolor de miembro fantasma; EC: ensayo cruzado; ECA: ensayo clínico aleatorizado; EP: estudio prospectivo; EQ: ensayo cuasiexperimental; ER: estudio retrospectivo; ERC: estudio retrospectivo de cohortes; EVA: escala visual analógica; GC: grupo control; GE: grupo experimental; IRMf: imagen por resonancia magnética funcional; MPI: West Haven-Yale Multidimensional Pain Inventory; NPS: Numerical Pain Sscale; NRS: Numerical Rating Scale; PEQ: Prosthetic Evaluation Questionnaire; SF-MPQ: Short-Form McGill Pain Questionnaire; TE: terapia de espejo; TENS: Transcutaneous electrical nerve stimulation (estimulación nerviosa eléctrica transcutánea); UPS: Universal pain scale.
Protocolo de aplicación de la TE en los estudios analizados
| Estudio | Intervención desarrollada | Período de intervención | Frecuencia de las sesiones | Duración de la sesión de tratamiento | Lugar de realización de la intervención |
|---|---|---|---|---|---|
| González García et al.1 | TE+Fco+TF | 68/95/68 sesionesa | - | 15min | Centro clínico |
| Kim y Kim14 | TE+Fco | 3 meses | 4/semana | 15min | Centro clínico+Domicilio |
| Clerici et al.15 | TE+Fco | 26 semanas | Diaria | 30min | Centro clínico+Domicilio |
| Wosnitzka et al.16 | TE+Fco | 3 semanas | Diaria | - | Centro clínico |
| Datta y Dhar3 | TE+Fco | 1 semana (hospital) 3 meses (domicilio) | 2-3/día | - | Centro clínico+Domicilio |
| Thomas17 | TE+Fco+TF | 8 semanas+6 semanasc | 1-2/semana | - | Centro clínico+Domicilio |
| Ramsey et al.18 | TE+Fco | 2 semanas | 2/día | 10min | Centro clínico+Domicilio |
| Toita et al.19 | TE+Fco | 2 semanas | Diaria | 15min | Centro clínico |
| Darnall y Li20 | TE | 1/2 meses | Diaria | 25min | Domicilio |
| Foell et al.21 | TE (+Fco)b | 1 mes | Diaria | 15min | Centro clínico/Domicilio |
| Schmalzl et al.22 | TE+TE sin feedbak visual+estímulo táctil | 8 sesiones | - | 5min | Centro clínico |
| Tilak et al.23 | TE/TENS | 4 días | Diaria | 20min | Centro clínico |
| Houston y Dickerson24 | TE+tela de Farabloc™ | 4 semanas | Diaria | 15min | - |
| Anghelescu et al.8 | TE (con/sin)+Fco | 4 sesiones (hospital)+Número desconocido (domicilio) | Varias veces/día | Variable | Centro clínico+Domicilio |
| Yildirim y Kanan25 | TE (+Fco)b | 4 semanas | Diaria | 20-25min | Centro clínico+Domicilio |
| Griffin et al.26 | TE | 19 sesiones de media (rango: 3-40 sesiones) | 5/semana (variable) | 15min (20min)d | Centro clínico |
| Finn et al.27 | TE/terapia visualización mental o TE sin feedback visual+Fco | 4 semanas | 5/semana | 15min | Centro clínico |
Fco: tratamiento farmacológico; TE: terapia de espejo; TF: tratamiento de Fisioterapia; TENS: Transcutaneous electrical nerve stimulation (estimulación nerviosa eléctrica transcutánea).
Los principales hallazgos en la revisión realizada son:
- -
La TE ha facilitado la reducción del DMF1,3,8,14–21,23–27, así como de los episodios de dolor diario1,8,16,18,26 o la duración de los mismos8,27. Incluso, se ha visto que se respondía bien a esta terapia, cuando no habían obtenido resultados positivos en tratamientos farmacológicos3,14,18 o no farmacológicos previos14,27. Sin embargo, en algunos casos, esta mejoría no se puede atribuir en exclusiva a la TE1,17–20,24,25,27, ni ha sido superior a otro tipo de tratamiento (discriminación sensorial sobre el muñon19, ilusión visuotáctil22, estimulación nerviosa eléctrica transcutánea23).
- -
En los casos en que se realizó seguimiento, estos beneficios a nivel del DMF se han mantenido en el tiempo1,3,15,16,18,24, sobre todo si se conserva la TE en domicilio3,21.
- -
También se han hallado mejoras a nivel funcional1,17,24, en el edema de la extremidad amputada17, en el estado de ánimo18,24, en la calidad del sueño18,24 o en tolerar mejor la prótesis o protetizarse antes24.
- -
Por otra parte, en los casos donde la TE se realizó con apoyo de una prótesis16,25, los beneficios sobre el DMF también se alcanzaron.
- -
Los beneficios de la TE se han visto independientemente de la etiología que explique la amputación en el paciente y que le ha llevado a padecer DMF: patología traumática3,14,17,19–22,27, oncológica8,15,18,22 o vascular periférica1,3,16,21,24,25. Tampoco la edad de los pacientes parece haber influido en este posible beneficio, aunque sí parece influir algún factor, como el nivel de estudios del paciente, existiendo una correlación positiva entre mejoría con la TE y mayor nivel de estudios20, o el grado de telescoping, hallándose una correlación negativa entre este y el efecto de la TE19,21,25.
- -
Sin embargo, hay casos donde la TE no es mejor que otras opciones terapéuticas19,22,23 o no se dan estos efectos positivos20, bien permaneciendo la sintomatología20, como es la sensación eléctrica14,20, aumentando el DMF20–22, bien dando lugar a otra sintomatología, como las reacciones de tristeza1 o de depresión20 al ver la imagen virtual de la extremidad amputada. En algunos casos, tampoco supuso una reducción en el consumo de fármacos8.
- -
Finalmente, con relación al protocolo de aplicación de la TE, esta terapia se suele aplicar en el centro clínico de referencia para el paciente y se continúa en domicilio3,8,14,15,17,18,21,25, haciéndose necesario para el paciente un período de aprendizaje previo8,15,16,20,25; las sesiones de TE suelen estar en torno a los 15min1,14,19,21,24,26,27; se realizan por lo general diariamente3,8,15,16,18–21,23–27; se logra una disminución significativa del DMF en 2-4 semanas3,8,16–27; y se suele acompañar1,3,8,14–19,27 o complementar con tratamiento farmacológico21,25.
Tras los principales hallazgos expuestos, la TE parece un tratamiento efectivo en el alivio del dolor en pacientes con DMF, ya que todos los estudios hallados en esta revisión actualizada1,3,8,14–21,23–27, salvo uno22, lo apoyan. Solo Schmalzl et al.22, que comparan 2 variedades de tratamiento de TE (movimiento vs. caricias mediante pincel), obtuvieron solo buenos resultados en una de las modalidades (estímulo táctil mediante pincel) y para unos determinados pacientes (para aquellos en los que realizar movimiento inicialmente les genera un aumento del DMF). Posiblemente esto pueda estar vinculado al tiempo transcurrido con DMF o, como señalan Griffin et al.26, según el grado de DMF inicial, exigiendo más sesiones y/o más tiempo de sesión según el DMF sea más elevado.
Sin embargo, y a pesar de los buenos resultados señalados por las diferentes investigaciones, se deben matizar ciertas cuestiones relevantes clínicamente. En la mayoría de los estudios hay un apoyo farmacológico previo a la intervención y durante la misma1,3,8,14–19,21,25,27 y/o se apoya la TE con otros tratamientos: fisioterapia sobre el muñón1,17, entrenamiento previo de lateralización e imaginación del movimiento16 o una malla de Farabloc™ para proteger el muñón de los campos electromagnéticos24. Por ello, la efectividad de la TE no se puede aseverar con certeza. Sin embargo, también hay que señalar como positivo que con la TE se ha reducido el uso de fármacos14, aunque Anghelescu et al.8 no hallaron lo mismo, o se obtuvieron buenos resultados en casos en que, inicialmente y solo con tratamiento farmacológico, los pacientes no habían obtenido mejorías3,18,20. Sin embargo, parece necesario discriminar el posible efecto del tratamiento farmacológico en futuras investigaciones, y ya que en caso de DMF muchos de los pacientes indicados para la TE están siendo medicados por protocolo postamputación y/o circunstancias de comorbilidad que presentan, se hacen precisos estudios donde se compare un grupo con/sin tratamiento farmacológico frente a otro al que a este tratamiento se le añada la TE.
Por otra parte, por lo hallado, parece que factores como etiología de base, extremidad afectada o edad no influyen en los resultados alcanzados por la TE. Sin embargo, sí se perciben factores relevantes que requieren necesariamente un mayor estudio en el futuro, como es el caso del nivel de estudios de los pacientes20, tiempo de evolución del DMF24,26, número de episodios de DMF padecidos por día y su duración8,27 o el uso o no de prótesis25. La influencia de estos factores permitiría conocer la relevancia clínica de aspectos como: si el aprendizaje de la TE por parte de los pacientes puede ser con una única sesión o no25, si esta debe ser dirigida por un profesional8,15 o si llega con emplear material audiovisual20; también si lo adecuado es enseñar la TE desde el momento inicial postamputación, aunque aún no exista DMF, o si debe este debe darse primero26; o si realmente el proceso de protetización del paciente es o no limitante del beneficio terapéutico de la TE, pues tanto se ha hallado que facilita la protetización24, como que sus beneficios sobre el DMF se ven limitados en caso de uso de prótesis25, además de que el resultado final puede estar más vinculado a la sintomatología asociada al DMF, como la sensación eléctrica14 o el telescoping19,21,25. En general, la TE parece tener un beneficio sobre el DMF, pero, al mismo tiempo, no todos los estudios hallados describen estas variables con relación a la muestra y su condición clínica, y/o no los analizan, aspectos aconsejables en futuras investigaciones. Así, por ejemplo, la variabilidad del número de ataques que los sujetos sufren parece decisiva en el éxito de la terapia, o la existencia o no de la sensación de telescoping y su influencia, no pareciendo adecuado centrarse solo en valorar la disminución o no de la intensidad del dolor.
En la tabla 3, por su parte, se puede observar ciertas similitudes con relación al protocolo de aplicación de la TE, tal y como se comentó en el apartado anterior. Sin embargo, se ven claras diferencias en ciertas cuestiones, al margen de que no en todos los casos se conocen la duración de la intervención1,8,21, la frecuencia de las sesiones de tratamiento1,22, su duración3,8,16,17 y el lugar donde se realizaron dichas sesiones de TE24. Así, los protocolos se diferencian en todos estos aspectos, observando que las intervenciones duran desde 4 días23 a 26 semanas15, la frecuencia de las sesiones varía desde una o 2 por semana17 a varias veces al día3,8, que su duración está entre 522 y 30min15, y que se realizan tanto en centro clínico y domicilio3,14,15,17,18,21,25, como solo en centro clínico1,16,19,22,23,26,27 o solo en domicilio20. Todo esto es indicativo de una falta de protocolización de la TE, confirmando la necesidad de establecer una estandarización de la misma y, con ello, facilitar la comparación de los estudios y de sus resultados permitiendo no solo evaluar la efectividad de un método como la TE, sino también adecuar su aplicación a las características más adecuadas de los pacientes. La protocolización facilitará, por tanto, comparar resultados e ir estableciendo los parámetros más adecuados de la intervención con TE en función del DMF y demás sintomatología asociada existente.
La falta de estandarización también se manifiesta en otras cuestiones. Así, con relación a las escalas utilizadas para la valoración de los pacientes, se observa un uso mayoritario de escalas subjetivas para valorar el grado de variación del DMF. Entre ellas destaca la escala visual analógica (EVA)1,3,14,15,21,23,26,27, pero también nos encontramos con la escala numérica NRS16,19,20,22 y su variante NPR17, el Inventario multidimensional del dolor de West Haven-Yale21, la escala universal de valoración del dolor UPS23, el cuestionario breve del dolor BPI24 y la versión corta del cuestionario de dolor de McGill26. Además, también se han utilizado: la escala o índice de Barthel1, para valorar la discapacidad física; el cuestionario DASH17, para valorar la funcionalidad de hombro, codo y mano; el Zung test15 y la escala de depresión del Centro de Estudios Epidemiológicos CES-D20, para evaluar la depresión; el cuestionario para evaluación protésica PEQ24, para valorar funcionalmente al amputado; y la resonancia magnética funcional21. Como se puede observar, se hace una valoración fundamentalmente subjetiva del DMF, haciéndose recomendable que en el futuro se complete la medida del dolor con escalas funcionales, así como que se incluyan también variables objetivas, a fin de lograr un protocolo estándar de valoración.
Tampoco se ve una línea común en cuanto a la toma de datos ni al seguimiento a medio y largo plazo realizado sobre los pacientes. Sería aconsejable realizar un seguimiento de los pacientes que sufren DMF a medio y largo plazo para ver el grado de uso de la TE, no solo durante el período en que los profesionales están supervisando a los pacientes, sino también de su uso de forma autónoma en domicilio, y su influencia sobre la evolución del DMF. En aquellos estudios en que se realiza seguimiento se ve que los beneficios obtenidos con la TE se mantienen en el tiempo1,3,8,14–16,21, pero la mayor parte son estudios de casos1,3,14–16, lo que limita su valor. Además, Anghelescu et al.8, aunque sí hallaron mejores resultados sobre el DMF en aquellos pacientes a los que se aplicó TE en cuanto a grado de dolor, duración e incidencia del mismo, esta mejoría no estuvo asociada, por otra parte, ni a una disminución de los marcadores de dolor ni a un menor consumo de fármacos.
Analizando, desde el punto de vista metodológico, los estudios publicados en estos últimos años, se ha visto que su calidad es bastante pobre. Así, 8 de ellos son estudios de caso14–18 o serie de casos1,3,19, 3 son estudios prospectivos20–22, 2 retrospectivos8,26, uno cruzado24, otro cuasiexperimental25, y solo 2 ensayos clínicos aleatorizados23,27. Esto no hace más que mostrar que el nivel de evidencia aportado por la mayoría de los artículos es bastante mejorable. En el futuro sería conveniente que hubiese un mayor control de sesgos y, con ello, obtener una mayor validez interna y tener más posibilidades de establecer una relación causa-efecto. Por ello, sería recomendable que futuras investigaciones tuviesen un diseño tipo ensayo clínico aleatorio.
Por su parte, también sería recomendable mejorar la validez externa de dichas futuras investigaciones. Las muestras utilizadas en los estudios hallados y analizados son variables, desde un sujeto14–18 hasta 31 pacientes20,26, pero en general son muestras muy pequeñas. Además, en ningún caso se calcula el tamaño muestral, repercutiendo esto negativamente en la validez externa de los estudios y en la posibilidad de generalizar los resultados obtenidos.
Con todo lo señalado hasta aquí, y a modo de resumen, los resultados de esta revisión indican que la TE parece ser efectiva en el alivio del DMF, pues las investigaciones analizadas manifiestan su beneficio clínico en cuanto al control sintomatológico, independientemente de la etiología de base, además de resultar un método de tratamiento seguro, sencillo y económico, que permite el automanejo del DMF por parte del paciente y el autotratamiento. Sin embargo, se hace patente la falta de calidad metodológica de los estudios, donde una parte de los mismos son estudios de caso o series de casos, lo que limita el nivel de evidencia, lo que llevaría a realizar un grado de recomendación C (recomendable pero no concluyente), recomendando, asimismo, la necesidad de desarrollar nuevos estudios, con un buen diseño metodológico, para poder analizar la pertinencia o no de la indicación de la TE a estos pacientes que sufren de DMF.
ConclusiónA modo de conclusión, se puede señalar que parece que la TE resulta eficaz en el alivio del DMF, así como en el control de los episodios de dolor diario y su duración. Estos beneficios clínicos se han obtenido independientemente de la etiología de la amputación, extremidad amputada o edad de los pacientes.
No obstante, quedan por definir diversos aspectos. Entre ellos, se pueden señalar la influencia en los resultados del nivel de dolor inicial y sintomatología asociada, determinar cuál es el momento más adecuado para iniciar la TE, la estandarización de un protocolo de aplicación, o la efectividad real de la TE en comparación con otros tratamientos.
Asimismo, sería necesario incrementar la calidad metodológica de los estudios realizados, fundamentalmente en el incremento del tamaño muestral y en el diseño de las investigaciones, así como en realizar un seguimiento a medio y largo plazo para ver su funcionalidad como método de autocontrol y autotratamiento del paciente amputado.
Finalmente, y tras lo señalado, se puede afirmar que la TE parece un método válido para el manejo del DMF, además de ser sencillo y muy económico, por lo que, tras una formación previa, se podría llevar a cabo en los domicilios y, por lo tanto, sería accesible a las poblaciones más distantes y/o desfavorecidas, ayudando, además, a la gestión del sistema de salud.
FinanciaciónEste trabajo no ha contado con financiación pública ni privada para su realización.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El presente trabajo no se presentó parcial o totalmente en la Reunión Anual de la SEN.