Dentro de los parámetros proporcionados al solicitar un análisis hematológico, la mayoría de los profesionales médicos, en específico aquellos especializados en medicina familiar, conocen ampliamente tres valores clave: hemoglobina (junto con el hematocrito y sus características), leucocitos (incluyendo linfocitos) y plaquetas. No obstante, existen ciertos indicadores que suelen pasar desapercibidos, como es el caso de los eosinófilos, cuyo aumento tiende a asociarse comúnmente con patologías de naturaleza alérgica.
En el presente artículo, nos centramos en estos tipos específicos de células, buscando facilitar la interpretación de los valores obtenidos y subrayando su importancia en dos de las afecciones respiratorias más prevalentes, aparte de la relación con las manifestaciones alérgicas: el asma y la enfermedad pulmonar obstructiva crónica (EPOC), se observa que el incremento o la normalidad de la determinación de los eosinófilos condicionan el fenotipo de la enfermedad e incluso, en algunos casos, el tratamiento.
Most physicians in general, and family physicians in particular, are familiar with certain parameters when ordering a hematological study, such as hemoglobin (including hematocrit and its features), leukocytes (including lymphocytes) and platelets. Nevertheless, there are two values that we use to overlook which are eosinophils and basophils. Specifically, eosinophils have a tendency to increase with allergic pathology.
This article focuses on this type of cells, helping to interpret the values obtained and highlighting their importance in two of the most frequent respiratory pathologies in primary care: asthma and COPD. In addition to observing how the increase or normality of these parameters condition the diagnosis, phenotype and even the treatment.
Interpretar una analítica de sangre que incluya un hemograma es un escenario muy frecuente en la consulta diaria del médico de familia, siendo la hematología y la bioquímica general las pruebas de sangre más solicitadas, ante la gran cantidad de datos que podemos obtener, para el estudio básico de cualquier paciente.
Los eosinófilos son leucocitos polimorfonucleares que participan en la regulación de las reacciones inmunes adaptativa e innata mediante el reconocimiento de alérgenos y patógenos a través de la llamada respuesta inmune de tipo 2 (T2), con la participación de citoquinas inflamatorias como interleucinas (IL)-4, IL-5 e IL-13.
Se ha demostrado que actúan frente a infecciones por parásitos y en enfermedades alérgicas mediadas por hipersensibilidad, así como en el caso del asma e infecciones víricas1,2. De hecho, se ha comprobado que la activación de eosinófilos es un arma de doble filo, ya que causa tanto una exacerbación aguda del asma como protección contra la infección viral grave del SARS-CoV-2, lo cual disminuye el riesgo de hospitalización y mortalidad en aquellos pacientes que presentaban asma con eosinofilia persistente3.
Las diferentes funciones que desempeñan los eosinófilos se deben a la expresión en su membrana de numerosos receptores y/o liberación de moléculas contenidas en los gránulos mediante la exocitosis, que son tóxicas para una gran variedad de tejidos, entre ellos el epitelio bronquial. La proliferación de los eosinófilos se encuentra regulada principalmente por las citoquinas, siendo la IL-5 la más potente, pues estimula su producción y diferenciación selectiva en la médula ósea. Esto provoca un aumento del número de eosinófilos tanto en la circulación sanguínea como en los tejidos diana, donde se activan y se degranulan, lo cual promueve la transición epitelial a mesenquimal de las células epiteliales bronquiales, la multiplicación de células musculares lisas y el depósito de colágeno. Además, se favorece la síntesis de leucotrienos, tromboxanos y prostaglandinas, de elevado potencial inflamatorio, con capacidad para inducir la contracción de la musculatura lisa, promover la secreción de moco y alterar la permeabilidad vascular4.
A continuación, se expone la utilidad del estudio de los eosinófilos para el médico de familia en las patologías respiratorias más prevalentes en nuestras consultas, como son el asma, la enfermedad pulmonar obstructiva crónica (EPOC) y la enfermedad alérgica como síndrome en general.
AsmaEl asma es una entidad caracterizada por un fenómeno inflamatorio de la vía aérea, con hiperrespuesta bronquial y obstrucción al flujo aéreo. Sin embargo, aunque estos signos sean comunes, representa una enfermedad heterogénea compleja. Actualmente, su clasificación ha evolucionado en varios endotipos, definidos por los mecanismos fisiopatológicos e inmunológicos subyacentes que se diferencian en la capacidad de respuesta a las terapias comunes, como los corticoesteroides inhalados o tratamientos biológicos, y en fenotipos, resultado de la unión entre la genética y los factores ambientales. Se ha observado una gran infiltración de eosinófilos en los pulmones de la mayoría de los pacientes con asma, principalmente en aquellos tipos graves no controlados en los que participa la respuesta T24.
Estudios como Unbiased Biomarkers for the Prediction of Respiratory Disease Outcomes (U-BIOPRED)5, la Guía Española para el Manejo del Asma (GEMA)6 y la Global Initiative forAsthma (GINA)7 han realizado una separación entre los distintos tipos de asma en función de las citoquinas implicadas, biomarcadores y características clínicas8,9. De esta manera, se distinguen dos patrones inflamatorios:
Un patrón no T2/T2 bajo, caracterizado por la ausencia de marcadores inflamatorios y respuesta de tipo T2. Los factores como el tabaquismo, la obesidad, las infecciones bacterianas y virales, la contaminación ambiental y/o laboral o el ejercicio físico, podrían ser agentes desencadenantes de la inflamación no T2, llegando a considerarse alguno de ellos subfenotipos como entidad propia10. Dentro de esta categoría, se englobarían además dos perfiles principales: el asma paucigranulocítica, mediante la acción de la vía de inflamasoma/interferón; y el asma neutrofílica, activada por vías metabólicas y mitocondriales.
Un patrón T2/T2 alto, donde se produce una exacerbación de los eosinófilos y un incremento del valor de óxido nítrico exhalado (FeNO) durante las pruebas de diagnóstico, a veces incluso puede estar relacionado con atopia y niveles altos de inmunoglobulina (Ig)E e incluyéndose patologías como la enfermedad respiratoria exacerbada por aspirina o la micosis broncopulmonar alérgica11. Clínicamente, la respuesta T2 se ha diferenciado entre asma alérgica y eosinofílica, ambas de relevancia en la práctica clínica en la atención primaria12, pues presenta una alta prevalencia, considerándose además como inflamación T2 refractaria cuando existe un criterio o más tales como eosinófilos en sangre ≥ 150 células/μL, FeNO ≥ 20 ppb, eosinófilos en esputo ≥ 2% y/o clínica de asma inducida por alérgeno.
Dada la variabilidad de procesos respiratorios con similitud y heterogeneidad clínica, no siempre es fácil incluir a los pacientes en alguno de los endotipos y fenotipos aceptados. Así pues, en un sujeto que presenta fenotipo alérgico y eosinofílico, un inicio precoz suele tener predominio alérgico, mientras que, si tiene fenotipo alérgico y eosinofílico de inicio tardío, se sugiere un predominio eosinofílico. No obstante, poco a poco se va consiguiendo una determinación más clara en el manejo del asma, y el recuento de eosinófilos en sangre (BEC) y en esputo (SEC) son actores clave a la hora de poder determinar algunos fenotipos, sirven como indicadores de control y guían al médico en las decisiones de tratamiento13,14.
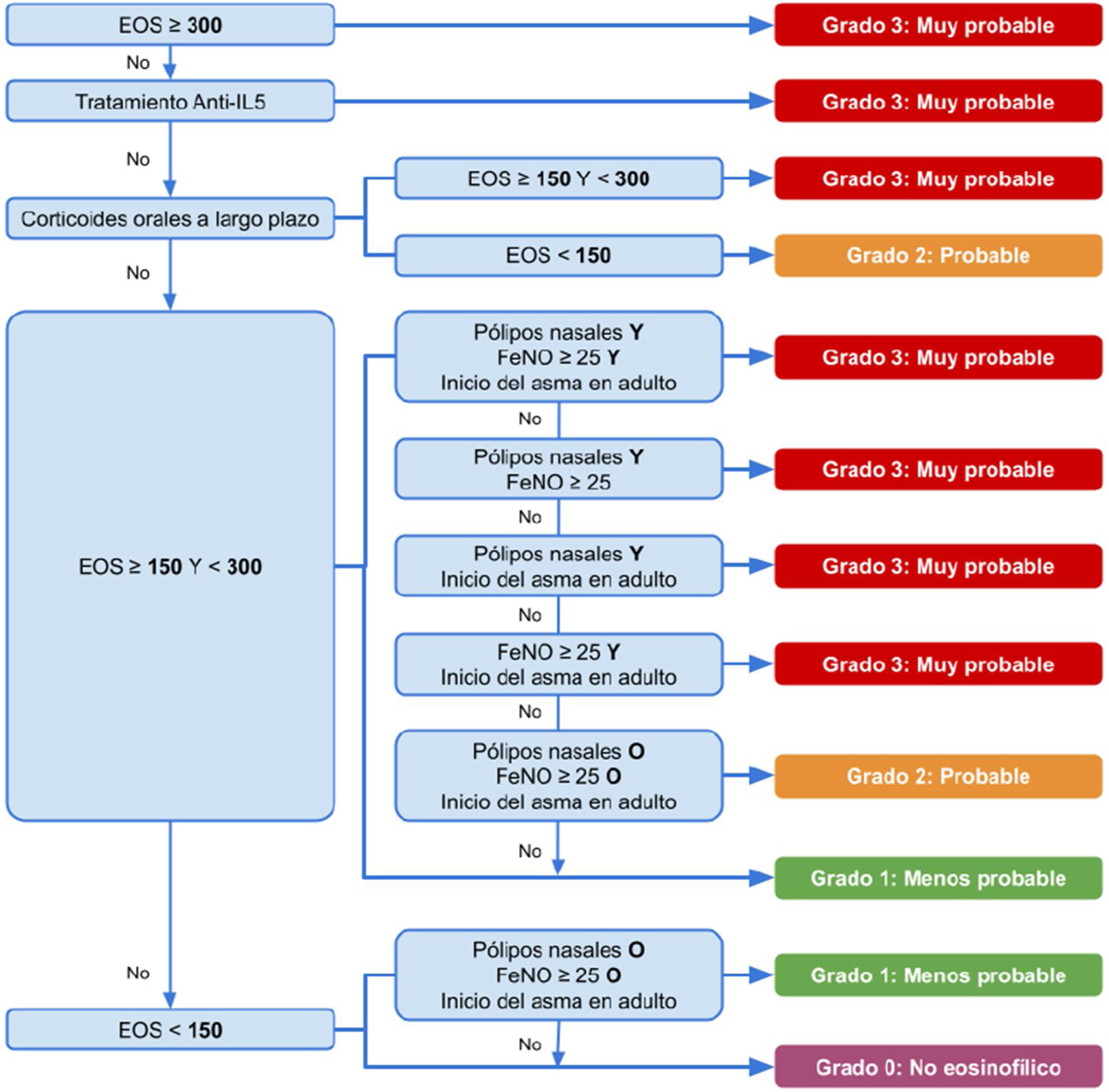
Para definir el asma eosinofílica en un paciente que no ingiere glucocorticoides sistémicos, se puede tomar en cuenta un BEC (actual o histórico) ≥ 300 células/μL en ≥ 2 determinaciones, mientras que, si los toma, se consideraría como inflamación T2 a partir de ≥ 150 células/μL. Se ha desarrollado un algoritmo para poder identificar si es asma eosinofílica, catalogándola como grado 3 (muy probablemente), grado 2 (probable), grado 1 (menos probable) y grado 0 (no eosinófila)15 (fig. 1).
Diagrama de flujo que muestra el algoritmo del fenotipo de asma grave eosinofílico y no eosinofílico.
Basado en Heaney et al.15
EOS: recuento de eosinófilos en sangre (células/μl) o BEC; FeNO: óxido nítrico exhalado fraccional (ppb); IL: interleucina. Inicio del asma en adulto cuando es ≥ 18 años.
La remodelación de las vías respiratorias es un proceso que puede ocurrir fisiológicamente como un mecanismo reparador tisular, donde los eosinófilos tienen un papel homeostático importante. Los niveles elevados de IgE y de eosinófilos en sujetos con asma alérgica frente a aquellos con concentraciones más bajas presentan una mayor angiogénesis de la pared de las vías respiratorias y remodelación microvascular16. Incluso, se ha demostrado que el aumento de eosinófilos en sangre como en el esputo de las vías respiratorias se asocia a mayor gravedad, mayor frecuencia de exacerbaciones17 y empeoramiento de la función pulmonar18, por ende, a un peor control del asma, mayor número de visitas ambulatorias y hospitalarias19, y un factor de riesgo futuro si persisten a pesar de tratamiento20. Existe, además, una reducción significativa de la aparición de cualquier exacerbación cuando la terapia se basó en el SEC, en comparación con el de los síntomas clínicos con o sin función pulmonar21. Aunque utilizar biomarcadores no es obligatorio y se emplean con poca frecuencia por los médicos de familia, estos permitirían una mejor caracterización del asma, así como la mejoría del uso y optimización de los corticoides orales22.
El avance de la investigación en los tratamientos contra el asma se ha centrado estos últimos años en los anticuerpos monoclonales. La eficacia y seguridad de los agentes biológicos para las respuestas T2 han sido bien evaluadas y han demostrado resultados favorables en ensayos clínicos y estudios en situaciones reales sobre la reducción de las exacerbaciones, la mejora de la calidad de vida y la función pulmonar en pacientes con enfermedad grave23, sobre todo en aquellos con eosinofilia elevada24, no siendo tan efectivos en el caso del asma no T2/T2 bajo25.
Las guías y expertos consideran a los eosinófilos como fuertes predictores de buena respuesta e indicaciones frente al tratamiento biológico anti-IL5 y su receptor (anti-IL-5R), incluyéndose en la terapia estándar para los pacientes con asma grave. Asimismo, si un sujeto presenta la enfermedad de fenotipo alérgico con un recuento de eosinófilos<150 células/μL y sin tratamiento con glucocorticoides de mantenimiento, el omalizumab es la primera opción de abordaje, mientras que si ese recuento oscila entre ≥ 150 y <300 células/μL, el omalizumab, el mepolizumab y el dupilumab se consideran alternativas válidas.
Es plausible que en el futuro se perfeccionen aún más las categorías del asma al enfocarse en una clasificación biológica endofenotípica que utilice biomarcadores combinados. Estudios más recientes han demostrado incluso la existencia de subpoblaciones de eosinófilos distintas tanto en el caso del asma como en el EPOC26. Esto contribuiría al desarrollo de estrategias más efectivas para lograr una identificación más precisa de los individuos que responderán favorablemente en situaciones reales.
En España, se han consensuado criterios de derivación del asma entre profesionales de medicina familiar, neumología y alergología27. La decisión última de la elección de un monoclonal concreto para un paciente corresponde exclusivamente a los neumólogos y/o alergólogos. No obstante, el fenotipado del asma puede comenzarse a realizar desde la atención primaria, incluyendo el recuento de los eosinófilos en los Point of Care28. Como se puede observar, la participación de estos en el asma desempeña un papel importante tanto en su fisiopatología como al indicar la gravedad, el fenotipo de asma, la respuesta al tratamiento y la adherencia terapéutica, siendo su conocimiento de importancia para el médico de familia.
Enfermedad pulmonar obstructiva crónicaLa EPOC es una enfermedad pulmonar común, prevenible y tratable que se caracteriza por síntomas respiratorios persistentes29–31. Es progresiva, debilitante y se asocia con la pérdida de la función pulmonar, peor calidad de vida, comorbilidades, mortalidad significativa y mayores costes en atención afectando a 200 millones de personas en todo el mundo y causando 3 millones de muertes al año32, el tabaquismo es la principal causa conocida, así como la predisposición genética33–36.
La respuesta inmunológica de los pacientes que padecen EPOC involucra tanto al sistema inmunológico innato como al adaptativo37–39. Al inicio, se pensó que la exacerbación de la EPOC estaba provocada principalmente por la inflamación mediada por neutrófilos, aunque 25-40% se produce por la participación de eosinófilos40,41. Es importante identificar este grupo de sujetos, ya que son más sintomáticos y tienen mayor riesgo de exacerbaciones, siendo un marcador de respuesta al tratamiento con corticoides inhalados (CSI)42. Sin embargo, la respuesta a los corticoides orales y a los agentes antieosinofílicos entre los individuos con EPOC es mixta y diferente a la del asma.
Los eosinófilos son células inmunes de la respuesta innata que están latentes en la sangre, pero al exponerse a citocinas proinflamatorias como las IL-33, IL-5, IL-6, se activan y migran a la sangre. Se sabe que la IL-5 es la principal implicada en la activación de estos en el contexto del asma eosinofílica. Sin embargo, el mecanismo en la EPOC es distinto43,44, pues recae el protagonismo en la IL-33 en lugar de IL-5, cuyo bloqueo ha demostrado que afecta a un mejor control de las exacerbaciones y su presencia señala un aumento excesivo de la reacción inflamatoria45. Esto sugiere un mecanismo indirecto por el cual los eosinófilos inducen la remodelación de las vías respiratorias en la EPOC. Se ha postulado que las funciones de estos en el asma están reguladas por células dendríticas y T colaboradoras 2 (Th2), mientras que en la EPOC están coordinadas por células linfoides innatas tipo 2 (ILC2)46,47.
Se ha comprobado que los SEC)> 3% están presentes en 28-32% de los pacientes con EPOC, mientras que los BEC)> 300 células/μL están en 14-24%. Los sujetos con cierto grado de EPOC eosinofílica tienen exacerbaciones más frecuentes, mayor riesgo de reingreso y mejores respuestas al tratamiento con CSI. Los eosinófilos del esputo tienen una asociación más estrecha con resultados clínicos como el volumen espiratorio forzado (FEV1) o la tasa de exacerbación en comparación con los que se encuentran en la sangre.
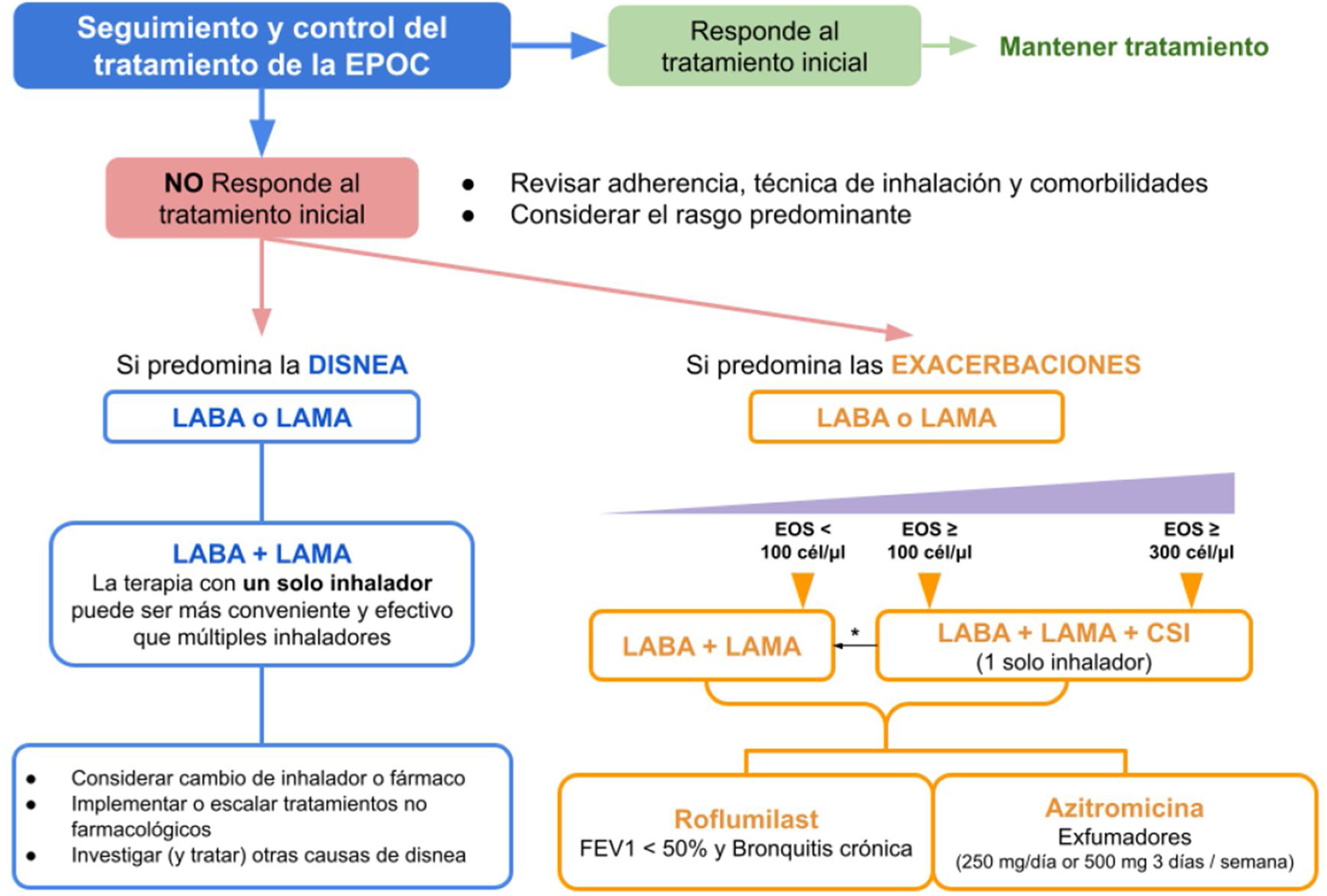
Dado que estos pacientes presentan un curso clínico más grave y mejores respuestas al tratamiento, esto respalda la adición más temprana de CSI a la terapia de mantenimiento de la EPOC. Esto se refleja en las directrices de la Iniciativa Mundial sobre Enfermedad Pulmonar Obstructiva Crónica (GOLD) de 2024 que favorecen su uso cuando existe BEC> 300 células/μL y su retirada si <100 células/μL48 (fig. 2). La única consideración importante a tener en cuenta es que varía con el tiempo, ya que se ve afectado por la edad, el sexo y la fase de la enfermedad (el inicio o durante la exacerbación)49.
Esquema de tratamiento de la EPOC.
Adaptado de la guía GOLD 202448.
CSI: corticoides inhalados; EOS: recuento de eosinófilos en sangre (células/μl); EPOC: enfermedad pulmonar obstructiva crónica; GOLD: Iniciativa Mundial sobre Enfermedad Pulmonar Obstructiva Crónica; LABA: beta-2 adrenérgicos de larga duración; LAMA: antimuscarínicos o anticolinérgicos de larga duración.
* Considerar desescalar los corticoides inhalados si presenta neumonía u otros efectos secundarios. En el caso de recuento de eosinófilos (EOS)> 300 células/μL, realizar una desescalada, pues es más probable la asociación con el desarrollo de exacerbaciones.
La relación entre eosinófilos en sangre periférica y la EPOC se ha visto reforzada por varios estudios observacionales y ensayos clínicos40,47, generándose dos debates complementarios.
En primer lugar, se discute si los eosinófilos en sangre periférica podrían ser un marcador para la elección del tratamiento durante la exacerbación. Según la revisión realizada por la Guía Nacional Española para el manejo de la EPOC (GesEPOC) de 2021, se ha comprobado que la eficacia de los corticoides sistémicos es mayor en pacientes con BEC> 300 células/μL, ya que se asocian con mayor número de reingresos después de una exacerbación a medio plazo36,47. No obstante, mientras que en el asma los niveles de eosinófilos en sangre están claramente vinculados con el riesgo de exacerbación posterior, los resultados en la EPOC son mixtos, la GOLD no aconseja emplearse como un biomarcador independiente de riesgo futuro. Aunque el recuento de eosinófilos puede ayudar a guiar el inicio del tratamiento con CSI (o también saber cuándo no utilizarlo), adquiere menos importancia cuando se intenta «reducir» la terapia triple a LABA/LAMA (beta-2 adrenérgicos de larga duración/antimuscarínicos o anticolinérgicos de larga duración), usando el historial de exacerbaciones como predictor clave50.
El segundo debate se debe a la relación entre eosinófilos en sangre periférica durante el estado estable de la enfermedad y en las exacerbaciones51. Para la GOLD, se define como «un episodio caracterizado por un incremento de la disnea, tos y/o expectoración que empeora en un lapso inferior a 14 días, que puede acompañarse de taquipnea y taquicardia y que suele asociarse a un incremento de la inflamación local y sistémica provocada por una infección (vírica y/o bacteriana), por contaminación ambiental o por otra agresión a las vías respiratorias». Esta definición más precisa subsana las limitaciones que se presentaban en revisiones anteriores, que mostraban las exacerbaciones de forma más inespecífica. Está comprobado los SEC producen solo un rendimiento adecuado en 70% de las veces, pudiendo provocar un broncoespasmo en pacientes con FEV1 basal bajo, cuyas muestras deben procesarse en un lapso de dos horas mediante métodos de cuantificación manuales. Por el otro lado, los BEC tienen una especificidad y sensibilidad razonables para predecir la eosinofilia en las vías respiratorias, aunque esto depende del estudio realizado, basándose algunos en la población de eosinófilos como porcentaje del recuento total de leucocitos mientras que otros se han centrado en el conteo absoluto. Además, el momento del BEC es importante ya que fluctúa a lo largo del curso de la EPOC. La mayoría de los estudios se han fundamentado en niveles basales para determinar la eosinofilia en las vías respiratorias, lo que puede no ser un reflejo fiel del estado inflamatorio. Varios trabajos han demostrado una correlación positiva de los eosinófilos del esputo y los niveles de BEC durante las exacerbaciones de EPOC. Sin embargo, el diagnóstico no debe realizarse durante estas últimas, sino cuando el paciente se encuentra estable52,53.
Un punto interesante que podría plantearse es si el BEC podría usarse o no para reducir el empleo de corticoides orales y prevenir efectos secundarios. Se ha demostrado que el tratamiento guiado por eosinófilos es una forma segura de reducir su exposición. Varios estudios, como el ensayo STARR254 o eo-Drive55 (actualmente en curso, NCT04234360) sugieren esa posibilidad analizando los eosinófilos al comienzo de la exacerbación y el uso de prednisolona junto a la terapia estándar, aunque la exposición a corticoesteroides puede causar grandes cambios en la inflamación de las vías respiratorias después de comenzar con ello41,54.
Son escasos los estudios actuales que consideran la variabilidad significativa de los eosinófilos en sangre a lo largo del tiempo y la mayoría se han basado en una sola medición para determinar el endotipo inflamatorio y, por tanto, el tratamiento. Para evitar esa influencia, el ensayo CORTICO-COP monitoreó repetidamente y ajustó la terapia dependiendo de si presentaban un BEC> 300 células/μL, se encontró una reducción del tiempo medio de exposición a corticoesteroides de cinco a dos días y una disminución de sus efectos secundarios, así como como un menor riesgo de empeorar la diabetes preexistente y de infecciones después de 90 días56. Otro estudio como COPERNICOS (actualmente en curso, NCT04481555) utiliza un protocolo en el que se va añadiendo o retirando un CSI a su tratamiento de base cada tres meses según el valor límite BEC de 300 células/μL para lograr los objetivos descritos sin ser inferior a las pautas de abordaje actuales.
Además, hay que tener en cuenta el empleo de los agentes biológicos, cuya eficacia está más que demostrada en el caso del asma eosinofílica, pero aún no se ha llegado a determinar en la EPOC. Estudios como METREX/METREO sugieren que el mepolizumab (anti-IL5) puede desempeñar un papel en la reducción del riesgo de exacerbaciones en pacientes con EPOC con un nivel elevado de eosinófilos en sangre, cumpliéndose sus resultados en el caso de METREX57. Sin embargo, esto no se replicó en METREO, lo que genera dudas sobre la solidez del resultado58. Por otro lado, el itepekinumab y el tozorakimab, anticuerpos anti-IL33, continúan en desarrollo para esta enfermedad, abriendo una nueva vía de tratamientos para la prevención de daño tisular59.
Con todo ello, la atención primaria desempeña un papel importante en el seguimiento y manejo de los pacientes con EPOC. Estudios basados en consultorios de Nueva Zelanda y Reino Unido ponen de manifiesto que un aumento de eosinófilos en sujetos con asma asociado, así como tener BEC> 150 células/μL estaba relacionado con un mayor número de antecedentes de exacerbaciones, y se beneficiaron mejor del tratamiento con CSI, reduciendo hasta 15% su riesgo absoluto60,61. Por tanto, el análisis de los eosinófilos permitiría adaptar mejor la terapia y realizar ajustes de la misma a lo largo del tiempo. No obstante, el acceso a pruebas complementarias y a los abordajes indicados suponen uno de los retos y limitaciones que se presentan al médico de familia.
Enfermedad alérgicaEl término alergia agrupa una multitud de eventos y patologías distintas, con la premisa común de ser un proceso fisiopatológico caracterizado por una respuesta anormal del propio sistema inmune a la presencia de un alérgeno. Los síntomas dependen del agente causante de la enfermedad y del propio individuo, siendo la rinoconjuntivitis la clínica más frecuente62. La presentación más grave en el paciente con alergia es la reacción anafiláctica. La identificación de la Ig específica para un determinado alérgeno es, al día de hoy, el parámetro analítico de elección para cuantificar y monitorizar la evolución de la patología alérgica. Esto supone romper el esquema clásico de estudiar el número absoluto de eosinófilos en los pacientes con clínica de enfermedad alérgica, dada su escasa utilidad en las decisiones terapéuticas63.
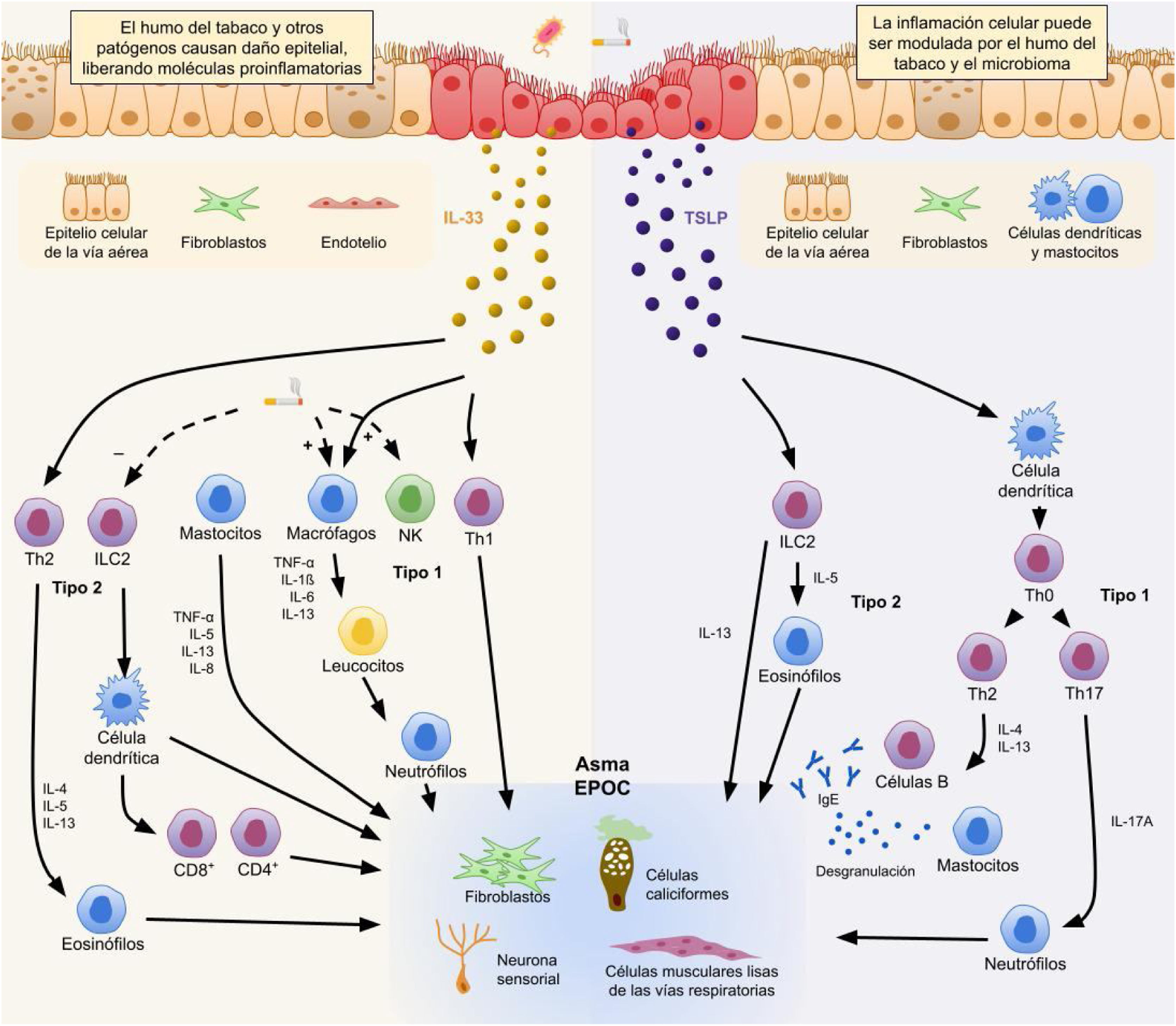
ConclusionesEn la consulta de atención primaria, las determinaciones más comunes que aparecen en el hemograma incluyen los eosinófilos, aunque estas no suelen tener un impacto significativo en la práctica clínica diaria. Estos leucocitos, con sus complejos mecanismos de activación (fig. 3), desempeñan un papel crucial en la comprensión de la fisiopatología de dos enfermedades respiratorias muy comunes como son el asma y la EPOC. Además, es esclarecedora la escasa utilidad de la valoración del número de eosinófilos en el campo de la patología alérgica, resaltando el papel de la determinación en la analítica de nuestros pacientes de los valores de IgE específica frente al alérgeno de sospecha fundamental.
Vías de activación del eosinófilo en la fisiopatología del asma y EPOC.
Basado en Calderón et al45.
EPOC: enfermedad pulmonar obstructiva crónica; Ig: inmunoglobulina; IL: interleucina; ILC: células linfoides innatas; NK: natural killer; Th: células T colaboradoras; TNF: factor de necrosis tumoral; TSLP: linfopoyetina estromal tímica.
Focalizar la atención en el valor absoluto de eosinófilos en la sangre es una necesidad cuando se determinen los adecuados diagnósticos, fenotipos y tratamientos del paciente con asma y EPOC. A partir de ello, incluso se establece una propuesta en la comunicación de atención primaria especializada para el posible uso o indicación de un abordaje terapéutico extendido al uso de algún tratamiento biológico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.