Editado por: Dr. Mariano de la Figuera von Wichmann
(Clínica Olivé Gumà, Barcelona, Spain)
Prof. Dr. Elena Segura-Grau
(Tondela Viseu Hospital Center, Viseu, Portugal)
Última actualización: Diciembre 2024
Más datosEl paciente con descompensación de insuficiencia cardiaca (IC) es un escenario frecuente en las consultas de atención primaria. La presencia de congestión subclínica es un predictor de rehospitalizaciones y de eventos adversos en estos pacientes. La valoración de la congestión resulta compleja por la escasa sensibilidad de los síntomas y los signos clásicos; lo que conlleva un infradiagnóstico, un inicio de tratamiento tardío y una mayor probabilidad de complicaciones derivadas. El médico de familia debe conocer nuevas técnicas de valoración de la congestión, como es el estudio de la congestión venosa con ecografía y la ecografía pulmonar; que permite detectar la existencia de congestión subclínica con mayor precisión. La ecografía clínica en manos del médico de familia puede individualizar la terapia descongestiva en los pacientes con IC de forma acertada, rápida e inocua.
The patient with heart failure (HF) is a frequent scenario in primary care consultations. The presence of subclinical congestion is a predictor of rehospitalization and adverse events in these patients. The assessment of congestion is complex due to the low sensitivity of classic symptoms and signs, which leads to underdiagnosis, delayed initiation of treatment and a greater likelihood of complications. The family doctor should be familiar with new techniques for congestion assessment, such as the study of venous congestion with ultrasound and pulmonary ultrasound. This makes it possible to know the existence of subclinical congestion in a more realistic way. Clinical ultrasound in the hands of the family doctor individualizes decongestive therapy in patients with HF in an accurate, fast and safe way.
La insuficiencia cardiaca (IC) es una de las enfermedades con mayor impacto sanitario y económico en nuestro país. Según diferentes estudios (PRICE1 con una cohorte española y el EPISERVE2), se estima que la prevalencia de IC en España oscila entre el 4,7 y el 7%, con una edad media de 65 años. Según el estudio IBERICAN, hasta el 3% de los pacientes vistos en atención primaria en España, presentan IC3. La IC es además, la primera causa de ingreso hospitalario en nuestro país, con más de 100.000 ingresos hospitalarios al año, suponiendo el 5% de todas las hospitalizaciones. La mortalidad al año del diagnóstico es también muy elevada (16%), aumentando hasta un 60% a los 10 años de la enfermedad4. Anualmente, es responsable del 4% de las muertes en España, siendo la tercera causa de muerte cardiovascular en nuestro país5,6.
Se trata de una enfermedad compleja de difícil reconocimiento, y generalmente infradiagnosticada, ya que los signos y los síntomas que habitualmente se han propuesto para su diagnóstico tienen una baja sensibilidad7. Esto es consecuencia de que clínicamente no somos capaces de valorar con fiabilidad la congestión residual (en el estudio DOSE-HF solo el 15% de los pacientes alcanzaron la euvolemia al alta de la hospitalización8). Los criterios clínicos habitualmente más utilizados, como la auscultación pulmonar, la mejoría clínica de la disnea o la pérdida de peso no son buenos marcadores de euvolemia, ni se correlacionan de forma fiable con la presión de llenado del ventrículo izquierdo9.
La congestión clínica se ha definido clásicamente por los signos y los síntomas típicos de IC como disnea, crepitantes pulmonares y edemas en miembros inferiores10; consecuencia de un aumento de la presión diastólica ventricular izquierda. Durante los últimos años el concepto de congestión ha evolucionado, haciendo hincapié en alejarse del concepto de «sobrecarga hídrica» y aproximándose al de «redistribución vascular». Las hipótesis más recientes apuntan a reservorios de líquido en compartimentos intravasculares periféricos (p. ej., el lecho esplácnico) que pueden llegar a producir una rápida redistribución de líquido hacia la circulación cardiopulmonar central, aumentando la presión hidrostática intravascular sin que ello conlleve un aumento del volumen de agua corporal11.
Como consecuencia de la relevancia clínica y de la complejidad que supone una valoración adecuada de la congestión, la ecografía se presenta como una herramienta novedosa que nos permite detectar con mayor fiabilidad la congestión del paciente con IC. La valoración ecográfica de la congestión se basa en 2 pilares que corresponden a los 2 fenotipos congestivos; la ecografía pulmonar en la valoración de la congestión extravascular o tisular; y la ecografía Doppler venosa en la valoración de la congestión intravascular12.
Congestión extravascular (pulmonar)Entre las características del síndrome clínico que conforma la IC, cuando el fallo implica a las cavidades cardíacas izquierdas, se produce congestión a nivel pulmonar. El aumento de líquido en espacios extravasculares comenzará a nivel del intersticio pulmonar y progresará con el aumento de presiones ocupando los alvéolos y posteriormente extravasando al espacio pleural. Aunque hace años la ecografía pulmonar era desechada por la presencia de artefactos en la exploración, el estudio e interpretación de estos ha supuesto un gran avance y ha convertido a la ecografía pulmonar en una técnica precisa, rápida y costo/eficiente, que permite detectar precozmente la presencia de congestión a nivel pulmonar para la evaluación inicial, monitorización y seguimiento del tratamiento diurético, e incluso en la estratificación pronóstica del paciente con IC.
Técnica de exploración ecográfica pulmonar y hallazgos normalesPara la mejor visualización de los artefactos en la ecografía pulmonar, debemos utilizar una configuración o «preset» de abdomen a una profundidad de unos 10-12cm. En cuanto a la sonda a utilizar, se puede utilizar cualquiera de las 3 sondas más habituales (convexa, lineal o sectorial), aunque preferentemente utilizaremos la primera de ellas pues nos permite visualizar con mayor profundidad la valoración de los artefactos. Las regiones anatómicas a estudiar en el examen ecográfico pulmonar variarán según la situación clínica del paciente. Si el paciente lo permite, podemos realizar la exploración en sedestación abarcando más zonas torácicas. Hay consenso en que una buena exploración puede lograrse explorando 4-6 zonas por hemitórax. La práctica clínica resalta un punto con especial interés que siempre debe ser explorado, el denominado punto posterolateral alveolar/pleural syndrome point (PLAPS). Este punto es el lugar donde se puede encontrar líquido o parénquima pulmonar no aireado, que por gravedad se deposita. El lugar anatómico donde posicionar la sonda sería en oblicuo con la muesca apuntando hacia craneal en línea axilar posterior, a la altura del diafragma (visualizamos en la pantalla el diafragma como una línea hiperecogénica siendo el techo del hígado/bazo en función de si se está estudiando el hemitórax derecho/izquierdo, respectivamente).
Hallazgos patológicosLíneas B como artefacto de interésEn condiciones normales el pulmón está ocupado por aire. Tiene una impedancia acústica muy diferente a la de los tejidos de alrededor, por eso cuando el ultrasonido se encuentra con la línea pleural, Esta actúa como un espejo y hace rebotar el sonido hacia el transductor. Este volverá de nuevo hacia el pulmón y nos provocará una imagen que se irá atenuando con la profundidad. Apreciaremos unas líneas hiperecogénicas similares a la línea pleural de la que son reflejo, ubicadas en una distribución paralela a está y equidistantes a la profundidad que existe entre la sonda y la línea pleural. Se continúan hasta el fondo de la pantalla. A estas líneas las denominaremos líneas A (fig. 1A). Expresan que el aire es el principal componente existente bajo la línea pleural.
Ecografía pulmonar. A) Estudio normal del compartimento anterior y superior del hemitórax derecho que revela la línea pleural como una línea hiperecoica horizontal entre 2 imágenes que dejan sombra acústica posterior, correspondientes a 2 costillas. Además, paralelas a la línea pleural y equidistantes, se objetivan 2 líneas A. B) Presencia de 2 líneas B en compartimento posterior e inferior del hemitórax derecho. Estas líneas B se visualizan como 2 imágenes lineales, hiperecoicas y verticales, que parten de la línea pleural.
Fuente: Imágenes de elaboración propia.
La combinación de líneas A, deslizamiento pleural con la respiración y la presencia del signo de la cortina en la base de ambos hemitórax, es indicativo de pulmón bien aireado o «pulmón seco». El signo de la cortina se puede visualizar aplicando la sonda convexa en línea media axilar con la marca de la sonda hacia craneal e intentando mostrar en la imagen de izquierda a derecha: aire/diafragma (línea hiperecogénica que separa el pulmón del abdomen)/hígado o bazo. Cuando visualicemos esta imagen, pedimos al paciente que realice una inspiración profunda para visualizar la imagen dinámica que se produce por el aire, barriendo de izquierda a derecha la imagen de la víscera que estemos explorando (video 1).
Cuando el balance aire/agua se ve alterado por la presencia de fluido en el intersticio o en los alvéolos aparecerán nuevos artefactos que nos permitirán evidenciar precozmente los cambios en el tejido pulmonar. La imagen que se genera en la interfase entre el aire alveolar y el fluido del septo interlobulillar engrosado es la de un nuevo artefacto al que se denomina línea B. Se visualizan con morfología en cola de cometa con una imagen hiperecogénica vertical. Están bien definidas, surgen de la línea pleura extendiéndose hasta la parte inferior de la pantalla sin desvanecerse, borran las líneas A y desplazan sincrónicamente con el deslizamiento pulmonar (fig. 1B y video 2). Podemos visualizar ocasionalmente líneas B en sujetos sanos, que suelen aparecer en las bases pulmonares. Ante la presencia de ≥3 líneas B en una región pulmonar a estudiar, podemos determinar enfermedad subyacente, como la presencia del síndrome intersticio/alveolar. La importancia del diagnóstico de este síndrome por ecografía en un determinado contexto clínico es debido a que su aparición por este método diagnóstico es más precoz que la propia radiología convencional.
Indicaciones de la ecografía pulmonar en la congestión pulmonarLas nuevas guías internacionales sobre el uso de la ecografía pulmonar la definen como una técnica factible y útil en medicina familiar. Es posible utilizarla como herramienta de diagnóstico de primera línea para el seguimiento de enfermedades o situaciones como el derrame pleural, la IC y la neumonía adquirida en la comunidad. Su uso en la etapa de diagnóstico ambulatorio no solo es beneficioso para el paciente y el médico, sino que por su rentabilidad también debe considerarse por su potencial para la reducción de costos sanitarios13.
Desde los primeros estudios de Liechtenstein14,15, considerado el padre de la ecografía pulmonar, se propone el uso de la ecografía como ayuda diagnóstica del síndrome intersticial al objetivar líneas B de distribución homogénea en ambos hemitórax, sin alteraciones de la línea pleural, y con frecuente aparición de derrame pleural (fig. 2 y video 3).
La sensibilidad de la ecografía en la detección del derrame pleural se ha visto que es ampliamente superior a la radiografía convencional de tórax, ya que la ecografía es capaz de detectar una cantidad mínima de derrame pleural de 5ml, mientras la radiología de tórax necesita una cantidad mínima de 75ml para detectarlos. El derrame en la IC suele ser pequeño, no ocupando más de un tercio del hemitórax y bilateral. Además, la ecografía al ser una técnica accesible y repetible, es útil para valorar las características del derrame pleural y la evolución que presenta como respuesta al tratamiento1617.
La ecografía pulmonar ha sido comparada con el resto de marcadores biológicos utilizados en la IC como el NT-proBNP y el CA125 demostrando buena correlación. Existe fuerte asociación entre las características y el número de las líneas B detectadas, y los niveles aumentados de NT-proBNP18. Los estudios de pacientes hospitalizados permiten correlacionar una peor evolución de aquellos pacientes que ingresan con mayor número de líneas B19,20. Se ha propuesto el uso de la ecografía pulmonar como apoyo para guiar el tratamiento diurético de los pacientes ambulatorios, consiguiendo una reducción del número de ingresos por descompensación de IC21,22.
Congestión intravascularVena cava inferiorTécnica de exploración y hallazgos normalesLa vena cava inferior (VCI), ubicada sobre un cuerpo vertebral y de manera paralela, a la derecha de la arteria aorta abdominal, posee un diámetro normal que varía entre 15 y 25mm. Es la estación final de destino de la sangre que proviene de los miembros inferiores y de los órganos del abdomen y pelvis, justo antes de acceder a la aurícula derecha. Para su visualización por ultrasonidos, se utilizará una sonda de baja frecuencia, como puede ser la sonda convexa. Los puntos anatómicos más utilizados para su visualización son 2: en epigastrio con la sonda en longitudinal con la muesca hacia craneal dirigiendo los ultrasonidos hacia el corazón del paciente y ligeramente a la izquierda; el segundo punto puede ser en la línea axilar media derecha del hipocondrio derecho, a la altura del diafragma, con la sonda en oblicuo y la muesca hacia craneal. Realizaremos cortes transversales y longitudinales, para su medida tanto en su estado basal como en el teórico colapso inspiratorio.
El diámetro de la VCI se mide a 2cm de su desembocadura en la aurícula derecha, considerándose un tamaño propio de congestión cuando se super el punto de corte de 21mm (fig. 3 y video 4). La medición se puede realizar tanto en modo B o aplicando el modo M, aunque la práctica clínica recomienda hacerlo preferiblemente en modo B. De hecho, el error más frecuente en la medida de este gran vaso es llevar un cabo un corte que no represente el diámetro máximo central de la luz vascular. Además, es importante calcular el grado de colapsabilidad de la cava, utilizaremos el diámetro de índice cava (IC) mediante la siguiente fórmula: (diámetro máximo en espiración – diámetro mínimo en inspiración)×100/ diámetro máximo en espiración. La normalidad de IC es >50%23.
Falsos hallazgos patológicosDescritos en el apartado anterior, los hallazgos de normalidad, se puede deducir que un diámetro mayor a 21mm y un índice de colapsabilidad <50% son hallazgos patológicos. Aunque, es importante conocer que existen determinadas situaciones en las que estos valores no traducen la presencia de congestión en nuestro paciente. Por ejemplo, en la valoración de los pacientes con hipertensión pulmonar, las personas jóvenes y/o atléticas sanas es posible encontrar un aumento del calibre de la VCI (aumento de la presión venosa central) sin que eso signifique una mayor congestión venosa27. Hasta 10 condiciones alteran esta supuesta relación entre el tamaño de la vena y el estado del volumen real:
- –
Determinantes respiratorios: ventilación mecánica no invasiva con PEEP alta y/o volumen tidal bajo, variación del patrón respiratorio en respiración espontánea y en el atrapamiento aéreo (asma/EPOC agudizado)
- –
Determinantes cardíacos: infarto de ventrículo derecho, el taponamiento cardíaco, fallo del ventrículo derecho crónico e IT severa.
- –
Determinantes abdominales: Aumento de la presión intraabdominal o ascitis
- –
Otros: trombosis de la vena cava, masas que compriman la vena cava y el desplazamiento lateral de la cava en inspiración y error en la técnica.
Es importante esclarecer que la VCI nos aporta información sobre la presión venosa central y no es un marcador de congestión como medida única. Constituye un marcador de congestión venosa cuando se lleva a cabo una ecografía multiórgano combinando una evaluación de más puntos críticos del sistema venoso, el estudio básico de las dimensiones cardíacas, la función de las cámaras cardíacas derecha e izquierda, una evaluación básica de ecografía pulmonar, y por supuesto, una valoración completa de toda la información clínica.
Por ello, se debe romper la inercia clínica de predicar en la práctica común con la premisa de inferir la volemia del paciente con una relación exclusiva y directamente proporcional al diámetro y la dinámica de la VCI24,25. Se ha descrito que a menudo los pacientes hipovolémicos presentan una VCI colapsada o de menor tamaño y que los pacientes con hipervolemia presentan una VCI dilatada con un colapso inspiratorio nulo. Esto afirma que el estudio de la VCI tiene más valor en los extremos de su presentación clínica26:
- 1.
VCI no dilatada (diámetro <21mm) y con variación inspiratoria >50% (IC>50%): se determina que el paciente no presenta congestión venosa, no candidato a completar búsqueda avanzada de congestión intravascular. Por lo tanto, no es necesario llevar a cabo una restricción en la administración de volumen si el paciente lo necesitara.
- 2.
VCI dilatada (diámetro >21mm) y no colapsable con la inspiración: sugestiva de sobrecarga hídrica, valorar tratamiento diurético y precaución a la hora de administrar volúmenes (video 5).
La especial importancia de este apartado focalizada en la actualización más reciente del tema y el manejo avanzado que implica la dificultad técnica de localizar los vasos a estudiar, hace que primero se exponga la utilidad y luego la técnica necesaria llevar a cabo cada estudio.
El estudio ecográfico de la VCI solo supone un primer filtro o «screening», para saber si existe congestión vascular cuando sospechamos una IC congestiva (si la VCI es filiforme o de tamaño normal con un buen colapso inspiratorio, descartaremos congestión vascular y no seguiremos buscando parámetros ecográficos de congestión vascular). Sin embargo, si el paciente presenta una VCI dilatada, disponemos de otros marcadores ecográficos de congestión venosa empleando la ecografía Doppler color y Doppler pulsado, que permite evaluar los flujos venosos y relacionarlos con el grado de congestión venosa del paciente.
La valoración venosa mediante ecografía Doppler no es algo nuevo, aunque su uso se ha extendido desde la publicación del protocolo VExUS28, donde se evaluó el grado de congestión en pacientes posquirúrgicos cardíacos a través del estudio de la vena suprahepática, la vena porta y la vena renal en su porción interlobular. El objetivo principal del estudio analizado fue desarrollar un sistema de clasificación de la congestión venosa por ultrasonido (VExUS) y validar su potencial valor clínico en la predicción de la aparición de la insuficiencia renal aguda (IRA) tras cirugía cardíaca, secundario a la sobrecarga hídrica29,30.
Aunque el intento de replicación del protocolo VExUS en los pacientes no quirúrgicos, concretamente en IC aguda, no han sido satisfactorios, sí se han obtenido buenos resultados al estudiar la variación del patrón Doppler pulsado a lo largo del circuito vascular de congestión que conforman la vena porta y la vena renal. En estudios recientes se está abriendo el abanico a la medición de otras venas como la femoral, la yugular interna y la esplénica como otras opciones novedosas para cuantificar el grado de congestión venosa en pacientes con ICA31.
Técnica de exploración. Hallazgos normales y patológicosA continuación, se explicará la técnica y la valoración de la congestión venosa de las 3 principales venas (suprahepática, porta y renal). Utilizaremos en todo momento una sonda de baja frecuencia (convexa o sectorial).
Vena suprahepáticaClásicamente, se posiciona la sonda a nivel subxifoideo en un plano transversal con el marcador hacia la derecha del paciente e inclinando la sonda hacia craneal, para insonar el hipocondrio derecho en busca de la entrada de cualquiera de las 3 venas suprahepáticas (derecha, media e izquierda) en la VCI. Aunque, una proyección muy socorrida es el corte longitudinal del hipocondrio derecho logrando visualizar la desembocadura de la vena suprahepática derecha en la VCI, sobre todo en los pacientes que presentan demasiado artefacto en la ventana subxifoidea. Una vez visualizada la vena suprahepática a estudiar, activaremos el Doppler pulsado y colocaremos el caliper justo antes de la entrada en la VCI. Establecemos la escala del Doppler color con límite de Nyquist en 30cm/s, observando la dirección del flujo venoso (en condiciones normales el color muestra un patrón de flujo alejándose de la sonda, configurado en la mayoría de los ecógrafos de color azul). Cuando se aplica el Doppler pulsado en condiciones normales, existe una onda inicial positiva A (que se correlaciona con contracción auricular), seguido de una onda S negativa (relajación auricular derecha durante la sístole cardíaca) y onda D negativa (relajación ventricular durante la diástole cardíaca); que será de menor tamaño que la onda S. A medida que aumenta la congestión, la onda D se irá haciendo más negativa y de mayor tamaño que la onda S; y en situaciones de congestión severa la onda S se hará incluso positiva (fig. 4).
Estudio en un corte longitudinal del hipocondrio derecho logrando visualizar la desembocadura de la vena suprahepática derecha (coloreada de azul en el Doppler color) en la vena cava inferior. A) Ecografía normal del Doppler pulsado de la vena suprahepática. B) Se muestran los cambios en las ondas producidas por el Doppler venoso a nivel de las venas suprahepáticas a medida que avanza la congestión intravascular:
a) Normalidad: onda S es mayor que la onda D, ambas negativas; b) Congestión leve: la onda D se hace mayor que la onda S, ambas negativas; c) Congestión severa: la onda S se hace positiva (podría estar alterado basalmente en paciente con insuficiencia tricúspidea severa.
Fuente: Imagen y figura de elaboración propia.
La principal limitación radica en la alta variabilidad del patrón del flujo que se objetiva tanto en situaciones fisiológicas como patológicas. Es por ello que debemos tener en cuenta otros parámetros a valorar, nunca utilizándolo como marcador aislado. Además, presenta una variabilidad importante del flujo en relación al momento del ciclo respiratorio que se esté llevando a cabo por el paciente. Otras variables que pueden modificar el flujo puede ser la realización de maniobras de Valsalva, el ayuno prolongado o el ejercicio físico aeróbico32. Dada su proximidad al corazón, existen alteraciones que pueden complicar la interpretación de las ondas. En pacientes que presenten comorbilidades como fibrilación auricular, bloqueo de rama izquierda o cirrosis hepática, se visualizarán patrones diferentes al comentado como normal, que dificultan la valoración. Además, en caso de insuficiencia tricuspídea (IT), la onda S estará alterada de forma crónica (pudiendo ser positiva en caso de IT severa)
Vena portaAplicaremos la sonda en línea axilar media derecha (ventana FAST) en un plano coronal (más preciso que subxifoideo) con el marcador hacia craneal y visualizando la vena porta en el centro de la imagen. Activando el Doppler color, y ubicando el caliper del Doppler pulsado en la vena porta justo antes de la división en ambas ramas portales (derecha e izquierda). Establecemos la escala del Doppler color con límite de Nyquist en 30cm/s, observando como normal un flujo venoso que se acerca a la sonda (en rojo, en la configuración de la mayoría de ecógrafos). El patrón de flujo venoso portal normal es monofásico sin apenas variación respiratoria32, por la protección que le otorgan los sinusoides hepáticos, que evitan transmisión de la presión en la aurícula derecha. A medida que aumenta la congestión, se genera un flujo retrógrado con la contracción auricular, que se transmite a los sinusoides hepáticos y a la vena porta; provocando un flujo bifásico (fig. 5). Esto genera un índice de pulsatilidad, que es directamente proporcional a la congestión (Vmáx-Vmin/Vmáx). Este índice nos permitirá objetivar congestión moderada si su valor es del 30-49% y congestión grave si es >50%.
Estudio Doppler pulsado de la vena porta. A) Ecografía normal del Doppler pulsado de la vena porta. B) Se muestran los cambios en las ondas producidas por el Doppler venoso a nivel de la vena porta a medida que avanza la congestión intravascular:
a) Normalidad: apenas existe pulsatilidad; b) Congestión leve: las ondas presentan una pulsatilidad >30%; c) Congestión severa: pulsatilidad >50% con ondas que se hacen negativas.
Fuente: Imagen y figura de elaboración propia.
Las principales limitaciones serán: su valoración en personas sanas, con IMC por debajo de la normalidad y en malformaciones arteriovenosas puede existir un aumento de pulsatilidad sin traducir la presencia de congestión venosa. Así también es posible encontrar una ausencia de pulsatilidad en situaciones de cirrosis hepática, esteatosis hepática o trombosis portal, en los que la transmisión de la presión en la aurícula derecha está atenuada en los sinusoides hepáticos33.
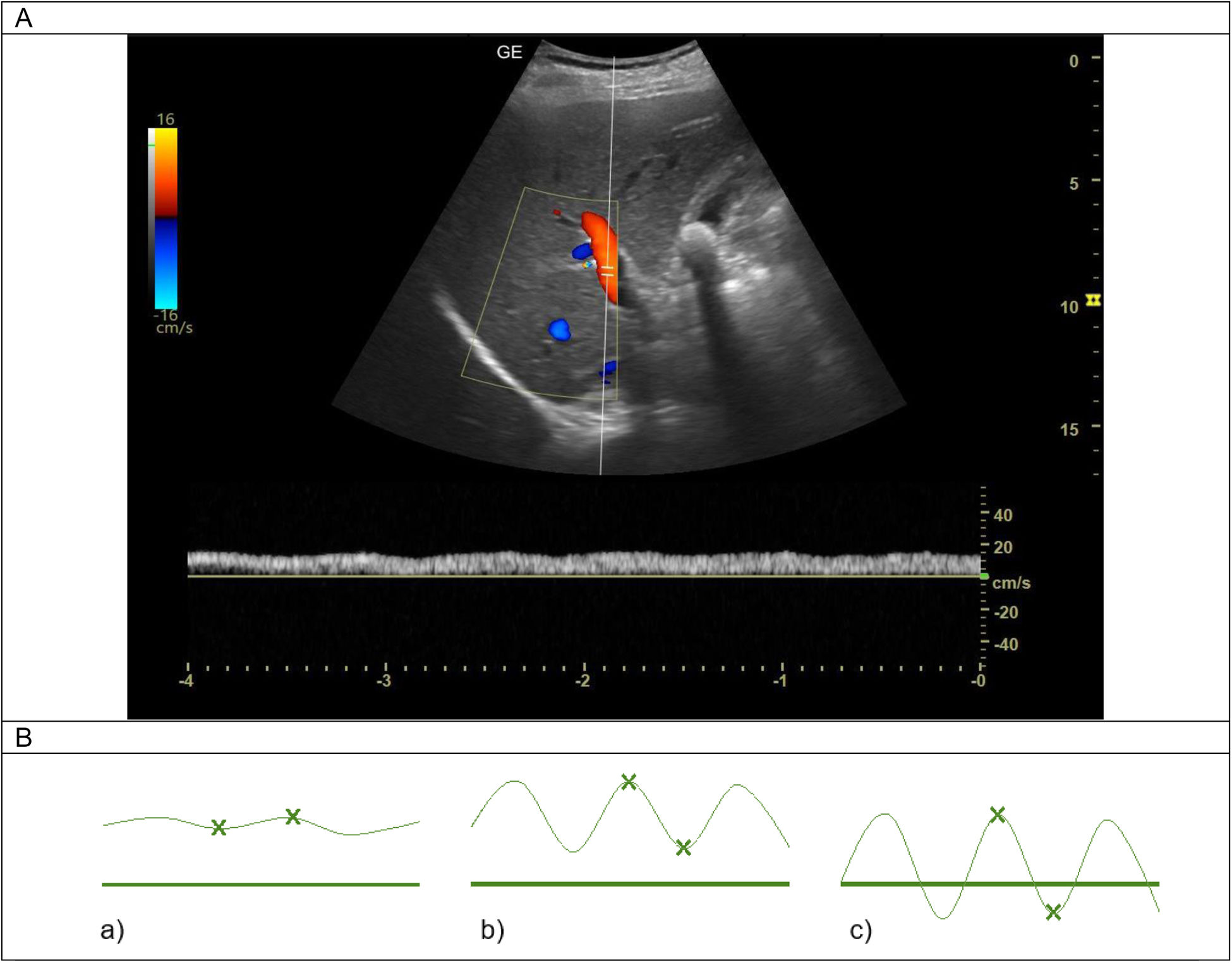
Vena renalSe situará la sonda en línea axilar posterior, en un plano coronal, con el marcador hacia craneal, a la altura de la región anatómica propia del riñón. Cuando visualicemos el riñón ajustando la profundidad para intentar que el estudio del riñón ocupe gran parte de la pantalla, se aplicaría el Doppler color y ubicamos el caliper del Doppler pulsado en la porción de la vena renal interlobular que se sitúa en la corteza renal. Puede ser de ayuda ampliar la imagen de esta zona para que nos resulte más fácil localizar las venas interlobulares. Establecemos la escala del Doppler color con límite de Nyquist en 10cm/s y objetivaremos un flujo de normalidad que se aleja (de color azul en la mayoría de las configuraciones del color) en las venas interlobulares. Aplicando el Doppler pulsado se objetiva un patrón de flujo arterial (onda positiva) y un patrón de flujo venoso (onda negativa) en la misma medición.
En condiciones normales, el flujo de las venas intrarrenales es monofásico y continuo durante el ciclo cardíaco. En la congestión leve/moderada observaremos un flujo bifásico con la aparición de 2 ondas sistólica «S» y diastólica «D», que corresponden a las que visualizamos en las venas suprahepáticas. A medida que progresa la congestión, en casos severos, veremos un flujo monofásico discontinuo con 2 o una sola onda «D» (monofásico diastólico) (fig. 6). Estos flujos sistólicos (S) y diastólicos (D) se relacionan con las ondas S y D del flujo hepático previamente mencionado. Nos apoyaremos en la morfología del flujo arterial (onda positiva) para delimitar la sístole de la diástole. Obtener el patrón del flujo de estas venas es la técnica más compleja de este documento, dado el pequeño tamaño de estos vasos y la dificultad para valorarlas en pacientes que ofrecen escasa colaboración. Puede ser de ayuda pedir al paciente que realice una apnea, para intentar conseguir el menor desplazamiento de los órganos con la respiración. Como limitación en pacientes con insuficiencia renal crónica grave (FG<15ml/min) o pacientes en diálisis, veremos un flujo monofásico venoso, sin que eso conlleve presencia de congestión34.
Estudio Doppler pulsado de la vena renal. A) Ecografía normal del Doppler pulsado de la vena renal. B) Se muestran los cambios en las ondas producidas por el Doppler venoso a nivel de las venas intrarrenales a medida que avanza la congestión intravascular. En este caso, las ondas positivas será siempre flujo arterial, por lo que se analizarán únicamente las ondas negativas (flujo venoso):
a) Normalidad: patrón monofásico continuo; b) Congestión leve: patrón bifásico discontinuo; c) Congestión severa: patrón monofásico discontinuo.
Fuente: Imagen y figura de elaboración propia.
Los signos y los síntomas de congestión en la IC tienen una baja sensibilidad, lo que supone un infradiagnóstico y un tratamiento insuficiente, que conlleva un aumento del número de hospitalizaciones y de la comorbilidad asociada.
La ecografía clínica, ya sea mediante la interpretación de líneas B en ecografía pulmonar, o mediante el análisis de las ondas del Doppler pulsado en los vasos abdominales; permite detectar de forma precoz y eficiente la congestión intra y extravascular.
Consideraciones éticasSe ha contado con el consentimiento del paciente y se han seguido los protocolos de los centros de trabajo sobre tratamiento de la información de los pacientes.
Conflicto de interesesLos autores expresan que no existe conflicto de intereses en el artículo realizado.