Evaluar la persistencia al tratamiento en sujetos con diabetes tipo 2 (DM2) polimedicados que se les administra un nuevo tratamiento con metformina 850mg de marca vs. genérica en situación de práctica clínica habitual.
Pacientes y métodosEstudio observacional-retrospectivo, realizado a partir de los registros médicos de pacientes ≥50 años, que iniciaron tratamiento con metformina (marca vs. genérico) entre el 01/01/2016 y el 31/12/2017. El seguimiento de los pacientes fue de 2 años. Principales medidas: persistencia al tratamiento y consecuencias clínicas (control metabólico [HbA1c] e ingresos hospitalarios). Cada paciente del grupo de marca (referencia) se emparejó con otro del grupo genérico mediante propensity score matching. Se realizó un modelo de riesgos proporcionales de Cox, p<0,05.
ResultadosSe emparejaron 863 pacientes con metformina de marca vs. genérica (relación 1:1). La media de edad fue de 60,8 (DE: 8,8) años y el 52,6% fueron mujeres. Con metformina de marca, la persistencia a los 24 meses de seguimiento fue un 8,6% superior a la genérica (63,2% vs. 58,2%; p=0,034). El hazard ratio relativo a la marca fue del 0,83 (IC 95%: 0,71-0,96, p=0,013). Durante el seguimiento hubo una mayor reducción porcentual de la HbA1c de marca vs. genérica (−6,8% vs. −4,1%; p=0,013). Hubo una reducción del 19,1% en los ingresos hospitalarios superior con metformina de marca vs. genérica (8,9% vs. 11,0%; p=0,148), aunque sin alcanzar la significación estadística.
ConclusionesLos pacientes polimedicados que iniciaron un nuevo tratamiento con metformina de marca para la DM2 se asociaron a un mayor grado de persistencia al tratamiento que los que lo iniciaron con metformina genérica, repercutiendo en un mejor grado de control metabólico (reducción porcentual de HbA1c).
To evaluate treatment persistence in patients with polymedicated type 2 diabetes (DM2) receiving new treatment with brand-name vs. generic metformin 850mg in usual clinical practice.
Patients and methodsObservational, retrospective study based on the medical records of patients aged ≥50 years who initiated metformin treatment (brand-name vs. generic) between 01/01/2016 and 31/12/2017. The follow up was two years. Main measures: treatment persistence and clinical consequences (metabolic control [HbA1c] and hospital admissions). Each patient in the brand-name group (reference) was paired with a patient from the generic group using propensity score matching. A Cox proportional risk model was constructed (p<0.05).
Results863 patients receiving brand-name metformin were matched (ratio 1:1) with patients receiving generic metformin. The median age was 60.8 years (SD: 8.8) years and 52.6% were female. Persistence at 24 months was 8.6% higher for brand-name vs. generic metformin (63.2% vs. 58.2%; p=0.034). The hazard ratio for brand-name metformin was 0.83 (95% CI: 0.71-0.96, p=0.013). During the follow-up there was a greater percentage reduction of HbA1c in the brand-name vs. generic group (−6.8% vs. −4.1%; p=0.013). There was a non-significant 19.1% reduction in hospital admissions in the brand-name vs. generic group (8.9% vs. 11.0%; p=0.148).
ConclusionsPolymedicated patients who initiated new brand-name metformin treatment for DM2 had greater treatment persistence than those who initiated it with generic metformin and had better metabolic control (percentage reduction in HbA1c).
La diabetes mellitus tipo 2 (DM2) es uno de los problemas de salud con mayor repercusión sanitaria en los países desarrollados, cuya incidencia se espera que crezca en las próximas décadas1,2. La prevalencia poblacional estimada se sitúa alrededor del 14,6%3, con una cierta variabilidad en función de los distintos estudios y métodos utilizados para el diagnóstico, pudiendo llegar al 20% en los mayores de 75 años2,4,5.
En cuanto al tratamiento, si tras un periodo de entre 3 y 6 meses con tratamiento no farmacológico no se consiguen los objetivos metabólicos, se debe iniciar un tratamiento farmacológico1,2,6. En la actualidad, están disponibles una serie de fármacos para el tratamiento de la DM2, como metformina (biguanidas), sulfonilureas, glinidas, glitazonas, inhibidores de las disacaridasas, inhibidores de la dipeptidilpeptidasa 4 (iDPP4), inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2) y agonistas del receptor del GLP-1 (AR GLP-1), que al igual que la insulina, pueden utilizarse en monoterapia o en combinación2,6,7.
Metformina es un fármaco de primera elección en el tratamiento de la DM2, tal como reconocen las principales guías de práctica clínica1,2,7. Sus beneficios, en cuanto a las complicaciones cardiovasculares y la mortalidad, la hacen prioritaria en los pacientes con DM28. No obstante, metformina no debería prescribirse en caso de insuficiencia renal severa (filtrado glomerular <30ml/min) o insuficiencia cardíaca avanzada8,9.
Varios estudios han demostrado que la discontinuación (falta de adherencia) al tratamiento con metformina se sitúa, al año de seguimiento, entre el 50 y 70%10–12. La falta de adherencia al tratamiento es uno de los problemas más importantes en la práctica diaria, ya que ocasiona una menor efectividad clínica, una falta de consecución de los objetivos del tratamiento y un posible aumento de los recursos sanitarios10–13. En la terapia farmacológica existen presentaciones de especialidades farmacéuticas de marca y genérica (equivalente farmacéutico genérico [EFG]). Los EFG son medicamentos con la misma eficacia, seguridad y calidad, y son bioequivalentes a la marca original14–18. Diversos estudios han demostrado que los cambios en la bioapariencia de un mismo principio activo (forma, color, tamaño, blíster o cartonaje) pueden interferir en la adherencia terapéutica de los pacientes19, favoreciendo la falta de control de la enfermedad y el riesgo de complicaciones20.
Con múltiples EFG, los envases de medicamentos dispensados en la oficina de farmacia comunitaria pueden tener apariencias diferentes, circunstancia que puede ocasionar una mayor complejidad a la continuidad del tratamiento (confusión de los pacientes), especialmente en algunos colectivos de pacientes mayores y polimedicados19. Por otra parte, las evidencias disponibles acerca de la relación entre estas variables son escasas en la vida real, tanto en la literatura internacional como en nuestro entorno sanitario, por lo que la realización de este estudio puede ser de interés. El objetivo de este estudio fue analizar la persistencia al tratamiento en sujetos ≥50 años con DM2, polimedicados, a quienes se les administra (inicio de la medicación) metformina 850mg de marca vs. EFG en situación de práctica clínica habitual.
Pacientes y métodosDiseño y población de estudioSe efectuó un estudio observacional, multicéntrico y longitudinal (de carácter retrospectivo), realizado a partir de la revisión de los registros médicos (bases de datos informatizadas, con datos disociados). La población de estudio se obtuvo a partir de los registros sanitarios de proveedores de salud de diversos centros de atención primaria y hospitalarios españoles (unificados en la base de datos anonimizada BIG-PAC)21. Los datos procedieron de diversas historias clínicas informatizadas y de otras bases de datos complementarias de financiación/provisión de servicios públicos, de 7 comunidades autónomas españolas (1,8 millones de pacientes). Se respetó la confidencialidad de los registros (anónimos) según la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales.
Criterios de inclusión y exclusiónSe incluyeron en el estudio los pacientes polimedicados (≥3 principios activos) que demandaron atención y que iniciaron un nuevo tratamiento con metformina (marca o EFG) entre el 01/01/2016 y el 31/12/2017 (periodo de reclutamiento, fecha índice), para el tratamiento de la DM2. Debieron reunir las siguientes características: a) edad ≥50 años; b) pacientes activos en la base de datos un mínimo de 12 meses antes de iniciar el estudio; c) estar en el programa de prescripciones crónicas para la obtención de las recetas médicas (con registro constatado de la dosis diaria, el intervalo de tiempo y la duración de cada tratamiento administrado; ≥2 recetas durante el periodo de seguimiento), y d) que se pudiera garantizar el seguimiento regular de los pacientes (≥2 registros sanitarios en el sistema informático). Fueron excluidos: a) los sujetos trasladados a otros centros, los desplazados o fuera de zona; b) los pacientes institucionalizados permanentemente; c) los que cambiaron de tratamiento (marca vs. EFG y viceversa), y d) con enfermedad mental severa, terminal y/o en diálisis.
Grupos de estudio y seguimientoSe diferenciaron 2 grupos de estudio en función del tratamiento inicial dispensado: a) metformina 850mg de marca y b) metformina 850mg EFG; en monoterapia. El periodo de seguimiento, a partir de la fecha de inclusión del paciente, fue de 2 años. Cada paciente del grupo de marca (referencia) se emparejó (1:1) con otro del grupo de EFG mediante propensity score matching (PSM).
Definición del diagnósticoLos registros de los pacientes con DM2 se obtuvieron a partir de la Clasificación Internacional de Enfermedades (novena edición) Modificación Clínica (CIE-09-MC; códigos: 250.00, 250.02; https://eciemaps.mscbs.gob.es). Los criterios seguidos siempre fueron a juicio del médico responsable de la asistencia.
Variables demográficas y comorbilidadesLas variables sociodemográficas y de comorbilidad (CIE-09-MC) fueron las siguientes: edad (continua y por rangos) y género, así como los antecedentes personales de hipertensión arterial, dislipemia, obesidad, fumadores activos, infarto de miocardio, ictus, enfermedad arterial periférica, insuficiencia cardíaca, insuficiencia renal, asma, EPOC, neuropatías, síndrome depresivo y neoplasias malignas. Como variable resumen de la comorbilidad general, para cada paciente atendido, se utilizó: a) el índice de comorbilidad de Charlson22 como una aproximación a la gravedad del paciente y b) el número de comorbilidades crónicas. Estas variables se obtuvieron al inicio del estudio (situación basal). Se obtuvo el tratamiento administrado en situación basal.
Medicación administrada y persistencia al tratamientoLa información se obtuvo de los registros procedentes de la dispensación farmacológica de medicamentos, según la Anatomical Therapeutic Chemical Classification System (código: ATC: A10BA02)23. La prescripción de marca o genérica a un paciente en concreto fue a criterio del médico (práctica clínica). La persistencia o duración del tratamiento con metformina 850mg se definió como el tiempo, medido en días, sin abandono del tratamiento inicial o sin cambio a otra medicación al menos 30 días después de la dispensación inicial. Este se calculó desde la fecha de inicio hasta la fecha de discontinuación (en días). La fecha de inicio fue la de inicio del tratamiento con metformina, mientras que la fecha de discontinuación fue la que sucedió primero entre: a) la fecha de finalización del periodo de seguimiento (2 años), b) fallecimiento, c) cambio a otro tratamiento antidiabético, y d) interrumpe/abandona la medicación (≥60 días sin renovar la medicación y/o ≥2 recetas). La persistencia al tratamiento se obtuvo a los 6, 12 y 24 meses de seguimiento.
Se obtuvo el número de medicamentos cardiovasculares y la especialidad médica responsable de la primera prescripción (medicina de familia o especialista hospitalario de referencia). Se consideró medicación cardiovascular la relacionada con los siguientes grupos terapéuticos (ATC): antihipertensivos, diuréticos, betabloqueantes, bloqueantes del canal de calcio, agentes activos sobre el sistema renina-angiotensina, agentes reductores de lípidos, otros antidiabéticos orales, agentes antitrombóticos y ácido acetilsalicílico. También se obtuvo el número de cambios de marca comercial realizados en la oficina de farmacia comunitaria (marca y EFG), la posología/día de metformina (1, 2 o 3 al día) y la dosis diaria total prescrita. Esta información se obtuvo durante el seguimiento de los pacientes.
Consecuencias clínicasComo una aproximación a la efectividad clínica se cuantificó: a) el cambio inicial-final de la hemoglobina glicosilada (HbA1c) y b) el porcentaje de ingresos hospitalarios por descompensación de la diabetes y/o complicaciones macrovasculares (incluye: cardiopatía isquémica [infarto agudo de miocardio, angina estable/inestable], accidente vasculocerebral [ictus, accidente isquémico transitorio, arteriopatía periférica], e insuficiencia renal) durante el periodo de seguimiento (2 años). Se obtuvieron los fallecimientos por todas las causas.
Análisis estadísticoLos criterios de búsqueda en la base de datos fueron a partir de sentencias informáticas (SQL script). Se revisaron cuidadosamente los datos, mediante análisis exploratorio y preparación de estos para el análisis, observando sus distribuciones de frecuencia y buscando posibles errores de registro o de codificación. Para minimizar las posibles variables de confusión se realizó un PSM (1:1; metformina de marca vs. metformina EFG). Las variables incluidas para el apareamiento fueron: edad, sexo, índice de Charlson (comorbilidad), tiempo desde el diagnóstico, HbA1c inicial, dosis de metformina inicial y la medicación basal. Procedimiento: vecino más próximo (greedy nearest neighbour algorithm). Se proporcionaron los coeficientes estandarizados (CE). Se efectuó un análisis estadístico descriptivo-univariante. Para los datos cualitativos: frecuencias absolutas y relativas. Para los datos cuantitativos: el uso de media, desviación estándar (DE), mediana y percentiles 25 y 75 de la distribución (amplitud intercuartil). Los intervalos de confianza (IC) del 95% para la estimación de parámetros se basaron en el número total de sujetos con valores no perdidos. La medida de la persistencia al tratamiento se analizó mediante un análisis de supervivencia de Kaplan-Meier (procedimiento: log-rank test). Se realizó un modelo de regresión de riesgos proporcionales de Cox para la corrección del tiempo de persistencia al tratamiento. Además, se efectuó un modelo de regresión logística (procedimiento: enter; estadístico: Wald) para evaluar la asociación entre: a) el control metabólico (reducción de la HbA1c) y b) los ingresos hospitalarios; con respecto a metformina (marca vs. ECG). Las covariables incluidas en los modelos multivariantes fueron las mencionadas con anterioridad en el apareamiento (PSM). Se utilizó el programa SPSSWIN versión 23, estableciéndose una significación estadística para valores de p<0,05.
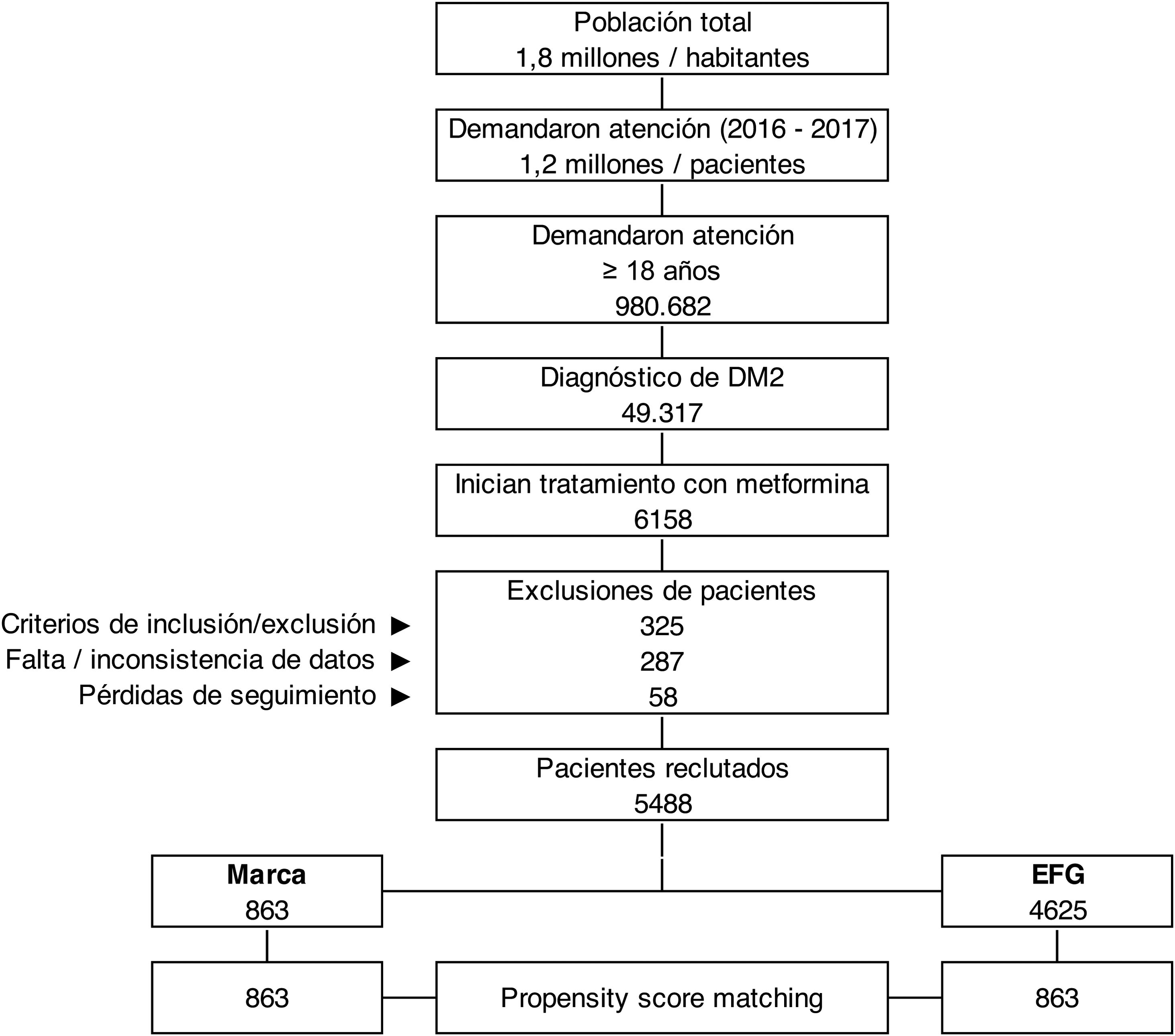
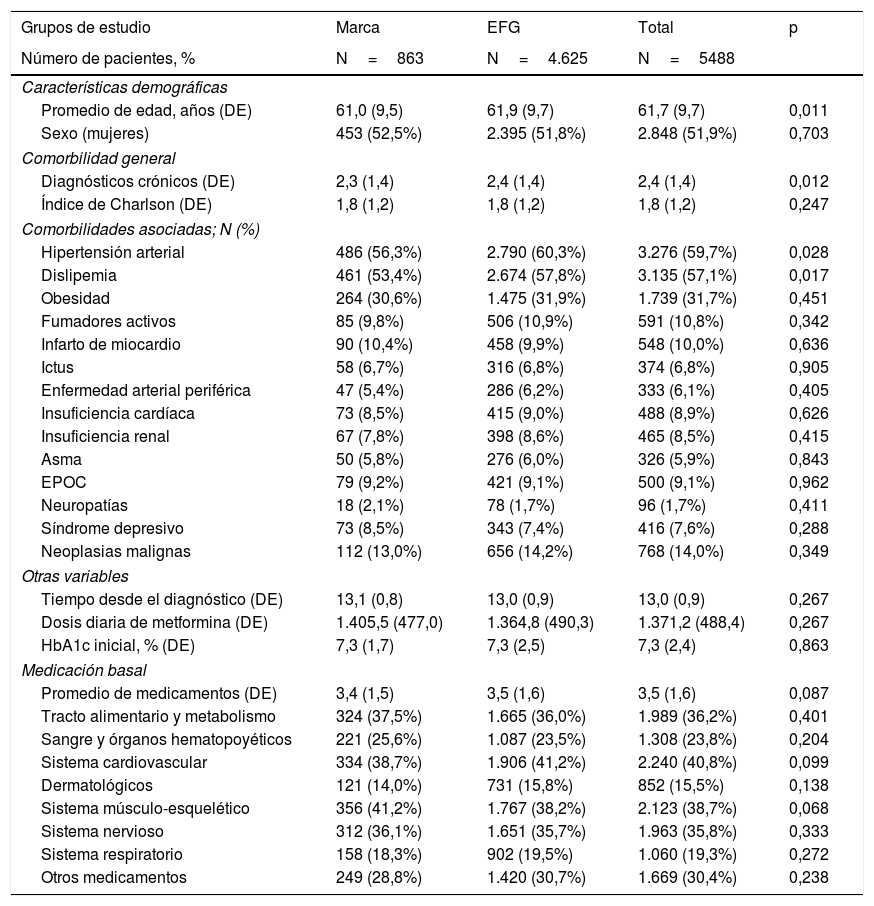
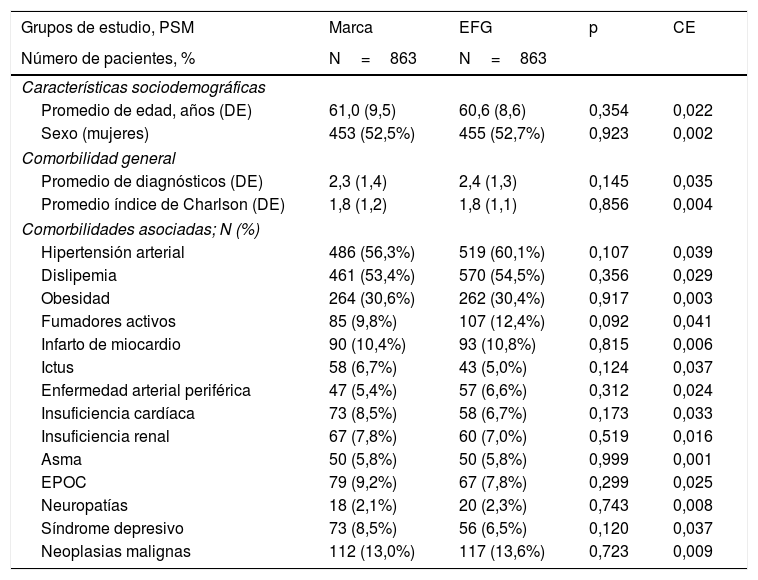
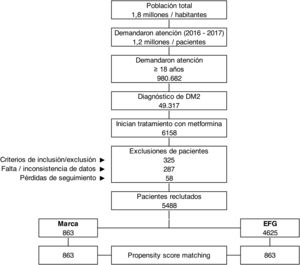
ResultadosDe una selección inicial de 980.682 sujetos ≥18 años asignados a los centros, se reclutaron 5.488 pacientes que reunían los criterios de selección para ser incluidos en el estudio (fig. 1). Se compararon los pacientes en tratamiento con: a) metformina de marca (N=863; 15,7%) vs. b) EFG (N=4.625; 84,3%). En la tabla 1 se muestran las características basales de la serie estudiada según los grupos de estudio. La media de edad fue de 61,7 (DE: 9,7) años y el 51,9% fueron mujeres. Del conjunto de pacientes, el 59,7% presentaron hipertensión arterial, el 57,1% dislipemia y el 31,7% obesidad. El promedio del índice de Charlson fue de 1,8 puntos, mientras que el promedio de medicación en situación basal fue de 3,5 (1,6) medicamentos. Hubo una aceptable comparabilidad basal entre los grupos de marca vs. EFG. Los 863 pacientes con metformina de marca se emparejaron en una relación 1:1 con EFG. Las características basales de la serie estudiada después de realizar el PSM se muestran en la tabla 2. La media de edad fue de 60,8 (DE: 8,8) años y el 52,6% fueron mujeres.
Características basales (demográficas, morbilidad, medicación) de la serie estudiada por grupos de estudio
| Grupos de estudio | Marca | EFG | Total | p |
|---|---|---|---|---|
| Número de pacientes, % | N=863 | N=4.625 | N=5488 | |
| Características demográficas | ||||
| Promedio de edad, años (DE) | 61,0 (9,5) | 61,9 (9,7) | 61,7 (9,7) | 0,011 |
| Sexo (mujeres) | 453 (52,5%) | 2.395 (51,8%) | 2.848 (51,9%) | 0,703 |
| Comorbilidad general | ||||
| Diagnósticos crónicos (DE) | 2,3 (1,4) | 2,4 (1,4) | 2,4 (1,4) | 0,012 |
| Índice de Charlson (DE) | 1,8 (1,2) | 1,8 (1,2) | 1,8 (1,2) | 0,247 |
| Comorbilidades asociadas; N (%) | ||||
| Hipertensión arterial | 486 (56,3%) | 2.790 (60,3%) | 3.276 (59,7%) | 0,028 |
| Dislipemia | 461 (53,4%) | 2.674 (57,8%) | 3.135 (57,1%) | 0,017 |
| Obesidad | 264 (30,6%) | 1.475 (31,9%) | 1.739 (31,7%) | 0,451 |
| Fumadores activos | 85 (9,8%) | 506 (10,9%) | 591 (10,8%) | 0,342 |
| Infarto de miocardio | 90 (10,4%) | 458 (9,9%) | 548 (10,0%) | 0,636 |
| Ictus | 58 (6,7%) | 316 (6,8%) | 374 (6,8%) | 0,905 |
| Enfermedad arterial periférica | 47 (5,4%) | 286 (6,2%) | 333 (6,1%) | 0,405 |
| Insuficiencia cardíaca | 73 (8,5%) | 415 (9,0%) | 488 (8,9%) | 0,626 |
| Insuficiencia renal | 67 (7,8%) | 398 (8,6%) | 465 (8,5%) | 0,415 |
| Asma | 50 (5,8%) | 276 (6,0%) | 326 (5,9%) | 0,843 |
| EPOC | 79 (9,2%) | 421 (9,1%) | 500 (9,1%) | 0,962 |
| Neuropatías | 18 (2,1%) | 78 (1,7%) | 96 (1,7%) | 0,411 |
| Síndrome depresivo | 73 (8,5%) | 343 (7,4%) | 416 (7,6%) | 0,288 |
| Neoplasias malignas | 112 (13,0%) | 656 (14,2%) | 768 (14,0%) | 0,349 |
| Otras variables | ||||
| Tiempo desde el diagnóstico (DE) | 13,1 (0,8) | 13,0 (0,9) | 13,0 (0,9) | 0,267 |
| Dosis diaria de metformina (DE) | 1.405,5 (477,0) | 1.364,8 (490,3) | 1.371,2 (488,4) | 0,267 |
| HbA1c inicial, % (DE) | 7,3 (1,7) | 7,3 (2,5) | 7,3 (2,4) | 0,863 |
| Medicación basal | ||||
| Promedio de medicamentos (DE) | 3,4 (1,5) | 3,5 (1,6) | 3,5 (1,6) | 0,087 |
| Tracto alimentario y metabolismo | 324 (37,5%) | 1.665 (36,0%) | 1.989 (36,2%) | 0,401 |
| Sangre y órganos hematopoyéticos | 221 (25,6%) | 1.087 (23,5%) | 1.308 (23,8%) | 0,204 |
| Sistema cardiovascular | 334 (38,7%) | 1.906 (41,2%) | 2.240 (40,8%) | 0,099 |
| Dermatológicos | 121 (14,0%) | 731 (15,8%) | 852 (15,5%) | 0,138 |
| Sistema músculo-esquelético | 356 (41,2%) | 1.767 (38,2%) | 2.123 (38,7%) | 0,068 |
| Sistema nervioso | 312 (36,1%) | 1.651 (35,7%) | 1.963 (35,8%) | 0,333 |
| Sistema respiratorio | 158 (18,3%) | 902 (19,5%) | 1.060 (19,3%) | 0,272 |
| Otros medicamentos | 249 (28,8%) | 1.420 (30,7%) | 1.669 (30,4%) | 0,238 |
Valores expresados en porcentaje o media (DE), p: significación estadística.
DE: desviación estándar; EFG: especialidades farmacéuticas genéricas; EPOC: enfermedad pulmonar obstructiva crónica; HbA1c: hemoglobina glicosilada.
Características basales de la serie estudiada
| Grupos de estudio, PSM | Marca | EFG | p | CE |
|---|---|---|---|---|
| Número de pacientes, % | N=863 | N=863 | ||
| Características sociodemográficas | ||||
| Promedio de edad, años (DE) | 61,0 (9,5) | 60,6 (8,6) | 0,354 | 0,022 |
| Sexo (mujeres) | 453 (52,5%) | 455 (52,7%) | 0,923 | 0,002 |
| Comorbilidad general | ||||
| Promedio de diagnósticos (DE) | 2,3 (1,4) | 2,4 (1,3) | 0,145 | 0,035 |
| Promedio índice de Charlson (DE) | 1,8 (1,2) | 1,8 (1,1) | 0,856 | 0,004 |
| Comorbilidades asociadas; N (%) | ||||
| Hipertensión arterial | 486 (56,3%) | 519 (60,1%) | 0,107 | 0,039 |
| Dislipemia | 461 (53,4%) | 570 (54,5%) | 0,356 | 0,029 |
| Obesidad | 264 (30,6%) | 262 (30,4%) | 0,917 | 0,003 |
| Fumadores activos | 85 (9,8%) | 107 (12,4%) | 0,092 | 0,041 |
| Infarto de miocardio | 90 (10,4%) | 93 (10,8%) | 0,815 | 0,006 |
| Ictus | 58 (6,7%) | 43 (5,0%) | 0,124 | 0,037 |
| Enfermedad arterial periférica | 47 (5,4%) | 57 (6,6%) | 0,312 | 0,024 |
| Insuficiencia cardíaca | 73 (8,5%) | 58 (6,7%) | 0,173 | 0,033 |
| Insuficiencia renal | 67 (7,8%) | 60 (7,0%) | 0,519 | 0,016 |
| Asma | 50 (5,8%) | 50 (5,8%) | 0,999 | 0,001 |
| EPOC | 79 (9,2%) | 67 (7,8%) | 0,299 | 0,025 |
| Neuropatías | 18 (2,1%) | 20 (2,3%) | 0,743 | 0,008 |
| Síndrome depresivo | 73 (8,5%) | 56 (6,5%) | 0,120 | 0,037 |
| Neoplasias malignas | 112 (13,0%) | 117 (13,6%) | 0,723 | 0,009 |
Valores expresados en porcentaje o media (DE), p: significación estadística.
CE: coeficiente estandarizado; DE: desviación estándar; EFG: especialidades farmacéuticas genéricas; EPOC: enfermedad pulmonar obstructiva crónica; PSM: propensity score matching (emparejamiento 1:1).
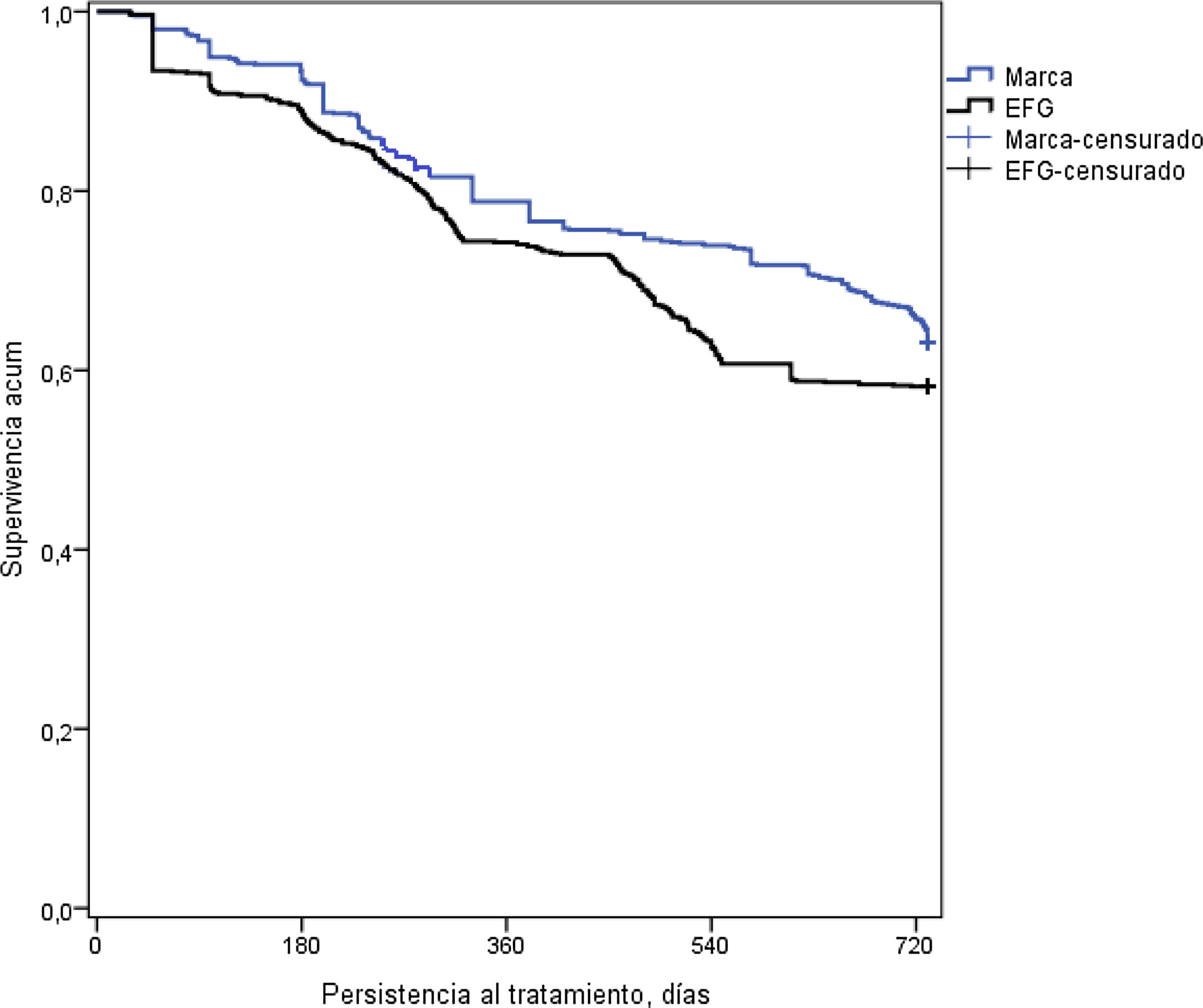
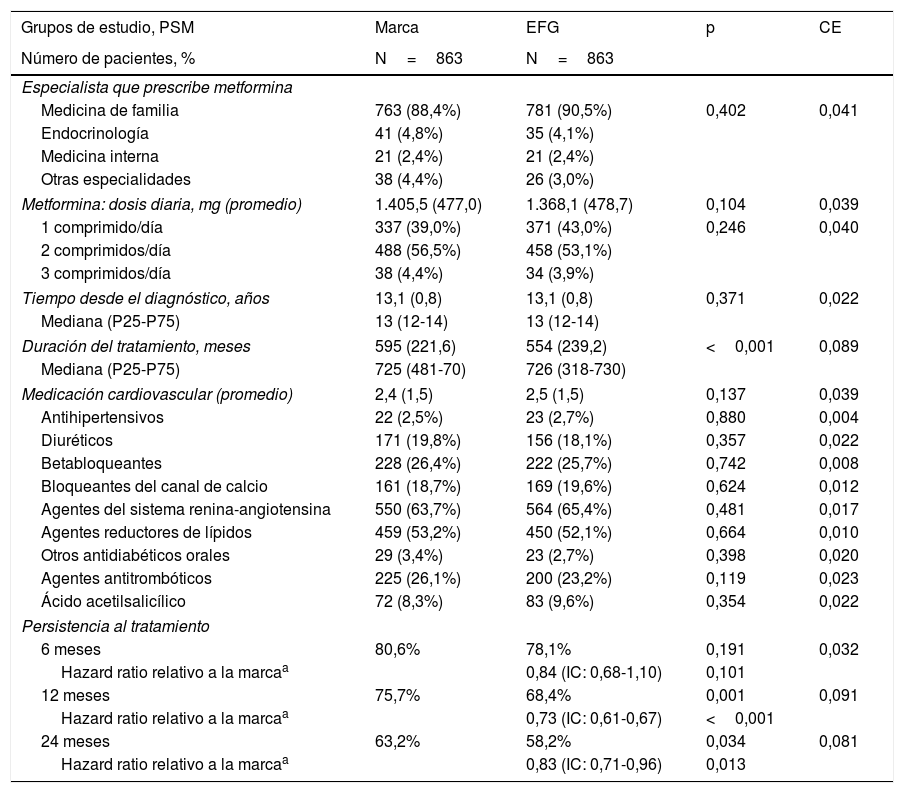
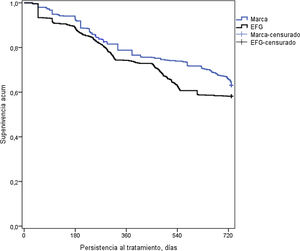
En la tabla 3 se detalla la persistencia al tratamiento, la medicación cardiovascular y otras variables de interés. Con metformina de marca, la duración media del tratamiento (595 vs. 554 días; p<0,001) y la persistencia a los 12 meses (75,7% vs. 68,4%; p=0,001) y a los 24 meses de seguimiento (63,2% vs. 58,2%; p=0,034) fue superior a la del EFG. El hazard ratio relativo a la marca fue del 0,83 (IC del 95%: 0,71-0,96, p=0,013), lo que implicaría que la prescripción y/o dispensación de marca reduce un 17% el riesgo de discontinuar el tratamiento. Por el contrario, la persistencia al tratamiento a los 6 meses fue similar (80,6% vs. 78,1%; p=0,191). En la figura 2 se detallan las curvas de Kaplan-Meier de persistencia y probabilidad acumulada de permanecer con el tratamiento a los 24 meses de seguimiento.
Persistencia al tratamiento, medicación cardiovascular y otras variables de interés
| Grupos de estudio, PSM | Marca | EFG | p | CE |
|---|---|---|---|---|
| Número de pacientes, % | N=863 | N=863 | ||
| Especialista que prescribe metformina | ||||
| Medicina de familia | 763 (88,4%) | 781 (90,5%) | 0,402 | 0,041 |
| Endocrinología | 41 (4,8%) | 35 (4,1%) | ||
| Medicina interna | 21 (2,4%) | 21 (2,4%) | ||
| Otras especialidades | 38 (4,4%) | 26 (3,0%) | ||
| Metformina: dosis diaria, mg (promedio) | 1.405,5 (477,0) | 1.368,1 (478,7) | 0,104 | 0,039 |
| 1 comprimido/día | 337 (39,0%) | 371 (43,0%) | 0,246 | 0,040 |
| 2 comprimidos/día | 488 (56,5%) | 458 (53,1%) | ||
| 3 comprimidos/día | 38 (4,4%) | 34 (3,9%) | ||
| Tiempo desde el diagnóstico, años | 13,1 (0,8) | 13,1 (0,8) | 0,371 | 0,022 |
| Mediana (P25-P75) | 13 (12-14) | 13 (12-14) | ||
| Duración del tratamiento, meses | 595 (221,6) | 554 (239,2) | <0,001 | 0,089 |
| Mediana (P25-P75) | 725 (481-70) | 726 (318-730) | ||
| Medicación cardiovascular (promedio) | 2,4 (1,5) | 2,5 (1,5) | 0,137 | 0,039 |
| Antihipertensivos | 22 (2,5%) | 23 (2,7%) | 0,880 | 0,004 |
| Diuréticos | 171 (19,8%) | 156 (18,1%) | 0,357 | 0,022 |
| Betabloqueantes | 228 (26,4%) | 222 (25,7%) | 0,742 | 0,008 |
| Bloqueantes del canal de calcio | 161 (18,7%) | 169 (19,6%) | 0,624 | 0,012 |
| Agentes del sistema renina-angiotensina | 550 (63,7%) | 564 (65,4%) | 0,481 | 0,017 |
| Agentes reductores de lípidos | 459 (53,2%) | 450 (52,1%) | 0,664 | 0,010 |
| Otros antidiabéticos orales | 29 (3,4%) | 23 (2,7%) | 0,398 | 0,020 |
| Agentes antitrombóticos | 225 (26,1%) | 200 (23,2%) | 0,119 | 0,023 |
| Ácido acetilsalicílico | 72 (8,3%) | 83 (9,6%) | 0,354 | 0,022 |
| Persistencia al tratamiento | ||||
| 6 meses | 80,6% | 78,1% | 0,191 | 0,032 |
| Hazard ratio relativo a la marcaa | 0,84 (IC: 0,68-1,10) | 0,101 | ||
| 12 meses | 75,7% | 68,4% | 0,001 | 0,091 |
| Hazard ratio relativo a la marcaa | 0,73 (IC: 0,61-0,67) | <0,001 | ||
| 24 meses | 63,2% | 58,2% | 0,034 | 0,081 |
| Hazard ratio relativo a la marcaa | 0,83 (IC: 0,71-0,96) | 0,013 | ||
Valores expresados en porcentaje o media (DE), p: significación estadística.
CE: coeficiente estandarizado; DE: desviación estándar; EFG: especialidades farmacéuticas genéricas; IC: intervalos de confianza del 95%; P: percentil; PSM: propensity score matching.
La medicación (cardiovascular, tabla 3) administrada durante el periodo de seguimiento fue ligeramente superior con metformina EFG (2,4 vs. 2,5; p=0,237), aunque sin alcanzar la significación estadística. El promedio de dosis diaria administrada con metformina de marca vs. EFG (1.406mg vs. 1.368mg; p=0,104), así como el número de comprimidos/día (2 comprimidos: 56,5% vs. 53,1%; p=0,246) y el especialista que inicia la prescripción (medicina de familia: 88,4% vs. 90,5%; p=0,402), respectivamente, mostraron resultados parecidos.
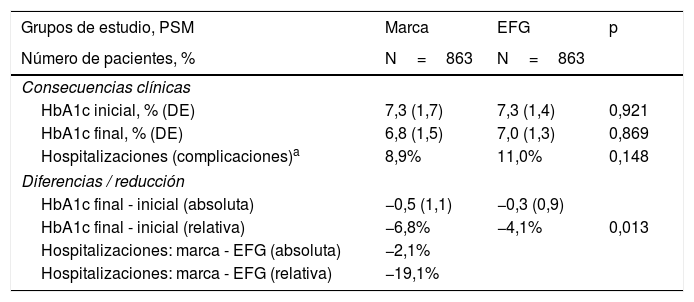
Las consecuencias clínicas (efectividad) según los grupos de estudio se detallan en la tabla 4. Durante el seguimiento hubo una mayor reducción porcentual de la HbA1c de marca vs. EFG (−6,8% vs. −4,1%; p=0,013); mientras que la reducción de los ingresos hospitalarios fue un 19,1% superior en el caso de la marca (8,9% vs. 11,0%; p=0,148), aunque sin alcanzar la significación estadística. Los fallecimientos fueron superiores con metformina EFG, aunque sin alcanzar la significación estadística (1,4% vs. 2,1%; p=0,258).
Consecuencias clínicas (efectividad) según los grupos de estudio
| Grupos de estudio, PSM | Marca | EFG | p |
|---|---|---|---|
| Número de pacientes, % | N=863 | N=863 | |
| Consecuencias clínicas | |||
| HbA1c inicial, % (DE) | 7,3 (1,7) | 7,3 (1,4) | 0,921 |
| HbA1c final, % (DE) | 6,8 (1,5) | 7,0 (1,3) | 0,869 |
| Hospitalizaciones (complicaciones)a | 8,9% | 11,0% | 0,148 |
| Diferencias / reducción | |||
| HbA1c final - inicial (absoluta) | −0,5 (1,1) | −0,3 (0,9) | |
| HbA1c final - inicial (relativa) | −6,8% | −4,1% | 0,013 |
| Hospitalizaciones: marca - EFG (absoluta) | −2,1% | ||
| Hospitalizaciones: marca - EFG (relativa) | −19,1% | ||
Valores expresados en porcentaje o media (DE), p: significación estadística.
DE: desviación estándar; EFG: especialidades farmacéuticas genéricas; HbA1c: hemoglobina glicosilada; PSM: propensity score matching.
Detalle de las complicaciones acontecidas durante el seguimiento (2 años); metformina de marca: 77 eventos; metformina EFG: 95 eventos. Por grupos de estudio: marca vs. EFG (descompensación diabética: 12 vs. 17; insuficiencia renal: 25 vs. 29; cardiopatía isquémica: 22 vs. 27; accidente vasculocerebral: 18 vs. 22), respectivamente. Durante el periodo de seguimiento fallecieron 30 pacientes (todas las causas), 12 en el grupo de marca (1,4%) y 18 en EFG (2,1%).
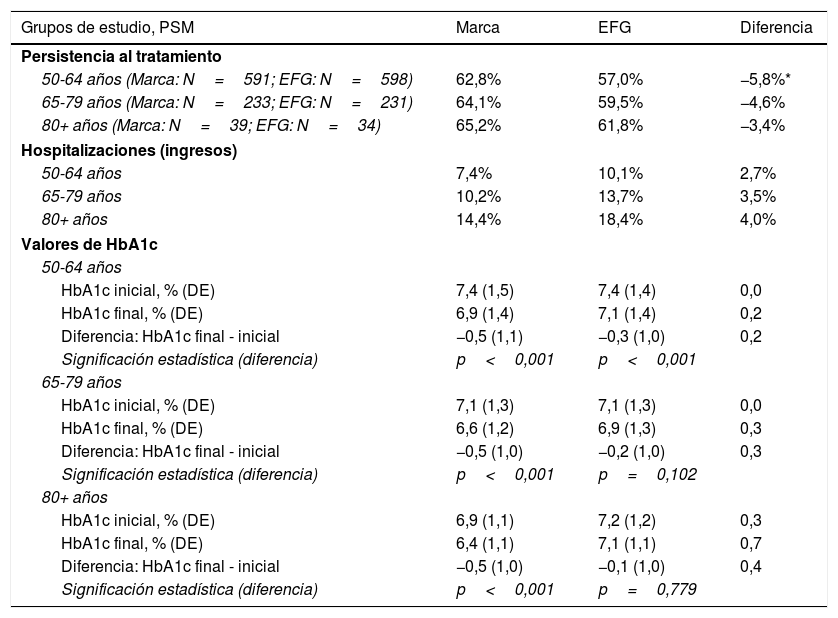
En la tabla 5 se detalla la persistencia al tratamiento, ingresos hospitalarios y valores de hemoglobina glicosilada por grupos de estudio y rangos de edad (subgrupos). Durante el periodo de seguimiento (24 meses), no se observan diferencias destacadas, respecto a los datos analizados con anterioridad. Además, en el modelo de regresión logística (corregido por covariables) se pudo comprobar que hubo una asociación entre el grado de control metabólico (reducción de HbA1c) con respecto al uso de metformina de marca vs. EFG (OR=0,75; IC del 95%: 0,67-0,84; p<0,001). En cuanto a los ingresos hospitalarios, no mostraron resultados concluyentes (OR=1,26; IC del 95%: 0,92-1,7; p=0,149).
Análisis de subgrupos. Persistencia al tratamiento, ingresos hospitalarios y valores de hemoglobina glicosilada por grupos de estudio y rangos de edad
| Grupos de estudio, PSM | Marca | EFG | Diferencia |
|---|---|---|---|
| Persistencia al tratamiento | |||
| 50-64 años (Marca: N=591; EFG: N=598) | 62,8% | 57,0% | −5,8%* |
| 65-79 años (Marca: N=233; EFG: N=231) | 64,1% | 59,5% | −4,6% |
| 80+ años (Marca: N=39; EFG: N=34) | 65,2% | 61,8% | −3,4% |
| Hospitalizaciones (ingresos) | |||
| 50-64 años | 7,4% | 10,1% | 2,7% |
| 65-79 años | 10,2% | 13,7% | 3,5% |
| 80+ años | 14,4% | 18,4% | 4,0% |
| Valores de HbA1c | |||
| 50-64 años | |||
| HbA1c inicial, % (DE) | 7,4 (1,5) | 7,4 (1,4) | 0,0 |
| HbA1c final, % (DE) | 6,9 (1,4) | 7,1 (1,4) | 0,2 |
| Diferencia: HbA1c final - inicial | −0,5 (1,1) | −0,3 (1,0) | 0,2 |
| Significación estadística (diferencia) | p<0,001 | p<0,001 | |
| 65-79 años | |||
| HbA1c inicial, % (DE) | 7,1 (1,3) | 7,1 (1,3) | 0,0 |
| HbA1c final, % (DE) | 6,6 (1,2) | 6,9 (1,3) | 0,3 |
| Diferencia: HbA1c final - inicial | −0,5 (1,0) | −0,2 (1,0) | 0,3 |
| Significación estadística (diferencia) | p<0,001 | p=0,102 | |
| 80+ años | |||
| HbA1c inicial, % (DE) | 6,9 (1,1) | 7,2 (1,2) | 0,3 |
| HbA1c final, % (DE) | 6,4 (1,1) | 7,1 (1,1) | 0,7 |
| Diferencia: HbA1c final - inicial | −0,5 (1,0) | −0,1 (1,0) | 0,4 |
| Significación estadística (diferencia) | p<0,001 | p=0,779 | |
Valores expresados en porcentaje o media (DE).
DE: desviación estándar; EFG: especialidades farmacéuticas genéricas; HbA1c: hemoglobina glicosilada; PSM: propensity score matching.
La persistencia al tratamiento a los 24 meses se asoció a la medicación de marca (r=−0,253; p<0,001) y a la posología/día administrada (r=−0,209; p=0,002). La persistencia no se asoció al especialista médico que inicia la prescripción (r=0,057; p=0,537). Además, cabe destacar que el promedio de cambios de «marca comercial» en prescripciones genéricas (promedio: 2,5 cambios/paciente; r=−0,306; p<0,001) se asoció con un aumento en la discontinuación del tratamiento. Al 58,2% de los sujetos (N=502/863) se les dispensaron 2+ «marcas comerciales» diferentes durante el periodo de seguimiento.
DiscusiónLos resultados del estudio ponen de manifiesto que los pacientes polimedicados ≥50 años que inician tratamiento con metformina de marca frente a EFG en monoterapia se asocian a una mayor persistencia al tratamiento, repercutiendo en un mejor grado de control metabólico (HbA1c). Aunque, cabe destacar la falta de estudios observacionales en condiciones de vida real en la bibliografía revisada, circunstancia que dificulta la comparación de los resultados, pero que, por otra parte, realzan la singularidad de este estudio.
Un medicamento EFG tiene la misma composición cualitativa/cuantitativa en principio activo y forma farmacéutica, con una bioequivalencia demostrada (biodisponibilidad) con el medicamento de referencia (marca)14,15. En nuestro país, la entrada al mercado de estos fármacos contribuyó a una reducción del gasto farmacéutico en la sanidad pública, aunque en la actualidad, tanto los medicamentos genéricos como los de marca presentan el mismo coste de adquisición debido a la existencia de un sistema de precios de referencia y de agrupaciones homogéneas que impone la igualdad de precios entre marcas y genéricos. Ante este escenario, no deberían existir argumentos farmacológicos, ni económicos, que impidan indistintamente la prescripción de medicamentos de marca o EFG.
En los medicamentos EFG, pueden existir diferencias en la composición de los excipientes y en su apariencia externa, circunstancia que puede repercutir en problemas de bioapariencia (tipo de envase, forma del comprimido, etc.)19,20. Los resultados globales del estudio están en consonancia con los estudios que apoyan la posibilidad de que un cambio en la apariencia del medicamento, en la dispensación de una receta, puede crear confusión a los pacientes, y reducir la adherencia (persistencia al tratamiento)19,20,24. Kesselheim et al.25 mostraron que los cambios en los colores y formas de los comprimidos/cápsulas aumentan el riesgo en la discontinuación en pacientes epilépticos. Los autores detallan que los cambios entre diferentes EFG pueden conllevar un riesgo para la salud de los pacientes, especialmente si presentan enfermedades crónicas. Goldszmidt et al.26 describieron que los cambios de medicamentos EFG (diferentes nombres comerciales) pueden afectar al cumplimiento terapéutico y a la efectividad clínica. Colombo et al.27 describen que la adherencia al tratamiento es un factor importante para el control metabólico y la prevención de la progresión de la enfermedad. El envejecimiento, las comorbilidades y la polifarmacia pueden afectar la adherencia e influir en el resultado de los tratamientos. Nuestros resultados parecen estar en consonancia con estas observaciones.
Los resultados del estudio muestran que la persistencia a los 24 meses de metformina de marca fue superior a la EFG (63,2% vs. 58,2%; HR=0,83). Flory et al.28, en una cohorte de 1.259 individuos, muestran una tasa de discontinuación temprana del 20,3%. Los autores detallan que la prescripción de dosis iniciales bajas de metformina mejora la persistencia de la medicación. Otros autores describen una persistencia al año de seguimiento inferior al 70%10–12. En cuanto a la comparación de diferentes antidiabéticos de marca vs. EFG, el estudio de Trotta et al.29 detalla que de los pacientes que recibieron EFG, el 61,0% tomó la misma marca comercial, el 23,3% experimentó un solo cambio y el 15,7% múltiples. Los autores manifiestan que en pacientes de edad avanzada tratados con antidiabéticos la adherencia fue similar entre los grupos (marca vs. EFG). No obstante, el efecto en la adherencia de los pacientes con múltiples cambios de EFG debe tenerse en cuenta (discontinuación). Nuestros resultados de persistencia al tratamiento son ligeramente superiores a los reportados por estos autores. Esta circunstancia podría explicarse por varias razones: a) el método de medida de la persistencia, b) es un estudio más reciente, y/o c) son pacientes que acuden regularmente a los controles y están sujetos a un seguimiento específico por parte de enfermería. Nuestros resultados son consistentes con estas observaciones, aunque no hemos encontrado ningún estudio similar al nuestro, que compare metformina de marca vs. EFG. En este sentido, además de las conocidas razones de incumplimiento, que pueden ser intencionadas (factores sociodemográficos, efectos secundarios, falta de comprensión del tratamiento o del estado de salud, etc.) o no intencionadas (olvido de cómo tomar la medicación correctamente, etc.), los resultados del estudio muestran que la prescripción genérica podría considerarse un factor más a tener en cuenta en este colectivo de pacientes.
En otros estudios en los que se compara marca con EFG, se observan resultados contradictorios. En general (conjunto de pacientes), en el uso de medicamentos EFG en enfermedades cardiovasculares no se encuentran discrepancias entre la adherencia/persistencia al tratamiento entre estos dos grupos de medicamentos16. Sin embargo, en neurología y en psicología los datos son más conflictivos y dependen de la enfermedad tratada17. Aunque las discrepancias son manifiestas, en función de la metodología utilizada, la población de estudio y otros factores relacionados con los proveedores y los pacientes30,31.
Durante el seguimiento hubo una mayor reducción porcentual de la HbA1c de marca vs. genérica; mientras que la reducción de los ingresos hospitalarios fue del −19,1%, aunque sin alcanzar la significación estadística (escaso tamaño muestral). La asociación entre la adherencia al tratamiento y la consecución de los objetivos terapéuticos de control y el riesgo de complicaciones en la progresión de la enfermedad están fuera de toda duda. En este sentido, nuestros resultados son consistentes con las evidencias disponibles en la literatura25–28,30–33.
Algunos autores recomiendan resaltar el nombre del principio activo en la etiqueta de los envases de los medicamentos EFG y alertan de las consecuencias que puede tener, en la adherencia de los pacientes, cambiar la apariencia del envase cada vez que se dispensa una nueva receta34. Nuestros resultados podrían respaldar estas aportaciones. En este sentido, a igualdad de eficacia y bioequivalencia entre el medicamento de marca y el EFG, los hallazgos de este estudio sugieren que los cambios en la apariencia del fármaco pueden repercutir en la seguridad del paciente, especialmente en enfermedades crónicas, pacientes mayores y/o polimedicados. La reducción de la variabilidad en la apariencia (imagen del medicamento o similar) entre medicamentos químicamente idénticos podría ayudar a promover la falta de discontinuación del tratamiento y mejorar la adherencia de este, aunque es técnicamente complicado de conseguir. Por tanto, o bien regulamos la normalización de la bioapariencia, o mejor aún, evaluamos el impacto que supone la falta de bioapariencia, como se ha puesto de manifiesto en este estudio35.
Las posibles limitaciones del estudio inciden en las propias de los estudios retrospectivos, como por ejemplo el infrarregistro de la enfermedad o la posible variabilidad de los profesionales y de los pacientes al ser un diseño observacional, o incluso al sistema de medida empleado para las principales variables del estudio, o a la posibilidad de la existencia de un sesgo de clasificación. En este aspecto, la posible inexactitud de la codificación diagnóstica en cuanto al diagnóstico, o bien la falta de alguna variable que pudiera influir en los resultados finales (nivel socioeconómico de los pacientes, evolución de la dosis farmacológica prescrita, obtención de la medicación, reacciones adversas, etc.), deben considerarse como una limitación del estudio. Aunque, a nuestro entender, la principal objeción al estudio fue el sesgo de selección por parte del médico responsable a la hora de iniciar un tratamiento de marca o EFG, puesto que no se realizó de forma aleatoria, como es habitual en situación de vida real. No obstante, este posible sesgo no debe repercutir en los resultados del estudio. Cabe destacar que hubiera sido de indudable interés analizar los diferentes motivos de suspensión del fármaco, puesto que no es lo mismo por ausencia de efectividad que por tolerancia; lamentablemente esta información no estuvo disponible en la base de datos. A pesar de que en el estudio los pacientes inician un nuevo tratamiento con metformina 850mg en monoterapia, no podemos descartar la existencia de un sesgo de selección. En primer lugar, porque los niveles iniciales de HbA1c quizás fueron sensiblemente bajos; y, en segundo lugar, por el escaso tamaño muestral conseguido. No obstante, este potencial sesgo debería de estar distribuido por igual en los dos grupos de estudio, circunstancia que no debería afectar a los resultados obtenidos.
Las perspectivas futuras se centran en replicar este estudio en otras instituciones sanitarias y en promover estrategias de intervención orientadas a fomentar la adherencia de los pacientes a los tratamientos prescritos por sus médicos. En conclusión, los pacientes polimedicados que iniciaron un nuevo tratamiento con metformina de marca vs. genérica para la DM2 se asociaron a un mayor grado de persistencia al tratamiento, repercutiendo en un mejor grado de control metabólico (reducción porcentual de HbA1c).
FinanciaciónEstudio patrocinado por FarmaIndustria.
AutoríaLos autores han contribuido en los siguientes aspectos: (1) la concepción y el diseño del estudio, o la adquisición de datos, o el análisis y la interpretación de los datos, (2) el borrador del artículo o la revisión crítica del contenido intelectual, y (3) la aprobación definitiva de la versión que se presenta.
Conflicto de interesesASM y ASN son consultores independientes (Atrys Health) en relación con el desarrollo de este estudio.