El objetivo principal de nuestro estudio consiste en conocer las distintas variables sociodemográficas, clínicas, analíticas y de funcionamiento que predicen la probabilidad de desarrollar una demencia en los pacientes con delirium que acuden a urgencias.
MétodoSe incluyeron a todos los pacientes con delirium (n=45) procedentes de urgencias que fueron ingresados en el servicio de geriatría del Hospital General Universitario de Ciudad Real (HGUCR) en el período 2016-2018, y cumplían criterios de inclusión y exclusión. Posteriormente se realizó un análisis bivariante y multivariante de las variables que predecían un diagnóstico de demencia a los 6 meses, así como un análisis discriminante.
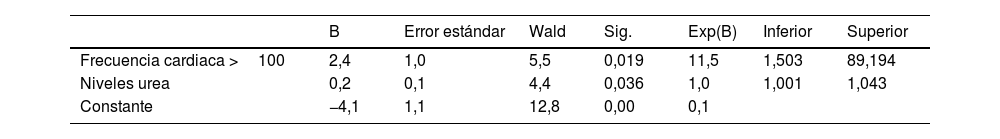
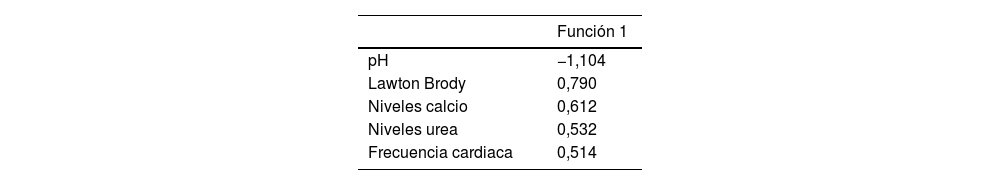
ResultadosEl 15,6% de los pacientes presentaron una demencia a los 6 meses del seguimiento y el 22,2% habían desarrollado deterioro cognitivo. Se obtuvo un modelo multivariante (R2 Nagelkerke 0,459) de la probabilidad de desarrollar una demencia, siendo la frecuencia cardiaca elevada la variable más importante (OR=11,5). El modelo fue capaz de predecir con el 100% de acierto los casos sin diagnóstico de demencia. Finalmente desarrollamos una función discriminante capaz de clasificar correctamente el 95,6% de los casos. Incluyó las siguientes variables por orden de influencia: pH, índice de Lawton Brody, calcio, urea y frecuencia cardiaca.
ConclusionesUnas pocas variables clínicas y analíticas fácilmente detectables en urgencias, especialmente la taquicardia, podrían ayudarnos a identificar mejor aquellos pacientes con delirium con mayor riesgo de desarrollar demencia, así como a desarrollar hipótesis sobre las variables implicadas en el desarrollo de demencia en pacientes con delirium.
The main aim of our study is to know the sociodemographic, clinical, analytical, and functional variables that predict the probability of developing dementia in patients with delirium who attend the emergency room.
MethodAll patients with delirium (n=45) from the emergency room who were admitted to the Geriatrics service of the General University Hospital of Ciudad Real (HGUCR) in 2016-2018 and met the inclusion and exclusion criteria were included. Subsequently, we ran a bivariate and multivariate analysis of the variables that predicted a diagnosis of dementia at six months and a discriminant analysis.
Results15.6% of patients presented dementia at six months of follow-up, 22.2% had developed cognitive impairment. We conducted a multivariate model (R2 Nagelkerke 0.459) for the probability of developing dementia, with elevated heart rate being the most crucial variable (OR=11.5). The model could excluded dementia with 100% accuracy. Finally, we achieved a discriminant function capable of correctly classifying 95.6% of the cases. It included the following variables of influence: pH, Lawton Brody index, calcium, urea, and heart rate.
ConclusionsA few clinical and analytical variables that are easily detectable in the emergency room, especially tachycardia, could help us better identify those patients with delirium at higher risk of developing dementia, as well as formulate hypotheses about the variables involved in the development of dementia in patients with delirium.
La demencia es un síndrome de naturaleza crónica o progresiva en el que existe una alteración de múltiples funciones corticales superiores, incluyendo la memoria, el pensamiento, la orientación, la compresión, el lenguaje, la capacidad de aprender y de realizar cálculos, así como la toma de decisiones que afectan gravemente a la vida diaria de nuestros pacientes1. Las deficiencias de las habilidades cognitivas están comúnmente acompañadas y ocasionalmente precedidas por un deterioro del control emocional, del comportamiento social o de la motivación, representando un problema de gran magnitud.
Según diferentes estimaciones, entre el 2% y el 10% de todos los casos de demencia comienzan antes de los 65años. La prevalencia se duplica con cada intervalo de 5años después de los 65años de edad2. En España, estudios poblacionales recientes indican prevalencias que oscilan entre el 5,5% y el 5,8% en los mayores de 65años, y entre el 8,5% y el 9,4% en los mayores de 70años3,4. En 2011 se calculó que, a nivel mundial, 35,6 millones de personas vivían con demencia, y diversos estudios epidemiológicos indican que este número aumenta de manera alarmante, pudiendo duplicarse cada 20 años debido al envejecimiento progresivo de la población2. Es importante señalar el riesgo del desarrollo de demencia en aquellos pacientes que han sufrido uno o varios episodios de delirium5, así como la relación existente entre los pacientes con déficits cognitivos previos y un mayor riesgo de un episodio incidente de delirium, independientemente incluso de los efectos de la edad6,7. La alta prevalencia mundial de la demencia en las familias, los cuidadores y las comunidades plantea la necesidad de desarrollar mejoras en la atención de la salud de los pacientes que la padecen8. Por todas estas razones, podría ser de interés conocer el riesgo individual de sufrir una demencia de los pacientes que ingresan en urgencias por delirium, a fin de mejorar la prevención y el cuidado del paciente frágil y anciano. Tampoco conocemos la existencia de modelos predictivos del riesgo en nuestro medio.
El objetivo principal de nuestro estudio consiste en conocer las distintas variables (sociodemográficas, clínicas, analíticas y de funcionamiento) que predicen la probabilidad de desarrollar una demencia en los pacientes con delirium que acuden a urgencias.
MétodoTipo de estudioSe trata de un estudio observacional, prospectivo y analítico.
Criterios de inclusión y exclusiónSe incluyeron a todos los pacientes que presentaron un diagnóstico clínico de delirium en las 24horas tras su ingreso en urgencias (n=176) durante el periodo comprendido entre octubre de 2016 y octubre de 2018. Se excluyeron los pacientes derivados de otros servicios del hospital o de otro hospital, los pacientes cuyo seguimiento no ha podido completarse debido al traslado a otro hospital o al fallecimiento durante su estancia hospitalaria, los pacientes en situación terminal (n=63), así como los pacientes con diagnóstico previo de demencia o puntuación <10 en el Mini Mental de Folstein (n=68).
La muestraTras aplicar los criterios de inclusión y exclusión se recogió toda la información necesaria sobre las variables objeto de estudio mediante el análisis exhaustivo de la historia clínica de cada uno de los pacientes, así como de la información recogida a pie de cama en la entrevista clínica realizada al paciente y a sus familiares. Se obtuvo así un total de 45 pacientes con diagnóstico de delirium que ingresaron en el servicio de geriatría del Hospital General Universitario de Ciudad Real (HGUCR) procedentes del servicio de urgencias. Posteriormente se comprobó cuáles de ellos habían desarrollado un síndrome demencial a los 6 meses del ingreso en urgencias.
Variables e instrumentos de medidaLa variable dependiente utilizada en el análisis multivariante y discriminante fue el diagnóstico clínico de demencia, realizado por neurología o geriatría usando criterios CIE-109 a los 6 meses del ingreso inicial en urgencias, y recogido en la historia clínica del paciente. Como variables independientes en el momento inicial del ingreso se incluyeron y detallaron las siguientes variables e instrumentos de medida correspondientes:
- 1.
Variables sociodemográficas: edad y sexo.
- 2.
Variables clínicas:
- 2.1
Motivo de consulta.
- 2.2
Antecedentes médicos.
- 2.3
Comorbilidades:
- -
Índice de comorbilidad de Charlson10,11: es un sistema de evaluación de la esperanza de vida a los diez años, basado en la edad y la comorbilidad. Consta de 19 ítems, que, si están presentes, se ha comprobado que influyen de una forma concreta en la esperanza de vida de nuestros pacientes.
- -
Déficit visual o auditivo.
- -
Portador de sonda vesical o nasogástrica.
- -
Ingresos recientes.
- 2.4
Exploración física y neurológica:
- -
Constantes vitales: presión arterial sistólica y diastólica, frecuencia cardiaca, temperatura y saturación de oxígeno.
- -
Sequedad de piel y mucosas: mediante el signo del pliegue.
- -
Auscultación cardiopulmonar: rítmico, arrítmico o presencia de ruidos patológicos.
- -
Abdomen: blando, depresible, doloroso y presencia de masas o megalias.
- -
Extremidades: edemas, equimosis y petequias.
- -
Escala de coma de Glasgow12: es un instrumento de evaluación neurológica que sirve para valorar el nivel de conciencia de una persona con daño cerebral. Permite explorar y cuantificar tres parámetros o criterios de observación clínica: la respuesta ocular, la respuesta verbal y la respuesta motora.
- 2.5
Exploraciones complementarias:
- 2.5.1
Analítica:
- -
Hemograma: niveles de hemoglobina, hematocrito, hematíes, leucocitos, linfocitos, segmentados y plaquetas.
- -
Bioquímica: niveles de glucosa, urea, creatinina, lactato deshidrogenasa (LDH), aspartato aminotransferasa (GOT), alanina aminotransferasa (GPT), amilasa, bilirrubina total, creatín-fosfocinasa (CPK), proteína C reactiva (PCR), procalcitonina (PCT) e iones (sodio, potasio, cloro y calcio).
- -
Coagulación: actividad de protrombina, tiempo de tromboplastina parcial activada (APTT), fibrinógeno y el índice internacional normalizado (INR).
- -
Gasometría arterial o venosa: analizando el pH, pO2, pCO2, HCO3, exceso de bases, saturación de oxígeno y niveles de ácido láctico.
- -
Sistemático de orina y urocultivo: presencia de leucocitos, nitritos, hematíes, glucosa.
- 2.5.2
Electrocardiograma: presencia de arritmias, cardiopatía isquémica u otras alteraciones.
- 2.5.3
Pruebas de imagen:
- -
Radiografía de tórax: existencia de derrame pleural, atelectasia, neumonía, masas o cardiomegalia.
- -
Tomografía axial computarizada (TAC) y/o resonancia magnética (RM).
- 2.6
Tratamiento habitual (clasificados por grupos farmacológicos): inhibidores de la bomba de protones, antagonistas H2, antihipertensivos, diuréticos, bloqueadores de los canales del calcio, hipouricemiantes, estatinas, analgésicos no opioides, opioides, corticoides, antiagregantes plaquetarios, insulina, antidiabéticos orales, antidepresivos, litio, benzodiacepinas, inhibidores de la acetilcolinesterasa, antipsicóticos, hipnóticos, anticoagulantes, antagonistas no competitivos del receptor NMDA, alfabloqueantes, vitaminas, ácido alendrónico, suplementos de hierro, calcio, potasio, antivertiginosos, antiparkinsonianos, anticonvulsivantes, anticolinérgicos, beta-bloqueantes, antibióticos, antifúngicos. Incluimos también la variable polifarmacia, que, de acuerdo a la Organización Mundial de la Salud (OMS)2,13, se define como el consumo de más de tres fármacos simultáneamente.
- 3.
Cognición y capacidad:
- -
Test Mini Mental de Folstein14,15. Se trata de un test de cribado de demencias, útil en el seguimiento evolutivo de las mismas. La versión utilizada puntúa como máximo un total de 30 puntos y considera deterioro cognitivo a una puntuación menor de 24/30. Los ítems están agrupados en diferentes categorías que representan aspectos relevantes de la función intelectual: orientación, memoria inmediata, atención y cálculo, recuerdo diferido, y lenguaje y construcción del mismo.
- -
Índice de Barthel16,17. Es un instrumento que mide la capacidad de una persona para realizar diez actividades de la vida diaria, consideradas como básicas, obteniendo una estimación cuantitativa de su grado de independencia.
- -
Cuestionario del estado mental de Pfeiffer18,19. Se trata de un breve cuestionario compuesto de diez preguntas que miden el grado de deterioro cognitivo. Las áreas evaluadas son la memoria a corto y a largo plazo, la información sobre hechos cotidianos, la capacidad de cálculo y la orientación.
- -
Índice de Katz20,21. Es un instrumento para evaluar la independencia de un sujeto en cuanto a la realización de las actividades básicas de la vida diaria. Consta de 6 ítems dicotómicos (bañarse, vestirse/desvestirse, uso del baño, movilidad, continencia y alimentación) ordenados jerárquicamente según la secuencia en que los pacientes pierden y recuperan la independencia para realizarlos. Finalmente se obtienen distintos grados A, B, C… F, de independencia.
- -
Índice de Lawton y Brody22,23. Recoge información sobre 8 ítems de actividades instrumentales de la vida diaria, como son: usar el teléfono, ir de compras, preparar la comida, realizar tareas del hogar, lavar la ropa, utilizar transportes, controlar la medicación y manejar el dinero. Mide, por tanto, la capacidad para la realización de cada una de las actividades instrumentales de la vida diaria. Sus valores oscilan entre el 0 (total dependencia) y el 8 (total independencia).
Se realizó un primer análisis descriptivo para caracterizar a los pacientes con delirium. A continuación se estudió la asociación bivariada de cada una de las variables recogidas en el estudio con la variable «demencia a los 6 meses», usando para ello la prueba de independencia chi-cuadrado (para las variables independientes de tipo cualitativo) o un análisis de la varianza de un factor ANOVA (para las variables independientes de tipo numérico). Para la prueba chi-cuadrado se ha tomado el valor de la razón de verosimilitud (RV) cuando el número de categorías de la variable independiente es superior a 2, y la corrección por continuidad (CC) cuando el número es 2 y no se cumplen las condiciones de aplicabilidad para usar el valor del estadístico chi-cuadrado (porcentaje mínimo del 80% de frecuencias esperadas por encima de 5). Posteriormente se realizó una regresión logística binaria, considerando como variable dependiente exclusivamente el diagnóstico de demencia a los seis meses (sin incluir el deterioro cognitivo incipiente), que fue codificado con el valor 0 si el paciente no desarrolla demencia, y el valor 1 en caso contrario. Y como variables independientes, aquellas que demuestran tener una asociación significativa con la variable respuesta, de las cuales la frecuencia cardiaca también se ha dicotomizado con el valor 0 (frecuencia cardiaca por debajo o igual de 100 latidos por minuto) y 1 (frecuencia cardiaca por encima de 100 latidos por minuto), por lo que hemos pasado a llamarla frecuencia cardiaca >100 o taquicardia, donde el 0 indicaría el valor «no» y el 1 el valor «sí». Para realizar la regresión logística se siguió el método de introducción hacia delante de Wald con una probabilidad de entrada de 0,1 y una probabilidad de salida igual a 0,15, calculándose los odd ratio con un 95% de confianza y la prueba de ajuste de Hosmer-Lemeshow. En último lugar, realizamos un análisis discriminante para seleccionar qué variables independientes permiten diferenciar grupos entre pacientes que desarrollarán demencia y pacientes que no lo harán, para lo cual se utilizó un método de inclusión por pasos basado en la lambda de Wilks, con un valor F de entrada igual a 3,84 y de salida igual a 2,71. Se utilizó el software estadístico SPSS (versión 20). El estudio fue aprobado por el Comité de Ética e Investigación del HGUCR.
ResultadosAnálisis descriptivo de los pacientes con deliriumDatos sociodemográficosSe incluyeron un total de 45 pacientes con diagnóstico de delirium que cumplían los criterios de inclusión y exclusión. La media muestral de la edad es de 89,4 años, con una desviación estándar (DE) de 3,9 y un intervalo de confianza al 95% (IC95%) de 88,2-90,6. De ellos, el 62,2% son mujeres y el 37,8% son hombres.
Motivos de consulta, antecedentes médicos y tratamientos farmacológicosPor orden descendente en frecuencia, son: disminución del nivel de consciencia (22,2%), deterioro del estado general (20%), disnea (17,8%) y fiebre (8,9%). La media muestral del tiempo de hospitalización es de 99,1h (DE=120,2h; IC95%: 63,1-135,4).
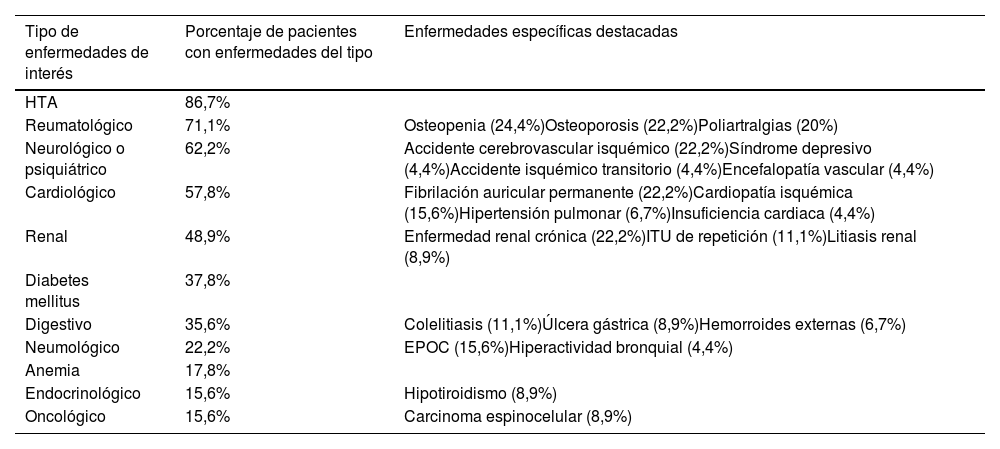
En la tabla 1 se muestran los antecedentes médicos, destacando que el 86,7% de los pacientes presenta hipertensión arterial (HTA); el 71,1%, enfermedades de tipo reumatológico; el 62,2%, de tipo neurológico, y el 57,8%, de tipo cardiológico.
Antecedentes médicos
| Tipo de enfermedades de interés | Porcentaje de pacientes con enfermedades del tipo | Enfermedades específicas destacadas |
|---|---|---|
| HTA | 86,7% | |
| Reumatológico | 71,1% | Osteopenia (24,4%)Osteoporosis (22,2%)Poliartralgias (20%) |
| Neurológico o psiquiátrico | 62,2% | Accidente cerebrovascular isquémico (22,2%)Síndrome depresivo (4,4%)Accidente isquémico transitorio (4,4%)Encefalopatía vascular (4,4%) |
| Cardiológico | 57,8% | Fibrilación auricular permanente (22,2%)Cardiopatía isquémica (15,6%)Hipertensión pulmonar (6,7%)Insuficiencia cardiaca (4,4%) |
| Renal | 48,9% | Enfermedad renal crónica (22,2%)ITU de repetición (11,1%)Litiasis renal (8,9%) |
| Diabetes mellitus | 37,8% | |
| Digestivo | 35,6% | Colelitiasis (11,1%)Úlcera gástrica (8,9%)Hemorroides externas (6,7%) |
| Neumológico | 22,2% | EPOC (15,6%)Hiperactividad bronquial (4,4%) |
| Anemia | 17,8% | |
| Endocrinológico | 15,6% | Hipotiroidismo (8,9%) |
| Oncológico | 15,6% | Carcinoma espinocelular (8,9%) |
Dentro de las comorbilidades que presentan nuestros pacientes, se debe destacar que la media muestral en la escala de Charlson es de 1,3 puntos (DE=1; IC95%: 1-1,7). Además, el 37,8% de los pacientes presentan déficit auditivo y visual, el 13,3% han tenido otros ingresos en los últimos 15 días por diversos motivos, y al 17,8% de los pacientes se les ha modificado el tratamiento en los últimos 15 días.
Los fármacos más utilizados fueron los inhibidores de la bomba de protones (66,7%), los diuréticos (62,2%) y los antihipertensivos (60%). En el anexo se añade una tabla 1 suplementaria con los fármacos más frecuentes que tomaban los pacientes de la muestra.
Exploración médicaEn relación a las constantes vitales, señalamos las medias y las desviaciones estándar de las mismas: presión arterial sistólica: x¯=135mmHg; DE=30; IC [126-144]; presión arterial diastólica: x¯=73mmHg; DE=14; IC [69-77]; frecuencia cardiaca: x¯=88,8l/min; DE=21,6; IC [82,4-95,3]; temperatura: x¯=36,8° C; DE=1; IC [36,5-37,1]; saturación de oxígeno: x¯=92,5%; DE=3,6; IC [91,4-93,5].
En la exploración física destacamos los siguientes hechos. La auscultación cardiorrespiratoria (ACR) fue rítmica en el 64,4% de los pacientes. En la misma, en el 53,3% de los pacientes se encontraron ruidos patológicos a la entrada de urgencias, siendo los más frecuentes: roncus 22,2%, crepitantes 17,8% y sibilantes 11,1%. En relación a la exploración abdominal, solamente el 4,4% de los pacientes presentaron un abdomen doloroso a su entrada en urgencias, y el 6,7% de los pacientes presentaron otras alteraciones. El nivel de conciencia de los pacientes medido con la escala de Glasgow presentó los siguientes valores: x¯=13,4; DE=1; IC95%: 13-13,7. Además, el 15,6% de los pacientes presentaron focalidad neurológica y el 13,3% otras alteraciones, principalmente estar desorientado/a (4,4%). Como otros datos reseñables de la exploración física comentamos que el 15,6% presentaron edemas en extremidades, el 11,1% otras alteraciones en miembros inferiores, y finalmente el 51,1% de los pacientes presentaron sequedad de piel y mucosas.
Exploraciones complementariasEn el sedimento de orina, el 33,3% de los pacientes presentaron un sedimento patológico. El 28,9% dieron positivo en leucocitos y el 17,8% en nitritos. En el ECG el hallazgo patológico más prevalente fue la fibrilación auricular en el 33,3% de los casos, y en el 11,1% de los casos se encontraron otras alteraciones. En la radiografía de tórax, el 48,9% de los pacientes presentaron cardiomegalia, el 20% neumonía, el 8,9% derrame pleural y el 4,4% atelectasias. Ningún paciente presentó masas torácicas en la radiografía de tórax. En la TAC craneal de urgencias se encontró patología en el 37,8% de los casos, siendo lo más frecuente la enfermedad vascular en el 11,1%. (Para datos analíticos, véase la tabla 2 suplementaria del anexo).
Estado cognitivo y funcional basalNo se detectaron diferencias estadísticamente significativas a la entrada en urgencias entre los grupos de pacientes que posteriormente presentaron demencia y los que no (tabla 2).
Cognición y capacidad funcional
| Situación basal | No dementes | Dementes | F (valor p) |
|---|---|---|---|
| Mini Mental Test | x¯=20,1 DE=4,5IC=[18,7-21,6] | x¯=18,3 DE=7IC=[11,9-24,7] | 0,844 (0,363) |
| Deterioro funcional previo de Bartlett | x¯=56,6 DE=23,8IC=[48,7-64,4] | x¯=68,1 DE=24,5IC=[45,4-90,8] | 1,380 (0,247) |
| Índice de Lawton y Brody | x¯=4 DE=2,4IC=[3,2-4,8] | x¯=5,3 DE=2,4IC=[2,8-7,9] | 3,322 (0,075) |
| Situación basal | No dementes | Dementes | Chi-cuadrado (valor p) |
|---|---|---|---|
| Índice de Katz | A-C: 57,9%D-F: 42,1% | A-C: 71,5%D-F: 28,6% | 0,062 (0,801)(CC) |
El diagnóstico principal fue infección respiratoria de vías bajas en el 20% de los pacientes, ITU complicada en el 13,3% y neumonía adquirida en la comunidad en el 11,1%.
Frecuencia y tipo de deterioro cognitivo a los 6 meses de seguimientoDel total de pacientes con diagnóstico de delirium, el 15,6% (7 pacientes) desarrollaron una demencia a los 6 meses, presentando el 11,1% (5 pacientes) una demencia vascular, el 2,2% (1 paciente) una demencia tipo mixta y el 2,2% (1 paciente) una demencia degenerativa. Finalmente, el 22,2% (10 pacientes) presentaron un deterioro cognitivo incipiente.
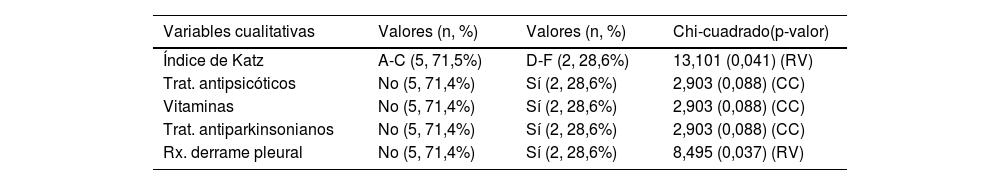
Análisis bivariante entre la variable «demencia a los 6 meses» y resto de variables del estudioDe entre todas las variables de nuestro estudio, únicamente presentan asociación significativa con el diagnóstico de demencia a los 6 meses el índice de Katz, el índice de Lawton-Brody, la frecuencia cardiaca, el derrame pleural, el pH, la urea, la creatinina y el calcio, y tratamientos como antipsicóticos, antiparkinsonianos y vitaminas (tabla 3).
Análisis bivariante
| Variables cualitativas | Valores (n, %) | Valores (n, %) | Chi-cuadrado(p-valor) |
|---|---|---|---|
| Índice de Katz | A-C (5, 71,5%) | D-F (2, 28,6%) | 13,101 (0,041) (RV) |
| Trat. antipsicóticos | No (5, 71,4%) | Sí (2, 28,6%) | 2,903 (0,088) (CC) |
| Vitaminas | No (5, 71,4%) | Sí (2, 28,6%) | 2,903 (0,088) (CC) |
| Trat. antiparkinsonianos | No (5, 71,4%) | Sí (2, 28,6%) | 2,903 (0,088) (CC) |
| Rx. derrame pleural | No (5, 71,4%) | Sí (2, 28,6%) | 8,495 (0,037) (RV) |
| Variables numéricas | No dementes (media; DE) | Sí dementes (media; DE) | F (valor p) |
|---|---|---|---|
| Lawton-Brody | (4; 2,4) | (5,3; 2,4) | 3,322 (0,075) |
| Frecuencia cardiaca | (86,2; 21,3 lpm) | (103; 18,7 lpm) | 3,793 (0,058) |
| GASO: pH | (7,39; 0,05) | (6,37; 1,97) | 10,012 (0,003) |
| BIOQ: Urea | (58,4; 28,4 mg/dl) | (104,6; 81,4 mg/dl) | 7,787 (0,008) |
| BIOQ: Creatinina | (1,29; 0,61 mg/dl) | (1,91; 1,41 mg/dl) | 3,704 (0,061) |
| BIOQ: Calcio | (8,5; 9 mg/dl) | (9; 0,5 mg/dl) | 2,052 (0,050) |
Se obtuvo un modelo estadísticamente significativo según la prueba de Ómnibus (ꭓ2=11,465; gl2; p≤0,003), que mostró la siguiente bondad de ajuste: R2 de Nagelkerke de 0,459; R2 de Cox y Snell de 0,225 y logaritmo de verosimilitud-2=27,435. La ecuación del modelo fue la siguiente:
donde p es la probabilidad de que el paciente desarrolle demencia (tabla 4).
Finalmente, el porcentaje global de acierto de las predicciones realizadas con el modelo es del 91,1%, siendo mejor la capacidad predictiva del modelo para los casos de «no demencia» (acierto 100%) que para los casos de demencia (acierto 42,9%).
Análisis discriminantePara la función encontrada, el valor de la lambda de Wilks es 0,267, que equivale a la varianza no explicada por el modelo, siendo por tanto el porcentaje de variabilidad explicada igual al 73,27%. Esta función discriminante es significativa (ꭓ2=34,976; p=0,000), por lo que podemos afirmar que puede clasificar adecuadamente a los sujetos.
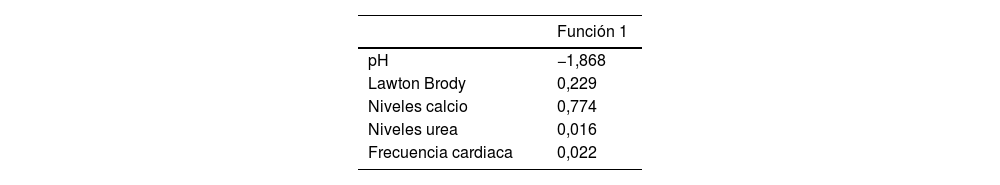
En la tabla 5 de coeficientes estandarizados observamos qué variables conforman la función discriminante y cuáles son más influyentes en dicha función (según el valor absoluto de los coeficientes), siendo el orden de influencia; pH, Lawton Brody, calcio, urea y frecuencia cardiaca., siendo los valores de la matriz de centroides −0,524 para la exclusión del diagnóstico de demencia y 4,894 para el diagnóstico positivo de la misma. Esta matriz nos permite conocer a qué grupo pertenecerá un nuevo paciente, según la proximidad de valor de la función discriminante a cada uno de los centroides.
La función discriminante viene dada por la tabla 6 de coeficientes no estandarizados, siendo la función: D=2,863-1,868 pH +0,229 Lawton Brody +0,774 calcio +0,016 urea +0,022 frecuencia cardiaca.
Finalmente, la función discriminante nos da el número de casos clasificados correctamente, que como vemos en nuestro caso, en promedio es del 95,6%. En este caso, todos los pacientes que no desarrollan demencia se clasifican correctamente, así como un 71,4% de los pacientes que sí la desarrollan.
DiscusiónHemos obtenido una serie de variables clínicas y analíticas que nos permiten tanto distinguir mejor aquellos pacientes con delirium ingresados en urgencias que desarrollarán demencia de los que no lo harán, como ver en qué se diferencian los pacientes con delirium que acaban desarrollando demencia de los que no lo harán. Esta información puede ser útil para ayudarnos a un mejor conocimiento de los factores de riesgo del síndrome demencial, así como a centrar la atención en aquellos pacientes que tienen más riesgo. En concreto, en nuestra muestra el mayor predictor de desarrollo de demencia fue la taquicardia. Además, tanto el modelo multivariante como la función discriminante obtenidos resultaron tremendamente precisos para identificar a aquellos pacientes sin demencia. También es reseñable que el tipo de demencia predominante en nuestra muestra fuera la demencia vascular, ya que el riesgo cardiovascular en los pacientes de la muestra era alto, dado que la HTA fue la comorbilidad más presente, y que la patología cardiológica y cerebrovascular fue muy prevalente.
De entre las variables analizadas que han ofrecido mayor potencial para predecir el riesgo de desarrollar una demencia queremos destacar el papel de la taquicardia (OR=11,5), además es una variable que sirve para distinguir aquellos pacientes que sufren demencia de aquellos que no. Así, una frecuencia cardiaca alta no solo se ha asociado al desarrollo de cardiopatía isquémica o insuficiencia cardíaca, con la mayor morbilidad que conllevan estas24,25, sino que la presencia de taquiarritmias, en concreto fibrilación auricular24, contribuye a la hipoperfusión cerebral y al tromboembolismo cerebral, noxas relacionadas con la función cognitiva. Además, es un importante factor de riesgo vascular independiente de accidente cerebrovascular, implicado en la aparición de cualquier tipo de demencia, no solo vascular26. Así mismo, la existencia de otros factores de riesgo cardiovascular también se asocia a demencia26.
Entre las variables capaces de distinguir entre aquellos pacientes con demencia y aquellos sin demencia, queremos destacar en primer lugar la importancia del equilibrio ácido-base. Así, se han encontrado alteraciones del mismo en los endosomas, unos orgánulos que realizan múltiples funciones en las células relacionadas con el metabolismo de membranas, absorción de nutrientes de las células, metabolismo proteico, desacoplamiento ligando-receptor y otras. Existen abrumadoras pruebas de que podrían tener un papel importante en la fisiopatología de la enfermedad de Alzheimer y otros trastornos neurodegenerativos, incluso previo al inicio del deterioro cognitivo. La acidificación en los endosomas tendría un papel en la formación de β-amiloide y en su aclaramiento, siendo esta una prometedora y potencial diana terapéutica en la enfermedad de Alzheimer y otros trastornos neurodegenerativos27,28. Otros recientes estudios también han subrayado el papel de las alteraciones del pH cerebral mediadas por el lactato en la patogenia de las enfermedades degenerativas y su potencial como posibles dianas terapéuticas29.
En segundo lugar, encontramos la presencia de niveles elevados de calcio como variable analítica implicada en el desarrollo de demencia, y aun sin conocer, en el momento actual, el mecanismo concreto implicado en el desarrollo de la demencia, destacamos que hay estudios poblacionales longitudinales que han encontrado que mayores niveles de calcemia son predictores de la progresión a demencia en personas sin demencia previa30. Además, algunos trabajos mencionan la hipercalcemia como una causa de demencia31, o destacan las relaciones entre el metabolismo del calcio y la demencia32. Además, el hiperparatiroidismo primario es una conocida etiología de demencia potencialmente reversible o tratable33.
Finalmente, la presencia de niveles altos de urea fue común en los pacientes que desarrollaron demencia. Algún estudio ha encontrado un posible papel de estos en el desarrollo de diabetes tipo2 y como marcador de riesgo en el desarrollo de enfermedades neurodegenerativas, como la enfermedad de Huntington34.
A diferencia de otros estudios publicados35-38, que se centran en el riesgo de desarrollar delirium en el paciente anciano, no conocemos ninguno que aborde la cuestión del riesgo de demencia en pacientes con delirium. Así, nuestros hallazgos, aunque modestos y limitados por el tamaño de la muestra, pueden contribuir a un mejor el conocimiento de las variables clínicas y analíticas implicadas en el desarrollo de demencia en pacientes frágiles y vulnerables, como los ancianos que ingresan en urgencias. Otras limitaciones son inherentes al corto período de seguimiento. No obstante, creemos que nuestro trabajo puede contribuir a elaborar modelos predictivos del riesgo de demencia más consolidados, y a entender mejor el papel de determinadas variables en el desarrollo de demencia en los pacientes de nuestro entorno. Sin duda son necesarios estudios con mayor tamaño muestral que contribuyan a entender mejor la comorbilidad entre el delirium y la demencia.
Finalmente, queremos concluir que unas pocas variables analíticas y clínicas, como la existencia de taquicardia y otras, fácilmente detectables en urgencias y en atención primaria, podrían ayudarnos a identificar mejor aquellos pacientes con mayor riesgo de desarrollar demencia, permitiendo además formular hipótesis sobre las variables implicadas en el desarrollo de demencia en pacientes que presentan delirium.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.