Estudiar la correlación entre los factores de riesgo cardiovascular (FRCV) y el deterioro cognitivo leve (DCL) en el ámbito de la Atención Primaria (AP).
Materiales y métodosEstudio observacional, transversal y multicéntrico realizado en el ámbito de la AP. Se recogió información sobre variables demográficas, FRCV, comorbilidades y deterioro cognitivo, determinado mediante la puntuación del Mini-Examen del Estado Mental (MMSE) y se correlacionaron mediante un análisis multivariado.
ResultadosSe recogieron datos de un total de 458 pacientes. Los FRCV correlacionados negativamente de forma significativa con el DCL fueron edad del paciente, presencia de enfermedades cardiovasculares, antecedentes familiares de dislipemia, presión arterial diastólica y niveles de colesterol; mientras que factores como el nivel de estudios y los niveles de ácido fólico se relacionaron positivamente de forma significativa con mejores resultados en la puntuación del MMSE.
ConclusionesSe confirma que la presencia de FRCV influye en el desarrollo del DCL, y es ya detectable en el ámbito de AP. La hipercolesterolemia y la hipertensión arterial son piezas clave en la potenciación de este deterioro, por lo que se tendrían que reforzar las medidas de control de estas dos patologías desde AP para frenar el desarrollo de demencias.
To evaluate the correlation between cardiovascular risk factors (CRF) and mild cognitive impairment (MCI) in the primary care setting.
Materials and methodsObservational, cross-sectional and multicenter study conducted in the setting of primary care. Information regarding demographic variables, CRF, comorbidities, and cognitive impairment determined by Mini-Mental State Examination (MMSE) score was collected. These data were correlated by multivariate analysis.
ResultsData from a total of 458 patients were collected. CRFs significantly negative correlated with MCI were patient age, presence of cardiovascular disease, family history of dyslipemia, diastolic blood pressure and cholesterol levels; while factors such as education level and folic acid levels were significant and positive related to higher MMSE scores.
ConclusionsThis study confirms that the presence of CRF impacts on MCI development, already detectable in the primary care setting. High cholesterol levels and high blood pressure are key elements in MCI, and therefore, measures to control these two conditions from primary care should be reinforced in order to stop the development of dementias.
El deterioro cognitivo leve (DCL) se define como un declive cognitivo mayor del esperado por la edad y el nivel cultural del individuo1, que no interfiere en las actividades de la vida diaria y, por tanto, sin la severidad de la demencia2,3. Los criterios diagnósticos del DCL requieren una queja subjetiva de deterioro cognitivo, de inicio gradual y que se mantiene al menos durante 6 meses4,5. Este síntoma subjetivo se debe confirmar con herramientas como el Mini-Mental State Examination (MMSE), un test que evalúa la orientación, la atención, el cálculo, la memoria inmediata y diferida, la capacidad visoespacial, el lenguaje y la habilidad constructiva del paciente6. El DCL es uno de los problemas de salud más extendidos en los países desarrollados y su incidencia está aumentando con el incremento de la esperanza de vida7.
Se han identificado diversos factores de riesgo asociados al DCL, tales como enfermedades vinculadas al envejecimiento (enfermedad cerebrovascular, hipertensión, diabetes, endocrinopatías) y otros factores intrínsecos del individuo (por ejemplo, genéticos)8. Además, la mayoría de pacientes con DCL presentan factores de riesgo vascular y se ha descrito una asociación entre una peor función cognitiva y un peor perfil cardiovascular (peor puntuación Framingham)4,9.
El control de los factores modificables es fundamental para evitar la aparición del DCL, y por ende, la demencia, puesto que el DCL se ha visto relacionado con el desarrollo de enfermedad de Alzheimer (EA), demencia frontotemporal y demencia por cuerpos de Lewy10,11. Se ha establecido que la tasa de conversión anual del DCL a demencia es de alrededor del 10-15%8,12.
En general, se presume que el control de los factores de riesgo cardiovascular (FRCV) como hipertensión, colesterol, diabetes, obesidad, perfil lipídico o síndrome metabólico podría tener un impacto positivo en la reducción del riesgo de DCL y la prevención de la demencia9,13–18. Asimismo, la presencia de componente vascular multiplica significativamente la tasa de progresión a demencia, en comparación con la EA pura19.
La prevención y la detección precoz de los FRCV constituye pues una estrategia de salud esencial para evitar el desarrollo del DCL y así mejorar la asistencia sanitaria y la evolución de estos pacientes, y en consecuencia la calidad de vida de sus familias y/o cuidadores20–22. La atención primaria (AP) es el escenario ideal para alcanzar este cometido.
El objetivo de nuestro estudio fue estudiar la correlación entre los FRCV y el DCL en el ámbito de AP con el fin de que se puedan establecer mejoras en las medidas de prevención del DCL.
Material y métodosSe llevó a cabo un estudio observacional, transversal y multicéntrico durante un período de 6 meses (de diciembre de 2017 a junio de 2018) en todo el territorio español. Inicialmente se identificaron 260 médicos de AP con conocimientos y experiencia en deterioro cognitivo para que participaran en el estudio. Cada investigador debía incluir 2 o 3 pacientes.
Para participar en el estudio, los pacientes debían tener 65 años o más y presentar 2 o más FRCV. Además, debían obtener una puntuación mayor de 21 en el Mini-Examen del Estado Mental (MMSE) de Folstein6, en el momento de ser incluidos o durante los 3 meses previos al inicio del proyecto.
El estudio se llevó a cabo de conformidad con el código ético de la OMS (Declaración de Helsinki) sobre experimentos con humanos23, recibió la aprobación del CEIC del Hospital Clínico San Carlos y todos los pacientes otorgaron el consentimiento informado para participar en el mismo.
Se recogió información acerca de los FRCV, deterioro cognitivo, variables sociodemográficas, historia familiar, historia personal, historia médica y exploraciones basales de los pacientes incluidos y se valoró su estado cognitivo mediante el test MMSE6. Los datos de las variables cuantitativas, como glucosa, colesterol o presión arterial, derivaron de las últimas medidas recogidas, las cuales no debían ser previas a los 6 meses anteriores a la inclusión en el estudio.
Para el cálculo del tamaño muestral se asumió una desviación estándar de 4,22 en la escala MMSE14,15, con un alfa bilateral del 5%. Así, fueron necesarios 298 sujetos por nivel de factor de riesgo, generando un total de 594 sujetos para incluir en el estudio. Se previó una tasa de pérdida de datos del 6%.
Análisis estadísticoLa comparación entre variables cualitativas se realizó mediante la prueba exacta de Fisher, la comparación entre grupos y variables cuantitativas se realizó mediante la prueba t de Student (en caso de 2 grupos) o mediante la prueba ANOVA de una vía (para 3 o más grupos), mientras que la comparación entre variables de naturaleza continua se realizó mediante el coeficiente de correlación de Pearson. Por último, en caso de no cumplirse las condiciones de aplicación de la prueba t de Student o de la prueba ANOVA, se recurrió a la prueba no paramétrica de la U de Mann-Withney (2 grupos) o la prueba de Kruskal-Wallis (para 3 o más grupos). Se utilizaron intervalos de confianza al 95% (IC 95%).
Con el fin de analizar la relación entre el déficit cognitivo (medido mediante el MMSE) y las diferentes variables evaluadas se realizó un análisis multivariado de los datos. En primer lugar, se obtuvo un análisis bivariado de los datos citados frente al valor del MMSE mediante las pruebas indicadas más arriba. Posteriormente, se aplicó un modelo de regresión lineal múltiple, con el método de selección Stepwise, incluyendo como variables candidatas para entrar en el modelo aquellas que mostraron una relación estadísticamente significativa de forma bivariada con el MMSE (p<0,05) o bien una relación casi significativa (p<0,1). El nivel de significación estadística predefinido fue del 0,05. Todos los cálculos se realizaron mediante el paquete estadístico SAS versión 9.4 (SAS Institute).
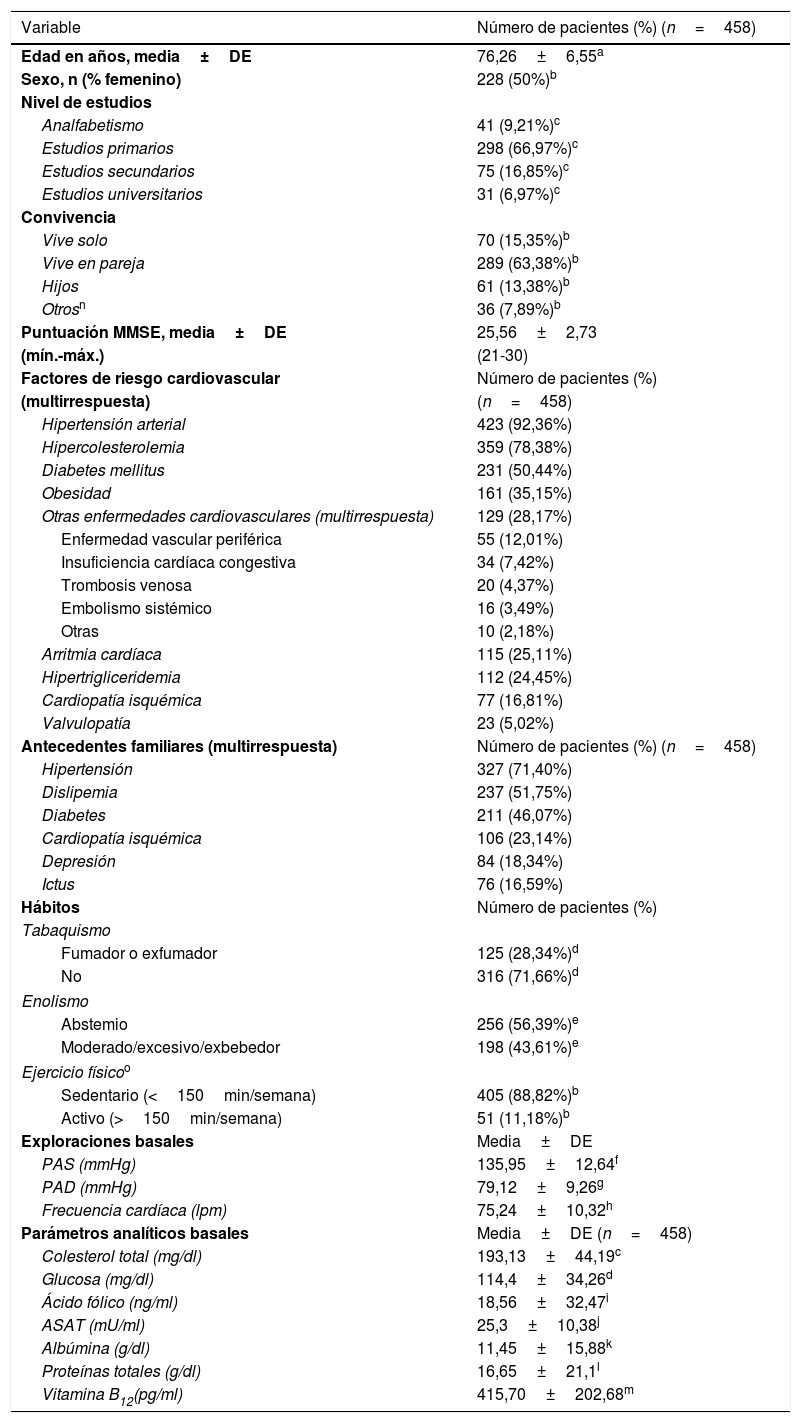
ResultadosEn el estudio participaron 257 investigadores que incluyeron un total 575 pacientes, excluyéndose 117 por no cumplir los criterios de inclusión o por cumplir alguno de los criterios de exclusión. La muestra final fue de 458 pacientes válidos. Las características demográficas y cognitivas de los pacientes se muestran en la tabla 1. La proporción entre sexos estuvo equilibrada (1:1) y la edad media fue de 76,26 (±6,55) años. La puntuación MMSE media fue de 25,56 (±2,73) puntos.
Características sociodemográficas, clínicas y cognitivas de los pacientes incluidos en el estudio
| Variable | Número de pacientes (%) (n=458) |
|---|---|
| Edad en años, media±DE | 76,26±6,55a |
| Sexo, n (% femenino) | 228 (50%)b |
| Nivel de estudios | |
| Analfabetismo | 41 (9,21%)c |
| Estudios primarios | 298 (66,97%)c |
| Estudios secundarios | 75 (16,85%)c |
| Estudios universitarios | 31 (6,97%)c |
| Convivencia | |
| Vive solo | 70 (15,35%)b |
| Vive en pareja | 289 (63,38%)b |
| Hijos | 61 (13,38%)b |
| Otrosn | 36 (7,89%)b |
| Puntuación MMSE, media±DE | 25,56±2,73 |
| (mín.-máx.) | (21-30) |
| Factores de riesgo cardiovascular | Número de pacientes (%) |
| (multirrespuesta) | (n=458) |
| Hipertensión arterial | 423 (92,36%) |
| Hipercolesterolemia | 359 (78,38%) |
| Diabetes mellitus | 231 (50,44%) |
| Obesidad | 161 (35,15%) |
| Otras enfermedades cardiovasculares (multirrespuesta) | 129 (28,17%) |
| Enfermedad vascular periférica | 55 (12,01%) |
| Insuficiencia cardíaca congestiva | 34 (7,42%) |
| Trombosis venosa | 20 (4,37%) |
| Embolismo sistémico | 16 (3,49%) |
| Otras | 10 (2,18%) |
| Arritmia cardíaca | 115 (25,11%) |
| Hipertrigliceridemia | 112 (24,45%) |
| Cardiopatía isquémica | 77 (16,81%) |
| Valvulopatía | 23 (5,02%) |
| Antecedentes familiares (multirrespuesta) | Número de pacientes (%) (n=458) |
| Hipertensión | 327 (71,40%) |
| Dislipemia | 237 (51,75%) |
| Diabetes | 211 (46,07%) |
| Cardiopatía isquémica | 106 (23,14%) |
| Depresión | 84 (18,34%) |
| Ictus | 76 (16,59%) |
| Hábitos | Número de pacientes (%) |
| Tabaquismo | |
| Fumador o exfumador | 125 (28,34%)d |
| No | 316 (71,66%)d |
| Enolismo | |
| Abstemio | 256 (56,39%)e |
| Moderado/excesivo/exbebedor | 198 (43,61%)e |
| Ejercicio físicoo | |
| Sedentario (<150min/semana) | 405 (88,82%)b |
| Activo (>150min/semana) | 51 (11,18%)b |
| Exploraciones basales | Media±DE |
| PAS (mmHg) | 135,95±12,64f |
| PAD (mmHg) | 79,12±9,26g |
| Frecuencia cardíaca (lpm) | 75,24±10,32h |
| Parámetros analíticos basales | Media±DE (n=458) |
| Colesterol total (mg/dl) | 193,13±44,19c |
| Glucosa (mg/dl) | 114,4±34,26d |
| Ácido fólico (ng/ml) | 18,56±32,47i |
| ASAT (mU/ml) | 25,3±10,38j |
| Albúmina (g/dl) | 11,45±15,88k |
| Proteínas totales (g/dl) | 16,65±21,1l |
| Vitamina B12(pg/ml) | 415,70±202,68m |
ASAT: aspartato aminotransferasa; DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; MMSE: Mini-Examen del Estado Mental; PAS: presión arterial sistólica; PAD: presión arterial diastólica.
En relación con los FRCV, los más frecuentes fueron hipertensión arterial (HTA) (92,36%) e hipercolesterolemia (78,38%). Además, los antecedentes familiares detectados más frecuentemente fueron también la HTA (71,40%) y la dislipemia (51,75%), así como la diabetes (46,07%) (tabla 1).
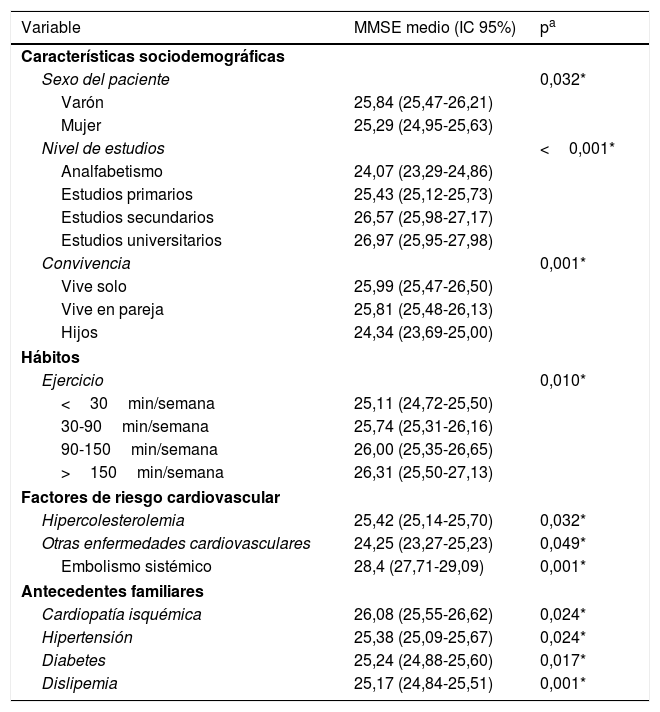
Análisis bivariadoEn relación con los factores demográficos, tanto la mayor edad como el sexo masculino se relacionaron significativamente con una menor puntuación en el cuestionario MMSE. También la presencia de hipercolesterolemia, enfermedades cardiovasculares, y antecedentes familiares de dislipemia, cardiopatía isquémica, HTA y diabetes se correlacionaron significativamente con una menor puntuación en el MMSE. En cambio, factores como el ejercicio y el nivel de estudios se correlacionaron positivamente con los resultados del test. Aquellos participantes que vivían con sus hijos también presentaron una puntuación significativamente más baja en el MMSE (tablas 2 y 3).
Variables cualitativas con una relación estadísticamente significativa con el deterioro cognitivo (puntuación MMSE)
| Variable | MMSE medio (IC 95%) | pa |
|---|---|---|
| Características sociodemográficas | ||
| Sexo del paciente | 0,032* | |
| Varón | 25,84 (25,47-26,21) | |
| Mujer | 25,29 (24,95-25,63) | |
| Nivel de estudios | <0,001* | |
| Analfabetismo | 24,07 (23,29-24,86) | |
| Estudios primarios | 25,43 (25,12-25,73) | |
| Estudios secundarios | 26,57 (25,98-27,17) | |
| Estudios universitarios | 26,97 (25,95-27,98) | |
| Convivencia | 0,001* | |
| Vive solo | 25,99 (25,47-26,50) | |
| Vive en pareja | 25,81 (25,48-26,13) | |
| Hijos | 24,34 (23,69-25,00) | |
| Hábitos | ||
| Ejercicio | 0,010* | |
| <30min/semana | 25,11 (24,72-25,50) | |
| 30-90min/semana | 25,74 (25,31-26,16) | |
| 90-150min/semana | 26,00 (25,35-26,65) | |
| >150min/semana | 26,31 (25,50-27,13) | |
| Factores de riesgo cardiovascular | ||
| Hipercolesterolemia | 25,42 (25,14-25,70) | 0,032* |
| Otras enfermedades cardiovasculares | 24,25 (23,27-25,23) | 0,049* |
| Embolismo sistémico | 28,4 (27,71-29,09) | 0,001* |
| Antecedentes familiares | ||
| Cardiopatía isquémica | 26,08 (25,55-26,62) | 0,024* |
| Hipertensión | 25,38 (25,09-25,67) | 0,024* |
| Diabetes | 25,24 (24,88-25,60) | 0,017* |
| Dislipemia | 25,17 (24,84-25,51) | 0,001* |
MMSE: Mini-Examen del Estado Mental.
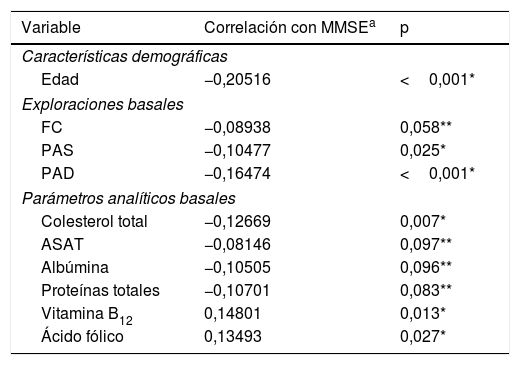
Variables cuantitativas con una relación estadísticamente significativa con el deterioro cognitivo (puntuación MMSE)
| Variable | Correlación con MMSEa | p |
|---|---|---|
| Características demográficas | ||
| Edad | −0,20516 | <0,001* |
| Exploraciones basales | ||
| FC | −0,08938 | 0,058** |
| PAS | −0,10477 | 0,025* |
| PAD | −0,16474 | <0,001* |
| Parámetros analíticos basales | ||
| Colesterol total | −0,12669 | 0,007* |
| ASAT | −0,08146 | 0,097** |
| Albúmina | −0,10505 | 0,096** |
| Proteínas totales | −0,10701 | 0,083** |
| Vitamina B12 | 0,14801 | 0,013* |
| Ácido fólico | 0,13493 | 0,027* |
ASAT: aspartato aminotransferasa; FC: frecuencia cardíaca; MMSE: Mini-Examen del Estado Mental; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
En cuanto a los resultados de las exploraciones basales o analíticas, se observó que valores elevados de presión arterial sistólica (PAS) y diastólica (PAD), así como de colesterol total se relacionaron con una menor puntuación en el test MMSE, mientras que los niveles de ácido fólico o vitamina B12 lo hacían con una mayor puntuación en el test (tabla 3).
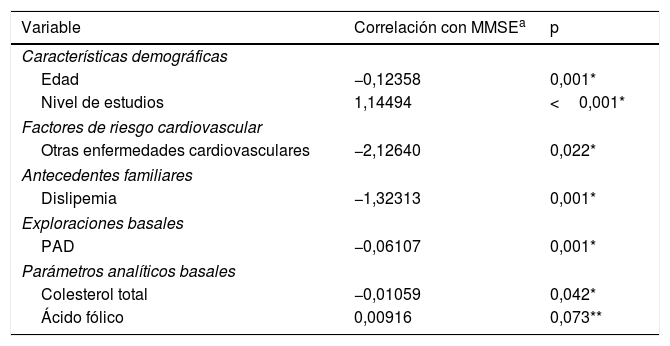
Análisis multivariadoTras realizar un análisis multivariado para el MMSE, las variables que mantuvieron su correlación negativa con la puntuación del test fueron la edad del paciente, la presencia de enfermedades cardiovasculares, los antecedentes familiares de dislipemia, PAD y colesterol; mientras que factores como el nivel de estudios y los niveles de ácido fólico seguían relacionándose significativamente con mejores resultados del test (tabla 4).
Variables asociadas al deterioro cognitivo (puntuación MMSE) según el análisis multivariante
| Variable | Correlación con MMSEa | p |
|---|---|---|
| Características demográficas | ||
| Edad | −0,12358 | 0,001* |
| Nivel de estudios | 1,14494 | <0,001* |
| Factores de riesgo cardiovascular | ||
| Otras enfermedades cardiovasculares | −2,12640 | 0,022* |
| Antecedentes familiares | ||
| Dislipemia | −1,32313 | 0,001* |
| Exploraciones basales | ||
| PAD | −0,06107 | 0,001* |
| Parámetros analíticos basales | ||
| Colesterol total | −0,01059 | 0,042* |
| Ácido fólico | 0,00916 | 0,073** |
MMSE: Mini-Examen del Estado Mental; PAD: presión arterial diastólica.
Este estudio ha permitido constatar la correlación entre los FRCV y el DCL en el ámbito de la AP, estableciendo factores como los niveles de colesterol, la presencia de enfermedades cardiovasculares y los antecedentes familiares de dislipemia como aquellos que pueden implicar un mayor riesgo de desarrollar DCL. Existe una amplia evidencia científica en la que se relaciona estos factores con una mayor propensión a desarrollar deterioro cognitivo. Se ha descrito una correlación entre un peor perfil de riesgo cardiovascular y una peor función cognitiva, así como relación con los niveles de colesterol, HTA, diabetes mellitus y enfermedad cerebrovascular8–10,14,17,18,24.
Aunque los datos obtenidos estarían en consonancia con los de estudios previos, también observamos algunas discordancias. En nuestros resultados, destaca la ausencia de la HTA y la diabetes como factores correlacionados con el DCL. Aunque el 50% de los pacientes del estudio presentaban diabetes y el 92% HTA, en el análisis multivariado no se observó una relación con el DCL. La diabetes, tanto de tipo 1 como de tipo 2, y la HTA son factores clásicamente asociados al deterioro cognitivo. No obstante, la influencia de los factores de riesgo puede ser distinta en función del tipo de demencia al que nos refiramos. Luchsinger et al. (2007) observaron que la diabetes se relacionaba con un mayor riesgo de DCL amnésico y con un mayor riesgo de EA. Sin embargo, no observaron relación directa con el DCL no amnésico25. En cuanto a la HTA, se ha descrito que presenta mayor repercusión en la demencia vascular26,27.
Tampoco hemos encontrado correlación entre alcoholismo y DCL a pesar de que esta relación ha sido ampliamente observada28, aunque no existe un consenso sobre tal premisa. Así, Stampfer et al. (2005) observaron que los pacientes con consumo moderado de alcohol (<15,0g de alcohol/día) presentaban mejores puntuaciones cognitivas medias que los no bebedores29, en línea con nuestros resultados.
Por otro lado, en este estudio también se han asociado factores de riesgo relacionados con las variables sociodemográficas de los pacientes. En consonancia con otros estudios epidemiológicos previamente publicados, la menor puntuación MMSE se ha relacionado con una mayor edad30,31, y también son coherentes con la literatura los hallazgos de que, a mayor nivel de estudios, mayor puntuación media en el MMSE32,33.
En cuanto a los datos de la exploración física y a los parámetros analíticos analizados, los resultados están alineados con los resultados observados en los FRCV. Tanto los niveles altos de colesterol como de HTA se relacionaban positivamente con el DCL. En este sentido cabe remarcar que existe una evidencia clara en la relación existente entre hipercolesterolemia (≥6,5mmol/l) e hiperlipidemia y el mayor riesgo de presentar DCL y demencia. Por tanto, el control de los niveles de colesterol se vuelve a establecer como clave en la prevención de las alteraciones cognitivas34. También se ha observado una relación entre la PAD y el DCL, de conformidad con estudios previos que relacionan la HTA con el riesgo de desarrollar DCL18,24. Aun así, cabe destacar que son los niveles altos de PAD los que se relacionan con este mayor riesgo y no la PAS. Tsivgoulis et al. (2009) tampoco identificaron ninguna asociación entre la PAS y el deterioro cognitivo, pero sí, en cambio, con la PAD35. Parece ser que los niveles elevados de PAD fomentan lesiones isquémicas a nivel cerebral, lo que podría conllevar atrofia vascular cerebral y, por tanto, potenciar el deterioro cognitivo en estos pacientes. Además, se ha observado que los niveles elevados de PAD (y no PAS) son un predictor independiente de la progresión de la hiperintensidad de la materia blanca en pacientes con EA de edad avanzada36.
También se ha observado que mantener niveles normales o elevados de ácido fólico puede reducir el deterioro cognitivo debido a la reducción de los niveles de homocisteína y el consiguiente daño oxidativo37,38. Esto podría explicar la correlación entre el MMSE y los niveles de ácido fólico basales ligeramente elevados observados en nuestro estudio.
La identificación de estos factores es importante, puesto que los marcadores modificables en el ámbito de la AP permiten una mejor prognosis39,40. Por tanto, es importante reforzar el control de todos estos parámetros desde AP para beneficiar la salud cognitiva de nuestros pacientes. El papel del médico de AP es fundamental para proporcionar una intervención en el estilo de vida y un apoyo a largo plazo para controlar los factores de riesgo del paciente. Asimismo, los datos clínicos recabados desde AP en la historia clínica se establecen como básicos a la hora de monitorizar más estrictamente estos pacientes para una rápida derivación a centros especializados41–43. Hubiese sido interesante conocer los valores de la TA y perfil lipídico de los pacientes en las etapas medias de la vida, que son los que condicionan el estado cognitivo en las edades más avanzadas. La naturaleza transversal del estudio ha imposibilitado conocer la influencia de este factor.
Este estudio presenta algunas limitaciones que se deben mencionar. Primeramente, la propia naturaleza del estudio, transversal, observacional, hace que estos resultados deban ser considerados con precaución, pues pueden haber estado sometidos a diferentes sesgos que pueden haber afectado a los resultados. Aun así, los medios estadísticos empleados nos han permitido establecer las variables que más robustamente estaban correlacionadas con los valores bajos en el MMSE, evitando el peso de variables confusoras. También la elección de la variable dependiente puede ser percibida como una limitación. Se sabe que el concepto de deterioro cognitivo es clínico, no psicométrico, y por tanto no podemos establecer la puntuación MMSE como diagnóstico preciso de DCL. Además, la utilidad del MMSE se puede ver entorpecida por numerosas e importantes limitaciones, fundamentalmente su falta de estandarización, el no poder ser aplicado a analfabetos y la gran influencia en sus resultados de las variables socioeducativas44. Aun así, sigue siendo considerado como la manera más objetiva y práctica que se dispone en nuestro ámbito para valorar la sospecha de presencia de DCL. Por último, la representatividad de los resultados podría verse amenazada debido a la utilización de un muestreo oportunista, al haber obtenido la muestra en consultas de AP. Sin embargo, consideramos que no existen razones fundamentales entre los individuos accesibles y el total de la población que pudieran suponer un sesgo de selección.
En conclusión nuestro estudio confirma la importancia que tiene el control de determinados FRCV en AP con el fin de disminuir la incidencia del DCL y por ende de la demencia. La hipercolesterolemia y la HTA se establecen como factores básicos que se deben controlar en nuestro ámbito para proteger la salud cognitiva de nuestros pacientes. Por este motivo, es importante dedicar más medios a este tipo de estudios que permitirán construir modelos teóricos, obtener un mayor conocimiento de los factores que inciden en el desarrollo del deterioro cognitivo y, sobre todo, orientar las medidas de prevención de demencia en un ámbito tan precoz como el de la AP.
FinanciaciónEste estudio ha sido financiado parcialmente por FERRER INTERNACIONAL, S.A..
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses. FERRER INTERNACIONAL, S.A. ha proporcionado asistencia técnica para la redacción del manuscrito.
Los autores agradecen la colaboración del Dr. José Lorenzo (FERRER INTERNACIONAL, S.A.) y Alba Gomez, PhD en la redacción del presente artículo.