Ofrecemos una revisión actualizada del tratamiento farmacológico del dolor neuropático con énfasis en las últimas recomendaciones basadas en la evidencia disponible. Los medicamentos propuestos como primera línea incluyen antidepresivos tricíclicos (particularmente amitriptilina), inhibidores de la recaptación de serotonina y noradrenalina (particularmente duloxetina), pregabalina y gabapentina. Los tratamientos de segunda línea comprenden los apósitos de lidocaína al 5% y parches de capsaicina al 8%, solamente para el dolor neuropático periférico, y el tramadol; mientras que los opioides potentes y la toxina botulínica A (para el dolor neuropático periférico) se consideran tratamientos de tercera línea. Futuras perspectivas engloban el desarrollo de nuevos fármacos y un abordaje terapéutico con un enfoque más personalizado, que es posible gracias a los recientes avances en la evaluación y comprensión del dolor neuropático.
We provide an updated review of the pharmacological treatment of neuropathic pain, with emphasis on the latest evidence-based recommendations. Drugs proposed as first line include tricyclic antidepressants (particularly amitriptyline), serotonin-noradrenaline reuptake inhibitors (particularly duloxetine), pregabalin and gabapentin. Second-line treatments include 5% lidocaine medicated plasters and capsaicin 8% patches, only for peripheral neuropathic pain and tramadol; whereas potent opioids and botulinum toxin A (for peripheral neuropathic pain) are considered third-line treatments. Future perspectives include the development of new drugs and a more personalised therapeutic approach, which is made possible by recent progress in the assessment and understanding of neuropathic pain.
En 1994 el dolor neuropático fue oficialmente definido por la Asociación Internacional para el Estudio del Dolor (International Association for the Study of Pain [IASP]) como el «dolor iniciado o causado por una lesión o disfunción primaria en el sistema nervioso». Esta definición fue ampliamente criticada, principalmente debido a la inclusión de los términos «disfunción» y «sistema nervioso», que fueron considerados demasiado indeterminados o poco precisos por muchos expertos. En este contexto, el grupo de interés especial en dolor neuropático de la IASP (NeuPSIG, por sus siglas en inglés, Special Interest Group on Neuropathic Pain) propuso una nueva definición en 2008, que recibió el respaldo de la IASP en 2011. Según esta nueva definición, el dolor neuropático es el «dolor causado por una lesión o enfermedad del sistema nervioso somatosensorial»1. En más de la mitad de los casos se localiza y afecta un área específica, claramente circunscrito a una zona del cuerpo (y hablamos de dolor neuropático localizado [DNL])2.
Por su elevada intensidad, cronicidad, capacidad de alterar de forma importante la calidad de vida del paciente y por el alto coste que genera, representa un problema sociosanitario de gran envergadura, que atañe a un grupo importante de población (5-8%), tanto en medio hospitalario como en Atención Primaria3–5. A esto se le suma la frecuente comorbilidad en forma de alteraciones del sueño, cansancio o pérdida de concentración, y que puede afectar considerablemente el estado de ánimo, la personalidad y las relaciones familiares y sociales del paciente. Todo ello, junto a la dificultad en el tratamiento, bien por falta de respuesta analgésica o por mala tolerabilidad a los analgésicos utilizados, complica el cuadro clínico6–7. Diferentes publicaciones refieren además que la mayoría de estos pacientes se encuentran infratratados, lo que aumenta el coste sanitario y la frustración de los profesionales y los pacientes8.
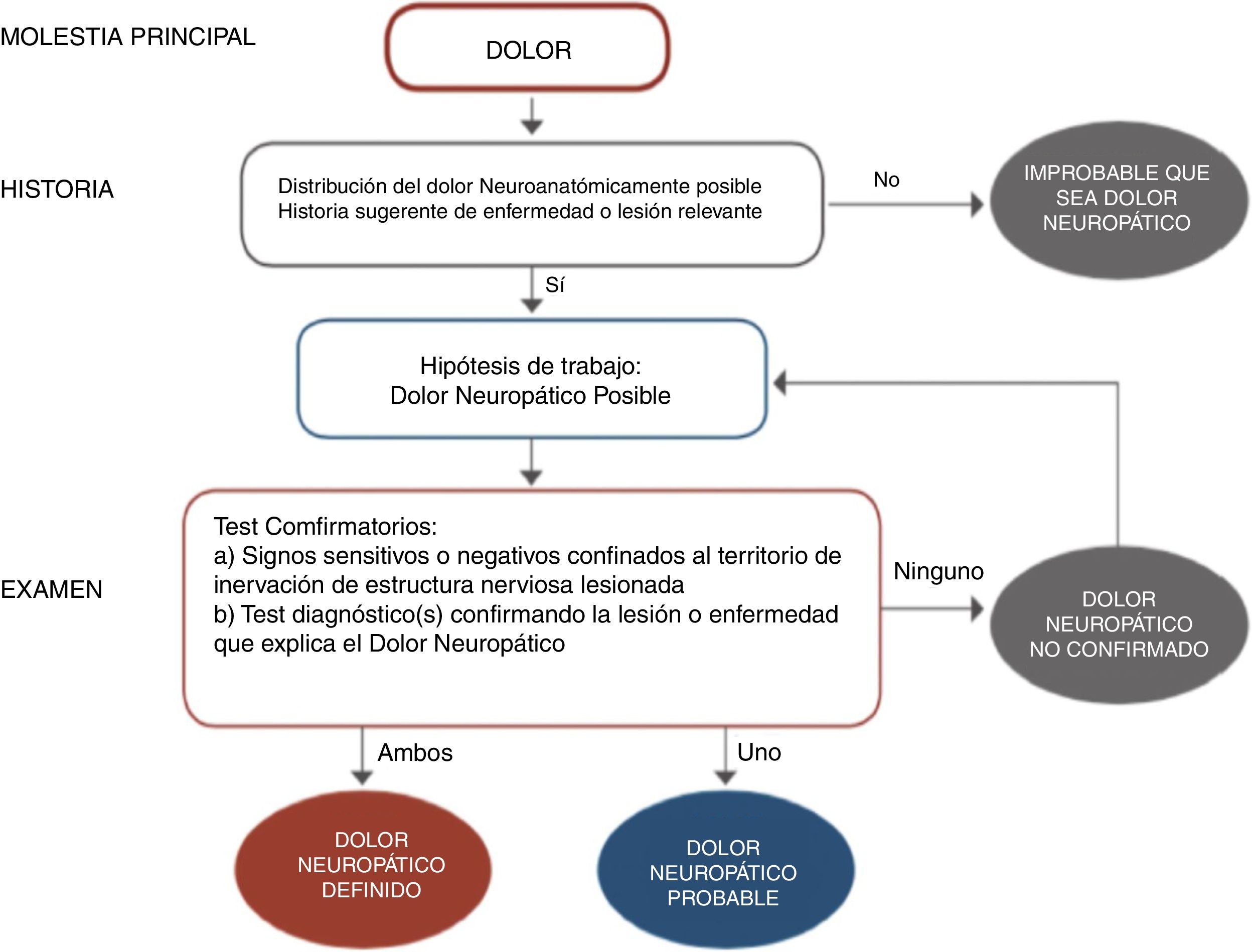
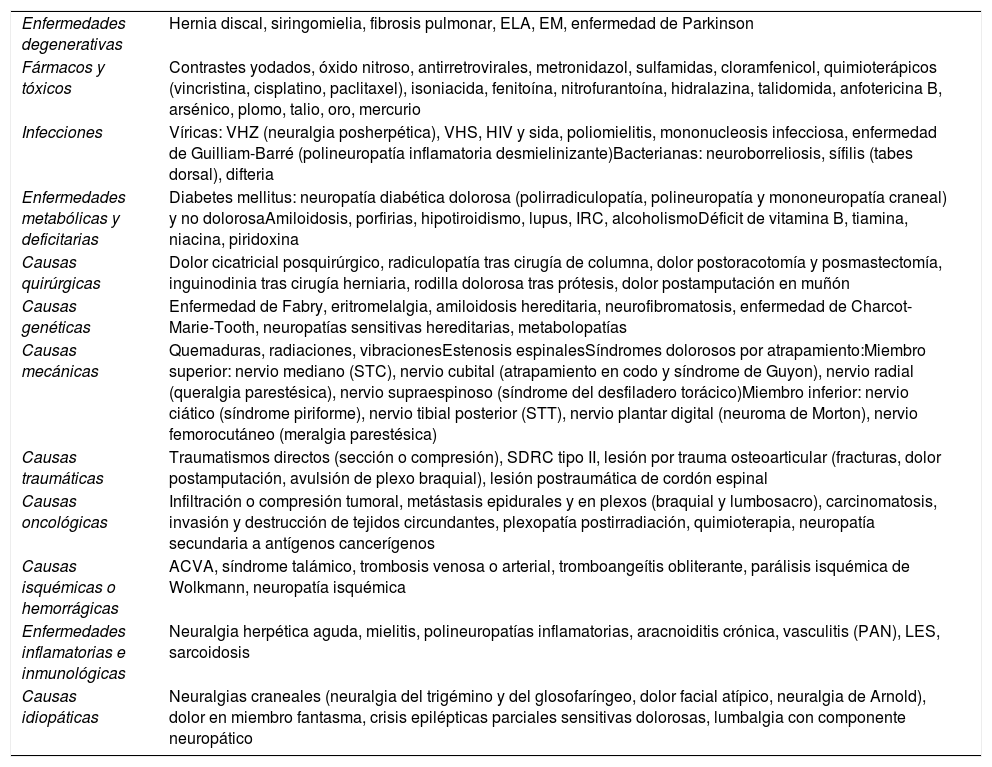
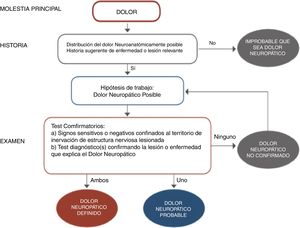
El diagnóstico es prioritario para iniciar un adecuado tratamiento y, aunque no sea dificultoso, requiere un mínimo de tiempo y experiencia. La frecuente y florida sintomatología neurológica, relacionada tanto con hipersensibilidad como hiposensibilidad (parestesias, disestesias, hiperalgesia, alodinia, zonas entumecidas e incluso paresias…) tienen que hacer sospechar un cuadro de dolor neuropático (fig. 1). Hoy en día la disponibilidad de algunos cuestionarios fáciles específicos para dolor neuropático periférico ha ayudado en este sentido9–10. La diversidad de cuadros clínicos que pueden cursar con un componente de dolor neuropático, sobre todo a nivel periférico, quedan descritos en las tablas 1 y 210–11.
Diagrama de flujo para el diagnóstico de dolor neuropático.
Adaptada de Alcántara Montero10.
Etiología del dolor neuropático periférico
| Enfermedades degenerativas | Hernia discal, siringomielia, fibrosis pulmonar, ELA, EM, enfermedad de Parkinson |
| Fármacos y tóxicos | Contrastes yodados, óxido nitroso, antirretrovirales, metronidazol, sulfamidas, cloramfenicol, quimioterápicos (vincristina, cisplatino, paclitaxel), isoniacida, fenitoína, nitrofurantoína, hidralazina, talidomida, anfotericina B, arsénico, plomo, talio, oro, mercurio |
| Infecciones | Víricas: VHZ (neuralgia posherpética), VHS, HIV y sida, poliomielitis, mononucleosis infecciosa, enfermedad de Guilliam-Barré (polineuropatía inflamatoria desmielinizante)Bacterianas: neuroborreliosis, sífilis (tabes dorsal), difteria |
| Enfermedades metabólicas y deficitarias | Diabetes mellitus: neuropatía diabética dolorosa (polirradiculopatía, polineuropatía y mononeuropatía craneal) y no dolorosaAmiloidosis, porfirias, hipotiroidismo, lupus, IRC, alcoholismoDéficit de vitamina B, tiamina, niacina, piridoxina |
| Causas quirúrgicas | Dolor cicatricial posquirúrgico, radiculopatía tras cirugía de columna, dolor postoracotomía y posmastectomía, inguinodinia tras cirugía herniaria, rodilla dolorosa tras prótesis, dolor postamputación en muñón |
| Causas genéticas | Enfermedad de Fabry, eritromelalgia, amiloidosis hereditaria, neurofibromatosis, enfermedad de Charcot-Marie-Tooth, neuropatías sensitivas hereditarias, metabolopatías |
| Causas mecánicas | Quemaduras, radiaciones, vibracionesEstenosis espinalesSíndromes dolorosos por atrapamiento:Miembro superior: nervio mediano (STC), nervio cubital (atrapamiento en codo y síndrome de Guyon), nervio radial (queralgia parestésica), nervio supraespinoso (síndrome del desfiladero torácico)Miembro inferior: nervio ciático (síndrome piriforme), nervio tibial posterior (STT), nervio plantar digital (neuroma de Morton), nervio femorocutáneo (meralgia parestésica) |
| Causas traumáticas | Traumatismos directos (sección o compresión), SDRC tipo II, lesión por trauma osteoarticular (fracturas, dolor postamputación, avulsión de plexo braquial), lesión postraumática de cordón espinal |
| Causas oncológicas | Infiltración o compresión tumoral, metástasis epidurales y en plexos (braquial y lumbosacro), carcinomatosis, invasión y destrucción de tejidos circundantes, plexopatía postirradiación, quimioterapia, neuropatía secundaria a antígenos cancerígenos |
| Causas isquémicas o hemorrágicas | ACVA, síndrome talámico, trombosis venosa o arterial, tromboangeítis obliterante, parálisis isquémica de Wolkmann, neuropatía isquémica |
| Enfermedades inflamatorias e inmunológicas | Neuralgia herpética aguda, mielitis, polineuropatías inflamatorias, aracnoiditis crónica, vasculitis (PAN), LES, sarcoidosis |
| Causas idiopáticas | Neuralgias craneales (neuralgia del trigémino y del glosofaríngeo, dolor facial atípico, neuralgia de Arnold), dolor en miembro fantasma, crisis epilépticas parciales sensitivas dolorosas, lumbalgia con componente neuropático |
ACVA: accidente cerebrovascular agudo; ELA: esclerosis lateral amiotrófica; EM: esclerosis múltiple; HIV: virus de la inmunodeficiencia humana; IRC: insuficiencia renal crónica; LES: lupus eritematoso sistémico; PAN: panarteritis nodosa; SDRC: síndrome de dolor regional complejo; sida: síndrome de inmunodeficiencia adquirida; STC: síndrome del túnel carpiano; STT: síndrome del túnel tarsiano; VHS: virus herpes simple; VHZ: virus herpes zóster.
Causas más frecuentes de dolor neuropático según su localización
| Dolor neuropático central | |
|---|---|
| Mielopatías y mielitis | Hematomielia, EM, déficit de vitamina B12, sífilis (tabes dorsal), cirugía, discopatía, isquemia e infarto, compresión por estenosis medular, posradiación, por HIV, traumatismos con lesión en cordón espinal, aracnoiditis |
| Lesiones talámicas | Neoplasias, enfermedades desmielinizantes, cirugía, lesiones vasculares como ictus, cirugía |
| Injuria cortico-subcortical | Lesiones traumáticas, vasculares como malformaciones arteriovenosas, tumores |
| Lesiones cerebrales | EM, siringomielia, ictus, convulsiones, tuberculoma, dolor de miembro fantasma, aracnoiditis, enfermedad de Parkinson |
| Dolor neuropático periférico | |
|---|---|
| Mononeuropatías | NPH, diabética, traumática, neuropatía del trigémino y del glosofaríngeo, STC y otras neuropatías por atrapamiento, por invasión neoplásica, traumáticas, posquirúrgicas |
| Polineuropatías | Metabólicas, tóxicas, infecciosas, farmacológicas, hereditarias, traumáticas |
| Plexopatías | Compresivas, neuromas, tumorales, por hernias discales |
| Radiculopatías | Cervical, dorsal, lumbosacraHernia discal, compresión, aracnoiditis |
| Afectación ganglios raíces | Herpes zóster |
| Afectación asta dorsal | Lesiones por avulsión |
EM: esclerosis múltiple; HIV: virus de la inmunodeficiencia humana; NPH: neuralgia posherpética; STC: síndrome del túnel carpiano.
Adaptada de Alcántara Montero10.
Numerosas recomendaciones terapéuticas para el dolor neuropático se han propuesto en la última década12–16. El NeuPSIG de la IASP publicó en 2015 una guía para el tratamiento farmacológico del dolor neuropático basada en una revisión sistemática y metaanálisis de ensayos publicados y no publicados17, excluyendo la neuralgia del trigémino para la cual han sido publicadas guías específicas18–19. Dichas recomendaciones incluyeron estudios aleatorizados, controlados con placebo, doble ciego con fármacos utilizados por vía oral o tópica en dosis repetidas, excepto para aquellos agentes con eficacia a largo plazo después de una única aplicación (por ejemplo, parches de capsaicina al 8%), y se utilizó el sistema Grading of Recommendations, Assessment, Development and Evaluation (GRADE) para calificar la calidad de la evidencia y la fuerza de las recomendaciones. En esta revisión resumiremos las principales recomendaciones de estas guías, los nuevos medicamentos en desarrollo, y los nuevos retos que se presentan en el manejo terapéutico del dolor neuropático.
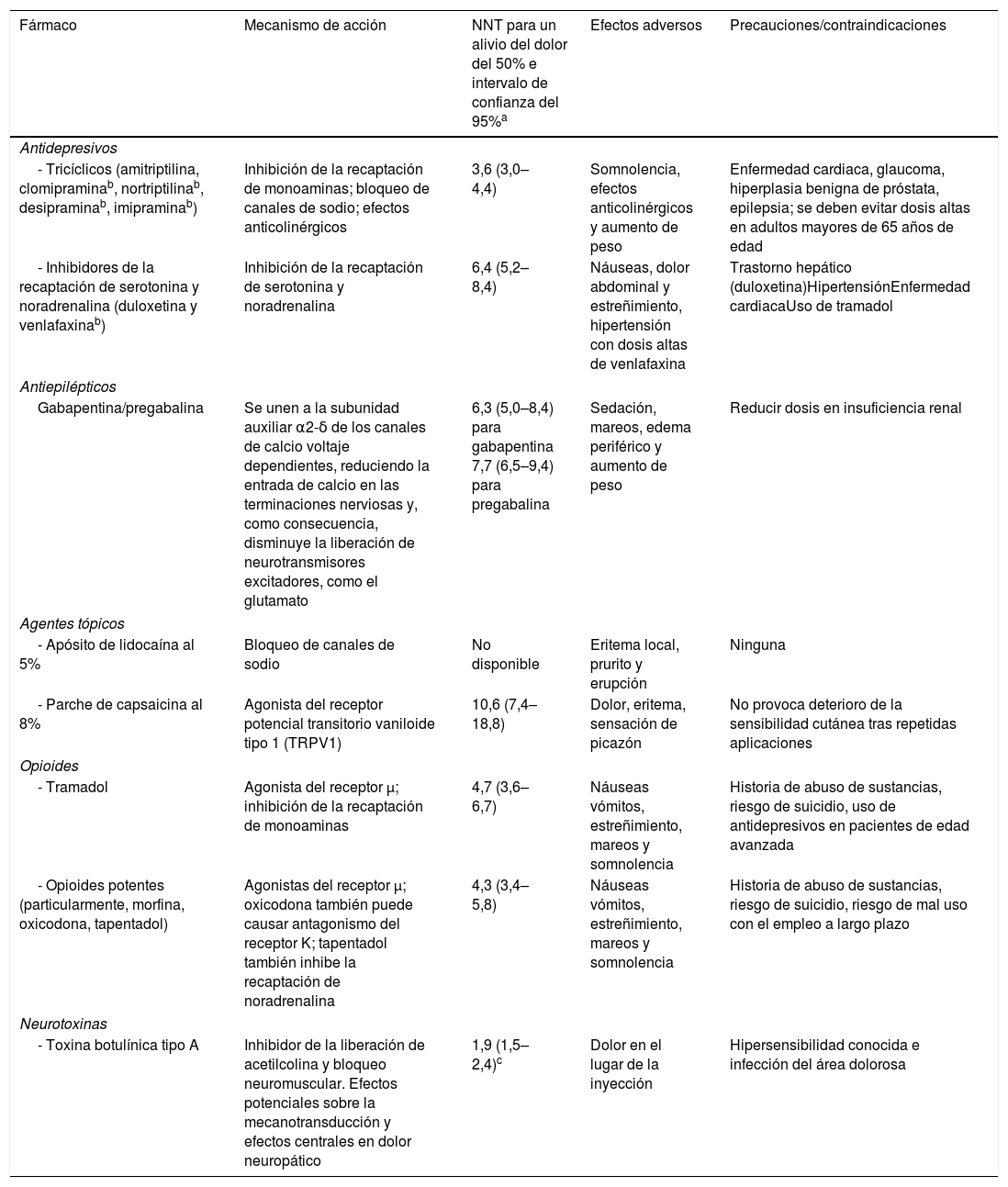
Fármacos actualmente recomendados en dolor neuropáticoFármacos recomendados en primera línea (Recomendación Fuerte según el sistema GRADE)17Los antidepresivos tricíclicos (ADT), especialmente amitriptilina, y los inhibidores de la recaptación de serotonina y noradrenalina (IRSN), en particular duloxetina, han confirmado su eficacia en varias condiciones de dolor neuropático y se recomiendan en primera línea (tabla 3)10,17. Los ADT e IRSN actúan inhibiendo la recaptación de serotonina y noradrenalina, aumentando así el control inhibitorio. Los ADT también actúan sobre los canales de sodio, receptores beta 2 adrenérgicos, receptores opioides y tienen efecto antagonista sobre el receptor N-metil-D-aspartato (NMDA), así como efectos anticolinérgicos y antihistamínicos20–21.
Recomendaciones en el tratamiento del dolor neuropático
| Fármaco | Mecanismo de acción | NNT para un alivio del dolor del 50% e intervalo de confianza del 95%a | Efectos adversos | Precauciones/contraindicaciones |
|---|---|---|---|---|
| Antidepresivos | ||||
| - Tricíclicos (amitriptilina, clomipraminab, nortriptilinab, desipraminab, imipraminab) | Inhibición de la recaptación de monoaminas; bloqueo de canales de sodio; efectos anticolinérgicos | 3,6 (3,0–4,4) | Somnolencia, efectos anticolinérgicos y aumento de peso | Enfermedad cardiaca, glaucoma, hiperplasia benigna de próstata, epilepsia; se deben evitar dosis altas en adultos mayores de 65 años de edad |
| - Inhibidores de la recaptación de serotonina y noradrenalina (duloxetina y venlafaxinab) | Inhibición de la recaptación de serotonina y noradrenalina | 6,4 (5,2–8,4) | Náuseas, dolor abdominal y estreñimiento, hipertensión con dosis altas de venlafaxina | Trastorno hepático (duloxetina)HipertensiónEnfermedad cardiacaUso de tramadol |
| Antiepilépticos | ||||
| Gabapentina/pregabalina | Se unen a la subunidad auxiliar α2-δ de los canales de calcio voltaje dependientes, reduciendo la entrada de calcio en las terminaciones nerviosas y, como consecuencia, disminuye la liberación de neurotransmisores excitadores, como el glutamato | 6,3 (5,0–8,4) para gabapentina 7,7 (6,5–9,4) para pregabalina | Sedación, mareos, edema periférico y aumento de peso | Reducir dosis en insuficiencia renal |
| Agentes tópicos | ||||
| - Apósito de lidocaína al 5% | Bloqueo de canales de sodio | No disponible | Eritema local, prurito y erupción | Ninguna |
| - Parche de capsaicina al 8% | Agonista del receptor potencial transitorio vaniloide tipo 1 (TRPV1) | 10,6 (7,4–18,8) | Dolor, eritema, sensación de picazón | No provoca deterioro de la sensibilidad cutánea tras repetidas aplicaciones |
| Opioides | ||||
| - Tramadol | Agonista del receptor μ; inhibición de la recaptación de monoaminas | 4,7 (3,6–6,7) | Náuseas vómitos, estreñimiento, mareos y somnolencia | Historia de abuso de sustancias, riesgo de suicidio, uso de antidepresivos en pacientes de edad avanzada |
| - Opioides potentes (particularmente, morfina, oxicodona, tapentadol) | Agonistas del receptor μ; oxicodona también puede causar antagonismo del receptor K; tapentadol también inhibe la recaptación de noradrenalina | 4,3 (3,4–5,8) | Náuseas vómitos, estreñimiento, mareos y somnolencia | Historia de abuso de sustancias, riesgo de suicidio, riesgo de mal uso con el empleo a largo plazo |
| Neurotoxinas | ||||
| - Toxina botulínica tipo A | Inhibidor de la liberación de acetilcolina y bloqueo neuromuscular. Efectos potenciales sobre la mecanotransducción y efectos centrales en dolor neuropático | 1,9 (1,5–2,4)c | Dolor en el lugar de la inyección | Hipersensibilidad conocida e infección del área dolorosa |
El número necesario a tratar (NNT) para el alivio del dolor del 50% en los ensayos controlados con placebo representa el número de pacientes necesarios a tratar para que uno tenga un alivio significativo del dolor en comparación con el placebo. Cuanto mayor sea el NNT, menor será la proporción de respondedores en comparación con el placebo (17).
Uso no aprobado para la indicación en «dolor neuropático» en España y, por lo tanto, cualquier uso en dolor neuropático debe considerarse «off label».
Este número proviene de ensayos clínicos pequeños de baja a moderada calidad y puede haber sido sobreestimado. Un ensayo clínico no publicado fue negativo (NNT desconocido) y el NNT en un ensayo clínico posterior al metanálisis fue de 7,3 (IC 95%: 3,0–16,6) (39).
Adaptada de Alcántara Montero10, Finnerup et al.17 y Attal et al.20.
Los efectos secundarios incluyen somnolencia, mareos, sequedad de boca e hipotensión ortostática. Los ADT pueden causar una prolongación del intervalo QT, por lo que se recomienda realizar un ECG antes de iniciar el tratamiento, especialmente en los ancianos22. Aunque la amitriptilina ha sido la más estudiada, y es la única que tiene indicación según la Agencia Europea de Medicamentos (EMA) y la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), todos los ADT tienen una eficacia similar en dolor neuropático. Las aminas secundarias (nortriptilina, desipramina) tienen menos efectos secundarios sedantes. Las aminas terciarias (amitriptilina, imipramina, clomipramina) no se recomiendan en dosis superiores a 75mg/día en pacientes mayores de 65 años debido a sus efectos sedantes, anticolinérgicos y riesgo de caídas22.
La eficacia de pregabalina y gabapentina está bien establecida para el tratamiento del dolor neuropático periférico, siendo la pregabalina el único fármaco con indicación en dolor neuropático central. Sus efectos analgésicos se relacionan principalmente con una disminución de la sensibilización central mediante la unión a la subunidad α2-δ de los canales de calcio voltaje dependientes23. Un efecto adicional de pregabalina o gabapentina combinada con ADT u opioides en comparación con la monoterapia se ha informado en varios ensayos clínicos24–26. Sin embargo, en un gran ensayo clínico con un diseño que refleja la práctica clínica, la eficacia y el perfil de efectos secundarios de la monoterapia en dosis altas (600mg de pregabalina o 120mg de duloxetina) fueron similares a los de la terapia de combinación en dosis moderadas (300mg de pregabalina y 60mg duloxetina diariamente) en pacientes con dolor neuropático periférico diabético que no respondieron a la monoterapia con pregabalina o duloxetina en dosis estándar (300mg/día de pregabalina o 60mg / día de duloxetina)27. Mareos y somnolencia son los efectos secundarios más frecuentes y las dosis deben ajustarse en pacientes con insuficiencia renal.
Fármacos recomendados en segunda línea (Recomendación Débil según el sistema GRADE)17Los tratamientos de segunda línea incluyen agentes tópicos para el dolor neuropático periférico (tabla 3)17. Los apósitos de lidocaína al 5% producen un efecto analgésico local al inhibir los canales de sodio voltaje-dependientes de los nervios dañados por la lesión. Estos canales ectópicos son estabilizados por la lidocaína, produciéndose de este modo analgesia sin efecto anestésico local asociado28. Los apósitos contienen lidocaína al 5%, conteniendo 700mg de principio activo por apósito. El área dolorosa debe cubrirse con el apósito una vez al día durante un intervalo de tiempo que, como máximo, debe ser de 12 horas. Los apósitos pueden cortarse en tamaños más pequeños antes de retirar la lámina de liberación. No deben utilizarse más de tres apósitos de 14 × 10cm al mismo tiempo (o sobre una superficie total mayor de 420cm2). Presentan una excelente tolerabilidad y buena eficacia. Debido a la escasa absorción su tolerabilidad sistémica es buena, aunque se puede producir algún efecto irritativo local, y el potencial de interacciones es mínimo. Los apósitos deben aplicarse sobre zonas de piel intacta, seca, no irritada y sin pelos. No debe aplicarse sobre áreas de piel inflamada o lesionada, heridas, dermatitis atópica o mucosas. Están indicados en el alivio sintomático del dolor neuropático asociado a infección previa por herpes zóster (neuralgia posherpética)29, pero han demostrado su utilidad fuera de indicación en otros modelos de DNL, como la polineuropatía diabética, polineuropatía sensorial idiopática, y dolor posquirúrgico y postraumático, disminuyendo el tamaño de la zona de alodinia asociado al DNL30.
La capsaicina es un agonista selectivo del receptor de potencial transitorio vaniloide tipo 1 (TRPV1). El estímulo inicial de estos receptores cutáneos produce dolor y eritema, causados por la liberación de neuropéptidos vasoactivos, sustancia P (SP), para posteriormente producirse una depleción de SP y desensibilización de los nociceptores cutáneos, que pierden parte de su sensibilidad a diversos estímulos31. El parche de capsaicina al 8%, 179mg capsaicina por parche, se aplica sobre la piel durante 30 o 60 minutos, dependiendo de la localización del dolor. Se podrá administrar un anestésico tópico en la zona de tratamiento o se le puede administrar un analgésico oral al paciente antes de aplicar este parche, para reducir las posibles molestias propias de la aplicación. El anestésico tópico deberá cubrir toda la zona de tratamiento con el parche de capsaicina 8% más un borde de 1 a 2cm. En los ensayos clínicos los pacientes recibieron pretratamiento con lidocaína tópica (4%), lidocaína (2,5%)/prilocaína (2,5%) o con 50mg de tramadol. Hasta cuatro parches pueden ser aplicados en un mismo momento y el tratamiento se puede repetir cada 3 meses tantas veces como sea necesario32. En la práctica clínica proporciona un alivio del dolor rápido y sostenido en pacientes con diversas condiciones de neuropático periférico, y reduce significativamente la prescripción de medicación analgésica concomitante33–34. Los principales efectos adversos son transitorios, reacciones locales, en el lugar de aplicación, principalmente dolor y eritema32.
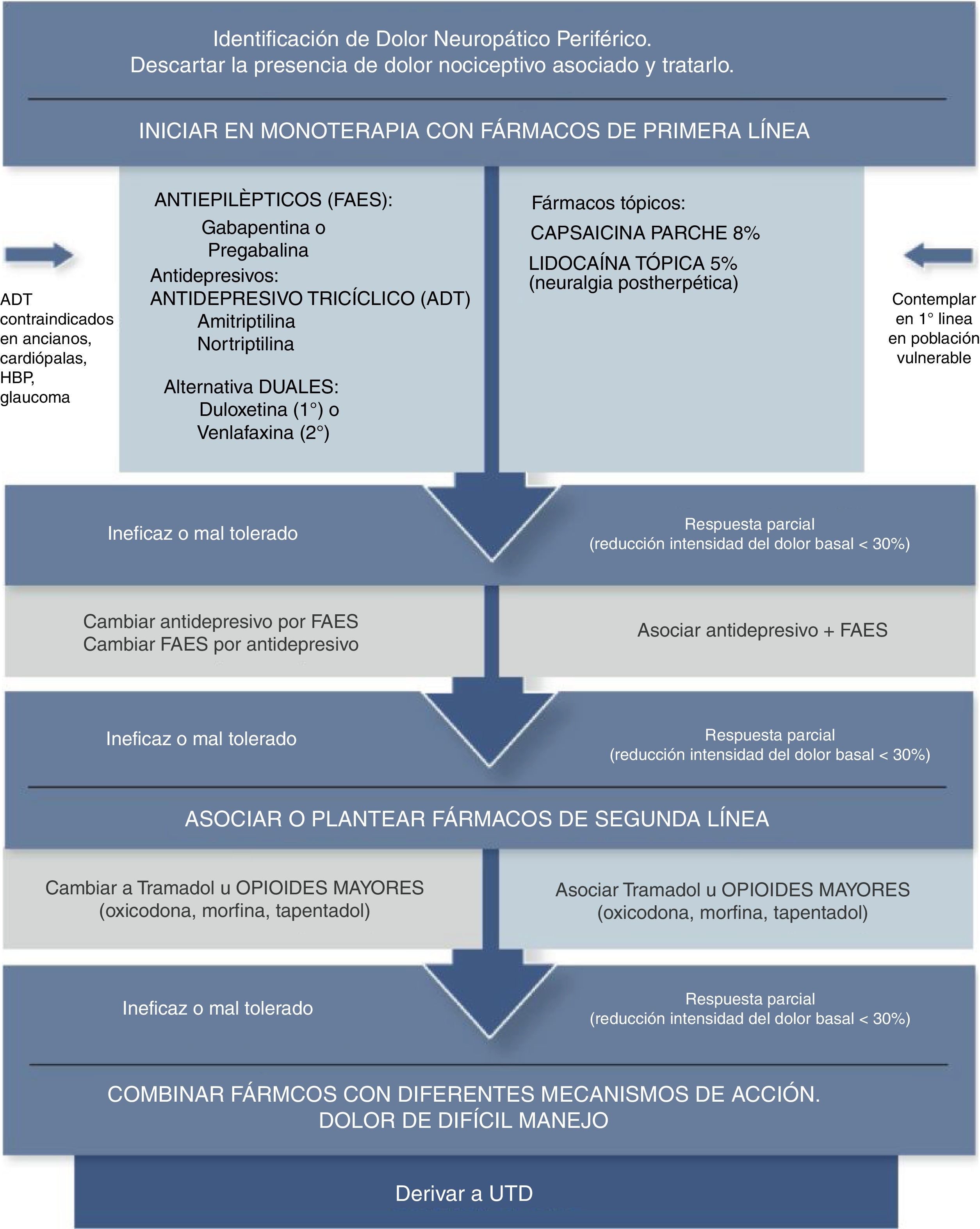
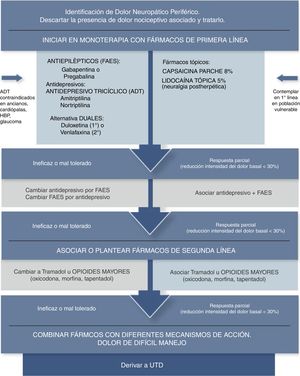
Algunos autores señalan que los tratamientos tópicos deben ser considerados como primera línea en manejo del DNL y en población vulnerable (ancianos, polimedicados, comorbilidades, etc.), debido a que la relación beneficio/riesgo es mucho mejor que la de los agentes sistémicos. La aplicación tópica se presenta como un tratamiento local, con una menor dosis total sistémica y evita el primer paso hepático, lo que reduce el riesgo de eventos adversos e interacciones farmacológicas34–37 (fig. 2).
Algoritmo analgésico de dolor neuropático periférico en Atención Primaria Adaptada de Alcántara Montero10.UTD: Unidad de Tratamiento del Dolor.
El tramadol, un opioide débil que inhibe la recaptación de serotonina y noradrenalina, ha demostrado ser beneficioso principalmente en dolor neuropático periférico (tabla 3). Se recomienda este medicamento como segunda línea, principalmente debido al riesgo potencial de abuso (aunque menos que con opioides potentes) y riesgo de confusión y somnolencia, particularmente en los ancianos17. Tramadol debe ser utilizado con precaución en asociación con antidepresivos17.
Fármacos recomendados en tercera línea (Recomendación Débil según el sistema GRADE)17Los opioides potentes, particularmente oxicodona, morfina y tapentadol, son moderadamente eficaces en el tratamiento del dolor neuropático periférico. Además, existe preocupación por el aumento de la prescripción, sobredosis, mal uso y morbilidad asociada a opioides38. Por lo tanto, estos medicamentos se recomiendan como tercera línea de tratamiento (tabla 3)17.
La toxina botulínica tipo A (BTX-A), una potente neurotoxina comúnmente utilizada para el tratamiento de la hiperactividad muscular focal, ha demostrado su eficacia hasta tres meses después de su administración en un conjunto de inyecciones únicas, posiblemente a través de un efecto central (tabla 3). Un ensayo clínico reciente a gran escala ha confirmado la eficacia de administraciones repetidas durante seis meses, con mejores efectos tras la segunda inyección39. La BTX-A es administrada por vía subcutánea en dosis de 50 a 200 UI repartidas sobre el área del dolor en el ámbito de atención especializada. La inyección es dolorosa, por lo que anestésicos locales y la inhalación de óxido nitroso al 50% y oxígeno pueden usarse antes y durante todo el tratamiento para minimizar el dolor39. Además del dolor sobre la zona de aplicación, el tratamiento generalmente se considera seguro aunque hay evidencia limitada de estudios a largo plazo. La BTX-A debe ser utilizada por especialistas como última opción en casos refractarios de dolor neuropático periférico y en zonas limitadas de dolor17.
En la tabla 4 se recogen la dosis diaria total y régimen de dosis de los fármacos recomendados en el tratamiento del dolor neuropático10,17.
Dosis diaria total y régimen de dosis de los fármacos recomendados en el tratamiento del dolor neuropático
| Dosis diaria total y régimen de dosis | Recomendaciones | |
|---|---|---|
| Recomendación fuerte de uso | ||
| Antidepresivos tricíclicos | Amitriptilina: 25-150mg, una vez al día o dividido en dos dosis | Primera línea |
| Antidepresivos inhibidores de la recaptación de serotonina y noradrenalina | Duloxetina: 60 a 120mg, una vez al día.Venlafaxina: 150–225mg, una vez al día (comprimidos de liberación prolongada) | Primera línea |
| Gabapentina | 1200–3600mg, dividida en tres dosis | Primera línea |
| Pregabalina | 300–600mg, dividida en dos dosis | Primera línea |
| Recomendación débil de uso | ||
| Tramadol | 200–400mg, divididas en una/dos (comprimidos de liberación prolongada)o tres dosis (cápsulas de liberación normal) | Segunda línea |
| Apósito de lidocaína al 5% | 1-3 apósitos en la región dolorosa una vez al día durante 12 h | Segunda línea (dolor neuropático periférico) |
| Parche de capsaicina al 8% | 1-4 parches en el área dolorosa durante 30-60min cada 3 meses | Segunda línea (dolor neuropático periférico) |
| Opioides potentes | Titulación individual | Tercera línea |
| Toxina botulínica tipo A (administración subcutánea) | 50–200 UI en el área dolorosa cada 3 meses | Tercera línea: uso por especialistas (dolor neuropático periférico) |
Estudios con otros antiepilépticos distintos de los ligandos α2-δ de los canales de calcio (por ejemplo, topiramato, oxcarbazepina, carbamazepina, acetato de eslicarbazepina, valproato, lacosamida, levetiracetam) han reportado resultados negativos, débiles o inconsistentes40–42, aunque medicamentos como la oxcarbazepina son probablemente efectivos en subgrupos de pacientes43. Los cannabinoides oromucosos (2,7mg delta-9-tetrahidro-cannabinol/2,5mg cannabidiol) han reportado una eficacia variable, particularmente en el dolor asociado a la esclerosis múltiple, pero varios ensayos clínicos no publicados fueron negativos en los objetivos primarios. Los resultados para los inhibidores selectivos de la recaptación de serotonina (ISRS), antagonistas de los receptores NMDA, mexiletina y clonidina tópica han sido generalmente inconsistentes o negativos17.
Nuevos fármacos en desarrollo clínico en dolor neuropáticoSe están desarrollando actualmente más de 100 moléculas que actúan en dianas específicas de potencial interés para el dolor44. En ellas están incluidas los antagonistas específicos de las isoformas de los canales de sodio, antagonistas de receptores vaniloides, agonistas de los canales de potasio, antagonistas de los receptores metabotrópicos del glutamato/NMDA o nuevos moduladores de los receptores NMDA, nuevos agonistas de receptores opioides, antagonistas del receptor H3 de la histamina, moduladores serotoninérgicos, agonistas nicotínicos, agonistas adrenérgicos, inhibidores de la óxido nítrico sintasa, antagonistas de los receptores de la orexina, antagonistas de los receptores de la angiotensina tipo II, agonistas del receptor I2 de imidazolinas, inhibidores de la apoptosis, agonistas del receptor cannabinoide CB2, antagonistas selectivos del receptor sigma-1, inhibidores de la amida hidrolasa de ácidos grasos, moléculas antifactor de crecimiento nervioso, terapia genética, etc.44.
Retos relacionados con el manejo terapéutico del dolor neuropáticoComo se ha comentado anteriormente, en los últimos años el número de estudios de investigación dedicados al dolor neuropático ha aumentado de forma considerable permitiendo el desarrollo de múltiples moléculas que actúan sobre nuevas dianas terapéuticas. Desafortunadamente la mayoría de estos fármacos potencialmente nuevos están en desarrollo preclínico temprano o han fracasado en los ensayos clínicos, aunque queda esperanza para algunos de ellos, como los antagonistas específicos de algunos subtipos de canales de sodio, antagonistas selectivos del receptor sigma-1, antagonistas de los receptores tipo 2 de la angiotensina II, etc.44. Una de las razones de estos resultados decepcionantes es el pobre valor predictivo de los modelos animales de dolor neuropático, lo que dificulta la extrapolación de los mecanismos descubiertos en los animales a los humanos. Este problema puede deberse a la naturaleza de los modelos en sí mismos (en general no replican completamente la enfermedad, siendo esencialmente modelos de síntomas), la naturaleza del comportamiento estudiado en los animales (el dolor evocado generalmente se estudia en los animales, mientras que el dolor espontáneo generalmente se evalúa en ensayos clínicos) y el sexo (predominio masculino en la investigación preclínica, mientras que ambos sexos están representados en la investigación clínica)45. Otras posibles explicaciones incluyen el hecho de que los mecanismos celulares y moleculares descritos en modelos animales de neuropatía afectan principalmente a los nervios sensoriales o la médula espinal, existiendo pocos estudios que investiguen los mecanismos cerebrales45. Estos problemas han llevado a varios científicos a proponer mejoras en la investigación preclínica sobre analgésicos. Los cambios sugeridos incluyen el refinamiento de las pruebas de comportamiento, el uso de modelos etológicos animales, la consideración de ambos sexos, la evaluación de condiciones comórbidas (como la ansiedad o los problemas cognitivos), el uso de la evaluación doble ciego y las investigaciones más exhaustivas de los efectos adversos45. Sin embargo, otra razón de las dificultades para extrapolar los hallazgos obtenidos en animales al dolor neuropático clínico en humanos se relaciona con las limitaciones de la investigación clínica.
Las disfunciones de los sistemas nociceptivos relacionados con una lesión neurológica confieren cualidades específicas de dolor que justifican la consideración del dolor neuropático como una entidad clínica, la cual ha demostrado ser multidimensional46. En particular, los estudios basados en cuestionarios de evaluación o pruebas sensoriales cuantitativas han proporcionado evidencia de la existencia de distintos subgrupos de pacientes en función de sus perfiles sensoriales (fenotipos), que se pueden observar en los síndromes de dolor neuropático y son independientes de la etiología47–48. Una de las hipótesis planteadas es que estos perfiles fenotípicos pueden ser sustitutos de los mecanismos fisiopatológicos subyacentes que no pueden explorarse directamente en los seres humanos. Varios estudios experimentales en pacientes con diversos tipos de lesiones nerviosas periféricas o centrales han demostrado correlaciones entre síntomas o combinaciones de síntomas (por ejemplo, dolor ardiente-quemante, dolor paroxístico) y marcadores objetivos de lesiones nerviosas49.
En la última década la mayoría de los expertos en dolor han defendido un enfoque terapéutico para el dolor neuropático basado en perfiles clínicos, valorando comorbilidades, como presencia de depresión, antecedentes de abuso de drogas, etc. Actualmente se acepta ampliamente que este enfoque personalizado debería reemplazar cada vez más la categorización tradicional del dolor neuropático basada en la etiología, el cual es responsable del fracaso del tratamiento en muchos pacientes48.
De acuerdo con estas hipótesis, varios estudios basados en cuestionarios de evaluación o pruebas sensoriales cuantitativas han demostrado que los diferentes analgésicos no actúan de manera uniforme sobre el dolor, sino que actúan de manera preferencial sobre signos o síntomas específicos, o combinaciones de signos y síntomas48–49. Otros estudios han sugerido que la respuesta a los fármacos para el dolor neuropático se puede predecir a partir de fenotipos clínicos. Un ejemplo de la relevancia de este enfoque lo proporciona el estudio realizado por Demant et al.43. Estos autores evaluaron el efecto del bloqueador de canales de sodio oxcarbazepina en pacientes con dolor neuropático periférico estratificado en función del fenotipo clínico. Un fenotipo, el fenotipo «nociceptor irritable», se caracterizó principalmente por un déficit térmico limitado en el área dolorosa, mientras que otro, el fenotipo del «dolor de desaferenciación» se caracterizó por un déficit térmico grave. El estudio encontró que los efectos de la oxcarbazepina fueron significativamente más fuertes contra el primero de estos fenotipos que contra el segundo43. Otro ejemplo interesante lo proporciona un estudio en tres centros sobre la administración repetida de BTX-A en pacientes con dolor neuropático periférico multietiológico, que mostró que la presencia o intensidad de alodinia al inicio del estudio se asoció con una respuesta significativamente más fuerte al fármaco activo39.
Desafortunadamente este enfoque terapéutico prometedor sigue siendo marginal, y la mayoría de los otros ejemplos de su utilidad potencial se basan en análisis post hoc49. Todavía se requieren ensayos multicéntricos a gran escala para proporcionar una demostración convincente de la relevancia de este enfoque para evaluar la eficacia de los fármacos que actúan sobre nuevas dianas terapéuticas en el dolor neuropático. También se requieren estudios que evalúen otros tipos de medidas de predicción. Un área de investigación prometedora a este respecto es el desarrollo de estudios terapéuticos utilizando el genotipado de pacientes. Por ejemplo, un ensayo clínico doble ciego controlado con placebo que utilizó un nuevo antagonista del canal de sodio Nav1.7 administrado como medicamento tópico en pacientes con neuralgia posherpética informó que solo los pacientes portadores del polimorfismo Nav1.7 R1150W respondían al fármaco50.
Para obtener un mayor conocimiento de los predictores de respuesta farmacológica, los ensayos clínicos futuros deberían obtener una descripción detallada del dolor del paciente de forma individual, incluyendo descriptores del dolor, signos sensoriales y factores psicosociales, e informar si alguno de estos factores está relacionado con el efecto. Esto podría generar hipótesis para ser examinadas en futuros ensayos clínicos, así como en revisiones sistemáticas y metaanálisis.
ConclusionesLa mayor parte de las guías de práctica clínica consultadas coinciden en señalar que los antidepresivos tricíclicos (particularmente amitriptilina), duales (particularmente duloxetina) y los antiepilépticos gabapentina/pregabalina, constituyen los fármacos de primera línea en el tratamiento del dolor neuropático (recomendación fuerte según el sistema GRADE), siendo el tramadol, los apósitos de lidocaína al 5% y parches de capsaicina al 8% fármacos de segunda línea (recomendación débil según el sistema GRADE), mientras que los opioides potentes constituirían una tercera línea de tratamiento (recomendación débil según el sistema GRADE) (fig. 2).
Por otro lado, la expansión del conocimiento en el dolor neuropático ha generado una serie de desafíos, como el desarrollo de nuevos fármacos basados en mecanismos fisiopatológicos investigados en animales, y el desarrollo de planteamientos terapéuticos óptimos en ensayos clínicos, más basados en enfoques personalizados que etiológicos.
Conflicto de interesesLos autores declaran no tener ningun conflicto de intereses.