La hepatitis autoinmune es una hepatopatía con impacto en la morbimortalidad de los pacientes. Pocos datos epidemiológicos existen sobre esta en Latinoamérica y Colombia.
ObjetivosDescribir las características demográficas, clínicas y de laboratorio de los pacientes con hepatitis autoinmune; el tratamiento y la respuesta al mismo, la evolución y curso de la enfermedad, requerimiento de trasplante hepático y mortalidad.
MétodosEstudio retrospectivo que incluyó una cohorte histórica de pacientes atendidos en un hospital universitario de Medellín, Colombia entre enero de 2010 y diciembre de 2016 con ≥16 años de edad al momento del diagnóstico de hepatitis autoinmune. Se recolectó la información a partir del registro de historias clínicas. Análisis estadístico utilizando SPSS versión 20.
ResultadosSe incluyeron 278 pacientes, el 90% eran mujeres, la mediana de edad al diagnóstico fue de 50 años. Un 37,8% estaban cirróticos al momento del diagnóstico. La remisión bioquímica fue del 85%. En los pacientes que progresaron a cirrosis se encontró una mayor proporción de hombres (21,2 vs. 7,8%, p=0,027), una mayor frecuencia de síndrome de solapamiento HAI-CEP (6,0 vs. 0%, p=0,006), una menor remisión bioquímica (57,6 vs. 89%, p=<0,001) y una mayor frecuencia de no respuesta al tratamiento (12,1 vs. 1,6%, p=0,004).
ConclusiónLa hepatitis autoinmune no es infrecuente en la población colombiana, predomina en mujeres pero tiene un comportamiento desfavorable en hombres. Un importante número de pacientes están cirróticos al momento del diagnóstico, la respuesta al tratamiento y complicaciones en nuestra población son similares a las descritas mundialmente.
Autoimmune hepatitis is a chronic liver disease that impacts on morbidity and mortality of patients. Few epidemiological data exist of this in Latin America and Colombia.
ObjectivesThe aim of this study is to describe the demographic, clinical and laboratory characteristics of the patients; the treatment and the response to it, the evolution and course of the disease, requirement of liver transplantation and mortality.
MethodsHistorical cohort study that include patients attended at an University Hospital in Medellin, Colombia between January 2010 and December 2016 with ≥16 years age at the time of diagnosis of autoimmune hepatitis. Data collection was done from the review of medical records. Statistical analysis was performed using SPSS version 20.
ResultsThe study included 278 patients, 90% of the patients were women, the median age at diagnosis was 50 years. 37.8% were cirrhotic at the time of diagnosis. The biochemical remission was 85%. In patients who developed cirrhosis it was found a higher proportion of men (21.2 vs. 7.8%, p=.027), a greater frequency of overlap autoimmune-primary sclerosant cholangitis (6.0 vs. 0% p=.006) and a greater frequency of non-response to treatment (12.1 vs. 1.6%, p=.004).
ConclusionAutoimmune hepatitis is not a rare disease in Colombian population; it predominates in women but has a less favourable course in men. An important number of patients are cirrhotic at the time of diagnosis, the response to treatment and complications in our population are similar to those described worldwide.
La hepatitis autoinmune (HAI) es una hepatopatía crónica de etiología desconocida descrita por primera vez por el Dr. Waldenström en 19501, produce impacto tanto en la morbimortalidad de los afectados así como carga económica en los sistemas de salud2, es una fuente potencial de falla hepática aguda y de progresión a cirrosis hepática3,4.
Se conoce una base de autoinmunidad en su fisiopatología similar a otras enfermedades autoinmunes, con reconocimiento de antígenos propios y una pérdida de tolerancia inmune generando una respuesta inmune contra los tejidos, siendo el hígado el principal comprometido4. Predomina en mujeres con una proporción de afectación mujer-hombre de 4:1 pudiendo ser de hasta 10:1 en la HAI tipo 25, afecta especialmente a personas jóvenes aunque se ha descrito afectación en todos los grupos de edad6,7.
Algunos estudios han encontrado una susceptibilidad genética para el desarrollo de HAI8 pudiendo llevar a una variabilidad en los datos sobre la incidencia y prevalencia de la enfermedad según el área geográfica estudiada. La población caucásica una de las más ampliamente descritas9,10 con una incidencia anual de 1,07 casos por 100.000 habitantes11 muy similar entre los países europeos.
En Latinoamérica no existen datos epidemiológicos claros, hay estudios que demuestran polimorfismos genéticos en el complejo del antígeno mayor de histocompatibilidad de la población latinoamericana diferentes a los encontrados en poblaciones de otros continentes12,13. En Colombia la información proviene de estudios descriptivos con una población de pacientes muy pequeña14.
El objetivo del presente estudio es describir las características demográficas, clínicas, de laboratorio y tratamiento de una cohorte de pacientes con HAI, en un Hospital Universitario de la ciudad de Medellín, Colombia; asimismo, describir la incidencia de desarrollo de cirrosis, recaída, de requerimiento de trasplante hepático, recurrencia postrasplante y mortalidad.
Materiales y métodosEstudio observacional de cohorte histórica, incluyó pacientes atendidos en los servicios de urgencias, hospitalización y consulta externa del Hospital Pablo Tobón Uribe de Medellín-Colombia entre el 1 de enero de 2010 y el 31 de diciembre de 2016.
Se realizó una búsqueda en el sistema de historia clínica electrónica de los pacientes con diagnóstico de HAI (código K754) según la Clasificación Internacional de Enfermedades (CIE -10) y para la identificación de los pacientes con síndromes de solapamiento HAI–colangitis biliar primaria (CBP) (HAI-CBP) y HAI-colangitis esclerosante primaria (CEP) (HAI-CEP) se evaluaron adicionalmente aquellos con diagnóstico de CBP (código K743).
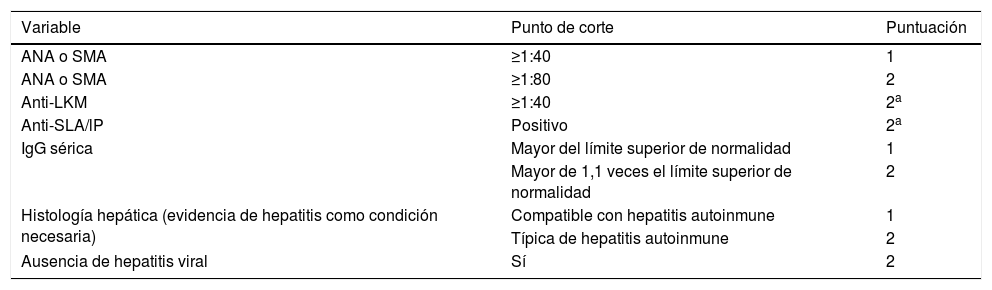
Se incluyeron pacientes con diagnóstico de HAI a partir de los 16 años de edad acorde con los criterios simplificados para el diagnóstico de HAI publicados en el 2008 por el Grupo Internacional de Hepatitis Autoinmune15 (tabla 1) y a aquellos con síndrome de solapamiento que cumplieran con las características bioquímicas, el perfil de autoanticuerpos, los hallazgos histológicos hepáticos y los hallazgos colangiográficos16.
Criterios simplificados para el diagnóstico de hepatitis autoinmune según el Grupo Internacional de Hepatitis Autoinmune (GIHA) en 2008
| Variable | Punto de corte | Puntuación |
|---|---|---|
| ANA o SMA | ≥1:40 | 1 |
| ANA o SMA | ≥1:80 | 2 |
| Anti-LKM | ≥1:40 | 2a |
| Anti-SLA/lP | Positivo | 2a |
| IgG sérica | Mayor del límite superior de normalidad | 1 |
| Mayor de 1,1 veces el límite superior de normalidad | 2 | |
| Histología hepática (evidencia de hepatitis como condición necesaria) | Compatible con hepatitis autoinmune | 1 |
| Típica de hepatitis autoinmune | 2 | |
| Ausencia de hepatitis viral | Sí | 2 |
≥6 puntos: hepatitis autoinmune probable.
≥7 puntos: hepatitis autoinmune definida.
La sumatoria máxima para los puntos de los autoanticuerpos es 2.
Histología típica de hepatitis autoinmune: hepatitis de interfase, infiltrados linfocítico/plasmocitario en espacios porta con extensión al lobulillo, emperipolesis, formación de rosetas.
Histología compatible con hepatitis autoinmune: hepatitis crónica con infiltrado linfocítico sin los otros hallazgos típicos de la hepatitis autoinmune.
ANA: anticuerpos antinucleares, LKM: anticuerpos antihígado-riñón-músculo (liver, kidney, muscle), SLA/lP: anticuerpos antiantígeno soluble hepático/hígado páncreas (soluble liver antigen/liver-pancreas); SMA: anticuerpos antimúsculo liso (smooth muscle antibodies).
Los pacientes con ausencia de datos clínicos, bioquímicos e histológicos completos en la historia clínica fueron excluidos.
Se recogieron variables demográficas, clínicas, serológicas, radiológicas, histológicas y de tratamiento.
Según la forma de presentación clínica al momento del diagnóstico se clasificaron como: asintomáticos con alteración de la bioquímica hepática a pacientes con ausencia de síntomas y presencia de anormalidad bioquímica del perfil hepático. Síntomas inespecíficos: astenia, anorexia, prurito, pérdida de peso y dolor abdominal con evidencia de alteración bioquímica hepática. Hepatitis aguda: dolor en hipocondrio derecho, náuseas e ictericia, con patrón de daño hepatocelular evidenciado en los laboratorios. Cirrosis hepática: presencia de signos clínicos de cirrosis (ginecomastia, telangiectasias, eritema palmar, circulación colateral, ascitis, y encefalopatía), bioquímicos (hipoalbuminemia, trombocitopenia, prolongación de tiempo de protrombina) e imaginológicos. Falla hepática aguda: clínica de hepatitis aguda con coagulopatía y desarrollo de encefalopatía en las primeras 26 semanas después del inicio de la ictericia acorde a la definición descrita por O’Grady et al.17. Hepatitis autoinmune de novo: pacientes con historia de trasplante hepático (sin diagnóstico de HAI pretrasplante) y que desarrollaron HAI en el periodo postrasplante.
El grado de fibrosis hepática por biopsia se evaluó según el puntaje METAVIR, con graduación de F0 a F4, siendo F0 ausencia de fibrosis y F4 fibrosis avanzada con cirrosis; asimismo, las características histológicas se clasificaron como: no compatible, compatible o típica de HAI según el GIHA15.
En la evaluación de la respuesta al tratamiento se consideró como: remisión bioquímica a la normalización de transaminasas y de IgG; remisión parcial a la mejoría clínica y descenso de transaminasas pero sin alcanzar normalización de las mismas, y como no respuesta a los que no alcanzaron a disminuir al menos un 25% los niveles de transaminasas tomando como referencia el nivel con las que inició el tratamiento.
Recaída se definió como la elevación de ALT mayor a 3 veces el límite superior de normalidad y la elevación de IgG o empeoramiento de los hallazgos histológicos después de haber alcanzado remisión con el tratamiento farmacológico.
La recolección de los datos se realizó mediante la revisión de historias clínicas del registro electrónico del hospital con un instrumento de recolección previamente diseñado. Para asegurar la calidad de los datos y disminuir el riesgo de sesgo de información se revisó el 10% de las historias clínicas en duplicado entre los investigadores.
Se realizó seguimiento de los pacientes hasta el 31 de diciembre de 2016 o hasta la última fecha que se tenía documentada en la historia clínica a partir de la cual se consideró como dato censurado si no había presentado ninguno de los desenlaces medidos.
En el análisis estadístico se empleó el paquete estadístico SPSS versión 20 registrada de la Universidad de Antioquia. Las variables categóricas se presentan como frecuencias absolutas y relativas, las variables continuas como media y desviación estándar si siguen una distribución normal o mediana y rango intercuartílico (RIC) si no siguen una distribución normal según la prueba de Kolmogorov Smirnov.
Se estimó la densidad de incidencia de complicaciones como cirrosis, requerimiento de trasplante hepático y muerte.
No se estimó un tamaño de muestra a priori ya que se incluyeron todos los pacientes con diagnóstico de HAI atendidos durante el periodo de estudio.
El estudio se adhirió a los lineamientos de la declaración de Helsinki versión 2013 para la investigación en seres humanos y a la resolución 008430 de 1993 sobre investigación clínica en Colombia y fue aprobado por el comité de ética del hospital.
El manuscrito final se adhirió a las recomendaciones STROBE para el reporte de estudios observacionales18.
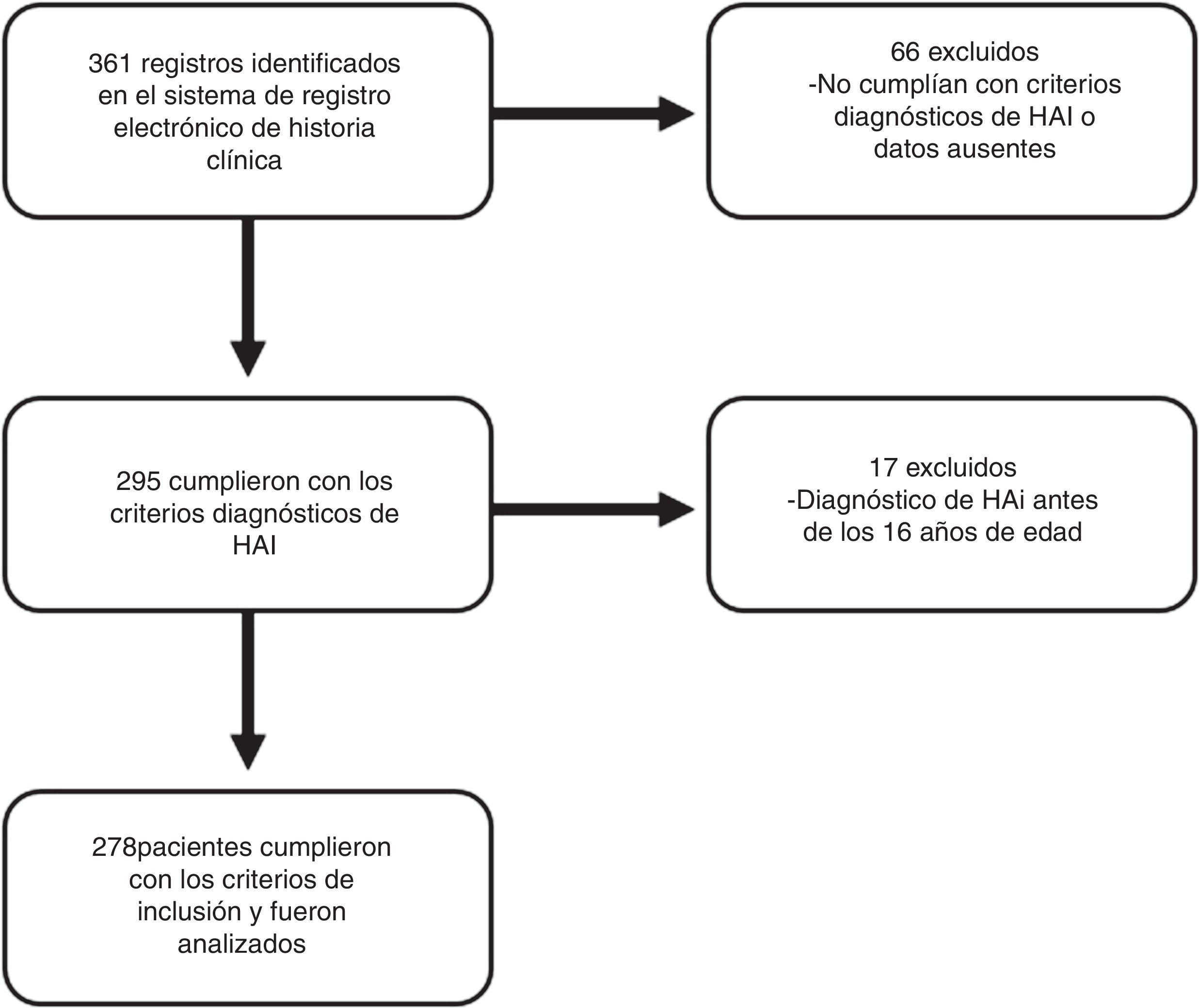
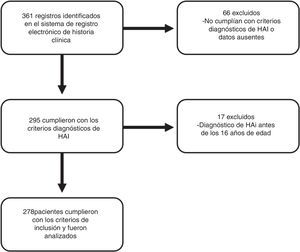
ResultadosUn total de 278 pacientes cumplieron con los criterios de inclusión (fig. 1). La mediana de seguimiento fue de 41 meses (RIC 16-74 meses), rango entre 0 y 241 meses.
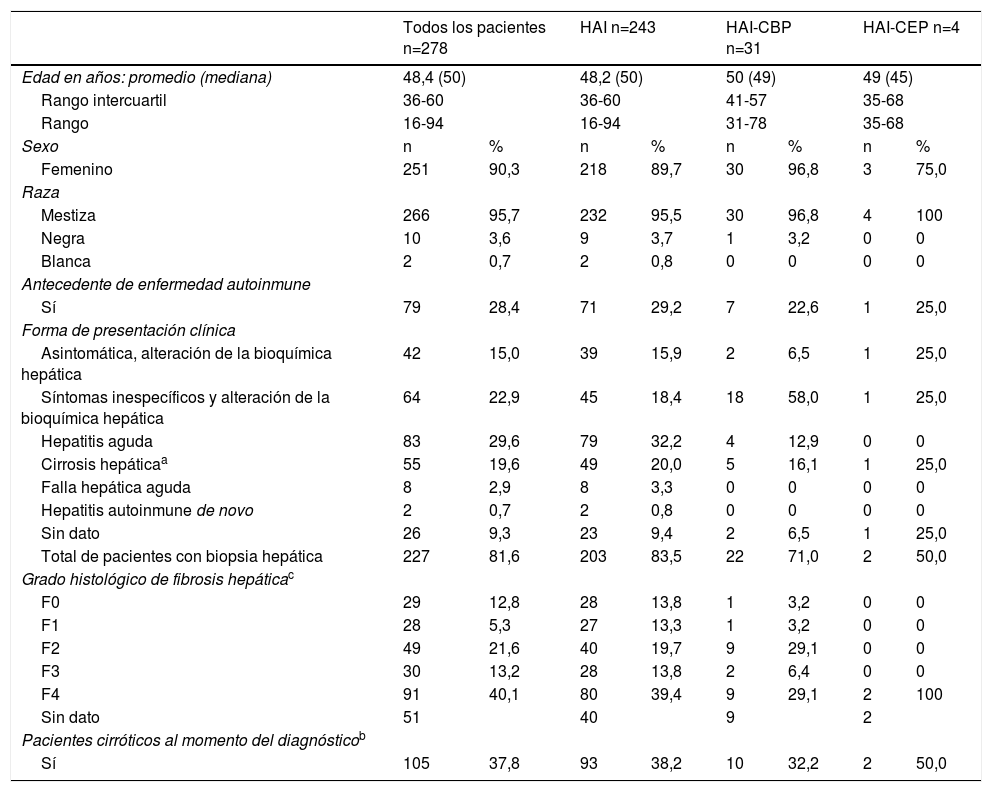
El 90% de los pacientes eran mujeres y la mayoría de raza mestiza. La mediana de edad al diagnóstico fue de 50 años con un rango entre 16 y 94 años, en los pacientes con falla hepática aguda el promedio de edad al diagnóstico fue el menor (35 años). Un total de 35 (12,6%) pacientes tuvieron síndrome de solapamiento HAI-CBP y HAI-CEP (tabla 2).
Características clínicas de los pacientes
| Todos los pacientes n=278 | HAI n=243 | HAI-CBP n=31 | HAI-CEP n=4 | |||||
|---|---|---|---|---|---|---|---|---|
| Edad en años: promedio (mediana) | 48,4 (50) | 48,2 (50) | 50 (49) | 49 (45) | ||||
| Rango intercuartil | 36-60 | 36-60 | 41-57 | 35-68 | ||||
| Rango | 16-94 | 16-94 | 31-78 | 35-68 | ||||
| Sexo | n | % | n | % | n | % | n | % |
| Femenino | 251 | 90,3 | 218 | 89,7 | 30 | 96,8 | 3 | 75,0 |
| Raza | ||||||||
| Mestiza | 266 | 95,7 | 232 | 95,5 | 30 | 96,8 | 4 | 100 |
| Negra | 10 | 3,6 | 9 | 3,7 | 1 | 3,2 | 0 | 0 |
| Blanca | 2 | 0,7 | 2 | 0,8 | 0 | 0 | 0 | 0 |
| Antecedente de enfermedad autoinmune | ||||||||
| Sí | 79 | 28,4 | 71 | 29,2 | 7 | 22,6 | 1 | 25,0 |
| Forma de presentación clínica | ||||||||
| Asintomática, alteración de la bioquímica hepática | 42 | 15,0 | 39 | 15,9 | 2 | 6,5 | 1 | 25,0 |
| Síntomas inespecíficos y alteración de la bioquímica hepática | 64 | 22,9 | 45 | 18,4 | 18 | 58,0 | 1 | 25,0 |
| Hepatitis aguda | 83 | 29,6 | 79 | 32,2 | 4 | 12,9 | 0 | 0 |
| Cirrosis hepáticaa | 55 | 19,6 | 49 | 20,0 | 5 | 16,1 | 1 | 25,0 |
| Falla hepática aguda | 8 | 2,9 | 8 | 3,3 | 0 | 0 | 0 | 0 |
| Hepatitis autoinmune de novo | 2 | 0,7 | 2 | 0,8 | 0 | 0 | 0 | 0 |
| Sin dato | 26 | 9,3 | 23 | 9,4 | 2 | 6,5 | 1 | 25,0 |
| Total de pacientes con biopsia hepática | 227 | 81,6 | 203 | 83,5 | 22 | 71,0 | 2 | 50,0 |
| Grado histológico de fibrosis hepáticac | ||||||||
| F0 | 29 | 12,8 | 28 | 13,8 | 1 | 3,2 | 0 | 0 |
| F1 | 28 | 5,3 | 27 | 13,3 | 1 | 3,2 | 0 | 0 |
| F2 | 49 | 21,6 | 40 | 19,7 | 9 | 29,1 | 0 | 0 |
| F3 | 30 | 13,2 | 28 | 13,8 | 2 | 6,4 | 0 | 0 |
| F4 | 91 | 40,1 | 80 | 39,4 | 9 | 29,1 | 2 | 100 |
| Sin dato | 51 | 40 | 9 | 2 | ||||
| Pacientes cirróticos al momento del diagnósticob | ||||||||
| Sí | 105 | 37,8 | 93 | 38,2 | 10 | 32,2 | 2 | 50,0 |
La comorbilidad más frecuente fue el hipotiroidismo con un 34,2%. Del total, 79 (28,4%) pacientes tenían otra enfermedad autoinmune (diferente al hipotiroidismo) siendo las más frecuentes el síndrome de Sjögren, el lupus eritematoso sistémico y la artritis reumatoide con 6,8, 6,4 y 2,5% respectivamente.
Tres (1%) pacientes estaban infectados por el virus de la hepatitis B, uno (0,3%) por el virus de la inmunodeficiencia humana y ninguno por el virus de la hepatitis C.
La principal forma de presentación clínica en los pacientes con HAI fue la hepatitis aguda (29,6%) y en los pacientes con HAI-CBP los síntomas inespecíficos con alteración de la bioquímica hepática (58%). Ocho (2,8%) pacientes se presentaron como falla hepática aguda y dos (0,7%) como HAI de novo (todos en el grupo de HAI).
En 26 (9,3%) pacientes no se obtuvo información sobre la forma de presentación clínica al momento del diagnóstico, de este grupo todos cumplieron con los criterios para el diagnóstico de HAI y/o síndromes de solapamiento.
Se consideró HAI inducida por medicamentos en 13 (4,6%) pacientes, la nitrofurantoína fue el medicamento más frecuentemente asociado (9 de los 13 casos), seguida de los antiinflamatorios no esteroideos (2 casos), el propiltiouracilo (un caso) y el adalimumab (un caso). De estos ninguno se presentó como falla hepática aguda y uno desarrolló cirrosis durante el seguimiento.
Al momento del diagnóstico de HAI 105 (37,8%) pacientes estaban cirróticos clínica, radiológica, bioquímica o histológicamente.
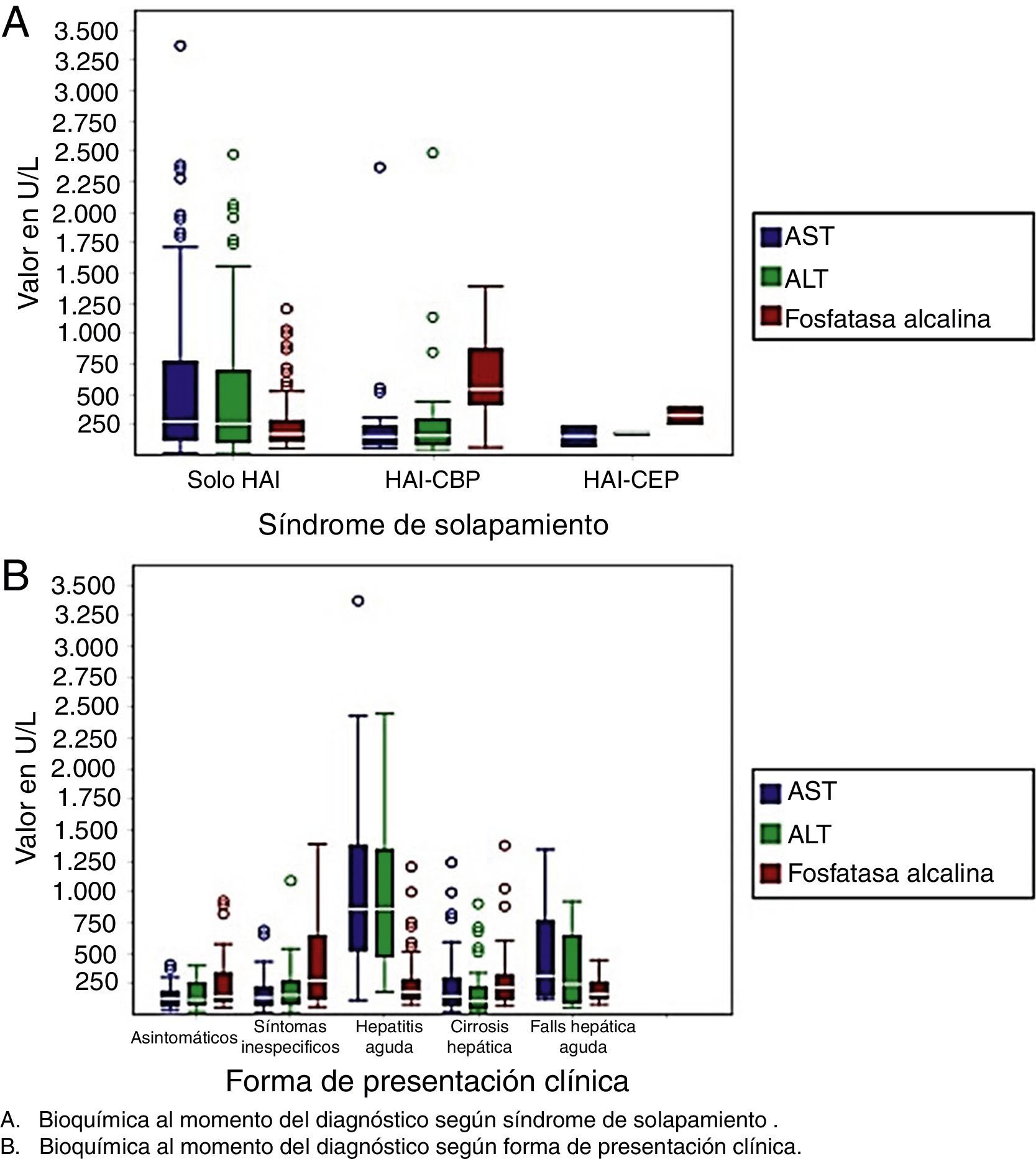
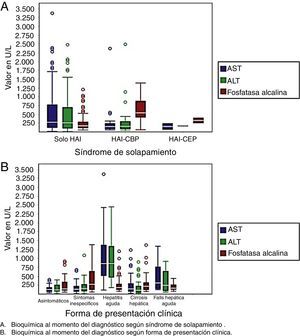
En cuanto a las variables de laboratorio, los pacientes con hepatitis aguda y falla hepática aguda presentaron niveles más elevados de transaminasas al momento del diagnóstico, igualmente los pacientes con HAI. Los pacientes con HAI-CBP y HAI-CEP presentaron mayores niveles de fosfatasa alcalina al compararse con los pacientes con HAI (fig. 2).
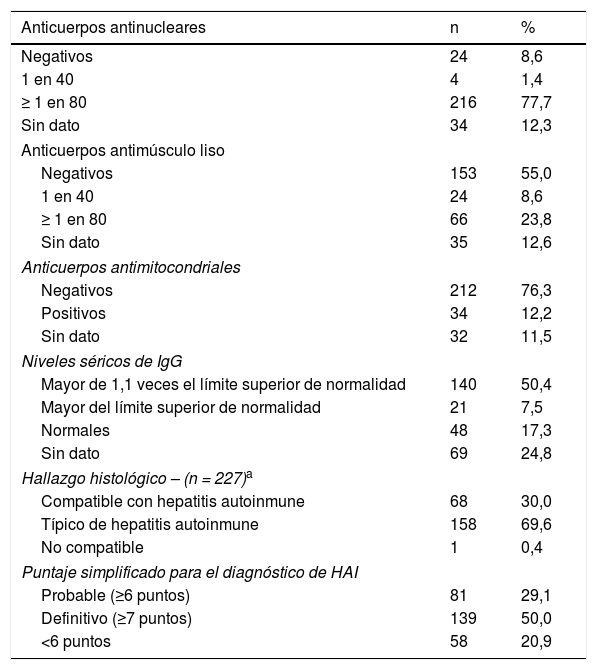
En total 233 (83,8%) pacientes tuvieron al menos un autoanticuerpo positivo (anticuerpos antinucleares o antimúsculo liso) y 25 (81%) pacientes de los 31 con HAI-CBP anticuerpos antimitocondriales (AMA) positivos. En 276 (99,2%) pacientes no se evaluaron los anticuerpos anti- SLA/lP o LKM.
De todos los pacientes a 227 (81,7%) se les realizó biopsia hepática, 226 (99,6%) de estas mostraron hallazgos compatibles (hepatitis crónica con infiltrado linfocítico) o típicos de HAI (hepatitis de interfase, infiltrado linfocítico-plasmocítico en espacios porta con extensión al lobulillo, emperipolesis y formación de rosetas). A 31 (88,5%) de los pacientes con síndrome de solapamiento se les realizó biopsia hepática, de los cuales 21 (67,7%) tuvo hallazgos típicos de HAI y todos cumplieron con los criterios diagnósticos serológicos, imaginológicos e histológicos de síndrome de solapamiento16.
Como se muestra en la tabla 3, en 220 (79,1%) de los 278 pacientes el puntaje simplificado para el diagnóstico fue ≥ 6 puntos (HAI probable o definitiva), de los 58 que tuvieron puntaje < 6 puntos 43 (74%) recibió tratamiento de inducción alcanzando una remisión bioquímica del 85%, asimismo, de los 51 pacientes que no tenían biopsia hepática 18 (35%) tenían diagnóstico clínico de cirrosis y 30 (58,8%) recibieron tratamiento de los cuales 23 (76,6%) tuvo remisión bioquímica (tabla 4).
Características serológicas e histológicas de los pacientes
| Anticuerpos antinucleares | n | % |
|---|---|---|
| Negativos | 24 | 8,6 |
| 1 en 40 | 4 | 1,4 |
| ≥ 1 en 80 | 216 | 77,7 |
| Sin dato | 34 | 12,3 |
| Anticuerpos antimúsculo liso | ||
| Negativos | 153 | 55,0 |
| 1 en 40 | 24 | 8,6 |
| ≥ 1 en 80 | 66 | 23,8 |
| Sin dato | 35 | 12,6 |
| Anticuerpos antimitocondriales | ||
| Negativos | 212 | 76,3 |
| Positivos | 34 | 12,2 |
| Sin dato | 32 | 11,5 |
| Niveles séricos de IgG | ||
| Mayor de 1,1 veces el límite superior de normalidad | 140 | 50,4 |
| Mayor del límite superior de normalidad | 21 | 7,5 |
| Normales | 48 | 17,3 |
| Sin dato | 69 | 24,8 |
| Hallazgo histológico – (n = 227)a | ||
| Compatible con hepatitis autoinmune | 68 | 30,0 |
| Típico de hepatitis autoinmune | 158 | 69,6 |
| No compatible | 1 | 0,4 |
| Puntaje simplificado para el diagnóstico de HAI | ||
| Probable (≥6 puntos) | 81 | 29,1 |
| Definitivo (≥7 puntos) | 139 | 50,0 |
| <6 puntos | 58 | 20,9 |
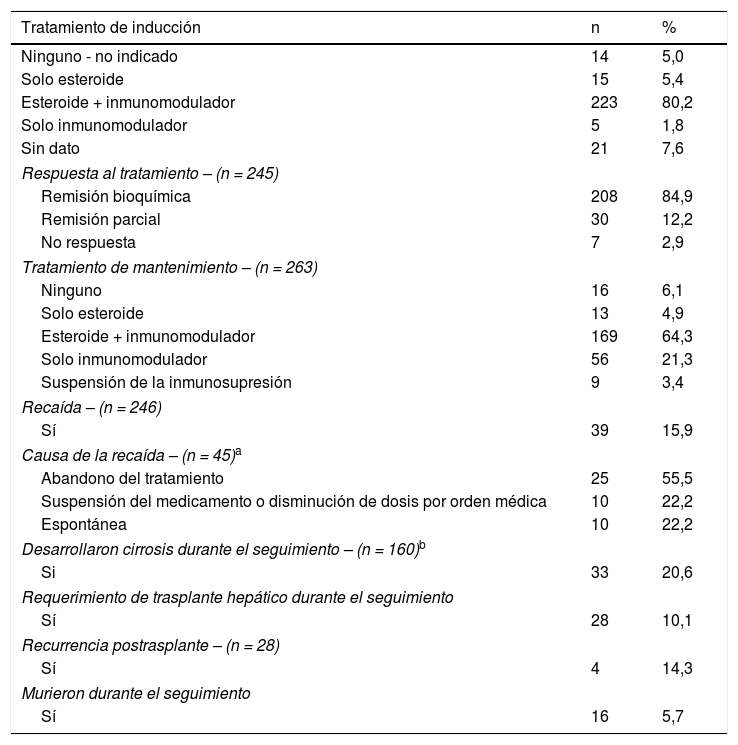
Tratamiento, respuesta al tratamiento y evolución en el tiempo
| Tratamiento de inducción | n | % |
|---|---|---|
| Ninguno - no indicado | 14 | 5,0 |
| Solo esteroide | 15 | 5,4 |
| Esteroide + inmunomodulador | 223 | 80,2 |
| Solo inmunomodulador | 5 | 1,8 |
| Sin dato | 21 | 7,6 |
| Respuesta al tratamiento – (n = 245) | ||
| Remisión bioquímica | 208 | 84,9 |
| Remisión parcial | 30 | 12,2 |
| No respuesta | 7 | 2,9 |
| Tratamiento de mantenimiento – (n = 263) | ||
| Ninguno | 16 | 6,1 |
| Solo esteroide | 13 | 4,9 |
| Esteroide + inmunomodulador | 169 | 64,3 |
| Solo inmunomodulador | 56 | 21,3 |
| Suspensión de la inmunosupresión | 9 | 3,4 |
| Recaída – (n = 246) | ||
| Sí | 39 | 15,9 |
| Causa de la recaída – (n = 45)a | ||
| Abandono del tratamiento | 25 | 55,5 |
| Suspensión del medicamento o disminución de dosis por orden médica | 10 | 22,2 |
| Espontánea | 10 | 22,2 |
| Desarrollaron cirrosis durante el seguimiento – (n = 160)b | ||
| Si | 33 | 20,6 |
| Requerimiento de trasplante hepático durante el seguimiento | ||
| Sí | 28 | 10,1 |
| Recurrencia postrasplante – (n = 28) | ||
| Sí | 4 | 14,3 |
| Murieron durante el seguimiento | ||
| Sí | 16 | 5,7 |
Prednisolona y azatioprina fueron los medicamentos más frecuentemente utilizados para el tratamiento de inducción y de mantenimiento. En el esquema de inducción la dosis de prednisolona administrada fue 0,5-1mg/kg/día y de azatioprina 1mg/kg/día, con un descenso gradual de la dosis de prednisolona en los siguientes tres meses y posterior aumento de la dosis de azatioprina hasta de 2mg/kg/día según la tolerancia y respuesta al tratamiento.
Los pacientes con HAI-CBP recibieron además ácido ursodesoxicólico a dosis de 15mg/kg/día.
La mediana para alcanzar la remisión fue de 13,4 semanas (RIC 7,2-34,4semanas).
En 56 (21,3%) de los 263 pacientes con tratamiento de mantenimiento se logró suspender los esteroides y en 9 (3,4%) los esteroides más el inmunomodulador. En 11 (84,6%) de los 13 casos de HAI inducida por medicamentos se logró suspender por completo el tratamiento farmacológico.
Tratamiento farmacológico de rescate se requirió en 20 (7,2%) pacientes, indicado principalmente por no alcanzar remisión bioquímica y en segundo lugar por el desarrollo de efectos adversos especialmente a la azatioprina. Los fármacos empleados fueron micofenolato de mofetilo, ciclosporina y tacrolimus en el 80, 15 y 5% respectivamente. De estos pacientes, once (55%) estaban cirróticos al momento del diagnóstico, 60% tuvo remisión bioquímica, 25% tuvo remisión parcial y el 15% no respondió al tratamiento.
Un total de 78 (28%) pacientes tuvo efectos adversos asociados al tratamiento siendo los más frecuentes osteoporosis, complicaciones infecciosas y síndrome de Cushing. De los pacientes que recibieron azatioprina el 2,4% presentó alteraciones hematológicas, 1,2% intolerancia gástrica y 0,4% neumonitis.
Al evaluar el grupo de pacientes que desarrolló cirrosis durante el seguimiento y compararlos con los que no la desarrollaron se encontró: una mayor proporción de hombres (21,2 vs. 7,8%, p=0,027), una mayor frecuencia de síndrome de solapamiento HAI-CEP (6,0 vs. 0%, p=0,006), una menor remisión bioquímica (57,6 vs. 89%, p=<0,001) y una mayor frecuencia de no respuesta al tratamiento (12,1 vs. 1,6%, p=0,004).
Se trasplantaron 28 (10,1%) pacientes, la principal indicación fue cirrosis hepática y sus complicaciones por hipertensión portal y el desarrollo de carcinoma hepatocelular. Los ocho pacientes con falla hepática aguda cumplieron con criterios de mal pronóstico, cinco (62,5%) de los cuales fueron llevados a trasplante hepático y los tres restantes no se trasplantaron por presentar contraindicación para el trasplante (dos pacientes hipertensión intracraneal severa y uno por pancreatitis hemorrágica). En los pacientes trasplantados hubo una recurrencia de HAI en el 14,3%.
Durante el seguimiento murieron 16 (5,7%) pacientes (4,8% de las mujeres y 14,8% de los hombres), de estos, cuatro (25%) se presentaron como falla hepática aguda (los tres que tenían contraindicado el trasplante y uno que se trasplantó y falleció un año después por choque séptico).
La principal causa de muerte fue disfunción orgánica múltiple secundaria a insuficiencia hepática y a complicaciones infecciosas relacionadas.
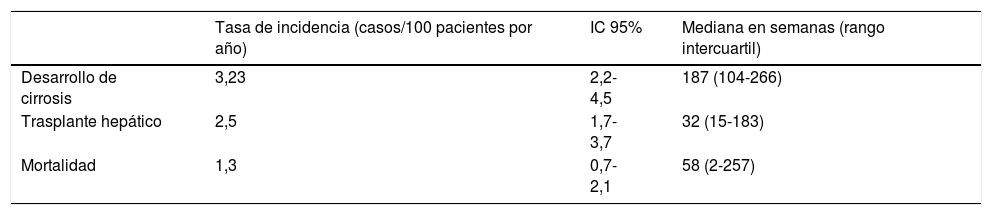
Las tasas de incidencia de desarrollo de cirrosis hepática, de requerimiento de trasplante hepático y de mortalidad se describen en la tabla 5.
Incidencia de cirrosis hepática, trasplante hepático y mortalidad en los pacientes con HAI
| Tasa de incidencia (casos/100 pacientes por año) | IC 95% | Mediana en semanas (rango intercuartil) | |
|---|---|---|---|
| Desarrollo de cirrosis | 3,23 | 2,2-4,5 | 187 (104-266) |
| Trasplante hepático | 2,5 | 1,7-3,7 | 32 (15-183) |
| Mortalidad | 1,3 | 0,7-2,1 | 58 (2-257) |
Se describe la cohorte más grande de pacientes con HAI publicada en Colombia y Latinoamérica. Al igual que lo publicado en la literatura mundial9,19–22 se corrobora un predominio en mujeres mayores de 40 años en la población colombiana, además, aunque se reporta una mayor afectación en la población de raza blanca y de origen caucásico9,23 los hallazgos de este estudio demuestran que la HAI también afecta a pacientes de otras razas, especialmente la mestiza, la cual es predominante en Latinoamérica. La variabilidad en cuanto a la incidencia de HAI en las diferentes razas posiblemente esté explicada por los diferentes polimorfismos en el sistema del antígeno leucocitario humano (HLA) tal y como lo demostró Duarte-Rey et al13 donde el HLA DQ2 y DR52 son factores de riesgo para el desarrollo de HAI en la población latinoamericana y el HLA DR3 y DQ2 en otros continentes especialmente el europeo y el norteamericano. Asimismo el HLA también podría explicar la presentación clínica y curso diferente de la HAI según el sexo, Al-Chalabi et al.19 describen diferentes HLA expresados más frecuentemente en hombres los cuales desarrollaron HAI a edad más temprana y tuvieron mayores recaídas. El presente estudio se encontró un curso más agresivo de la HAI en los hombres colombianos, con una mayor frecuencia de desarrollo de cirrosis, menor remisión bioquímica, mayor frecuencia de requerimiento de trasplante hepático y de muerte.
La presentación de la HAI es variable, siendo la hepatitis aguda la más frecuente19,22,24,25 a diferencia de los síndromes de solapamiento como la HAI-CBP donde predominan los síntomas inespecíficos como el prurito (58% en este estudio). En el 15% de los pacientes la única manifestación fue la alteración del perfil bioquímico hepático (predominio de transaminasas en HAI y fosfatasa alcalina en síndromes de solapamiento), por lo que siempre se debe tener presente la HAI como diagnóstico diferencial en pacientes con bioquímica hepática anormal, hallazgos también descritos por otros autores19,21,22. El 37,8% estaban cirróticos en la biopsia inicial pero solo la mitad de estos tenían signos clínicos de hepatopatía lo que confirma el bajo rendimiento diagnóstico del examen físico para el diagnóstico de cirrosis26 y el riesgo de complicaciones que corren estos pacientes al no ser detectados clínicamente.
La biopsia hepática es una herramienta valiosa para el diagnóstico de HAI27, sin embargo en algunas ocasiones la condición clínica de los pacientes contraindica la realización de esta, así, el porcentaje de pacientes con biopsia hepática en los estudios publicados de HAI es variable (por lo general menor del 85%)19,22,23,28 por lo cual el presente estudio es representativo para la descripción de la HAI en Latinoamérica ya que se tuvo confirmación histológica en el 81% de los pacientes, de estos, el 99% tuvo hallazgos típicos o compatibles con HAI.
El puntaje simplificado para el diagnóstico de HAI tiene una sensibilidad mayor del 80% y especificidad mayor del 90% con un punto de corte ≥615 siendo un reto el diagnóstico en pacientes con puntaje < 6 puntos. En el 21% de los pacientes el puntaje simplificado fue < 6 puntos, hallazgos principalmente explicados por: la falta de medición de IgG sérica, la ausencia de biopsia hepática en 28 (48%) de estos pacientes y la infección por virus de la hepatitis B en un paciente. Aunque la ausencia de biopsia hepática pudo ser limitante para descartar otras etiologías (por ejemplo la esteatohepatitis no alcohólica) la respuesta bioquímica al tratamiento ayudó a corroborar el diagnóstico en estos pacientes tal y como se describe en las guías de tratamiento27.
Se presentó una mayor frecuencia de AMA negativos (19%) en los pacientes con HAI-CBP comparado a lo descrito en otros estudios, sin embargo, todos cumplían con los criterios de París (elevación de fosfatasa alcalina ≥5 veces el límite superior de normalidad del laboratorio y hallazgos histológicos de lesiones ductales o colangitis destructiva)16 los cuales han demostrado buen rendimiento para el diagnóstico de síndrome de HAI-CBP29.
La combinación de prendisolona con azatioprina fue el esquema de inducción más utilizado y es el tratamiento de elección según diferentes guías27,30,31, se recomienda el inicio diferido de la azatioprina (2 semanas después del inicio de la prednisolona) para evitar efectos adversos relacionados con la azatioprina27. El inicio simultáneo de estos 2 medicamentos durante el tratamiento de inducción no estuvo asociado a una mayor frecuencia de efectos adversos y la remisión alcanzada fue comparable con la descrita en el mundo utilizando este mismo esquema, 84,9%28,32.
De manera interesante hubo 13 pacientes con HAI inducida por medicamentos donde el principal medicamento implicado fue la nitrofurantoína, asociación claramente establecida por Björnsson et al. en un estudio de la Clínica Mayo28 donde estos pacientes presentaron un curso clínico menos agresivo, con mayor remisión bioquímica permitiendo la suspensión de la inmunosupresión en un porcentaje mayor de pacientes. En el presente estudio en el 85% de los casos inducidos por medicamentos se pudo suspender la inmunosupresión a diferencia del grupo no inducido por medicamentos donde solo en el 21,3% de los casos se logró suspender el glucocorticoide y en el 3% el retiro completo del tratamiento.
Hubo recaída en el 15% de los pacientes, la principal causa fue la falta de adherencia al tratamiento (55%). El acompañamiento multidisciplinario en nuestros países podría disminuir esta tasa.
La recurrencia de HAI postrasplante ha sido descrita entre 12 y 46%33, en el presente estudio se reporta una recurrencia postrasplante en cuatro (14,3%) pacientes. En tres de los cuatro se mejoró la función del injerto con las modificaciones de la inmunosupresión y una paciente requirió retrasplante de hígado por cirrosis del injerto, la misma paciente tuvo nuevamente recurrencia 6 años después del retrasplante con progresión a cirrosis del injerto.
Como lo plantea el Czaja34 las razones por las cuales la HAI recurre son inciertas aunque se han planteado algunas como: la suspensión temprana de glucocorticoides, la incompatibilidad de HLA entre el donante y el receptor, los diferentes regímenes de inmunosupresión35 y más recientemente la actividad de la enfermedad demostrada histológicamente y en la bioquímica hepática antes del trasplante36.
El pronóstico en cuanto a mortalidad, desarrollo de cirrosis, falla hepática aguda y supervivencia libre de trasplante es variable y está influenciado por la severidad de la presentación inicial, el reconocimiento temprano de la enfermedad, la coexistencia de otras condiciones que afecten el hígado, la instauración de un tratamiento oportuno y adecuado, la adherencia al tratamiento por parte de los pacientes y el grado de respuesta al tratamiento27.
Las tasas de progresión a cirrosis, de trasplante hepático y de mortalidad fueron similares a lo reportado mundialmente24.
Las limitaciones del estudio fueron: primero, existe riesgo de sesgo de información al tratarse de un estudio retrospectivo y a que la recolección de datos fue a partir de historias clínicas, sin embargo, la calidad de los datos se aseguró al revisar el 10% de las historias clínicas en duplicado y a que los hepatólogos del hospital trabajan en grupo y existe una alta homogeneidad en sus conceptos. Segundo, se trató de un estudio de un solo centro, sin embargo, es un centro de referencia de enfermedades hepáticas y trasplante hepático a nivel nacional.
Como fortalezas se destacan: el número de pacientes, ya que se trata del estudio de HAI con más pacientes reportado a nivel nacional y de Latinoamérica. Segundo, más del 80% de los pacientes tuvo biopsia hepática permitiendo una alta confianza en el diagnóstico de HAI; por último, el tiempo de seguimiento (mediana de 41 meses y rango hasta 241 meses) ya que permitió conocer el comportamiento y evolución de la HAI en la población colombiana.
ConclusiónLa HAI no es una enfermedad rara en nuestro medio, predomina en mujeres pero tiene un comportamiento poco favorable en los hombres. Tiene una amplia variabilidad de presentación clínica y un gran número de pacientes están cirróticos al momento del diagnóstico. Se debe realizar un diagnóstico oportuno para establecer un tratamiento adecuado para evitar la progresión de la enfermedad y la presentación de complicaciones. La respuesta al tratamiento y las complicaciones desarrolladas en la población colombiana son similares a las descritas en otros centros del mundo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.