El objetivo del estudio fue conocer la prevalencia y las características clínico-epidemiológicas de los pacientes con infección crónica por el virus de la hepatitis D (VHD).
Pacientes y métodosSe realizó un estudio descriptivo retrospectivo de los pacientes con infección por VHD en seguimiento en un área de salud en el año 2023. A los pacientes portadores de HBsAg se les realizó la detección de anticuerpos frente al VHD. En todas las muestras positivas para anticuerpos se realizó la detección de ARN del VHD. Se revisaron las historias clínicas.
ResultadosDe los 340 pacientes portadores de HBsAg, 24 (7,1%) presentaban anticuerpos anti-VHD, y 6 (25%) presentaban ARN del VHD detectable (infección crónica). La prevalencia de infección crónica en portadores de HBsAg fue 1,8%. Todos los pacientes presentaron una infección por genotipo 1. La mitad de los pacientes eran de origen africano y el 29,2% españoles. De los seis pacientes con hepatitis, 5 (83,3%) presentaban cirrosis y 2 (33,3%) hepatocarcinoma. La mitad de los pacientes tuvieron alguna reagudización de la enfermedad durante el seguimiento. De los 18 pacientes sin viremia, 2 (11,1%) presentaron cirrosis (uno de reciente diagnóstico). El tiempo medio de seguimiento de los pacientes sin viremia fue de 13,5 años.
ConclusionesLa prevalencia de infección crónica por VHD en nuestro medio es baja y se presenta en todos los casos como una enfermedad avanzada, con reagudizaciones en el seguimiento. Los pacientes sin viremia probablemente hayan resuelto la infección, al no detectársele en ningún momento.
The objective of this study was to know the prevalence and clinical-epidemiological characteristics of patients with chronic infection due to hepatitis D virus (HDV).
Patients and methodsA retrospective descriptive study was carried out on patients with HDV infection under follow-up in a hospital in 2023. All patients carrying HBsAg were tested for antibodies against HDV. HDV RNA detection was performed in all antibody-positive samples. The medical records were reviewed.
ResultsOf the 340 patients carrying HBsAg, 24 (7.1%) had anti-HDV antibodies, and 6 (25%) had detectable HDV RNA (chronic infection). The prevalence of chronic hepatitis in HBsAg carriers was 1.8%. All patients had a genotype 1 infection. Half of the patients were of African origin and 29.2% were Spanish. Of the 6 patients with chronic infection, 5 (83.3%) had cirrhosis and 2 (33.3%) had hepatocellular carcinoma. Half of the patients had some exacerbation of the disease during follow-up. Of the 18 patients without viremia, 2 (11.1%) presented cirrhosis (one recently diagnosed). The mean follow-up time of patients without viremia was 13.5 years.
ConclusionsThe prevalence of chronic HDV hepatitis in our area is low and in all cases it presents as an advanced disease, with exacerbations during follow-up. Patients without viremia have probably resolved the infection, as viremia was not detected in any moment.
El virus de la hepatitis delta (VHD) es un virus defectivo que necesita del antígeno de superficie del virus de la hepatitis B (HBsAg) para su replicación. La infección por el VHD produce las formas más graves de hepatitis viral en adultos. A pesar de ello, es una enfermedad olvidada de la que se desconoce su prevalencia real y para la que, hasta la reciente aprobación del bulevirtide, no existía tratamiento específico.
Varios metaanálisis recientes, basados en estudios realizados principalmente en la década de los 80 y 90, estimaron prevalencias muy variables1–3, si bien todos coinciden en la existencia de una heterogeneidad geográfica y en que la carga de la enfermedad probablemente sea mayor que la estimada. Este desconocimiento se debe en parte a que, a pesar de que las guías de manejo de la hepatitis B recomiendan descartar la infección por el VHD en todos los portadores de HBsAg4, esto se realiza en menos de la mitad de los pacientes5–7. En España, el último estudio de seroprevalencia publicado estimaba que el 7,7% de los portadores del virus de la hepatitis B (VHB) estaban infectados por el VHD8, pero se desconoce la prevalencia de hepatitis crónica que, si bien se estima baja, se desconoce cómo se puede ver afectada con las migraciones desde países de mayor endemia. En la actualidad, la prevalencia es alta en Asia Central, en la cuenca del Amazonas y en África subsahariana9. Por otra parte, también desconocemos el comportamiento y progresión de la enfermedad en nuestro entorno como consecuencia de su infradiagnóstico y por no disponer de sistemas robustos para su detección10,11. Aunque se sabe que el VHD produce una enfermedad hepática con rápida progresión a cirrosis y hepatocarcinoma12,13, existen estudios que sugieren que la progresión es variable y que un porcentaje mayor de lo esperado podría tener un curso indolente14.
Con el objetivo de conocer la prevalencia de la infección crónica por el VHD y las características de los pacientes, realizamos un estudio clínico-epidemiológico de la enfermedad en nuestra área.
Pacientes y métodosSe realizó un estudio clínico-epidemiológico descriptivo retrospectivo de la infección crónica por el VHD en un área sanitaria que cubre una población de aproximadamente 350.000 habitantes mayores de 14 años en la isla de Gran Canaria (España).
Pacientes. Se incluyeron todos los pacientes en seguimiento en el año 2023 en la Unidad de Hepatología de nuestro hospital. En nuestra área, desde el año 1990 se realiza el diagnóstico del VHD en todos los portadores del HBsAg, mediante la detección en suero de anticuerpos específicos (diagnóstico reflejo) y, desde el año 2010, a todos los pacientes con anticuerpos se les realiza la PCR para la detección de ARN del virus (diagnóstico doble reflejo). A todos los pacientes con infección por VHD se les realizó en cada visita (1-2 veces/año) la detección de ARN.
La infección por VHD fue definida por la presencia de anticuerpos frente al VHD sin detección de viremia, e infección crónica cuando se detectó ARN del VHD en suero.
En el año 2023, se revisaron las historias clínicas de todos los pacientes y se recogieron datos epidemiológicos (sexo, edad, país de nacimiento, coinfección con VIH y VHC, factores de riesgo asociados a la infección), analíticos, clínicos (grado de afectación hepática, evolución de la enfermedad) y de tratamiento.
Detección de anticuerpos. Se realizó mediante una prueba de inmunoensayo quimioluminiscente (LIAISON® XL Murex Anti-HDV Assay; Diasorin, Saluggia, Italia).
Detección de ARN vírico. Se realizó por PCR con retrotranscripción (Lightmix® kit Hepatitis D virus, TibMolBiol) previa extracción del ARN por el sistema EasyMag® (Biomerieux). Entre los años 2010 y 2014 se realizó una PCR cualitativa y a partir de esa fecha se cuantificó la carga vírica con la misma prueba de PCR, la cual permite detectar menos de 10 copias/mL. A todos los pacientes se les realizó en al menos una muestra la carga viral con otros dos sistemas de cuantificación comercializados, validados para la cuantificación de todos los genotipos (Roboscreen® HDV RNA Quantification kit 2.0; Roboscreen Diagnostics y Hepatitis Delta RT-PCR system kit® Vircell), los cuales permiten detectar menos de 10 copias/mL siguiendo las recomendaciones del fabricante.
Genotipado. Se realizó por secuenciación masiva (NGS). Se utilizó una estrategia de secuenciación basada en amplicones de longitud casi completa utilizando cebadores superpuestos15. Estos amplicones se secuenciaron utilizando la tecnología Illumina y las bibliotecas resultantes se procesaron utilizando el sistema NextSeq 1000. Para el ensamblaje se utilizó el software CLC-Genomics-Workbench, que emplea secuencias de referencia de varios genotipos obtenidos de la base de datos del virus de la hepatitis delta (https://hdvdb.bio.wzw.tum.de/hdvdb/).
Análisis estadístico. Las variables categóricas fueron comparadas con la prueba de chi cuadrado y se consideraron diferencias estadísticamente significativas valores de p<0,05.
Aspectos éticos. El estudio fue aprobado por el Comité Ético del Hospital Universitario de Gran Canaria Dr. Negrín (Código CEIm 2024-055-1).
ResultadosEn nuestra área hay 444 pacientes diagnosticados de infección crónica por VHB, de los cuales 25 (5,6%) tienen infección por el VHD (prevalencia: 7,1 por 100.000 personas; 0,007%). De los 444 pacientes, 340 (76,6%) están en seguimiento en la Unidad de Hepatología y 104 no acuden a las consultas (uno de ellos con infección por VHD sin viremia). De los 340 pacientes en seguimiento, 24 (7,1%) presentaban anticuerpos frente al VHD, y de estos, en 6 (25,0%) se detectó ARN viral en suero. La detección del ARN viral se realizó en todos los pacientes, en al menos una muestra, con las tres técnicas de PCR utilizadas, con una completa concordancia. En todos los casos la infección por VHD se diagnosticó de forma simultánea al VHB, sin poder determinar si se trataba de una coinfección o sobreinfección. La prevalencia de infección crónica por VHD entre portadores del VHB fue del 1,8% y la prevalencia de infección crónica diagnosticada en nuestra población fue de 1,7 casos por 100.000 habitantes. En todos los pacientes con viremia se realizó el tipado y todos presentaban una infección por el genotipo 1.
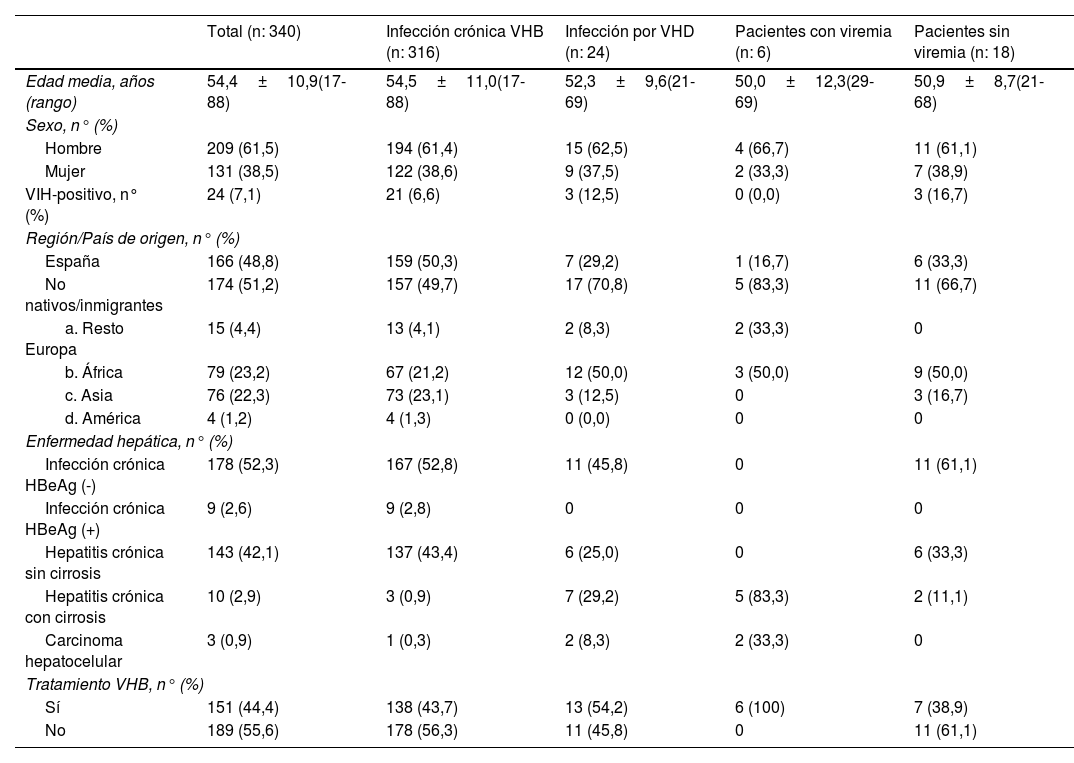
En la tabla 1 se comparan las características clínico-epidemiológicas de los pacientes con infección crónica por el VHB y los pacientes con infección por VHB y VHD, diferenciando pacientes con viremia y sin viremia. Con respecto a las características epidemiológicas, el 15,2% de los pacientes de origen africano tenían infección por el VHD (91,7% subsaharianos), frente al 4,2% de los españoles y 3,9% de los asiáticos (uno de China, uno de India y uno de Pakistán). De los siete pacientes españoles, dos tenían antecedentes de adicción a drogas y en otros dos la transmisión fue probablemente por contacto familiar. En relación con las características clínicas, el 29,2% de los pacientes con infección por VHD presentaban cirrosis, frente al 0,9% de los monoinfectados por el VHB (p<0,05).
Características clínico-epidemiológicas de los pacientes con infección crónica por virus de hepatitis B (VHB) y con infección crónica con virus de hepatitis D (VHD), con y sin viremia
| Total (n: 340) | Infección crónica VHB (n: 316) | Infección por VHD (n: 24) | Pacientes con viremia (n: 6) | Pacientes sin viremia (n: 18) | |
|---|---|---|---|---|---|
| Edad media, años (rango) | 54,4±10,9(17-88) | 54,5±11,0(17-88) | 52,3±9,6(21-69) | 50,0±12,3(29-69) | 50,9±8,7(21-68) |
| Sexo, n° (%) | |||||
| Hombre | 209 (61,5) | 194 (61,4) | 15 (62,5) | 4 (66,7) | 11 (61,1) |
| Mujer | 131 (38,5) | 122 (38,6) | 9 (37,5) | 2 (33,3) | 7 (38,9) |
| VIH-positivo, n° (%) | 24 (7,1) | 21 (6,6) | 3 (12,5) | 0 (0,0) | 3 (16,7) |
| Región/País de origen, n° (%) | |||||
| España | 166 (48,8) | 159 (50,3) | 7 (29,2) | 1 (16,7) | 6 (33,3) |
| No nativos/inmigrantes | 174 (51,2) | 157 (49,7) | 17 (70,8) | 5 (83,3) | 11 (66,7) |
| a. Resto Europa | 15 (4,4) | 13 (4,1) | 2 (8,3) | 2 (33,3) | 0 |
| b. África | 79 (23,2) | 67 (21,2) | 12 (50,0) | 3 (50,0) | 9 (50,0) |
| c. Asia | 76 (22,3) | 73 (23,1) | 3 (12,5) | 0 | 3 (16,7) |
| d. América | 4 (1,2) | 4 (1,3) | 0 (0,0) | 0 | 0 |
| Enfermedad hepática, n° (%) | |||||
| Infección crónica HBeAg (-) | 178 (52,3) | 167 (52,8) | 11 (45,8) | 0 | 11 (61,1) |
| Infección crónica HBeAg (+) | 9 (2,6) | 9 (2,8) | 0 | 0 | 0 |
| Hepatitis crónica sin cirrosis | 143 (42,1) | 137 (43,4) | 6 (25,0) | 0 | 6 (33,3) |
| Hepatitis crónica con cirrosis | 10 (2,9) | 3 (0,9) | 7 (29,2) | 5 (83,3) | 2 (11,1) |
| Carcinoma hepatocelular | 3 (0,9) | 1 (0,3) | 2 (8,3) | 2 (33,3) | 0 |
| Tratamiento VHB, n° (%) | |||||
| Sí | 151 (44,4) | 138 (43,7) | 13 (54,2) | 6 (100) | 7 (38,9) |
| No | 189 (55,6) | 178 (56,3) | 11 (45,8) | 0 | 11 (61,1) |
HBeAg: antígeno e del virus de hepatitis B.
Dos pacientes con infección por VHD sin viremia presentaban cirrosis; uno inició recientemente tratamiento antiviral con entecavir y el otro, de origen indio, diagnosticado y tratado para el VHB desde hace más de 25 años, mantiene cargas virales indetectables para ambos virus, aunque presenta progresión de la enfermedad hepática. El tiempo medio de seguimiento de los 18 pacientes no virémicos fue de 13,5±7,2 (intervalo: 1-36) años; el 61,1% llevan más de 10 años de seguimiento en nuestro hospital.
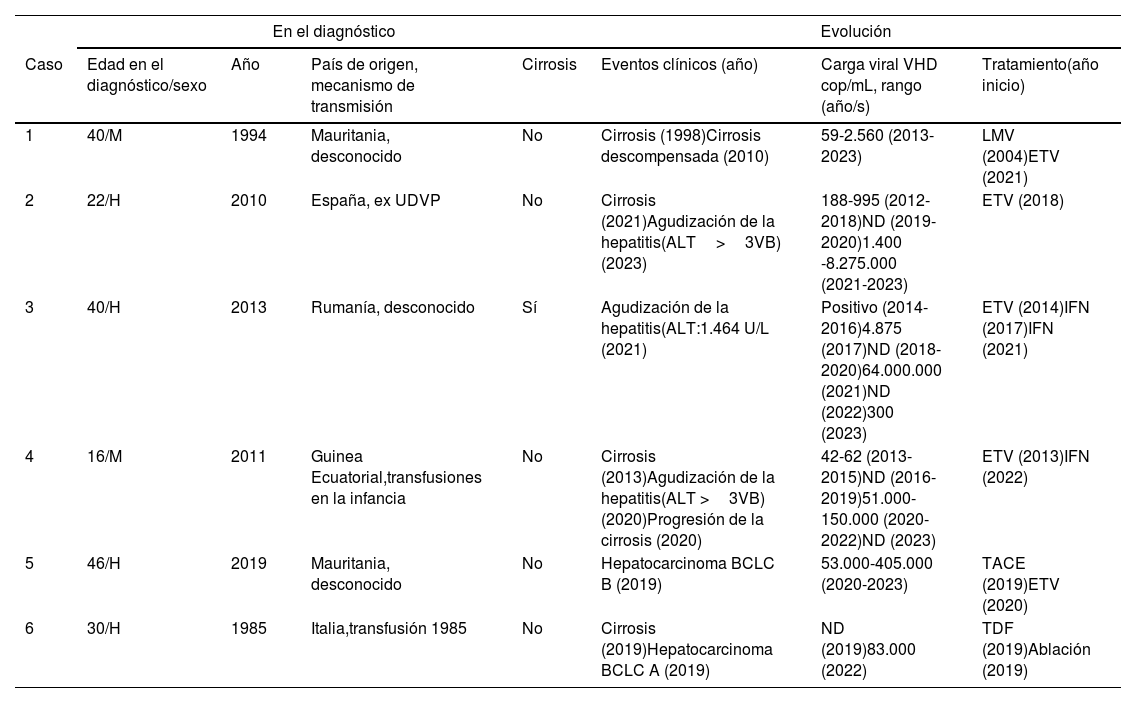
En la tabla 2 se recoge la evolución clínica de los seis pacientes con infección crónica por VHD. En el momento del diagnóstico solo un paciente presentaba cirrosis y otro un carcinoma hepatocelular. A pesar de recibir tratamiento para la hepatitis B con respuesta virológica, la enfermedad hepática empeoró en todos los pacientes. El único candidato a trasplante hepático fue el paciente 6, actualmente en lista de espera. Ningún paciente presentó coinfección con otros virus hepatotropos, ni ninguna condición que favoreciera la progresión de la fibrosis. A lo largo del seguimiento, la mitad de los pacientes virémicos presentó una reagudización del cuadro clínico, con elevación de la carga vírica y de las transaminasas y progresión de la enfermedad hepática (pacientes 2, 3 y 4). Dos pacientes (pacientes 3 y 4) recibieron tratamiento con interferón (IFN). El paciente 3 recibió dos ciclos de IFN durante 48 semanas (uno en 2017 y otro en 2021), consiguiendo la negativización del ARN vírico a los pocos meses del inicio del mismo y que mantuvo más de un año después de su retirada, pero con recaída posterior. La paciente 4 logró la resolución de la infección con negativización del HBsAg.
Caracterísiticas clínico-epidemiológicas y evolución de los seis pacientes con infección crónica por virus de hepatitis D (VHD)
| En el diagnóstico | Evolución | ||||||
|---|---|---|---|---|---|---|---|
| Caso | Edad en el diagnóstico/sexo | Año | País de origen, mecanismo de transmisión | Cirrosis | Eventos clínicos (año) | Carga viral VHD cop/mL, rango (año/s) | Tratamiento(año inicio) |
| 1 | 40/M | 1994 | Mauritania, desconocido | No | Cirrosis (1998)Cirrosis descompensada (2010) | 59-2.560 (2013-2023) | LMV (2004)ETV (2021) |
| 2 | 22/H | 2010 | España, ex UDVP | No | Cirrosis (2021)Agudización de la hepatitis(ALT>3VB) (2023) | 188-995 (2012-2018)ND (2019-2020)1.400 -8.275.000 (2021-2023) | ETV (2018) |
| 3 | 40/H | 2013 | Rumanía, desconocido | Sí | Agudización de la hepatitis(ALT:1.464 U/L (2021) | Positivo (2014-2016)4.875 (2017)ND (2018-2020)64.000.000 (2021)ND (2022)300 (2023) | ETV (2014)IFN (2017)IFN (2021) |
| 4 | 16/M | 2011 | Guinea Ecuatorial,transfusiones en la infancia | No | Cirrosis (2013)Agudización de la hepatitis(ALT >3VB) (2020)Progresión de la cirrosis (2020) | 42-62 (2013-2015)ND (2016-2019)51.000-150.000 (2020-2022)ND (2023) | ETV (2013)IFN (2022) |
| 5 | 46/H | 2019 | Mauritania, desconocido | No | Hepatocarcinoma BCLC B (2019) | 53.000-405.000 (2020-2023) | TACE (2019)ETV (2020) |
| 6 | 30/H | 1985 | Italia,transfusión 1985 | No | Cirrosis (2019)Hepatocarcinoma BCLC A (2019) | ND (2019)83.000 (2022) | TDF (2019)Ablación (2019) |
H: hombre; M: mujer; UDVP: usuario de drogas vía parenteral; ND: no detectable; VB: valor basal; TACE: quimioembolización transarterial; LMV: lamivudina; ETV: entecavir; IFN: interferón; TDF: tenofovir diproxil fumarato.
La hepatitis delta es la forma más grave de hepatitis viral crónica, con progresión frecuente a cirrosis y hepatocarcinoma16. Debido a las campañas de vacunación frente al VHB, la prevalencia de hepatitis delta se ha reducido, ya que las generaciones más jóvenes están protegidas frente al VHB y, por lo tanto, también frente al VHD9. En Europa, solo en algunos países de Europa del este, la infección por VHD permanece endémica17. En España, en los pocos estudios epidemiológicos publicados, se observa una disminución en la seroprevalencia en los últimos años y un cambio en la epidemiología. La incidencia se ha reducido drásticamente en las personas adictas a drogas18; sin embargo, la inmigración y la transmisión sexual emergen como factores de riesgo19,20.
En nuestro estudio, la seroprevalencia del VHD entre los portadores del HBsAg fue similar al estimado en el estudio de seroprevalencia nacional8 y la prevalencia de infección crónica fue del 1,8%. Esta baja prevalencia es acorde con lo esperado, debido a la reducción de la transmisión por la vacunación y a la progresión heterogénea de una enfermedad para la que hasta ahora el único tratamiento curativo era el trasplante, por lo que los pacientes en los que la enfermedad no progresa se espera que tengan cargas virales bajas o indetectables, como se ha observado en algún estudio21. Nuestro trabajo pone en valor este dato de baja prevalencia, ya que desde hace más de 30 años se realiza el diagnóstico reflejo en todos los portadores del HBsAg. Por tanto, parece esperable que la mayoría de los pacientes que diagnostiquemos procedan de áreas endémicas, en donde la prevalencia es alta y la cobertura vacunal baja, o bien se trate de pacientes que se hayan infectado hace más de 30 años, en los que la enfermedad haya presentado una lenta progresión.
Existen pocos estudios longitudinales que evalúen en un largo periodo la evolución de los pacientes, por lo que se desconocen los factores de riesgo de peor evolución, si bien se han señalado entre ellos la viremia persistente y el genotipo12,21–24. La mayoría de nuestros pacientes con anticuerpos sin viremia no presentaban hepatitis ni tuvieron en ningún momento reactivación de la viremia a pesar de tener un seguimiento largo, por lo que lo más probable es que hayan resuelto espontáneamente la infección. Sin embargo, todos los pacientes con viremia presentaron una hepatopatía crónica avanzada, sin mejoría clínica. Solo un paciente sin viremia presentó un comportamiento similar, con progresión de la enfermedad a pesar de la negativización del ADN del VHB. Debido a las limitaciones de las pruebas diagnósticas y a que están solo estandarizadas para la detección del genotipo 1, no se podría descartar un falso negativo, ya que en las infecciones con genotipos diferentes de 1 la sensibilidad podría variar. Además, la mayoría de las veces se utilizan pruebas de PCR poco sensibles, en donde la sensibilidad y reproducibilidad, principalmente en muestras con viremias bajas, podría verse afectada. Una sensibilidad reducida podría diagnosticar a pacientes con viremias con baja carga como pacientes no virémicos o con viremias transitorias, como recientemente se ha descrito25. En nuestro estudio, las viremias transitorias siempre se han producido en pacientes con valores bajos de la carga vírica o cuando los pacientes estaban en tratamiento con interferón. Por ello, creemos que debe ser prioritario el uso de pruebas diagnósticas de PCR cuantitativas sensibles, que permitan indicar el tratamiento para todos los pacientes con replicación. También sería necesario el desarrollo y estandarización de pruebas que permitan conocer la sensibilidad de la cuantificación de genotipos no 1.
A lo largo del seguimiento, dos pacientes recibieron tratamiento con interferón con negativización de la viremia, que mantuvo unos meses después de concluido el tratamiento, pero con recaída posterior, como se ha descrito previamente26,27, aunque otra paciente logró la resolución de la infección con negativización del HBsAg.
Nuestro estudio presenta como limitaciones el ser un estudio local y retrospectivo. Estudios multicéntricos, con un mayor número de pacientes, pueden aclarar el papel de esta infección en nuestro medio. Por otra parte, el uso de pruebas moleculares de cuantificación de la viremia más sensibles permitirá conocer la verdadera carga de la enfermedad y mejorar su manejo.
Este estudio tiene interés debido a que en nuestra área sanitaria desde hace más de 30 años se realiza un diagnóstico reflejo a todos los portadores del VHB con detección de anticuerpos frente al VHD y desde hace 13 años, además, se realiza en todos los casos la PCR. Adicionalmente, hemos realizado la detección de la carga viral con tres pruebas diagnósticas diferentes de PCR a todos los pacientes en al menos una muestra, con una muy buena concordancia; por tanto, podemos concluir que en nuestra área sanitaria hay una baja prevalencia de hepatitis crónica por el VHD, que se presenta como una enfermedad avanzada y que todos los pacientes pertenecen a grupos de riesgo establecidos. En todos los casos se detectó el genotipo 1. En la actualidad, la mayor parte de los pacientes con anticuerpos para el VHD sin datos de viremia, probablemente hayan resuelto su infección. Recientemente se han publicado unas guías de manejo de la infección por el VHD28, enfermedad poco prevalente en nuestro entorno que, si bien no supone un gran problema de salud pública, constituye un grave problema de salud para el paciente que la padece. Si bien la adquisición por vía parenteral está en regresión, podremos ver nuevos casos asociados sobre todo a los movimientos migratorios.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.