Hasta en 10-20% de los pacientes con cancer, la causa de muerte se puede atribuir a desnutrición. Los pacientes con sarcopenia presentan más toxicidad a la quimioterapia, menos tiempo libre de progresión, menor capacidad funcional y más complicaciones quirúrgicas. Los tratamientos antineoplásicos tienen una alta prevalencia de efectos adversos que comprometen al estado nutricional. Los nuevos quimioterápicos presentan toxicidad directa sobre el tubo digestivo (náuseas, vómitos, diarrea y/o mucositis). Presentamos la frecuencia de efectos adversos con impacto nutricional de los quimioterápicos utilizados en el tratamiento de tumores sólidos más frecuentes, así como estrategias para realizar el diagnóstico precoz y el tratamiento nutricional.
Material y métodosRevisión de tratamientos oncológicos de uso habitual (citotóxicos, inmunoterapia, terapias dirigidas) en cáncer colorrectal, hepático, pancreas, pulmón, melanoma, vejiga, ovario, próstata y riñón. Se registra la frecuencia (%) de efectos grastrointestinales y los de grado ≥ 3. Se realizó una búsqueda bibliográfica sistemática en PubMed, Embase, UpToDate, guías internaciones y fichas técnicas.
ResultadosSe muestran en forma de tablas en las que aparecen los fármacos junto con la probabilidad de que presenten cualquier efecto adverso digestivo y el porcentaje de efectos adversos graves (grado ≥ 3).
DiscusiónLos antineoplásicos se asocian a alta frecuencia de complicaciones digestivas con repercusión nutricional, lo que pueden disminuir la calidad de vida y provocar la muerte como consecuencia de la desnutrición o por el efecto limitante de tratamientos subóptimos, cerrando el círculo desnutrición-toxicidad.
Es necesario informar al paciente sobre los riesgos y establecer protocolos locales respecto al uso de fármacos antidiarreicos, antieméticos y adyuvantes en el manejo de la mucositis. Proponemos algoritmos de actuación y consejos dietéticos que pueden utilizarse directamente en consulta, para prevenir las consecuencias negativas de la desnutrición.
The cause of death can be attributed to malnutrition in 10-20% of cancer patients. Patients with sarcopenia present more chemotherapy toxicity, less progression-free time, less functional capacity and more surgical complications. Antineoplastic treatments have a high prevalence of adverse effects that compromise nutritional status. The new chemotherapy agents present direct toxicity on the digestive tract (nausea, vomiting, diarrhea and/or mucositis). We present the frequency of adverse effects with nutritional impact of the most frequent chemotherapy agents used in the treatment of solid tumors, as well as strategies for early diagnosis and nutritional treatment.
Material and methodsReview of commonly used cancer treatments (cytotoxic agents, immunotherapy, targeted therapies) in colorectal, liver, pancreatic; lung, melanoma, bladder, ovary, prostate and kidney cancer. The frequency (%) of gastrointestinal effects, and those of grade ≥ 3 are recorded. A systematic bibliographic search was carried out in PubMed, Embase, UpToDate, international guides and technical data sheets.
ResultsThey are shown in the form of tables in which the drugs appear together with the probability that they present any digestive adverse effect and the percentage of serious adverse effects (Grade ≥ 3).
DiscussionAntineoplastic drugs are associated with a high frequency of digestive complications with nutritional repercussions, which can reduce QoL and cause death as a result of malnutrition or due to the limiting effect of suboptimal treatments, closing the malnutrition-toxicity loop.
It is necessary to inform the patient about the risks and establish local protocols regarding the use of antidiarrheal drugs, antiemetics and adjuvants in the management of mucositis. We propose action algorithms and dietary advice that can be used directly in clinical practice, to prevent the negative consequences of malnutrition.
El cáncer es una de las principales causas de morbimortalidad del mundo. Los datos más recientes disponibles de incidencia, prevalencia y mortalidad por cáncer en nuestro medio son del informe anual de la Sociedad Española de Oncología Médica.El número de cánceres diagnosticados en España en el año 2021 se estima en 276.239 casos, según los cálculos de la Red Española de Registros de Cáncer (REDECAN), aunque esta cifra puede variar, ya que esta estimación no incluye el posible efecto de la pandemia de la COVID-19. Los cánceres más frecuentemente diagnosticados son los de colon y recto (43.581 nuevos casos), próstata (35.764), mama (33.375), pulmón (29.549) y vejiga urinaria (20.613).
Respecto a la mortalidad, el cáncer sigue constituyendo una de las principales causas de mortalidad mundial, con aproximadamente 9,9 millones de muertes relacionadas con tumores en 2020. Los cánceres responsables del mayor número de fallecimientos, a nivel mundial, fueron el cáncer de pulmón (18% del total de muertes por cáncer), el cáncer colorrectal (9,4%), el cáncer de hígado (8,3%), el cáncer de estómago (7,7%) y el cáncer de mama (6,9%)1.
La desnutrición es una complicación frecuente en el paciente con cáncer. En las diferentes series publicadas afecta a 20-70% de los pacientes, dependiendo de la edad, el tipo de cáncer y el estadio tumoral, siendo más frecuente en los pacientes de mayor edad, con tumores más avanzados y en determinadas localizaciones. Los pacientes con tumores del tracto gastrointestinal, cabeza y cuello, hígado y pulmón son los que presentan desnutrición con mayor frecuencia2. Se estima que hasta en 10-20% de los pacientes con cáncer la causa de muerte se puede atribuir a la desnutrición3. Por otra parte, los pacientes con sarcopenia presentan más toxicidad a la quimioterapia, menos tiempo libre de progresión tumoral, menor capacidad funcional y más complicaciones quirúrgicas4,5.
La desnutrición en el paciente con cáncer se debe a la activación de una respuesta inflamatoria sistémica condicionada por las moléculas producidas por el tumor y la consecuente activación de diferentes rutas que producen anorexia, pérdida de peso y sarcopenia. La anorexia es un síntoma que se debe a una alteración de las vías del apetito a nivel del sistema nervioso central producido por el propio tumor o sus complicaciones (náuseas, diarrea, dolor)2. Se diferencia de la caquexia cancerosa, que se define como un síndrome caracterizado por pérdida de peso involuntaria junto con disminución de masa magra, con o sin pérdida de masa grasa, que no puede ser revertido con terapia nutricional convencional y que conduce a deterioro funcional6. Es importante detectar la desnutrición de forma precoz para instaurar lo más pronto posible una terapia médica nutricional. Por ello, se deben instaurar programas de cribado de desnutrición en estos pacientes; lo que, junto con el control del dolor y otros síntomas y un abordaje psicosocial, son igualmente importantes en el tratamiento del paciente con cáncer. Existen datos de aumento de la calidad de vida cuando se trata al paciente de forma global7.
Los tratamientos antineoplásicos dirigidos a reducir o eliminar las células tumorales son uno de los pilares del tratamiento del paciente con cáncer. Sin embargo, no hay que olvidar que estos tratamientos tienen potencialmente una alta prevalencia de efectos adversos, de los cuales, los que comprometen al estado nutricional, mediante alteraciones en las funciones digestivas son los más frecuentes.
En la actualidad se dispone de un amplio abanico de fármacos con actividad antineoplásica. A los quimioterápicos clásicos se han unido dos nuevos grupos de fármacos: aquellos dirigidos contra las dianas moleculares (agentes biológicos o terapias dirigidas) y la inmunoterapia. Las terapias dirigidas bloquean moléculas específicas implicadas en la proliferación y crecimiento de las células cancerosas. Los fármacos inhibidores del punto de control inmunológico (inmunoterapia) actúan contra las células tumorales a través del propio sistema inmune.
Comparado con la quimioterapia convencional, estos fármacos son más específicos y producen menos efectos tóxicos8,9. Aun así, no están exentos de efectos adversos, bien porque se administran durante periodos de tiempo prolongados o porque son capaces de inducir una gran variedad de efectos tóxicos directos sobre el tubo digestivo, tales como náuseas, vómitos, diarrea y/o mucositis. Estos efectos secundarios son reversibles con el tiempo, pero pueden contribuir a deteriorar el estado nutricional, razón por la que se recomienda una búsqueda activa para poder detectar la desnutrición de forma precoz.
La capacidad emetógena de lo citostáticos utilizados en monoterapia es muy variable y la utilización de fármacos en combinación incrementa su incidencia e intensidad. A pesar del uso generalizado de tratamientos para la prevención de las náuseas y vómitos inducidos por quimioterapia, este efecto adverso continúa presentándose en un alto porcentaje de pacientes (alrededor de 50%), siendo más común en los fármacos quimioterápicos clásicos, como el cisplatino, que en los agentes biológicos diana-específicos, fármacos antidiana o terapias dirigidas. A nivel intestinal puede producirse tanto diarrea como estreñimiento, dependiendo del fármaco utilizado. La diarrea es un efecto adverso muy frecuente (> 10% de los pacientes) en fármacos como la capecitabina y el irinotecán. Se trata de una toxicidad limitante de dosis, que se potencia con la asociación a otros fármacos quimioterápicos (por ejemplo, la combinación de cetuximab con irinotecán en cáncer colorrectal). Este efecto adverso también es común en la terapia dirigida, especialmente en los inhibidores de la tirosina-cinasa (TKI) del receptor del factor de crecimiento epidérmico (EGFR) y del receptor del factor de crecimiento endotelial vascular (VEGFR). Por lo que respecta a la mucositis, entendida como la inflamación de la mucosa digestiva, desde la boca hasta el ano, es un efecto secundario muy frecuente, apareciendo hasta en 35-40% de los pacientes que reciben quimioterapia10.
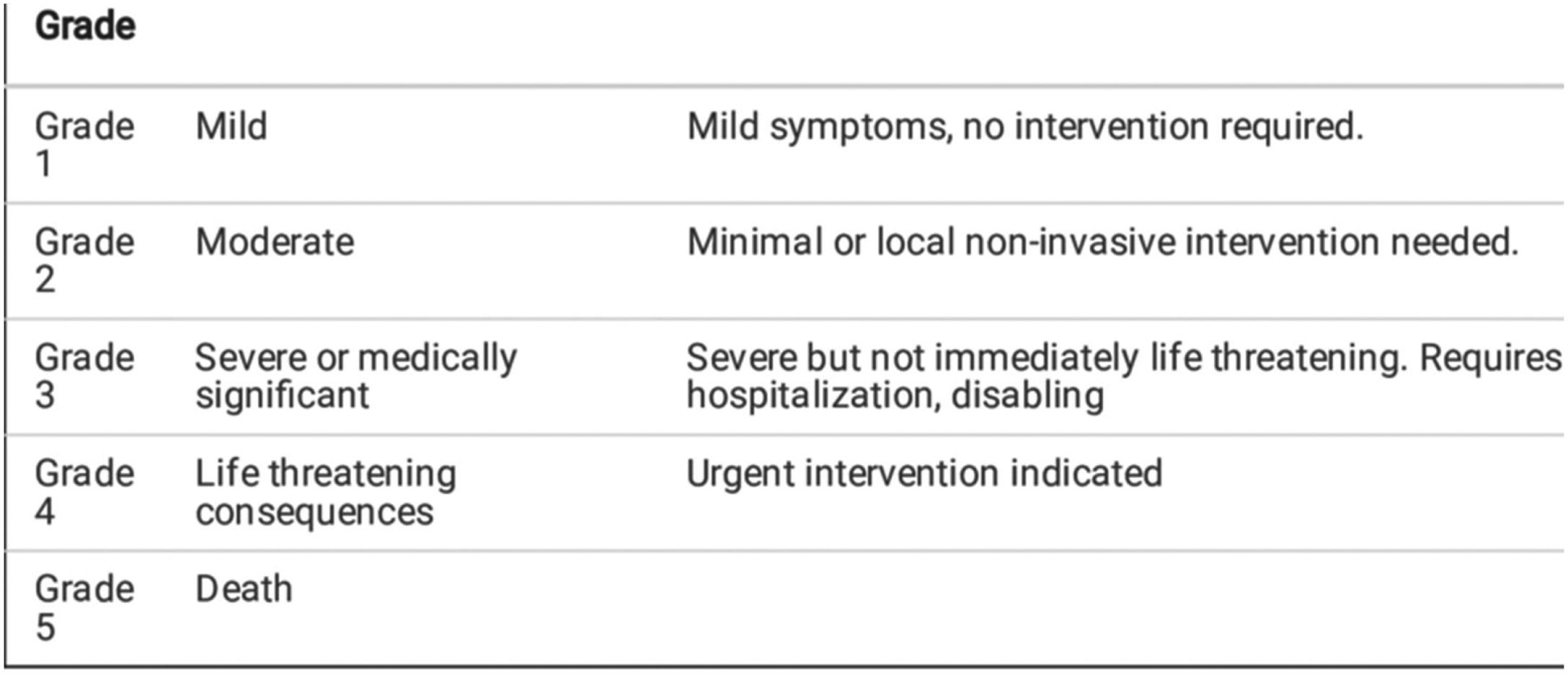
La toxicidad debe ser evaluada en lo que respecta a su gravedad, momento de aparición (inmediata, precoz, retardada o tardía) y duración. Los criterios comunes de toxicidad se encuadran según la gravedad y la afectación de los diferentes órganos o sistemas. Cada centro puede emplear un sistema de gradación de la toxicidad, siendo los más empleados los del National Cancer Institute, (Common Terminology Criteria for Adverse Events v5.0)11 (tabla 1), los del Eastern Cooperative Oncology Group (ECOG)12o los de la Organización Mundial de la Salud13. También existen escalas autoadministradas como la Patient Reported Outocomes-Common Toxicity Criteria for Adverse Events (PRO-CTCAE)14.
En esta revisión presentamos la frecuencia de efectos adversos con impacto a nivel nutricional (náuseas, vómitos, diarrea, mucositis) de los fármacos quimioterápicos utilizados con mayor frecuencia en el tratamiento de los tumores sólidos más frecuentes, así como las estrategias para realizar un diagnóstico precoz y un tratamiento nutricional adaptado a cada tipo de toxicidad.
Material y métodosSe realizó una revisión de todos los tratamientos oncológicos de uso clínico habitual en España incluyendo los fármacos citotóxicos, la inmunoterapia, las terapias dirigidas y cualquier combinación de los mismos, para la terapia de los tumores sólidos más frecuentes del aparato digestivo (colorrectal, hepático y páncreas); cáncer de pulmón, melanoma, y tumores genitourinarios (urotelial, ovario, próstata y riñón). Se registra la frecuencia (%) de efectos adversos grastrointestinales, de cualquier grado, tales como la diarrea, náuseas/vómitos y mucositis; así como los de grado igual o superior a 3.
Una vez recopilados, se realizó una búsqueda bibliográfica sistemática. Para ello se han utilizado las bases de datos electrónicas PubMed, Embase y UpToDate, realizando las modificaciones pertinentes según los requisitos de cada base de datos, y empleando los operadores de búsqueda «AND» y «OR». Se utilizó el término «cancer therapy» combinado sucesivamente con los siguientes: «gastrointestinal toxicity» y «cancer chemotherapy». Se incluyeron metaanálisis, revisiones sistemáticas y ensayos clínicos, así como las guías internaciones que aportasen buena evidencia sobre la toxicidad del tratamiento oncológico. Además de la búsqueda en bases de datos electrónicas, se revisaron todas las fichas técnicas de los medicamentos, de acuerdo con los estudios que avalan su autorización.
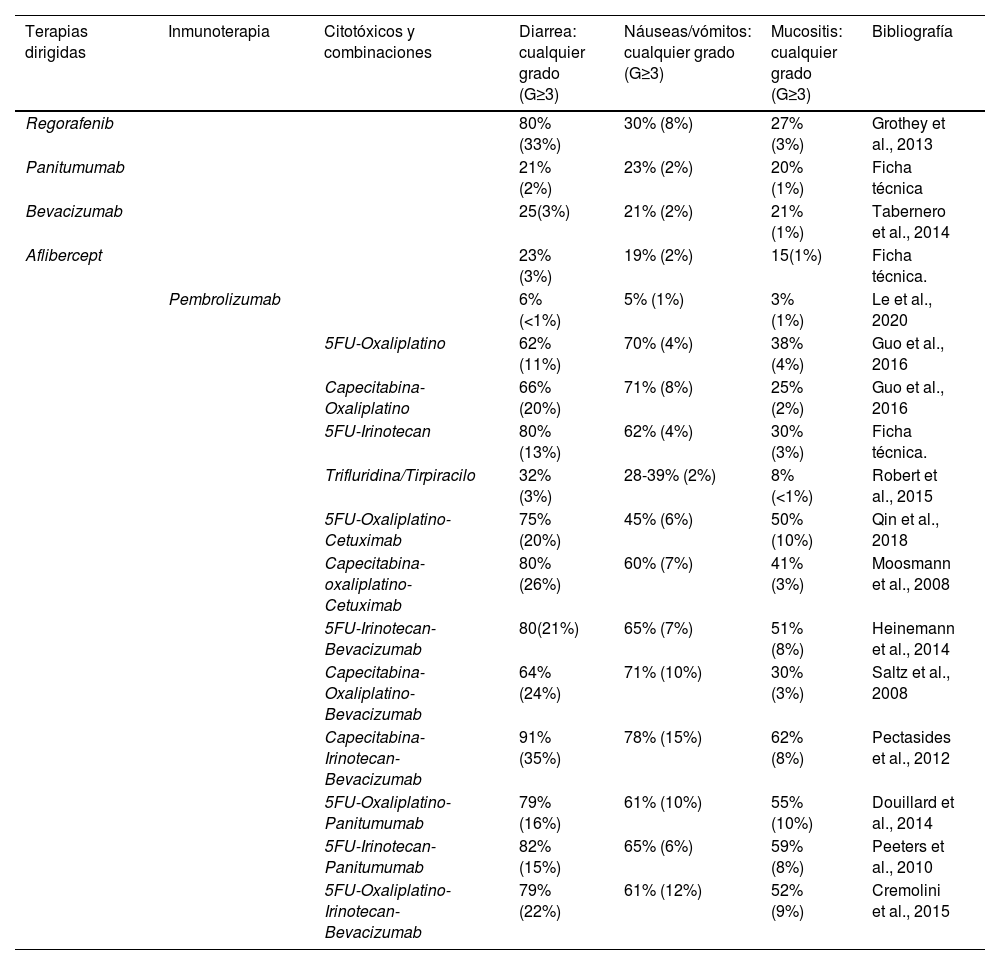
ResultadosLos resultados se expresan en forma de tabla en las que aparecen los fármacos comúnmente utilizados en el tratamiento de cada tipo de tumor, junto con la probabilidad de que presenten cualquier efecto adverso digestivo y, entre paréntesis, el porcentaje de efectos adversos graves (grado igual o superior a 3) (tabla 2).
Efectos adversos comunes de los distintos tratamientos quimioterápicos. Fármacos para el tratamiento del cáncer de colon y recto
| Terapias dirigidas | Inmunoterapia | Citotóxicos y combinaciones | Diarrea: cualquier grado (G≥3) | Náuseas/vómitos: cualquier grado (G≥3) | Mucositis: cualquier grado (G≥3) | Bibliografía |
|---|---|---|---|---|---|---|
| Regorafenib | 80% (33%) | 30% (8%) | 27% (3%) | Grothey et al., 2013 | ||
| Panitumumab | 21% (2%) | 23% (2%) | 20% (1%) | Ficha técnica | ||
| Bevacizumab | 25(3%) | 21% (2%) | 21% (1%) | Tabernero et al., 2014 | ||
| Aflibercept | 23% (3%) | 19% (2%) | 15(1%) | Ficha técnica. | ||
| Pembrolizumab | 6% (<1%) | 5% (1%) | 3% (1%) | Le et al., 2020 | ||
| 5FU-Oxaliplatino | 62% (11%) | 70% (4%) | 38% (4%) | Guo et al., 2016 | ||
| Capecitabina-Oxaliplatino | 66% (20%) | 71% (8%) | 25% (2%) | Guo et al., 2016 | ||
| 5FU-Irinotecan | 80% (13%) | 62% (4%) | 30% (3%) | Ficha técnica. | ||
| Trifluridina/Tirpiracilo | 32% (3%) | 28-39% (2%) | 8% (<1%) | Robert et al., 2015 | ||
| 5FU-Oxaliplatino-Cetuximab | 75% (20%) | 45% (6%) | 50% (10%) | Qin et al., 2018 | ||
| Capecitabina-oxaliplatino-Cetuximab | 80% (26%) | 60% (7%) | 41% (3%) | Moosmann et al., 2008 | ||
| 5FU-Irinotecan-Bevacizumab | 80(21%) | 65% (7%) | 51% (8%) | Heinemann et al., 2014 | ||
| Capecitabina-Oxaliplatino-Bevacizumab | 64% (24%) | 71% (10%) | 30% (3%) | Saltz et al., 2008 | ||
| Capecitabina-Irinotecan-Bevacizumab | 91% (35%) | 78% (15%) | 62% (8%) | Pectasides et al., 2012 | ||
| 5FU-Oxaliplatino-Panitumumab | 79% (16%) | 61% (10%) | 55% (10%) | Douillard et al., 2014 | ||
| 5FU-Irinotecan-Panitumumab | 82% (15%) | 65% (6%) | 59% (8%) | Peeters et al., 2010 | ||
| 5FU-Oxaliplatino-Irinotecan-Bevacizumab | 79% (22%) | 61% (12%) | 52% (9%) | Cremolini et al., 2015 |
| Fármacos para el tratamiento del cáncer hepatocelular | |||||
|---|---|---|---|---|---|
| Terapias dirigidas | Citotóxico | Diarrea: cualquier grado (G≥3) | Nauseas/vómitos: cualquier grado (G≥3) | Mucositis: cualquier grado (G≥3) | Bibliografía |
| Cabozantinib | 54-74% (10%) | 31-50% (2%) | 13-51% (1-5%) | Abou-Alfa et al., 2018 | |
| Lenvatinib | 39% (4%) | 20% (1%) | Kudo et al., 2018 | ||
| Regorafenib | 41% (3%) | 17% (1%) | 13% (1%) | Bruix et al., 2017 | |
| Sorafenib | 46% (4%) | 14% (1%) | Kudo et al., 2018 | ||
| Fármacos para el tratamiento del cáncer de páncreas | ||||
|---|---|---|---|---|
| Citotóxicos y combinaciones | Diarrea: cualquier grado (G≥3) | Náuseas/vómitos: cualquier grado (G≥3) | Mucositis: cualquier grado (G≥3) | Bibliografía |
| Gemcitabina | 9% (<2%) | 21% (%) | 10(<1%) | Burris et al., 1997 |
| Gemcitabina + Nab-paclitaxel | 30% (6%) | 45% (<1%) | Von Hoff et al., 2013 | |
| FOLFIRINOX* | 45% (12%) | 80% (14%) | Conroy et al., 2011 | |
| Gemcitabina + Capecitabina | 45% (5%) | (<7%) | (2%) | Neoptolemos et al., 2017 |
| Irinotecánliposoml + 5FU + Leucovorin | 59% (13% | 52% (11%) | Wang-Gillam et al., 2016 | |
| Oxaliplatino + fluoropirimidinas | 30% (<8%) | 40% (<5%) | Pelzer et al., 2011 | |
| Fármacos para el tratamiento del cáncer de pulmón | ||||||
|---|---|---|---|---|---|---|
| Terapias dirigidas | Inmunoterapia | Citotóxicos y combinaciones | Diarrea: cualquier grado (G≥3) | Náuseas/vómitos: cualquier grado (G≥3) | Mucositis: cualquier grado (G≥3) | Bibliografía |
| Afatinib | 74,7% (9,9%) | 20,7% (1,5%) | 30,1% (4,1%) | Ficha Técnica | ||
| Erlotinib | 57% | 33% | Ficha Técnica | |||
| Gefitinib | 46,6% (3,3%) | 16% (0,3%) | 6,8% (0,8%) | Ficha Técnica | ||
| Osimertinib | 49% (1,2%) | 20% | Ficha Técnica | |||
| Alectinib | 16% (0,7%) | 19% (0,5%) | Ficha Técnica | |||
| Crizotinib | 54% (8%) | 51% (10,7%) | Ficha Técnica | |||
| Brigatinib | 38-53% | 23% -24% | 0,13% | Camidge et al., 2018 | ||
| Pembrolizumab | 21% | 21% | Ficha técnica | |||
| Nivolumab | 16 (1,55%) | 26-14% | 2% | Ficha técnica | ||
| Nivolumab+Ipilimumab | 22% (5%) | 24% | Ficha Técnica | |||
| Atezolizumab | 19% | 14-22% | Ficha Técnica | |||
| Carboplatino+Pemetrexed | (1,4%) | Socinski et al., 2009 | ||||
| Carboplatino+Gemcitabina | (0,5%) | (1%) | Kosmidis et al., 2008 | |||
| Cisplatino+Pemetrexet | (6,1-7,2%) | Scagliotti et al., 2008 | ||||
| Cisplatino+Gemcitabina | (3,9-6,1%) | Scagliotti et al., 2008 | ||||
| Cisplatino+etopósido | (3%) | (11%) | Lara et al., 2009 | |||
| Cisplatino+ irinotecán | (19%) | (14%) | Lara et al., 2009 | |||
| Vinorelbina+Paclitaxel | 7,40% | 38,90% | Stathopouloset al., 2004 | |||
| Paclitaxel+Gemcitabina | (0,5%) | (1,4%) | Kosmidis et al., 2008 | |||
| Fármacos para el tratamiento del cáncer renal | |||||
|---|---|---|---|---|---|
| Terapias dirigidas y combinaciones | Inmunoterapia y combinaciones | Diarrea: cualquier grado (G≥3) | Nauseas/vómitos: cualquier grado (G≥3) | Mucositis: cualquier grado (G≥3) | Bibliografía |
| Sunitinib | 57% (8%) | 49% (3%) | Motzer et al., 2014 | ||
| Pazopanib | 46% (0%) | 31% (0%) | 15% (8%) | Ficha técnica | |
| Sorafenib | 46% (0%) | 31% (0%) | 15% (8%) | Khan et al., 2010; | |
| Axitinib | 55% (10%) | 33% (2%) | 15% (1%) | Ficha técnica | |
| Cabozantinib | 74% (11%) | 50% (4%) | 19% (<1%) | Choueiri et al., 2015 | |
| Tivozanib | 23% (2%) | 12% (1%) | 11% (1%) | Motzer et al., 2013 | |
| Afatinib | 75-95% (14%) | 25% (1%) | 30-70% (4-8%) | Ficha técnica | |
| Temsirolimus | 34% (5%) | 34% (1,6%) | 20% (1%) | Ficha técnica | |
| Everolimus | 27% (2%) | 46% (7%) | 23% (3%) | Choueiri et al., 2015 | |
| Axitinib-Pembrolizumab | 54,3% (9,1%) | 27,7% (0,9%) | 13,3% (0,9%) | Rini et al., 2019 | |
| Lenvatinib - Everolimus | 71,4% (0%) | 57,1% (0%) | 42% | Matsubara et al., 2018 | |
| Axitinib - Avelumab | 62,2% (6,7%) | 341% (1,4%) | 14,1% (1,2%) | Motzer et al., 2019 | |
| Nivolumab - Ipilimumab | 27% (4%) | 20% (1%) | 2% (0%) | Motzer et al., 2018 | |
| Nivolumab | 12% (1%) | 14% (<1%) | 3% (0%) | Motzer et al., 2015 | |
| Fármacos para el tratamiento del cáncer de urotelial | |||||
| Inmunoterapia | Citotóxicos y combinaciones | Diarrea: Cualquier grado (G≥3) | Náuseas/vómitos: Cualquier grado (G≥3) | Mucositis: Cualquier grado (G≥3) | Bibliografía |
| Pembrolizumab | 9% (1,1%) | 11% (0,4%) | Hussain et al., 2018 | ||
| Atezolizumab | 7% (0%) | 11% (0%) | Petrylak et al., 2018 | ||
| Avelumab | 16,6% (0,6%) | 15,7% (0,3%) | Powles et al., 2020 | ||
| Cistaplatino-Gemcitabina | (3%) | (22%) | (1%) | Van der Maaseet al., 2000 | |
| MVAC* | (8%) | (21%) | (18%) | Van der Maaseet al., 2000 | |
| Docetaxel | (4%) | (3-4%) | (5,3%) | Ficha técnica | |
| Vinflunina | 12,9% (1%) | 30,9% (2,9%) | 27,1% (2%) | Ficha técnica | |
| Fármacos para el tratamiento del cáncer de próstata | |||||
|---|---|---|---|---|---|
| Bloqueo androgénico | Citotóxicos | Diarrea: cualquier grado (G≥3) | Náuseas/vómitos: cualquier grado (G≥3) | Mucositis: cualquier grado (G≥3) | Bibliografía |
| Darolutamida | 6,9% (0%) | 5% (0,2%) | Fizaki et al., 2019 | ||
| Apalutamida | 16% | Ficha técnica | |||
| Abiraterona | 18% (1%) | 21-30% (2%) | Bono et al., 2011 | ||
| Enzalutamida | 11-22% | 12-14% | Beer et al., 2014 | ||
| Cabazitaxel | 39,7% (3,2%) | 26,2% (0%) | 7,9% (0%) | Wit et al., 2019 | |
| Docetaxel | 32% (4%) | 42% (4%) | 20% (5,3%) | Tannock et al., 2004 | |
| Fármacos para el tratamiento del melanoma | |||||
|---|---|---|---|---|---|
| Terapias dirigidas | Inmunoterapia | Diarrea: Cualquier grado (G≥3) | Nauseas/vómitos: Cualquier grado ((G≥3) | Mucositis: Cualquier grado (G≥3) | Bibliografía |
| Vemurafenib | 28-50% (2%) | 18-26% (1%) | - | McArthuer et al., 2014 | |
| Vemurafenib + Cobimetinib | 61% (7%) | 43% (1%) | - | Ascierto et al., 2016 | |
| Dabrafenib + Trametinib | 36% (1%) | 37% (1%) | - | Robert et al., 2019 | |
| Encorafenib + Binimetinib | 35% (3%) | 42% (2%) | - | Ascierto et al., 2020 | |
| Vismodegib | 17% (1-2%) | 32,7% (0%) | - | Basset-Seguin et al., 2015 | |
| Sonidegib | 30,4% (1,3%) | 38% (1,3%) | - | Lear et al., 2019 | |
| Pembrolizumab | 19% (0,8%) | 11% | - | Robert et al., 2019 | |
| Nivolumab | 13% | 12% | - | Robert et al., 2015 | |
| Ipilimumab | 38,4% (4,2%) | 33,9(1,3%) | - | Hodi et al., 2010 | |
| Nivolumab + Ipilimumab | 43% | 40% | - | Larkin et al., 2019 | |
| Cemiplimab | 13,2% (0,5%) | - | 2,4% (0%) | Migden et al., 2020 | |
| Avelumab | 9% (0%) | 9% (0%) | - | Kaufman et al., 2018 | |
| Fármacos para el tratamiento del cáncer de ovario | |||||
|---|---|---|---|---|---|
| Terapias dirigidas | Citotóxicos y combinaciones | Diarrea: Cualquier grado (G≥3) | Náuseas/vómitos: Cualquier grado (G≥3) | Mucositis: Cualquier grado (G≥3) | Bibliografía |
| Niraparib | 19,9% (0,3%) | 73% (3%) | Mirza et al., 2016 | ||
| Olaparib | 29% (2%) | 40-70% (2%) | Ficha técnica | ||
| Paclitaxel+carboplatino | 24,4% (2,8%) | 76,3% (5,9%)/45,5% (2,8%) | 20,4% (0,5%) | Andreas et al., 2003 | |
| Paclitaxel+Cisplatino | 33,1% (3,3%) | 90,9% (14,3%)/68,4% (10,4%) | 23% (0,3%) | Andreas et al., 2003 | |
| Gemcitabina+carboplatino | 14,8% (1,4%) | 42,3% (2,9%) vómitos | PfistererJ et al., 2006 | ||
En el cáncer colon y recto, el porcentaje de efectos adversos gastrointestinales es muy elevada, destacando la terapia con citotóxicos en combinación, en la llamada quimioterapia adyuvante. La capacidad emetógena del oxaliplatino es alta, y combinada con las fluoropirimidias (5-fluorouracilo y capecitabina) asciende a 70-71% (4-8% grado ≥ 3). En el grupo de fármacos de la terapia dirigida, tales como el bevacizumab (anti-VEGF) o panitumumab (anti-EGFR) en monoterapia, la frecuencia de náuseas y vómitos oscila entre 21-23%. No obstante, este grupo de fármacos suelen administrarse en asociación a otros citostáticos para aumentar su efectividad, pero también su toxicidad, aumentando hasta 45-78% (6-10% grado ≥ 3). Respecto a la diarrea, se observa que es el efecto adverso más frecuente y de mayor grado, destacando el irinotecán y cetuximab (anti-EGFR). La toxicidad de la terapia en combinación de citotóxicos y terapia dirigida puede aumentar desde 82% con 5FU-irinotecán + panitumumab, hasta 91% (35% grado ≥ 3) con la combinación capecitabina-irinotecán-bevacizumab. La mucositis es el menos frecuente, oscilando entre 25-62% en las terapias combinadas.
En el cáncer hepatocelular destaca la terapia dirigida. El cabozantinib en monoterapia, es el fármaco con mayores efectos adversos, produciendo diarrea hasta en 74% de los pacientes (10% grado ≥ 3); náuseas/vómitos en 50% y mucositis hasta en 51%.
Respecto al cáncer de páncreas, el tratamiento más utilizado es la combinación de fármacos citotóxicos. El esquema de FOLFIRINOX está asociado a unos efectos adversos elevados, produciendo náuseas/vómitos en 80% (14% grado ≥ 3) de los pacientes y diarrea en 45% (12% grado ≥ 3).
En el cáncer de pulmón de células no microcíticas, los anti-EGFR y los TKI, ampliamente utilizados, se caracterizan por su elevada toxicidad digestiva, destacando la diarrea en 46-74,4% de los pacientes tratados, particularmente alta con afatinib (casi 10% grado ≥ 3). El alectinib es el tratamiento que menos diarrea produce, en torno a 16%, (solo 0,7% con grado ≥ 3). La frecuencia de nauseas/vómitos es menor, produciéndose entre 16-51% de los pacientes, mientras que la mucositis sigue siendo la toxicidad menos frecuente (< 20%), exceptuando tratamiento con afatinib, que puede aumentar hasta 30%. En cuanto a los fármacos inhibidores del punto de control inmunológico, la toxicidad digestiva es frecuente, destacando la diarrea. Los inhibidores de la proteína 1 de muerte celular programada (PD-1), llegan a producir diarrea entre 16-21% (1,5% grado ≥ 3). Esta toxicidad grave aumenta (5%) en los tratamientos en combinación como el de nivolumab junto a ipilimumab (anti-CTLA4). Los anticuerpos contra el ligando 1 PD-L1, como atezolizumab también pueden causar diarrea (19%) aunque generalmente leve.
El tratamiento con citotóxicos, más utilizados en el tratamiento de cáncer de pulmón microcítico, se caracteriza por su poder emetógeno, pudiendo producir en más de 7% de los pacientes, náuseas y vómitos grado ≥ 3 con el tratamiento basado en cisplatino y pemetrexed. El tratamiento basado en cisplatino e irinotecán es el que registra mayor porcentaje de diarrea grado ≥ 3 (19%), náuseas y vómitos (14%). Respecto a la mucositis, la incidencia aumenta hasta en 38,9% de los pacientes, al ser tratados con vinorelbina y paclitaxel.
En el cáncer renal, el tratamiento más habitualmente utilizado es la terapia dirigida. Los anti-VEGFR se caracterizan por la alta incidencia de diarrea (23-74%). Destacando el cabozantinib con 74% de los pacientes (11% grado ≥ 3), seguido del sunitinib con 57% (8% grado ≥ 3). Respecto a la mucositis, aumenta su frecuencia hasta 15-19%, con el cabozantinib. El tratamiento con afatinb, se relaciona con una alta incidencia de diarrea (75-95%) y mucositis (30-70%). El everolimus y temsirolimus son inhibidores de la mTOR y sus efectos adversos más frecuentes son diarrea (27-34%) y mucositis (23-20%). Por lo que respecta al tratamiento con inmunomoduladores, la incidencia, tanto de diarrea (12%) como de náuseas (14%), es menor que en combinación. De este modo, en el tratamiento de axitinib + avelumab, la incidencia de diarrea llega a 62,2% (6,7% grado ≥ 3); las náuseas hasta 34% y la mucositis 14%.
En relación con el cáncer urotelial, el tratamiento más habitual es la quimioterapia adyuvante con citotóxicos. Los esquemas basados en platino producen náuseas/vómitos hasta en 22% de los pacientes. La vinflunina puede aumentar esta toxicidad hasta 30,9%, además de una mucositis en el 27,1%. La inmunoterapia, cada vez es más utilizada, reduce la toxicidad emetógena hasta en 11-15% de los pacientes. La diarrea sigue siendo un efecto presente en la inmunoterapia, dándose en 16% de los pacientes tratados con avelumab, aunque menos de 1% eran de grado ≥ 3.
En el cáncer de próstata persistente o recurrente, se utilizan los medicamentos de bloqueo androgénico. La tolerabilidad de este grupo de fármacos es bastante buena, a excepción de la abiraterona que llega a producir diarrea en el 18% de los pacientes y náuseas/vómitos entre 21-30% (< 2% de grado ≥ 3). El tratamiento con taxanos aumenta su toxicidad, sobre todo con docetaxel con diarrea en 32% (4% grado ≥ 3); náuseas/vómitos en 42% (4% grado ≥ 3) y mucositis en 20% (5% grado ≥ 3).
La inmunoterapia es una modalidad de tratamiento sistémico importante para el melanoma metastásico. Se caracteriza por toxicidad grastrointesinal elevada, destacando la diarrea. El bloqueo de CTLA-4, por el ipilimumab ocasiona diarrea y colitis en 38% de los pacientes (4,2% grado ≥ 3). El tratamiento en combinación con nivolumab (anti-PD1) puede aumentar su toxicidad hasta en 43%. EL poder emetógeno es también elevado, con una frecuencia de 33,9-40%. La toxicidad relacionada por el resto de anti PD1 (pembrolizumab y cemiplimab), es menos frecuente (diarrea: 19% y náuseas/vómitos: 11%). Respecto al tratamiento con terapia dirigida con BRAF más inhibidores de MEK, el tratamiento en monoterapia con vemurafenib está asociado a una diarrea en 28-50% de los pacientes y 18-26% de náuseas/vómitos. El tratamiento basado en vemurafenib + cobimetinib es la combinación asociada a mayor toxicidad, llegando a producir diarrea en 61% (7% grado ≥ 3) de los pacientes y náuseas/vómitos en 43%. La mucositis no es una reacción adversa frecuente ni grave en este grupo de fármacos.
En el cáncer de ovario, la quimioterapia basada en platino es la más utilizada. El paclitaxel en combinación con cisplatino, es el tratamiento con más toxicidad asociada, produciendo náuseas en más de 90% (14,3% grado ≥ 3) y vómitos en 68,4% (14,3% grado ≥ 3). La diarrea se da en un 33% de los pacientes y la mucositis en 23%. Al combinarlo con carboplatino, la toxicidad es algo menor, pero aun así elevada (náuseas: 76,3% y vómitos: 45,5%; diarrea: 24,4%; mucositis: 20,4%). El esquema de gemcitabina con carboplatino, reduce la toxicidad digestiva (vómitos: 42,3%, diarrea: 14,8%).
Respecto a la terapia dirigida, los inhibidores de la PARP, utilizados en tratamiento de mantenimiento, están asociados a una toxicidad emetógena muy elevada, con 73% de pacientes en el caso de niraparib y 40-70% en el caso de olaparib. La diarrea es también un efecto muy frecuente, hasta 29% con este último.
DiscusiónLos efectos adversos digestivos debidos a los tratamientos antineoplásicos son un problema muy frecuente en los pacientes con cáncer. Los servicios de oncología son cada vez más conscientes del riesgo de desnutrición asociado a dichos tratamientos; sin embargo, con frecuencia los pacientes derivados a los servicios de endocrinología y nutrición llegan con desnutrición franca; o bien, el primer contacto se produce durante un ingreso por la toxicidad del tratamiento, asociado a una alta frecuencia de complicaciones intestinales con repercusión nutricional: diarrea, estreñimiento, colitis, perforación intestinal, mucositis, náuseas y vómitos. Asimismo, pueden disminuir notablemente la calidad de vida de los pacientes e, incluso, provocar la muerte como consecuencia directa de la desnutrición asociada o por el efecto limitante que condiciona la necesidad de realizar tratamientos oncológicos subóptimos.
La toxicidad digestiva de los fármacos antineoplásicos puede afectar a los pacientes por tres mecanismos: el propio efecto adverso y sus complicaciones (disconfort, dolor, deshidratación, sangrado, etc.), la disminución en la efectividad del tratamiento (retrasos y suspensiones de dosis) y el desarrollo, o el empeoramiento de desnutrición y sarcopenia. Este último mecanismo puede aumentar a su vez la toxicidad, cerrando un círculo vicioso (desnutrición-toxicidad) al limitar la administración de la dosis inicialmente calculada15. Por ejemplo, se ha descrito 93% de pacientes con cáncer de colon y sarcopenia que presentan efectos adversos a la administración de flurouracilo, comparado con 52% de pacientes sin sarcopenia16.
En el caso de las terapias dirigidas, se ha relacionado los TKI con la aparición o exacerbación de un cuadro específico de malnutrición, la sarcopenia o pérdida de masa muscular, relacionándolo en algunos casos con disminución de la supervivencia. El mecanismo subyacente de esta toxicidad no es bien conocido, pero se cree relacionado con la inhibición de la vía PI3K/AKT/mTOR, que inhibiría la síntesis de proteínas a nivel muscular17.
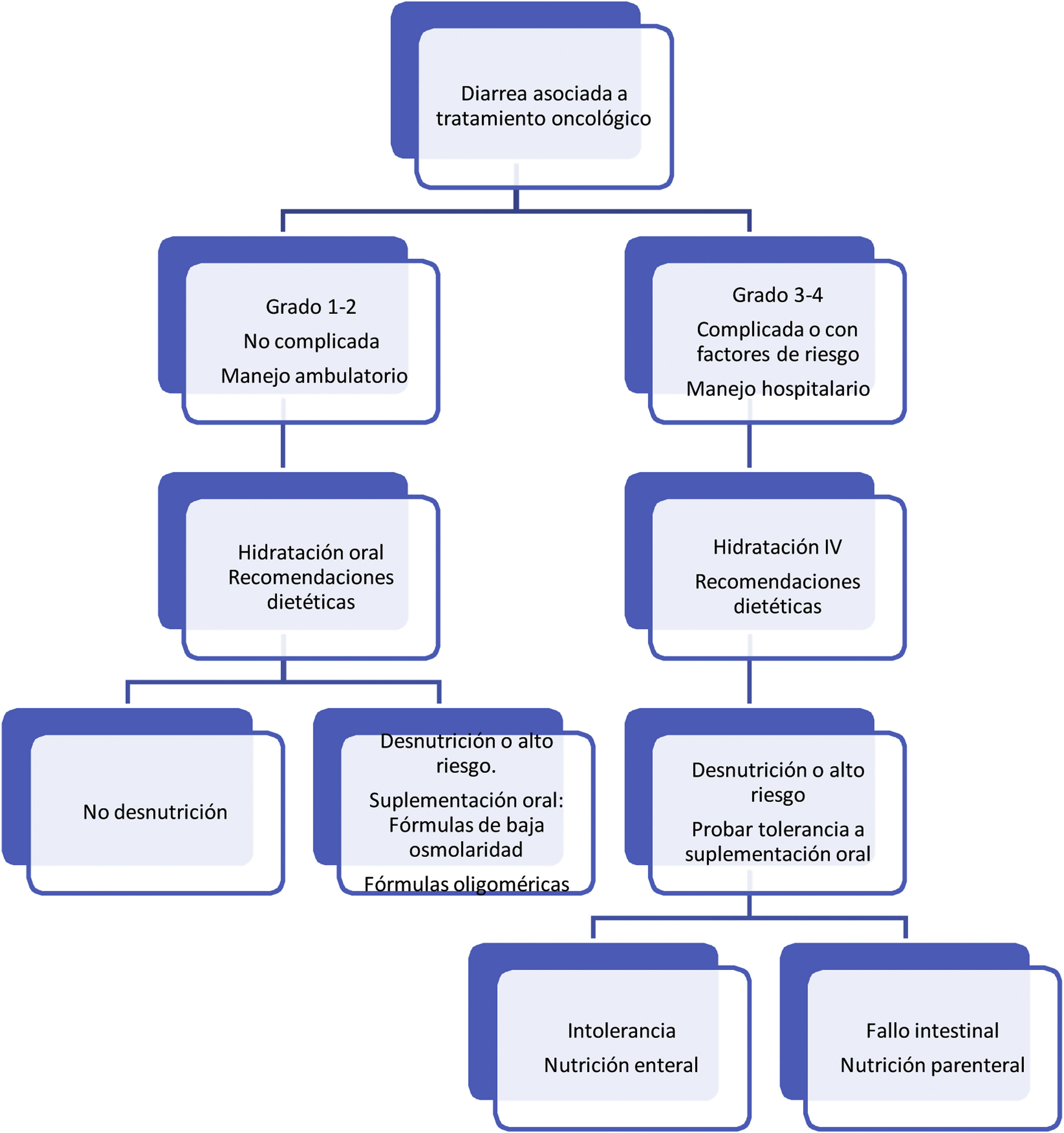
DiarreaLa diarrea es un efecto secundario muy frecuente de los fármacos utilizados contra los tumores sólidos. Como observamos en las tablas, entre los quimoterápicos convencionales, los más relacionados con la aparición de diarrea son las fluoropirimidinas y el irinotecán. El mecanismo subyacente en el caso de los tratamientos quimioterápicos suele ser un daño agudo sobre la mucosa intestinal, con aparición de una diarrea secretora a los cinco a siete días de la administración del citostático. En el caso de irinotecán, además, puede aparecer un cuadro de diarrea aguda en las primeras 24 h de la administración, debido a un síndrome colinérgico agudo (motivo por el cual se suele suministrar una dosis previa de atropina). En el caso de las fluoropirimidinas, este cuadro diarreico puede ser muy severo en aquellos enfermos con déficit en la actividad de la enzima dihidropirimidina deshidrogenasa (DPD), por lo que se recomienda su determinación previa a la administración de dichos citostáticos18.
Respecto a las terapias dirigidas molecularmente (agentes antidiana), algunos TKI presentan alta incidencia de diarrea (75-45%) a través de diferentes mecanismos, daño directo de la mucosa colónica, aumento de motilidad, disbiosis e, incluso, hiperclorhidria causada por la alteración de la vía de señalización del EGFR.
Por otro lado, los anticuerpos monoclonales dirigidos contra EGFR, como cetuximab y panitimumab, o contra el VEGFR, como el bevacizumab, no suelen producir diarrea en monoterapia, pero sí cuando se combinan con quimioterapia convencional. Lo mismo ocurre con el aflibercept, antagonista del factor A de crecimiento endotelial vascular (VEGF-A).
Un aspecto relevante es la aparición de colitis inmunomediada, principal efecto adverso producido por la administración de fármacos ICIs a nivel gastrointestinal, derivados de la producción de linfocitos T autorreactivos contra diferentes tejidos. La aparición de estos síntomas suele darse al inicio del tratamiento. No obstante, la diarrea y/o colitis puede recurrir meses después de la interrupción o finalización del tratamiento, simulando una enfermedad inflamatoria crónica intestinal.
En cuanto a los fármacos inhibidores del punto de control inmunológico, ipilimumab produce diarrea en 23-33% de pacientes y los inhibidores de la proteína 1 de la muerte celular programada (PD-1), en 19%. La incidencia es mayor entre los pacientes que toman una combinación de ambos (44%). Los anticuerpos contra el ligando 1 de la muerte celular programada (PD-L1) también pueden causar diarrea aunque generalmente leve. Los inhibidores de B-RAF (vemurafenib, dabrafenib y encorafenib) tienen un perfil muy aceptable en cuanto al riesgo de diarrea, con cifras inferiores a 5-6% de diarreas grado 2-3; no obstante, cuando se asocian a inhibidores de MEK, al contrario que con la toxicidad cutánea, incrementan levemente el riesgo de diarrea y de náuseas/vómitos19.
Aunque la toxicidad gastrointestinal es relativamente frecuente con los inhibidores de las enzimas de la poli (ADP ribosa) polimerasa (PARP) (niraparib y olaparib) suelen ser toxicidades leves y, en el caso de la diarrea, el riesgo es bajo y no suele ser motivo de ajuste o suspensión de dosis. Respecto a los inhibidores del receptor mTOR (tensirolimus y everolimus) la toxicidad digestiva grave es poco frecuente.
Por último, cabe destacar la enterocolitis neutropénica, síndrome clínico que se desarrolla principalmente en pacientes sometidos a tratamiento con altas dosis de quimioterapia. Aunque la incidencia real de esta patología es desconocida, la mayoría de los estudios la sitúan en 5,3%, aunque esta cifra es probablemente una subestimación. Se caracteriza por dolor abdominal y fiebre con neutropenia (< 0,5 × 109/L) y aumento del grosor de la pared intestinal a nivel del colon. Los agentes quimioterápicos relaciones son aquellos empelados para el tratamiento de leucemias y tumores sólidos como el etopósido, taxanos, platinos, gemcitabina y 5-fluorouracilo20,21.
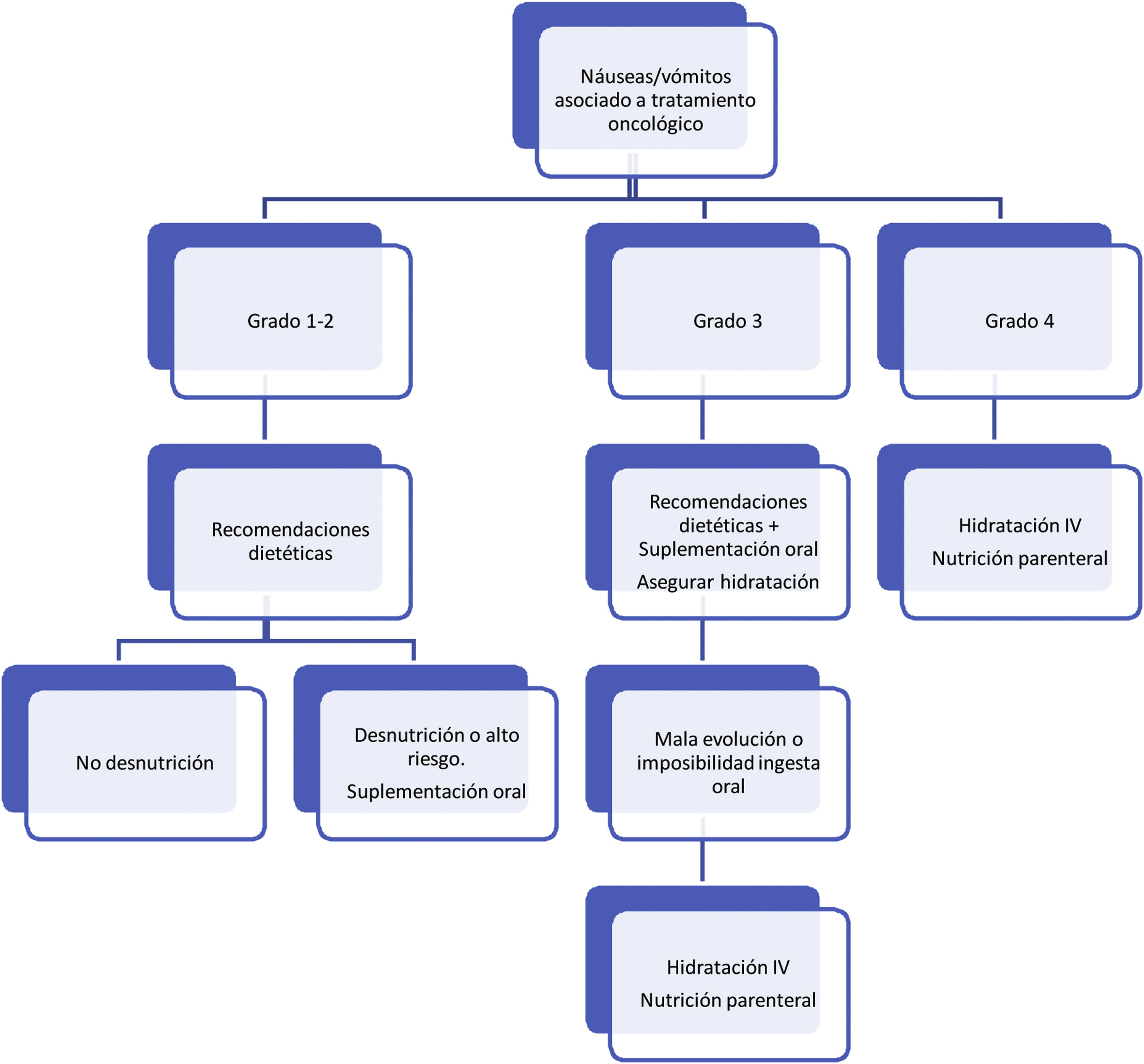
Náuseas/vómitosLas náuseas y los vómitos inducidos por la quimioterapia representaban un efecto secundario tan habitual en la quimioterapia clásica que se estableció una división de los citostáticos en función de su potencial emetógeno: quimioterapia altamente emetógena (> 90% de probabilidad de vómitos, como el cisplatino, la ciclofosfamida a altas dosis o la dacarbazina), quimioterapia moderadamente emetógena (30-90%, como el carboplatino, el oxaliplatino y las antraciclinas), quimoterapia de bajo riesgo emetógeno (10-30%, como los taxanos, la gemcitabina, la capecitabina o el topotecán) y quimioterapia mínimamente emetógena (< 10%, como la bleomicina, los alcaloides de la vinca o el metrotexate oral). Asimismo, las náuseas/vómitos inducidos por la quimioterapia, se pueden dividir en función del tiempo transcurrido desde la administración en tres categorías, con distinto mecanismo etiopatogénico: emesis aguda, (< 24 h), relacionada con la acción de la serotonina; la emesis tardía, (> 24 h), de etiología peor conocida, en probable relación con la sustancia P; y la emesis anticipatoria, como una respuesta condicionada a episodios previos. Son factores predisponentes el sexo femenino, la edad < 50 años, así como los antecedentes de cinetosis o de emesis gravídica; sin embargo, el consumo crónico excesivo de alcohol, redujo el riesgo5.
El mejor conocimiento de su fisiopatología, la aparición de diferentes fármacos antieméticos (inhibidores 5-HT3, antagonistas del receptor NK1) y la difusión de guías de prevención han logrado un mejor control, especialmente en el caso de la emesis aguda, pese a lo cual, más de un tercio de los pacientes siguen experimentado náuseas y vómitos inducidos por quimioterapia22–24. Esta elevada incidencia, junto a otros efectos habituales de la quimioterapia como la hiporexia, la disgeusia y la cacosmia, suponen un alto riesgo de desnutrición.
En el caso de las terapias antidiana o los tratamientos inmunoterápicos, se incluyen siempre dentro de las categorías de bajo riesgo emetógeno. No obstante, se desconocen tanto los mecanismos subyacentes a la emesis por estos fármacos como la eficacia de los fármacos antieméticos habituales, lo que supone un riesgo de malnutrición limitado pero peor conocido.
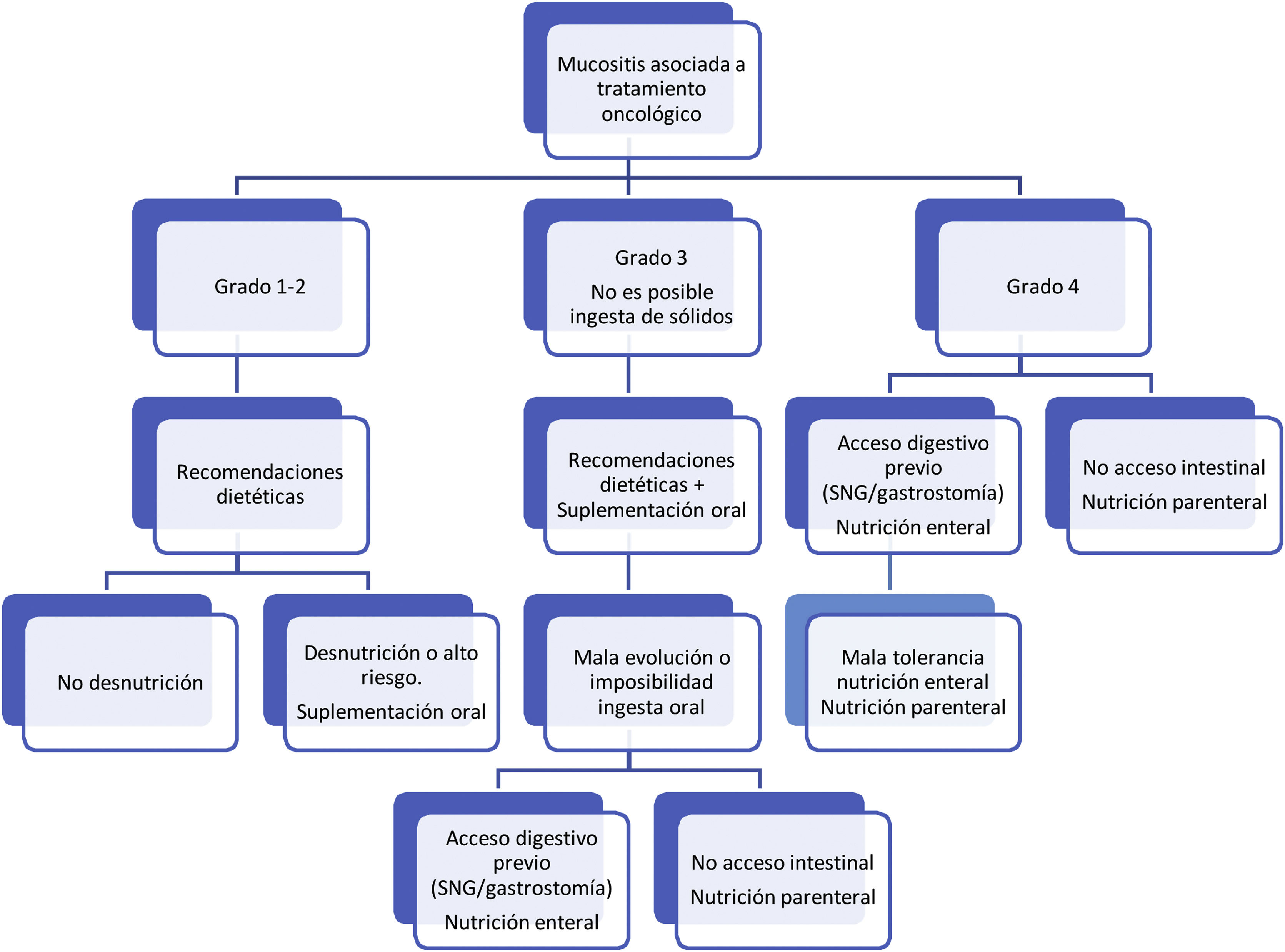
MucositisLa mucositis oral es un proceso frecuente en los tratamientos quimioterápicos convencionales y puede implicar un grave riesgo de desnutrición en casos severos o prolongados. El riesgo de mucositis es especialmente importante en los tratamientos de quimio-radioterapia en el área orofaríngea, así como en los tratamientos con altas dosis de quimioterapia mieloablativa, donde se llega a cifras de 75% de mucositis grado 3-425.Los agentes quimioterápicos que afectan a la síntesis de DNA (agentes alquilantes, antraciclinas, antimetabolitos), producen mucositis con mayor frecuencia.
Especial importancia, como en el caso de la diarrea, tiene el déficit en la actividad de la enzima DPD en los pacientes que reciben fluoropirimidinas.
La mucositis inducida por la quimioterapia suele comenzar como lesiones eritematosas dolorosas, que pueden avanzar a ulceración mucosa, pudiendo, en casos graves, impedir la ingesta por vía oral. Normalmente aparece a partir de los cinco a siete días de la administración del tratamiento citostático y, con frecuencia, coincide con otras toxicidades como diarrea o toxicidad hematológica, lo que puede agravar el estrés nutricional. Son factores predisponentes la mala higiene bucal y el estado de desnutrición previa.
El riesgo de mucositis es relativamente bajo tanto con la inmunoterapia como con la mayor parte de las terapias dirigidas molecularmente frente al cáncer, con la excepción de los inhibidores del receptor de rapamicina (mTOR) (tensirolimus y everolimus), en los que las tasas de mucositis grado ≥ 3 oscila entre 33-53%26.
Terapia médica y dietético-nutricional frente a la toxicidad digestiva de los fármacos antineoplásicosEn primer lugar, es necesario informar al paciente sobre los riesgos de aparición de las diferentes toxicidades para un abordaje precoz de las mismas. Además, será de gran utilidad establecer protocolos locales respecto al uso escalonado de fármacos antidiarreicos (loperamida, codeína, octreótido, etc.), antieméticos (antagonistas dopaminérgicos, antagonistas del receptor de serotonina, corticoides) y adyuvantes en la prevención y manejo de la mucositis (fármacos tópicos, palifermina).
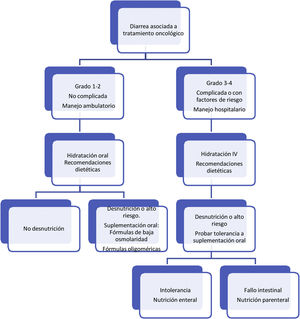
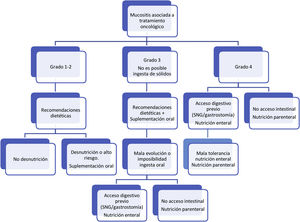
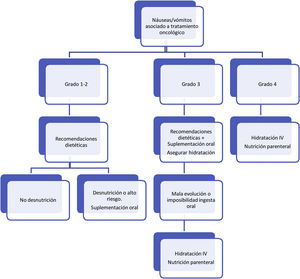
Respecto al tratamiento dietético-nutricional, en función del grado y de la existencia de factores de riesgo o signos de alarma de complicación proponemos los siguientes algoritmos de actuación (figs. 1-3)27. Los consejos dietéticos para cada una de las toxicidades digestivas que se indican en el algoritmo se exponen en la tabla 328–30. Debemos señalar que el tratamiento dietético-nutricional de las diferentes toxicidades se deberá iniciar precozmente para disminuir la progresión de las mismas y la desnutrición asociada y en ocasiones se mantendrán a largo plazo e incluso de forma crónica.
Recomendaciones dietéticas para pacientes
| 1) Diarrea ocasionada por tratamiento oncológico |
| Consejos a la hora de elegir los alimentos:• Consuma alimentos astringentes como arroz y pasta, patata hervida, pan blanco o verduras cocidas como la zanahoria.• Evite alimentos integrales, legumbres enteras, fruta con piel y leche con lactosa.• Tome la fruta sin piel, cocida, en almíbar o en zumos colados según tolerancia.• Restrinja los alimentos muy ricos en grasa.• Limite el consumo de bebidas estimulantes como el café, el té y los refrescos, así como los azúcares añadidos (azúcar de mesa, miel, etc.).• Introduzca carne, pescado o huevo en las dos comidas principales del día para evitar la pérdida de masa muscular. |
| Consejos a la hora de cocinar:• Utilice formas de cocción sencillas de los alimentos como vapor, microondas, hervido o papillote y evite fritos y rebozados. |
| Consejos generales:• Divida la ingesta diaria en tomas frecuentes y de poco volumen y coma lentamente.• Ingiera abundante líquido en pequeñas tomas e intente que la mayor parte sea fuera de las comidas principales.• Las soluciones para la rehidratación oral facilitadas en farmacias pueden ayudar a la reposición de minerales perdidos (evitar las soluciones rehidratantes comerciales o caseras)• Procure no tomar los alimentos ni muy fríos ni muy calientes.• Realice ejercicio físico de forma diaria en la medida de sus posibilidades. |
| 2) Recomendaciones dietéticas para pacientes con náuseas-vómitos debidos a tratamiento oncológico |
| Consejos a la hora de elegir los alimentos:• Evite alimentos grasos, fritos, ácidos o muy condimentados.• Reduzca el consumo de alimentos flatulentos como legumbres, col, coliflor.• Restrinja alimentos poco calóricos como lácteos desgrasados, grandes cantidades de verdura, sopas, infusions.• Introduzca carne blanca, pescado o huevo en al menos las dos comidas principales del día para evitar la pérdida de masa muscular. |
| Consejos a la hora de cocinar:• Utilice formas de cocción sencillas que disminuyan el olor de los alimentos como vapor, microondas, hervido o papillote.• Intente que los platos sean apetecibles, a base de alimentos de su agrado y fáciles de tragar, masticar y digerir. |
| Consejos generales:• Divida la ingesta diaria en tomas frecuentesde poco volumen y coma lentamente.• Ingiera abundante líquido en pequeñas tomas e intente que la mayor parte sea fuera de las comidas principales.• Procure tomar los alimentos ni muy fríos ni muy calientes.• Repose después de las comidas, sentado o semiincorporado, durante 30 minutos para mejorar la digestión.• Realice ejercicio físico de forma diaria en la medida de sus posibilidades. |
| 3) Recomendaciones Para Pacientes Con Mucositis |
| Consejos a la hora de elegir los alimentos:• Elija alimentos blandos, suaves o triturados (arroz, quesos frescos pasteurizados o UHT, verduras cocidas, purés) para reducir el dolor al deglutir.• Evite alimentos secos, ácidos, picantes o muy calientes que puedan irritar la mucosa.• Limite el consumo de alimentos poco calóricos como lácteos desgrasados, grandes cantidades de verdura, sopas, infusions.• Introduzca carne, pescado, huevo o legumbres en al menos las dos comidas principales del día para evitar la pérdida de masa muscular.• Tome hielo o cubitos a base de zumos de frutas para reducir la sintomatología bucal (sequedad, dolor e inflamación de encías y lengua, descamación). |
| Consejos a la hora de cocinar:• Utilice formas de cocción sencillas que disminuyan el olor de los alimentos como vapor, microondas, hervido o papillote.• Intente que los platos sean apetecibles, a base de alimentos de su agrado y fáciles de tragar y masticar para evitar la fatiga.• Utilice salsas para acompañar sus platos y así favorecer la deglución. |
| Consejos generales:• Divida la ingesta diaria en numerosas tomas de poco volumen y coma lentamente.• Ingiera abundante líquido en pequeñas tomas e intente que la mayor parte sea fuera de las comidas principales.• Mantenga una buena higiene bucal y realice enjuagues de forma frecuente con agua y manzanilla/bicarbonato/tomillo.• Realice ejercicio físico de forma diaria en la medida de sus posibilidades. |
Es importante conocer los efectos adversos digestivos asociados a cada tipo de fármaco quimioterápico, para poder prevenir su aparición y reducir el riesgo de aparición de desnutrición. Asimismo, los profesionales implicados en el tratamiento del paciente oncológico deben adaptar la terapia médica nutricional a las necesidades que requiera en cada momento durante el proceso de la enfermedad. Por otra parte, no nos podemos olvidar de la importancia de instaurar el diagnóstico de riesgo de desnutrición e implementar la terapia médica nutricional de forma precoz, idealmente tras el diagnóstico en las diferentes especialidades médicas, al mismo tiempo en que se deriva al paciente al especialista, para prevenir las consecuencias negativas de la desnutrición asociada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.