En la actualidad, la mayoría de los pacientes con diabetes mellitus tipo 1 (DMT1) no logra alcanzar los objetivos de control glucémico recomendados para reducir el riesgo de complicaciones agudas y crónicas. Los sistemas híbridos de asa cerrada o sistemas de infusión automatizada de insulina emergen como una oportunidad para mejorar el control metabólico, la calidad de vida y reducir el impacto psicosocial de la diabetes tipo 1. En este artículo se analiza la evidencia en relación con su eficacia y seguridad, los retos que plantean y las mejores prácticas para optimizar los resultados en su implementación en la práctica clínica.
At present, the majority of patients with type 1 diabetes mellitus do not achieve the recommended glycemic control goals to reduce the risk of acute and chronic complications. Hybrid closed-loop systems or automated insulin infusion systems emerged as an opportunity to improve metabolic control, quality of life and reduce the psychosocial impact of type 1 diabetes. This article analyzes the evidence regarding their effectiveness and safety, the challenges they pose and best practices to optimize results when implemented in clinical practice.
La diabetes mellitus tipo 1 (DMT1) es una patología crónica y demandante que supone un desafío constante para los niños y adolescentes con diabetes y sus familias, constituyendo un enorme reto para los sistemas de salud. El objetivo del tratamiento en la edad pediátrica es alcanzar y mantener un manejo glucémico dentro de los objetivos recomendados con el fin de reducir el riesgo de complicaciones agudas y crónicas, y los potenciales efectos perjudiciales de la hipoglucemia y la hiperglucemia en el desarrollo cognitivo y la estructura cerebral, así como mejorar la calidad de vida de los niños y adolescentes con DMT11.
No obstante, aún en la actualidad, y pese a los avances tecnológicos y del desarrollo de nuevas formulaciones de análogos de insulina, la mayoría de los pacientes no consigue alcanzar los objetivos glucémicos que promueven las sociedades internacionales. En efecto, solo el 21% mantiene niveles de hemoglobina glicosilada (HbA1c) por debajo de 7,0%, según datos recientes de más de 25.600 niños incluidos en el registro de la iniciativa SWEET (Better control in Pediatric and Adolescent diabeteS: Working to crEate CEnTers of Reference)2. La HbA1c media entre los pacientes de 1 a 15 años es de 8,6% según el informe del registro T1D Exchange del periodo 2021-2022, y entre los menores de seis años, de 8,0%3,4. Además, se estima que 1,4 millones de niños y jóvenes menores de 20 años están diagnosticados de DMT1 en el mundo, y que el número global de personas que viven con diabetes tipo 1 aumentará a nivel mundial entre un 66% y un 116% entre 2020 y 20405.
Todo ello pone de manifiesto la necesidad, aún no completamente satisfecha, de emplear métodos más eficaces para lograr los objetivos del control glucémico, para lo que, en los últimos cinco años, se han efectuado grandes avances en los sistemas de infusión automatizada de insulina (Automated Insulin Delivery [AID]). De este modo, los sistemas híbridos de asa cerrada o sistemas AID están transformando gradualmente el tratamiento clínico de la DMT1 abriendo una ventana de oportunidad para mejorar la salud y calidad de vida de las personas con diabetes y reducir el impacto psicosocial de la enfermedad.
El objetivo de esta revisión es el de analizar la evidencia actual en relación con su eficacia y seguridad, los retos que plantean y las mejores prácticas para optimizar los resultados obtenidos en la asistencia clínica.
Sistemas Automated Insulin Delivery: funcionamiento, componentes y resultados clínicosLos sistemas AID están compuestos por un dispositivo de monitorización continua de glucosa (MCG) conectado con un algoritmo que responde en tiempo real a las variaciones en los niveles de glucosa ajustando las dosis de insulina que administra una bomba de insulina. Los sistemas AID actuales se consideran sistemas híbridos porque requieren por parte del usuario el anuncio de las ingestas y del ejercicio6. El algoritmo de control puede estar alojado en la bomba de insulina o en una aplicación móvil y, fundamentalmente, existen tres tipos; a saber: Proportional - Integrative - Derivative (PID), Model Predictive Control (MPC) o lógica difusa.
- 1.
Los algoritmos PID ajustan la administración de insulina de acuerdo con los datos de la monitorización de glucosa basándose en tres elementos: la diferencia entre los niveles de glucosa medidos y objetivo (el componente proporcional), el área bajo la curva entre la glucosa medida y objetivo (el componente integral) y la tasa de cambio en los niveles de glucosa medidos a lo largo del tiempo (el componente derivado).
- 2.
Los algoritmos MPC utilizan un modelo matemático predictivo que determina las excursiones de glucosa y ajusta la administración de insulina para alcanzar el objetivo, considerando para ello la sensibilidad a la insulina estimada.
- 3.
Los algoritmos basados en lógica difusa modulan la administración de insulina de acuerdo con un conjunto de reglas diseñadas para imitar el conocimiento y el razonamiento de expertos en el tratamiento de la diabetes.
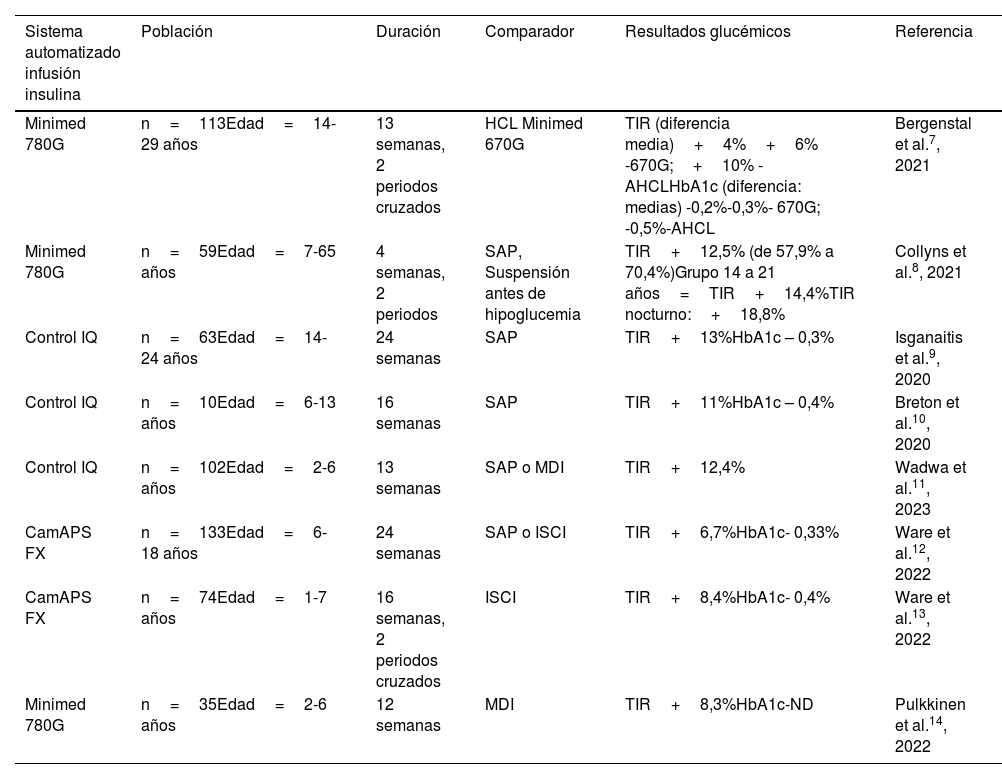
Los sistemas AID han demostrado un aumento homogéneo y clínicamente relevante del tiempo en rango (TIR: 70-180mg/dL) entre un 9% y un 14% en comparación con el tratamiento estándar en ensayos clínicos aleatorizados controlados en niños y adolescentes con diabetes7–14, incluso en niños por debajo de los seis años (tabla 1). La mejoría observada del TIR se acompaña de una reducción de la glucosa media y de la HbA1c entre un 0,3 y un 0,5%, siendo mayor durante el periodo nocturno y, de forma global, en los ensayos en los que el grupo de estudio parte de una HbA1c previamente más elevada. Respecto al tiempo en hipoglucemia, algunos estudios no muestran diferencias, mientras que en otros se observa una reducción significativa, incluso en comparación con sistemas integrados con suspensión automática en predicción de glucosa baja8,10.
Estudios clínicos aleatorizados con sistemas automatizados de infusión de insulina (sistemas AID)
| Sistema automatizado infusión insulina | Población | Duración | Comparador | Resultados glucémicos | Referencia |
|---|---|---|---|---|---|
| Minimed 780G | n=113Edad=14-29 años | 13 semanas, 2 periodos cruzados | HCL Minimed 670G | TIR (diferencia media)+4%+6% -670G;+10% -AHCLHbA1c (diferencia: medias) -0,2%-0,3%- 670G; -0,5%-AHCL | Bergenstal et al.7, 2021 |
| Minimed 780G | n=59Edad=7-65 años | 4 semanas, 2 periodos | SAP, Suspensión antes de hipoglucemia | TIR+12,5% (de 57,9% a 70,4%)Grupo 14 a 21 años=TIR+14,4%TIR nocturno:+18,8% | Collyns et al.8, 2021 |
| Control IQ | n=63Edad=14-24 años | 24 semanas | SAP | TIR+13%HbA1c – 0,3% | Isganaitis et al.9, 2020 |
| Control IQ | n=10Edad=6-13 años | 16 semanas | SAP | TIR+11%HbA1c – 0,4% | Breton et al.10, 2020 |
| Control IQ | n=102Edad=2-6 años | 13 semanas | SAP o MDI | TIR+12,4% | Wadwa et al.11, 2023 |
| CamAPS FX | n=133Edad=6-18 años | 24 semanas | SAP o ISCI | TIR+6,7%HbA1c- 0,33% | Ware et al.12, 2022 |
| CamAPS FX | n=74Edad=1-7 años | 16 semanas, 2 periodos cruzados | ISCI | TIR+8,4%HbA1c- 0,4% | Ware et al.13, 2022 |
| Minimed 780G | n=35Edad=2-6 años | 12 semanas | MDI | TIR+8,3%HbA1c-ND | Pulkkinen et al.14, 2022 |
AHLC: advance hybrid closed loop; HbA1c: hemoglobina glicosilada; HCL: hybrid closed loop; ISCI: Infusión subcutánea continua de insulina; MDI: múltiples dosis de insulina; ND: no disponible; SAP: Sensor Augmented Pump; TIR: tiempo en rango (70-180mg/dL).
En pacientes en tratamiento previo con múltiples inyecciones diarias de insulina (MDI) y utilizando un protocolo estructurado de iniciación de 10 días, Petrovski et al. demuestran en un estudio prospectivo de 12 semanas de duración en niños y adolescentes entre 7 y 17 años una mejoría del TIR de+36,7% (de 42,1± 18,7% de base a 78,8± 6,1% al final del estudio) con un descenso de la HbA1c desde 8,6± 1,7% a 6,5± 0,7%15. En pacientes recién diagnosticados de DMT1, los sistemas AID demuestran una mejoría del TIR en los primeros 12 y 24 meses en comparación con el tratamiento estándar en un ensayo aleatorizado controlado, que, sin embargo, no se traduce en una mejoría en la preservación de la reserva pancreática16,17.
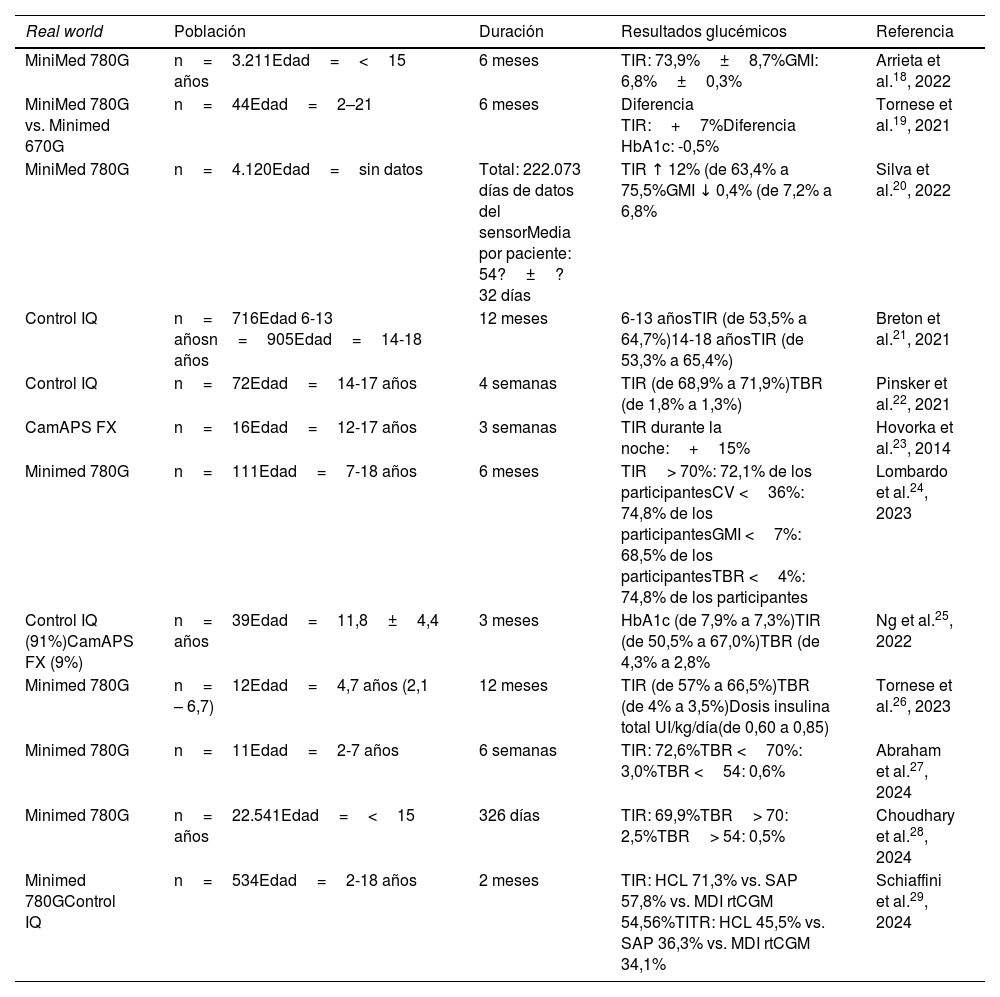
Los datos de los estudios en vida real evidencian, asimismo, la superioridad de los sistemas AID para mejorar el TIR, el Time in Tight Range (TITR: 70-140mg/dL), la HbA1c, la glucemia media y reducir el tiempo en hipoglucemia y en hiperglucemia a medio plazo, en grandes grupos poblacionales, e incluso, en los niños menores de seis años18–29 (tabla 2).
Estudios en la vida real con sistemas automatizados de infusión de insulina (sistemas AID)
| Real world | Población | Duración | Resultados glucémicos | Referencia |
|---|---|---|---|---|
| MiniMed 780G | n=3.211Edad=<15 años | 6 meses | TIR: 73,9%±8,7%GMI: 6,8%±0,3% | Arrieta et al.18, 2022 |
| MiniMed 780G vs. Minimed 670G | n=44Edad=2–21 | 6 meses | Diferencia TIR:+7%Diferencia HbA1c: -0,5% | Tornese et al.19, 2021 |
| MiniMed 780G | n=4.120Edad=sin datos | Total: 222.073 días de datos del sensorMedia por paciente: 54?±?32 días | TIR ↑ 12% (de 63,4% a 75,5%GMI ↓ 0,4% (de 7,2% a 6,8% | Silva et al.20, 2022 |
| Control IQ | n=716Edad 6-13 añosn=905Edad=14-18 años | 12 meses | 6-13 añosTIR (de 53,5% a 64,7%)14-18 añosTIR (de 53,3% a 65,4%) | Breton et al.21, 2021 |
| Control IQ | n=72Edad=14-17 años | 4 semanas | TIR (de 68,9% a 71,9%)TBR (de 1,8% a 1,3%) | Pinsker et al.22, 2021 |
| CamAPS FX | n=16Edad=12-17 años | 3 semanas | TIR durante la noche:+15% | Hovorka et al.23, 2014 |
| Minimed 780G | n=111Edad=7-18 años | 6 meses | TIR> 70%: 72,1% de los participantesCV <36%: 74,8% de los participantesGMI <7%: 68,5% de los participantesTBR <4%: 74,8% de los participantes | Lombardo et al.24, 2023 |
| Control IQ (91%)CamAPS FX (9%) | n=39Edad=11,8±4,4 años | 3 meses | HbA1c (de 7,9% a 7,3%)TIR (de 50,5% a 67,0%)TBR (de 4,3% a 2,8% | Ng et al.25, 2022 |
| Minimed 780G | n=12Edad=4,7 años (2,1 – 6,7) | 12 meses | TIR (de 57% a 66,5%)TBR (de 4% a 3,5%)Dosis insulina total UI/kg/día(de 0,60 a 0,85) | Tornese et al.26, 2023 |
| Minimed 780G | n=11Edad=2-7 años | 6 semanas | TIR: 72,6%TBR <70%: 3,0%TBR <54: 0,6% | Abraham et al.27, 2024 |
| Minimed 780G | n=22.541Edad=<15 años | 326 días | TIR: 69,9%TBR> 70: 2,5%TBR> 54: 0,5% | Choudhary et al.28, 2024 |
| Minimed 780GControl IQ | n=534Edad=2-18 años | 2 meses | TIR: HCL 71,3% vs. SAP 57,8% vs. MDI rtCGM 54,56%TITR: HCL 45,5% vs. SAP 36,3% vs. MDI rtCGM 34,1% | Schiaffini et al.29, 2024 |
CV: coeficiente de variación; GMI: Glucose Management indicator; HbA1c: hemoglobina glicosilada; HCL: hybrid closed-loop; MDI: múltiples inyecciones diarias de insulina; rtCGM: Real Time Continuouos Glucose Monitoring; SAP: sensor augmented pump; TBR: tiempo por debajo de rango (< 70mg/dL); TIR: tiempo en rango (70-180mg/dL); TITR: Time In Tight Range, tiempo en rango estrecho (70-140mg/dL).
Finalmente, existen pocos estudios en los que se comparen los resultados entre los distintos sistemas AID actuales. Bassi et al., en un estudio retrospectivo describen un incremento del TIR ligeramente mayor en el grupo de pacientes en tratamiento con el sistema Minimed™ 780G (Medtronic, Estados Unidos) respecto al grupo de pacientes tratados con el sistema Control IQ™ (Tandem Diabetes Care, Estados Unidos) tras un año desde el inicio del sistema30. Mientras que Schiaffini et al. no encuentran diferencias en el TIR entre ambos sistemas en un estudio que incluye 31 niños y adolescentes con edad media de 13,05±2,4 años tras cuatro semanas de tratamiento31. Beato-Víbora et al., en un estudio multicéntrico retrospectivo que incluye 150 pacientes de edades comprendidas entre 16 y 72 años, comparando los mismos sistemas, tampoco hallan diferencias significativas en el TIR ni en la HbA1c32. Santova et al. comparan los resultados de un total de 512 niños y adolescentes <19 años en tratamiento con los sistemas 780G de Medtronic, Control IQ de Tandem y el sistema Do IT Yourself Android APS y encuentran una menor HbA1c en el grupo con Android APS, seguido del grupo con Control IQ, aunque describen diferencias significativas entre los tres grupos en relación con la duración de la diabetes, edad, dosis de insulina, índice de masa corporal y número de pacientes en cada grupo de tratamiento33.
Impacto en la calidad de vidaEn relación con la calidad de vida, aunque los resultados no son tan homogéneos como los descritos con respecto al control metabólico, los sistemas AID han demostrado, en ensayos aleatorizados controlados, mejorar la satisfacción con la tecnología, la calidad del sueño y la calidad de vida relacionada con la diabetes en comparación con el tratamiento con múltiples dosis o sistemas integrados con suspensión en predicción de hipoglucemia34,35. En contraste con los sistemas AID de primera generación, el nivel de satisfacción con la tecnología es mayor con los sistemas avanzados y aumenta en relación con un mayor empleo del modo automático36.
Los padres de niños con DMT1 experimentan una mejoría en la calidad del sueño, así como una disminución del miedo a la hipoglucemia y estrés relacionado con la diabetes37.
Características técnicas de los sistemas Automated Insulin DeliveryMinimed 780G MedtronicUtiliza un algoritmo interoperable de tipo PID y lógica difusa, la bomba de insulina Minimed 780GTM y el sensor Guardian 4TM y próximamente, el sensor SimpleraTM (Medtronic, Estados Unidos). Al iniciar el sistema, requiere al menos de 48 horas de uso en modo manual. En su modo automático, el algoritmo calcula automáticamente la dosis basal cada cinco minutos en función de la glucosa del sensor, la tendencia, el objetivo y el historial de insulina. Permite programar el objetivo de glucosa en 100, 110 o 120mg/dL. Administra bolos correctores automáticos hasta cada cinco minutos, con un objetivo de 120mg/dL si se ha alcanzado la basal máxima. La duración de la insulina activa (DIA), programable de dos a ocho horas, también influye en el cálculo de dosis de insulina por parte del algoritmo.
El cálculo de los bolos preprandiales se basa en la ratio carbohidratos/insulina. La dosis se ajusta en función de la glucosa detectada por el sensor en el momento de administrar el bolo utilizando un factor de corrección calculado por el sistema. Este sistema incluye una función llamada Safe Meal Bolus por la cual el sistema puede reducir la dosis de insulina correspondiente para la comida en caso de predicción de hipoglucemia. En modo manual, dispone de una función de suspensión automática de insulina en predicción de hipoglucemia.
Tandem Control-IQCombina el algoritmo Control IQ, de tipo MPC, la bomba tandem t:Slim X2TM (Tandem Diabetes Care, Estados Unidos) y el sensor dexcom G6/G7TM (Dexcom, Estados Unidos) o freestyle libreTM (Abbott Diabetes Care, Reino Unido). El sistema administra las dosis basales programadas por el usuario con la capacidad de aumentarlas automáticamente en caso de que la predicción de glucosa en los siguientes 30 minutos se encuentre fuera del intervalo objetivo de glucosa (112,5-160mg/dL). El sistema puede administrar un bolo corrector automático (60% del bolo calculado en función del factor de corrección) en caso de predicción de glucosa superior a 180mg/dL en los próximos 30 minutos. En caso de predicción de glucosa inferior a 80mg/dL, el sistema suspende la infusión de insulina. En modo automático, el objetivo de glucosa para el cálculo de dosis de corrección es de 110mg/dL y la DIA es de cinco horas, sin opción de modificarlos.
El sistema permite la administración de bolos extendidos con un máximo de dos horas y la utilización de basales temporales.
CamAPS FXEs el único sistema AID aprobado actualmente para niños desde 1 año de edad. Utiliza el algoritmo CamAPS FXTM (CamDiab Ltd., Reino Unido), la bomba de insulina YpsopumpTM (Ypsomed, Suiza) y el sensor Dexcom G6TM (Dexcom, Estados Unidos) o freestyle libre 3TM (Abbott Diabetes Care, Reino Unido). Utiliza un algoritmo de tipo MPC. Administra de forma automática la insulina basal en forma de bolos extendidos cada 8 a 12 minutos en función de los datos del sensor. El algoritmo no se aloja en la bomba sino en una aplicación móvil. El objetivo de glucosa puede personalizarse por tramos horarios entre 80 y 198mg/dL. No administra bolos correctores automáticos. Los bolos para las comidas o correcciones se administran desde la aplicación y se permite su sobre corrección sin salir del modo automático. Dispone de cartuchos de insulina precargados.
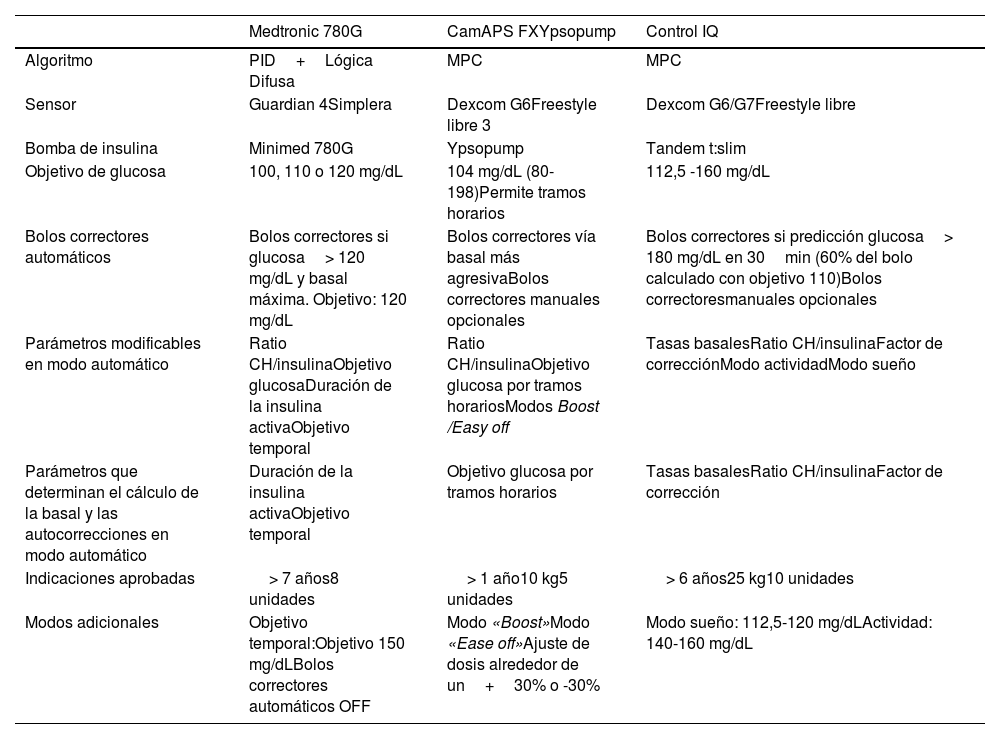
En la tabla 3 se describen las características técnicas de los sistemas AID disponibles en la actualidad en España para su uso en la edad pediátrica.
Sistemas híbridos de asa cerrada/infusión automatizada de insulina disponibles en España
| Medtronic 780G | CamAPS FXYpsopump | Control IQ | |
|---|---|---|---|
| Algoritmo | PID+Lógica Difusa | MPC | MPC |
| Sensor | Guardian 4Simplera | Dexcom G6Freestyle libre 3 | Dexcom G6/G7Freestyle libre |
| Bomba de insulina | Minimed 780G | Ypsopump | Tandem t:slim |
| Objetivo de glucosa | 100, 110 o 120 mg/dL | 104 mg/dL (80-198)Permite tramos horarios | 112,5 -160 mg/dL |
| Bolos correctores automáticos | Bolos correctores si glucosa> 120 mg/dL y basal máxima. Objetivo: 120 mg/dL | Bolos correctores vía basal más agresivaBolos correctores manuales opcionales | Bolos correctores si predicción glucosa> 180 mg/dL en 30min (60% del bolo calculado con objetivo 110)Bolos correctoresmanuales opcionales |
| Parámetros modificables en modo automático | Ratio CH/insulinaObjetivo glucosaDuración de la insulina activaObjetivo temporal | Ratio CH/insulinaObjetivo glucosa por tramos horariosModos Boost /Easy off | Tasas basalesRatio CH/insulinaFactor de correcciónModo actividadModo sueño |
| Parámetros que determinan el cálculo de la basal y las autocorrecciones en modo automático | Duración de la insulina activaObjetivo temporal | Objetivo glucosa por tramos horarios | Tasas basalesRatio CH/insulinaFactor de corrección |
| Indicaciones aprobadas | > 7 años8 unidades | > 1 año10 kg5 unidades | > 6 años25 kg10 unidades |
| Modos adicionales | Objetivo temporal:Objetivo 150 mg/dLBolos correctores automáticos OFF | Modo «Boost»Modo «Ease off»Ajuste de dosis alrededor de un+30% o -30% | Modo sueño: 112,5-120 mg/dLActividad: 140-160 mg/dL |
PID: algoritmo PID (Proportional, Integrative y Derivative); MPC: algoritmo Model Predictive Control; Ratio CH/insulina: ratio carbohidratos/insulina.
Actualmente se recomienda ofrecer los sistemas AID a todos los niños y adolescentes con DMT1 que sean capaces de usar el dispositivo de manera segura (ellos mismos o con la ayuda de sus cuidadores) (recomendación grado A de la American Diabetes Association [ADA])38. Especialmente debe considerarse en aquellos con control glucémico fuera de objetivos, hipoglucemias problemáticas o elevada variabilidad glucémica, basando la elección de tratamiento en las circunstancias, deseos y necesidades del individuo y su familia6,38,39.
La decisión de iniciar el sistema debe ser consensuada con el paciente y su familia sobre la base de una información completa sobre las expectativas en relación con los resultados y los requerimientos por parte del paciente. Tanto este como la familia deben comprometerse a completar el programa de formación, a seguir las recomendaciones de seguridad sobre la prevención de la cetoacidosis y realizar los esfuerzos necesarios para cubrir adecuadamente las necesidades de insulina para las comidas39.
Formación e inicio del sistema Automated Insulin Delivery desde múltiples inyecciones diarias de insulinaLos pacientes que inician un sistema AID, junto con sus familias y/o cuidadores, deben recibir formación específica en un programa estructurado que aborde los aspectos detallados en la tabla 4 de manera gradual y sistemática, recomendándose específicamente valorar iniciar el sistema en modo manual antes de activar el modo automático, incluso en los sistemas que no requieran obligatoriamente este paso previo39.
Contenidos esenciales en el programa de formación para el inicio de sistemas híbridos de asa cerrada
| Antes de iniciar el sistema en modo manual: | Antes de iniciar el sistema en modo automático: |
|---|---|
| Componentes del sistema. Formación técnica para la utilización del sistema. Programa de descarga y aplicaciones de cuidadores. | Componentes del sistema. Formación técnica para la utilización del sistema. Programa de descarga y aplicaciones de cuidadores. |
| Cambio de equipo de infusión incluido resorvorio de insulina cada 2-3 díasRotación. Llenado de tubo suficiente en función de la longitud. Llenado de la cánula. | Cambio de equipo de infusión incluido reservorio de insulina cada 2-3 días.Rotación. Llenado de tubo suficiente en función de la longitud. Llenado de la cánula. |
| Funcionamiento del sistema en modo manual:- Concepto de basal y bolo.- Concepto de basal temporal.- Calculador de bolo: ratio gramos/unidad, factor de corrección, objetivo (intervalo o valor único), definición insulina activa e implicaciones en el cálculo del bolo. | Funcionamiento del sistema en modo automático:- Algoritmo del modo automático. Basal automática/bolo automáticos.- Qué parámetros influyen en el algoritmo.- Concepto de bolo de insulina iniciado por el usuario y dosis de insulina administrada por el algoritmo.- Cuándo valorar desactivar el modo automático.- Cuándo y cómo sobrecorregir la recomendación de bolo del sistema. |
| Manejo de la hipoglucemia:- Habitualmente las dosis de HC requeridas son menores que con múltiples dosis de insulina (MDI) y no suele ser necesario utilizar HC de absorción lenta.- Función de suspensión antes de hipoglucemia. Criterios de suspensión y activación.- Evitar sobreactuar en caso de suspensión automática. No duplicar acciones.- En caso de hipoglucemia grave, administrar glucagón y desconectar la bomba hasta glucemia> 70 mg/dL. | Manejo de la hipoglucemia:-Habitualmente las dosis de hidratos de C requeridas son menores que con el modo manual. No suele ser necesario utilizar HC de absorción lenta.- En caso de hipoglucemia grave, administrar glucagón y desconectar la bomba hasta glucemia> 70 mg/dL. |
| Tratamiento de la hiperglucemia:- Hiperglucemia> 250 mg/dL durante más de 2 horas y cuerpos cetónicos en sangre negativos: cambiar el equipo de infusión incluido el reservorio de insulina y administrar bolo corrector.- Hiperglucemia> 250 mg/dL durante más de 2 horas y cuerpos cetónicos en sangre positivos: administrar bolos correctores con pluma (no utilizar la bomba). Cambiar el equipo de infusión incluido el reservorio de insulina. Seguir protocolo de cetosis.- En caso de cetoacidosis diabética, retirar el sistema y manejar con fluidoterapia intravenosa y perfusión de insulina. | Tratamiento de la hiperglucemia:- Hiperglucemia> 250 mg/dL durante más de 2 horas y cuerpos cetónicos en sangre negativos: cambiar el equipo de infusión incluido el reservorio de insulina. Valorar administrar un bolo corrector.- Hiperglucemia> 250 mg/dL durante más de 2 horas y cuerpos cetónicos en sangre positivos: administrar bolos correctores con pluma (no utilizar la bomba). Cambiar el equipo de infusión incluido el reservorio de insulina. Mantener el sistema en modo manual mientras se administren bolos con pluma. Seguir el protocolo de cetosis.- En caso de cetoacidosis diabética, retirar el sistema y manejar con fluidoterapia intravenosa y perfusión de insulina. |
| Estrategias de seguridad para la prevención de la CAD:- Sospechar siempre obstrucción en caso de hiperglucemia inexplicada o glucemia> 250 mg/dL durante 2 horas.- Días de enfermedad: adaptar la programación del sistema. Aumento de las necesidades de insulina (+10-50%). Vigilar con frecuencia la glucemia y los cuerpos cetónicos en sangre. | Estrategias de seguridad para la prevención de la CAD:- Sospechar siempre obstrucción en caso de hiperglucemia inexplicada o glucemia> 250 mg/dL durante 2 horas.- Días de enfermedad: adaptar la programación del sistema. Aumento de las necesidades de insulina (+10-50%). Vigilar con frecuencia la glucemia y los cuerpos cetónicos en sangre. Valorar desactivar el modo automático si no se obtienen en buenos resultados. |
| Ajustes durante el ejercicio:- Utilizar una dosis basal temporal más baja desde una hora antes a la realización del ejercicio aeróbico.- Recomendaciones para evitar hiperglucemia en relación con ejercicio anaerobio.- Actitud en caso de desconexión durante ejercicio.- Aporte de hidratos de carbono en caso de ejercicio prolongado. | Ajustes durante el ejercicio:- Utilización del modo actividad u objetivo temporal. Cuándo programarlo y desactivarlo para evitar hipoglucemia o hiperglucemia- Recomendaciones para evitar hiperglucemia en relación con ejercicio anaerobio.- Actitud en caso de desconexión durante ejercicio (suspensión de la infusión de insulina).- Aporte de hidratos de carbono en caso de ejercicio prolongado. |
| Pauta alternativa con MDI en caso de fallo del sistema. | Pauta alternativa con MDI en caso de fallo del sistema. |
CAD: cetoacidosis diabética; HC: hidratos de carbono.
Este enfoque brinda al paciente la oportunidad de aprender a utilizar el sistema en modo manual, lo cual puede resultar imprescindible en situaciones específicas, como la ausencia de datos del sensor o la necesidad de aplicar dosis máximas o mínima durante un periodo prolongado, en las que el sistema no puede operar en modo automático. Además, permite realizar anticipadamente ajustes en las dosis basales y en los parámetros para el cálculo de bolo, lo que contribuirá a una adaptación más rápida del algoritmo posteriormente.
Por lo general, la transición del modo manual al modo automático puede llevarse a cabo en un periodo de dos a siete días si se opta por comenzar en modo manual39. En el sistema 780G un periodo de al menos 48h en modo manual desde las 24h del día de inicio es requerido por el sistema como requisito para la activación del modo automático. En los sistemas CamAPS-Ypsopump y Tandem Control IQ es posible activar el modo automático desde el inicio. No obstante, es crucial señalar que este proceso debe ser individualizado, teniendo en cuenta la preparación tanto del paciente como de su familia o cuidadores. En los casos en los que el sistema se inicie en modo manual, la valoración de las dosis de insulina administradas en los días anteriores a la transición a modo automático resulta de especial relevancia. En situaciones en las que la dosis diaria total en los días previos no refleje las necesidades habituales del paciente, el algoritmo del sistema requerirá un periodo más largo para adaptarse adecuadamente a las necesidades del paciente, lo que condicionará un impacto subsiguiente en los resultados de control glucémico durante las primeras semanas.
Inicio del modo automático y optimización del control glucémicoLos parámetros susceptibles de programación que determinan el funcionamiento del modo automático difieren entre los distintos sistemas y se encuentran detallados en la tabla 3.
En todos los casos es esencial, con anterioridad a la activación del modo automático, que los pacientes reciban la formación específica sobre el funcionamiento del algoritmo, así como las variaciones en las recomendaciones sobre la prevención de episodios de hipo e hiperglucemia.
Los conceptos de «insulina administrada por el paciente» e «insulina administrada por el algoritmo» son más pertinentes en el contexto del modo automático que los conceptos de «insulina basal» e «insulina en bolo», pues facilitan la comprensión del impacto de las acciones del paciente en la respuesta del sistema y la importancia de la no sobreactuación en caso de hipo o hiperglucemia6.
Los objetivos del paciente deben mantenerse alineados con el objetivo de glucosa programado en el modo automático. Esto resulta esencial, ya que, si el paciente actúa buscando cifras de glucosa más elevadas, provocará que el sistema administre insulina para alcanzar el objetivo, lo que resulta en un incremento de la variabilidad glucémica y del riesgo de hipoglucemia. De manera similar, la implementación de estrategias para prevenir la hiperglucemia posprandial, como la optimización del intervalo de tiempo entre la administración de la insulina y el comienzo de la ingesta o el ajuste de la ratio carbohidratos/insulina, evitará la administración sobreañadida de insulina por parte del sistema en respuesta al pico de glucemia posprandial y contribuirá a obtener mejores resultados glucémicos.
El porcentaje de insulina administrada por el sistema en forma de dosis basal automática y/o bolos correctores automáticos puede servir como indicador para evaluar la necesidad de ajustar los parámetros del modo automático o de implementar estrategias destinadas a reducir la glucemia en el periodo posprandial. En general y empíricamente, en el caso del sistema Medtronic 780G, se considera que un porcentaje de autocorrección superior al 20% indica que es necesario reducir el objetivo o la DIA o que no se están cubriendo adecuadamente las necesidades de insulina en relación con las ingestas. En este último caso, se debe valorar optimizar el tiempo entre la administración de los bolos y el inicio de la ingesta y la necesidad de reducir las ratios carbohidratos/insulina. Con el sistema CamAPS-YPsopump, como reflejo de una necesidad de optimización de los bolos preprandiales, podríamos ver un porcentaje de dosis basal respecto a la dosis diaria total elevado para las necesidades del paciente. Finalmente, con el sistema Tandem Control IQ, en esta situación, podríamos observar tanto un incremento de la autocorrección como de la dosis basal.
Asimismo, resulta importante actualizar periódicamente los parámetros que no inciden en el algoritmo, como el patrón basal en el caso del sistema 780G de Medtronic o el sistema CamAPS FX, así como todos los parámetros del calculador del bolo. En caso de interrupción del modo automático el sistema recurrirá a dichos parámetros para operar en modo manual.
Inicio del modo automático en el sistema 780G de MedtronicPara la mayoría de los pacientes que inician el modo automático con el sistema 780G, los mejores resultados se obtienen al comenzar el sistema con un objetivo de 100mg/dL y DIA de 2 horas18,40. En el caso de los pacientes con un control glucémico previo fuera de objetivos, se puede considerar comenzar con un objetivo más elevado y adaptarlo progresivamente.
En los pacientes con mayor sensibilidad a la insulina, especialmente los niños más pequeños, se recomienda valorar inicialmente una DIA más prolongada para evitar la tendencia a la hipoglucemia en relación con el fenómeno anti-alba. Posteriormente, se recomienda programar el objetivo más bajo tolerado.
En este sistema, los bolos para las comidas administrados por el paciente están determinados por la ratio carbohidratos/insulina programada y por el ajuste que realiza el algoritmo. En ocasiones, el algoritmo puede aplicar una reducción al bolo para una comida y este puede resultar de menor tamaño de lo que correspondería por la ratio programada (Safe Meal Bolus)36. La función Safe Meal Bolus considera la dosis diaria total, la ratio programada, la cantidad de carbohidratos totales, la insulina activa y la estimación del riesgo de hipoglucemia en las siguientes cuatro horas para decidir la reducción del bolo calculado. La sugerencia de bolo del sistema no puede sobrecorregirse. En el caso de que, en un momento dado, el sistema recomiende bolos inferiores a lo correspondiente por la ratio programada e inferiores a los necesario para el paciente, en lugar de introducir cantidades de hidratos de carbono falsas, es preferible salir del modo automático, administrar el bolo utilizando el bolo wizard y, cuando termine de administrase el bolo, volver a activar el modo automático. En estas circunstancias, introducir hidratos de carbono falsos resultará en general poco efectivo para incrementar el bolo sugerido. Además, la cantidad de hidratos de carbono diaria es un parámetro que el algoritmo tiene en consideración para adaptar su respuesta, por lo que esta práctica puede influir de forma negativa posteriormente. Reducir la ratio tampoco será efectivo en el caso de que el ajuste se deba a la función Safe Meal Bolus.
Otras características de las que dispone el algoritmo del sistema 780G de Medtronic y que es conveniente conocer para entender las respuestas del sistema son:
Safe Correction Bolus: el sistema reduce cada bolo corrector automático calculado considerando el riesgo de glucosa baja en las dos horas posteriores.
Meal Detection Module: cuando el sistema detecta una comida omitida o subestimada (para lo cual utiliza un promedio ponderado de la tasa de variación de glucosa), el algoritmo reduce el umbral de predicción de baja glucosa para permitir una menor reducción de los bolos de corrección automática41. En otras palabras, modifica el efecto de la función Safe Correction Bolus.
Límite de autocorrección: 8% de la dosis total diaria de insulina como corrección automática dentro de un periodo de 45 minutos. Una vez que se ha alcanzado este límite, en el momento en el que el paciente introduzca un nivel de glucosa en sangre, las autocorrecciones volverán a administrarse si se cumplen los criterios para ello42.
Inicio del modo automático en el sistema Tandem-Control IQCon el sistema Tandem-Control IQ, los mejores resultados se obtienen cuando el patrón basal, las ratios carbohidratos-insulina y los factores de corrección están correctamente ajustados con anterioridad al inicio del modo automático. Para evitar hipoglucemia por acumulación de insulina en caso de bolos administrados con intervalos de tiempo inferiores a la DIA, es esencial que el paciente conozca el concepto de insulina activa y cómo lo utiliza el calculador de bolo. Con este sistema, el calculador solo restará la insulina activa de bolos previos (manuales o automáticos) del bolo correspondiente a la comida en caso de que la glucosa se encuentre por debajo del objetivo. Si la glucosa se encuentra por encima del objetivo, restará la insulina activa solo de la parte del bolo correspondiente a la corrección. El ajuste del factor de corrección se considera el factor determinante más importante en relación con el aumento del TIR y la reducción de la variabilidad glucémica43.
Inicio del modo automático en el sistema CamAPS-YpsopumpEl sistema CamAPS permite programar el objetivo de glucosa personal por tramos horarios. El algoritmo es capaz de aprender de los resultados y es habitual un tiempo de aprendizaje inicial de varias semanas. El algoritmo adapta progresivamente su respuesta considerando simultáneamente: la dosis de insulina total media, la necesidad de insulina por cada hora del día y la glucosa posprandial. En este último caso, si el paciente sobrestima o subestima constantemente los hidratos de carbono, el sistema empezará a ajustar la administración de insulina después de las comidas44. En los niños pequeños, con elevada sensibilidad a la insulina y requerimientos de dosis de esta muy bajos, es preferible comenzar con objetivos más altos y reducirlos progresivamente. Al inicio, durante el periodo de aprendizaje del sistema, que puede extenderse dos a tres semanas, se debe recomendar no sobreactuar tanto en relación con glucemias bajas como altas, evitando la utilización del «modo boost» y la administración adicional de bolos correctores manuales; ya que estas prácticas suelen contribuir a un aumento de la variabilidad glucémica en la edad pediátrica.
Principales retos de los actuales sistemas Automated Insulin DeliveryLos sistemas AID actuales aún tienen diversos desafíos, entre los que cabe mencionar la elevada frecuencia de problemas relacionados con la piel que se derivan del uso de los adhesivos de sensores y sistemas de infusión45,31, así como la ausencia de algoritmos que automaticen satisfactoriamente la infusión de insulina en relación con las ingestas y la adaptación automática al ejercicio físico no anunciado. En lo que se refiere a las ingestas, aunque con los sistemas AID actuales, los mejores resultados se obtienen optimizando el contaje de hidratos de carbono, la ratio programada y el momento de administración del bolo, existen estudios que demuestran que es posible alcanzar el objetivo de TIR> 70% con un anuncio simplificado de las comidas46 y el sistema podría manejar pequeños snacks no anunciados de hasta 20g de carbohidratos sin incrementos de glucemia superiores a 50mg/dL47. Por otro lado, aunque se han realizado avances importantes, como la definición de categorías específicas para los sistemas interoperables por parte de la Administración de Alimentos y Medicamentos de los EE. UU. (FDA), las posibilidades actuales con respecto a la interoperabilidad de los componentes del sistema continúan siendo muy limitadas. Finalmente, es importante destacar que conseguir garantizar un acceso equitativo para todos los pacientes con DMT1 sigue siendo quizá el reto más relevante en relación con estos sistemas y, en general, con lo que respecta al tratamiento de la DMT1.
FinanciaciónEl presente trabajo no ha recibido financiación para su realización.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.