Los paragangliomas (PGL) son tumores neuroendocrinos (TNE) inusuales y encapsulados, localizados en la glándula suprarrenal o en los ganglios extraadrenales. Los PGL extraadrenales pueden desarrollar un componente gangliocítico con células ganglionares, denominados paragangliomas gangliocíticos (PG). La localización más frecuente es el duodeno, apareciendo con síntomas digestivos o como hallazgo incidental.
Describimos a un paciente de 43 años, con dolor epigástrico, náuseas y vómitos. La tomografía axial computarizada (TAC) informó de una imagen nodular en el duodeno. Se realizó una punción aspiración con aguja fina (PAAF), describiéndose grupos de células neuroendocrinas y tejido neural en el informe anatomopatológico. La cirugía fue el tratamiento elegido. Dado que no presentaba invasión linfática ni del parénquima pancreático, no se administró radioterapia (RT).
El manejo de los PG no está adecuadamente establecido y se recomienda el enfoque de un equipo multidisciplinar, para guiar las opciones terapéuticas. La resección quirúrgica sigue siendo el tratamiento principal, considerándose RT adyuvante en caso de invasión linfática.
Paragangliomas (PGLs) are rare and encapsulated neuroendocrine tumors (NET), located in the adrenal gland or the extra-adrenal paraganglia. Extra-adrenal PGLs may develop a gangliocytic component with ganglion cells which are called gangliocytic paragangliomas (GPs). The most common location is the duodenum, and they appear with digestive symptoms or as an incidental finding.
We described a 43 years old patient, with epigastric pain, nausea and vomiting. The CT-scan reveals a nodular image in the duodenum. An ultrasound-guided FNA was performed and the pathological report revealed neuroendocrine cell groups and neural tissue. Surgery was the chosen treatment. As the patient did not present lymphatic or pancreatic parenchyma invasion, radiotherapy (RT) was not administered.
The management of GPs is not well established and multidisciplinary team approach is recommended to lead to therapeutic options. Surgical resection is still key in the treatment, and adjuvant RT may be considered in cases of lymph node invasion.
Paciente de 43 años, sin antecedentes personales de interés, que acude a Urgencias por dolor epigástrico de pocos días de evolución, irradiado a espalda que empeora con la ingesta, asociando náuseas y vómitos. Se deriva a la consulta de Digestivo, objetivándose mediante tomografía axial computarizada (TAC) una imagen nodular de 1,6cm en segunda porción duodenal, en probable relación con tumor neuroendocrino (TNE). Se solicitó una punción aspiración con aguja fina (PAAF) y el resultado anatomopatológico mostró grupos celulares neuroendocrinos y tejido neural. La colangiografía por resonancia magnética (RM) ofreció tumor del estroma gastrointestinal (GIST) y TNE como diagnósticos diferenciales. Por otro lado, dicha lesión duodenal no mostró captación en el estudio con octreoscan. Además, los valores de catecolaminas y metanefrinas en orina resultaron normales.
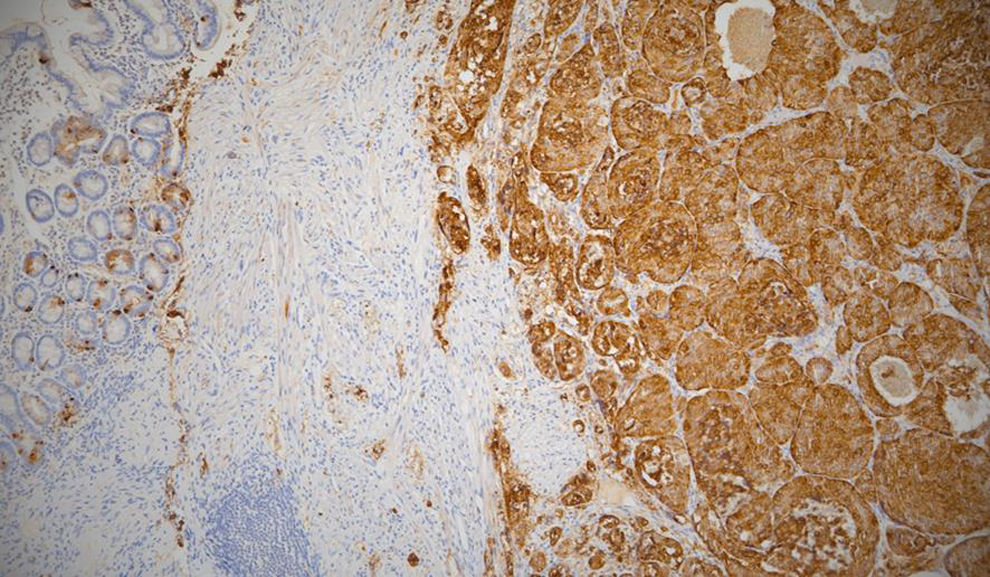
Se decidió intervención quirúrgica, realizándose enucleación del tumor junto con tutorización de la vía biliar con tubo de Kehr. Los resultados anatomopatológicos de la muestra resultaron compatibles con paragangliomas gangliocíticos (PG) con tres patrones histológicos diferenciales (figs. 1 y 2). Cada uno de ellos presentó una tinción inmunohistoquímica diferente. El componente neuroendocrino fue positivo para sinaptofisina, cromogranina y enolasa (fig. 3), mientras que el componente de células de Schwann resultó positivo para S100 (proteína presente en las células derivadas de la cresta neuronal [células de Schwann y melanocitos]; se utiliza como marcador inmunohistoquímico), sinaptofisina y enolasa, y las células ganglionares fueron positivas para sinaptofisina, enolasa y neurofilamentos. Dicha muestra presentó un índice Ki67 <1%, sin presentar infiltración de la capa submucosa intestinal, linfática ni del parénquima pancreático. El estudio genético de la muestra fue negativo. Se realizó una secuenciación de nueva generación (NGS), incluyendo puntos calientes de mutación, variación del número de copias (CNV) y mutaciones de fusión (inter e intragénicas). Sin embargo, no se incluyeron mutaciones del factor-2 alfa inducible por hipoxia (HIF-2α). Dada la ausencia de afectación linfática, no se administró radioterapia (RT).
ManejoLos paragangliomas (PGL) son TNE encapsulados y raros, que pueden localizarse en la médula suprarrenal o en los ganglios extraadrenales.
En algunos casos, los PGL pueden desarrollar un componente gangliocítico con células ganglionares, conocidos como PG1. Este tumor inusual incluye tres componentes característicos: células neuroendocrinas epitelioides, células fusiformes con diferenciación de células de Schwann y células ganglionares2 (figs. 1-3).
La lesión fue descrita por primera vez por Dahl et al. en 19573. Fue caracterizado como PGL benigno no cromafín por Taylor et al. en 19614. Posteriormente, en 1971, Kepes et al. comenzaron a utilizar el término «paraganglioma gangliocítico», reconociendo las características tanto de paraganglioma como de ganglioneuroma5.
La localización más frecuente es el duodeno, denominándose paraganglioma gangliocítico duodenal (PGD), seguido del sistema respiratorio, médula espinal, yeyuno, esófago y apéndice.
Los PGD se manifiestan clínicamente con dolor abdominal, hemorragia digestiva o ictericia obstructiva, pero también se diagnostican como hallazgo incidental. El dolor abdominal ocurre en un tercio de los pacientes, pudiendo ser epigástrico con características dispépticas6. Aunque la mayoría son esporádicos, se ha descrito una asociación con la neurofibromatosis tipo I (NF1)7.
Las mutaciones HIF-2α son responsables del síndrome de múltiples PGL y somatostatinomas duodenales, asociados con policitemia (síndrome de Pacak-Zhuang). Este tipo de mutaciones estuvo presente en el 20% de los PG en la serie de Zhuang et al.8. La mayoría de los casos se consideraron no funcionantes, a excepción de los TNE ampulares productores de somatostatina, también asociados con NF1. Cabe destacar que estos tumores suelen confundirse con otras neoplasias gastrointestinales en pruebas de imagen y/o endoscopias9.
Los PGD tienen buen pronóstico, siendo inusual la recurrencia. Se han descrito pocos casos con metástasis en los ganglios linfáticos y/o hepáticas10–15, representando el 5-7% de los pacientes diagnosticados16. No obstante, el PG periampular debe ser considerado como un tumor de mayor potencial maligno, debido a que se registraron metástasis en el 26,3% de los mismos17. Como datos de interés, parece haber mayor riesgo de metástasis en los ganglios linfáticos si presentan extensión más allá de la capa submucosa intestinal y en pacientes más jóvenes7,9,16. Dicha afectación linfática parece influir en la modalidad de tratamiento, pero no en el pronóstico7.
La resección quirúrgica es el tratamiento principal, variando según la extensión de la lesión. Puede abarcar desde una resección submucosa endoscópica hasta una duodenopancreatectomía12,15.
Áreas de incertidumbreAunque el origen de los PG continúa sin estar claro, se han propuesto dos teorías para explicarlo. La primera propuesta es un origen ectodérmico, surgido de células pluripotentes derivadas de la cresta neural. Se encuentran en las glándulas de Lieberkühn o en los ganglios celíacos durante el desarrollo fetal. El segundo sugiere que se originan a partir de células epiteliales derivadas del endodermo en el primordio ventral del páncreas y de células ganglionares o fusiformes neuroectodérmicas6. Las células ganglionares expresan sinaptofisina, enolasa específica de neuronas y neurofilamento, indicando su diferenciación neuronal1.
Tres casos han mostrado que la RT externa adyuvante puede ser de utilidad en metástasis ganglionares regionales7,13,14. Dichos pacientes se mantienen libres de recurrencia hasta la fecha, siendo el máximo tiempo de seguimiento registrado de ocho años14. En general, no se recomienda la quimioterapia (QT), dada la baja probabilidad de metástasis a distancia y la escasa respuesta a la misma de este tipo de tumores. Se ha descrito un caso sin recurrencia durante un seguimiento de tres años, tras recibir cinco ciclos de QT16.
GuíasActualmente, dado que no existen guías específicas para los PG, se utilizan los protocolos de PGL en estos casos. Como todos los PGL son potencialmente metastásicos, se eliminó la discriminación entre benignos y malignos en la clasificación de tumores endocrinos de la Organización Mundial de la Salud (OMS)18. La presentación clínica de los PGL es extremadamente variable y depende de muchos factores: localización anatómica, tamaño del tumor, extensión, funcionalidad, causa hereditaria o esporádica, potencial de malignidad y tiempo transcurrido desde el inicio de los síntomas hasta el diagnóstico.
El TAC o la resonancia magnética (RM) son las pruebas de imagen más utilizadas para su localización. Aunque presentan una sensibilidad y una especificidad similares, el TAC proporciona mejores detalles anatómicos19. Los PGL suelen ser masas sólidas, hipervasculares y bien definidas20. Las opciones de tratamiento dependen de la extensión de la enfermedad, constituyendo la cirugía la base del tratamiento para la mayoría de los pacientes18,21.
Conclusiones y recomendacionesSe trata de un tumor extremadamente raro. El diagnóstico anatomopatológico resulta esencial para el diagnóstico, dado que puede haber discordancia entre las correspondientes pruebas de imagen. Podríamos considerar la infiltración más allá de la capa submucosa intestinal, como factor de riesgo de metástasis linfáticas.
Dada su muy baja prevalencia, se recomienda la valoración conjunta por un equipo multidisciplinar para guiar la mejor opción terapéutica. La resección quirúrgica continúa siendo la clave del tratamiento, valorando asociar RT adyuvante en los casos de invasión linfática. No se dispone de evidencia suficiente para recomendar el uso de QT.
FinanciaciónLos autores declaran no haber recibido ningún tipo de financiación para el desarrollo de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.