Las pruebas de imagen con radionúclidos como [123I] Metayodobencilguanidina (MIBG), [18F]-fluorodesoxiglucosa, [18F]-fluorodopa o 68Ga-DOTA(0)-Tyr(3)-octreotate son de utilidad para el diagnóstico, la estadificación y el seguimiento de los feocromocitomas (PHEOs) y paragangliomas (PGLs) (PPGLs). Además de su capacidad de detección y localización de la enfermedad, permiten una mejor caracterización molecular, lo cual es de utilidad para la planificación de la terapia dirigida con MIBG marcada con yodo-131 (131I) o con la terapia con radionúclidos receptores de péptidos (PRRT) con DOTATATE marcado con [177Lu] u otros agentes relacionados en pacientes con enfermedad metastásica. En esta revisión detallamos las principales características de los radiofármacos empleados en el estudio funcional de los PPGLs y el papel de las pruebas de imagen con radionúclidos para la evaluación inicial, estadificación, selección de pacientes para terapia molecular dirigida y planificación de radioterapia. También se ofrece una serie de recomendaciones prácticas en cuanto al estudio funcional según los diferentes escenarios clínicos y genéticos en los que se presenten los PPGLs, y sobre las indicaciones y eficacia de terapia con [131I]-MIBG y 177Lu-DOTATATE.
Radionuclide imaging tests with [123I] Metaiodobenzylguanidine (MIBG), [18F] -fluorodeoxyglucose, [18F] -fluorodopa, or 68Ga-DOTA(0)-Tyr(3)-octreotate are useful for the diagnosis, staging and follow-up of pheochromocytomas (PHEOs) and paragangliomas (PGLs) (PPGLs). In addition to their ability to detect and localize the disease, they allow a better molecular characterization of the tumours, which is useful for planning targeted therapy with iodine-131 (131I) -labelled MIBG or with peptide receptor radionuclide therapy (PRRT) with [177Lu] -labelled DOTATATE or other related agents in patients with metastatic disease. In this review we detail the main characteristics of the radiopharmaceuticals used in the functional study of PPGLs and the role of nuclear medicine tests for initial evaluation, staging, selection of patients for targeted molecular therapy, and radiation therapy planning. It also offers a series of practical recommendations regarding the functional imaging according to the different clinical and genetic scenarios in which PPGLs occur, and on the indications and efficacy of therapy with [131I] -MIBG and 177Lu-DOTATATE.
Los feocromocitomas (PHEOs) y paragangliomas (PGLs) (PPGLs) son tumores neuroendocrinos poco frecuentes que derivan de las células de la cresta neural del sistema nervioso simpático y parasimpático1,2. Los PHEOs surgen de la médula suprarrenal y los PGLs de los paraganglios localizados fuera de la médula suprarrenal. Los PGLs se pueden localizar a lo largo de todo el organismo y se clasifican en simpáticos y parasimpáticos dependiendo de su origen. El 80-85% de los tumores de células cromafines son PHEOs y el 15-20% PGLs3. Se estima que entre un 0,2-0,6% de los pacientes con HTA presentan PHEOs4 y aproximadamente el 5% de los pacientes con incidentalomas suprarrenales5.
Existe consenso que la determinación de metanefrinas fraccionadas plasmáticas y/o urinarias es la prueba diagnóstica de elección, e inicial para establecer el diagnóstico de hipersecreción endógena de catecolaminas en pacientes con sospecha clínica6,7. Una vez establecido el diagnóstico bioquímico se debe proceder a la realización de estudios de imagen para la localización del tumor productor de catecolaminas8. En este sentido, la gammagrafía con 123I-metayodobencilguanidina (MIBG), la tomografía por emisión de positrones (PET/TC) con 18F-fluorodesoxiglucosa (18F-FDG) y las pruebas funcionales para receptores de somatostatina (SSTR) como el 68Ga- DOTA(0)-Tyr(3)-octreotate son útiles para detectar lesiones no manifestadas con las modalidades de imagen convencionales1 (fig. 1). Además, se debe valorar la realización de pruebas funcionales antes de la decisión de tratamiento en pacientes con PPGLs malignos o con riesgo aumentado de enfermedad metastásica debido al gran tamaño del tumor primario, tumor extraadrenal, multifocalidad o enfermedad recurrente1,7. El tipo de prueba de medicina nuclear se debe adaptar a las características del tumor, incluyendo localización, tamaño, perfil de secreción catecolaminérgica y pruebas genéticas del paciente, ya que la sensibilidad y especificidad de las distintas pruebas es ampliamente variable según dicho contexto2,9. En este sentido, cada vez va ganando mayor importancia el contexto genético del paciente para guiar la selección de las pruebas de medicina nuclear, tanto con fines diagnósticos como de tratamiento10,11. Cada modalidad de imagen molecular se basa en mecanismos de captación celular únicos que dependen del comportamiento molecular del tumor, que, a su vez, está determinado por el perfil genético del tumor12. Las pruebas funcionales ofrecen también la posibilidad de planificar una terapia dirigida con radionúclidos con MIBG marcada con yodo-131 ([131I]-MIBG) o terapia con radionúclidos receptores de péptidos (PRRT) con DOTATATE marcado con [177Lu] u otros agentes relacionados, terapias que han mostrado resultados prometedores y escasa toxicidad en pacientes con enfermedad metastásica13–19.
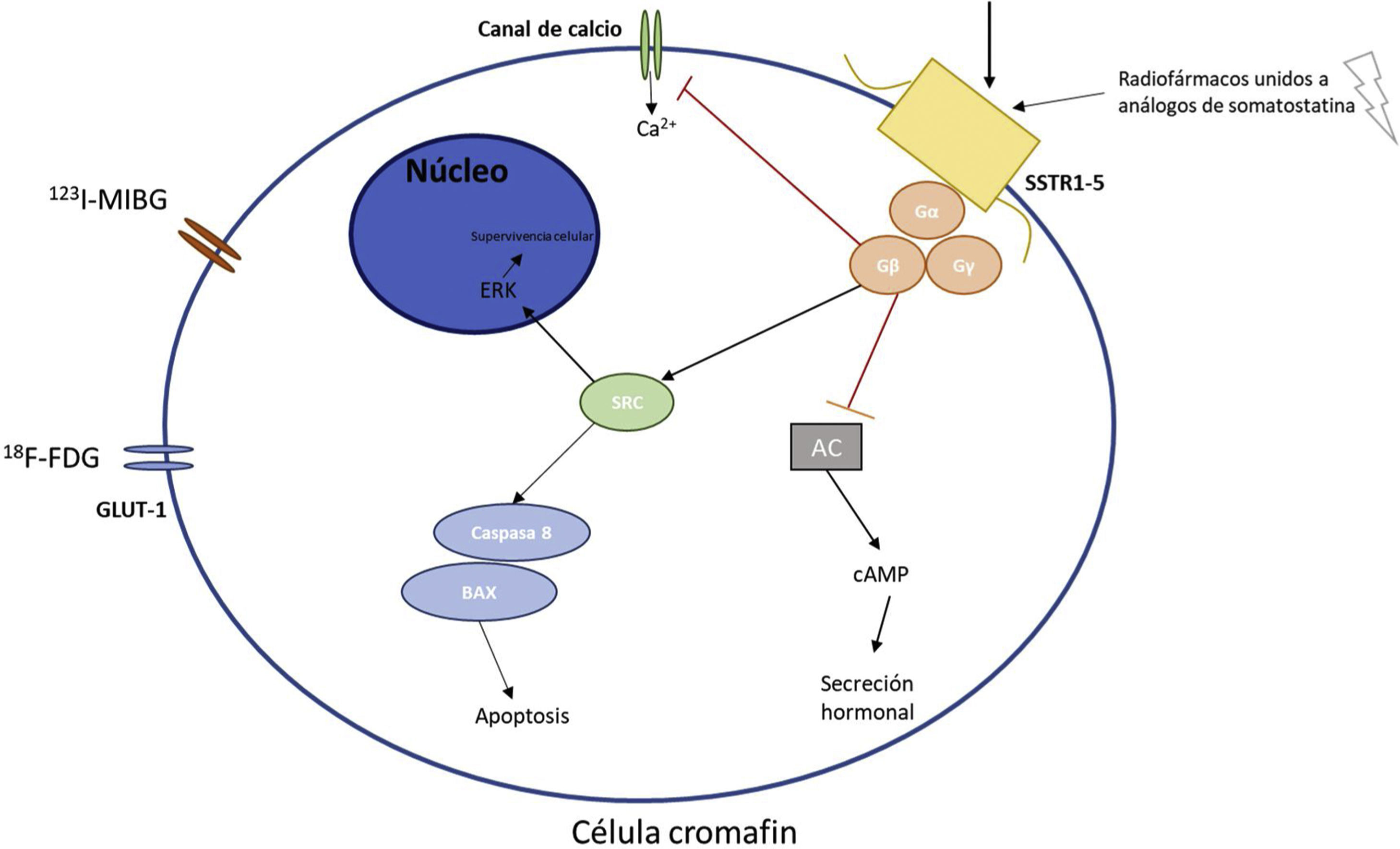
Principales receptores y vías metabólicas de la célula cromafín donde actúan los diferentes radionúclidos.
En la figura 1 se explican los mecanismos moleculares básicos de la célula cromafín y los principales receptores utilizados en diagnóstico y tratamiento con radionúclidos de los PPGLs.
AC: adenilato ciclasa; SSTR1-5: Receptor de somatostatina tipos 1-5; cAMP: AMP cíclico; SRC: Proto-oncogén tirosin-proteín quinasa; ERK: quinasas reguladas por señales extracelulares; 123I-MIBG: metayodobencilguanidina; GLUT-1: Transportador de glucosa 1; 18F-FDG: fluorodesoxiglucosa.
En esta revisión se detallan las características principales de los radiofármacos empleados en el diagnóstico de los PPGLs y el papel de las pruebas funcionales para la evaluación inicial, incluyendo estadificación, selección de pacientes para terapia molecular dirigida y planificación de radioterapia, en pacientes con PPGLs. También se ofrece una serie de recomendaciones para la práctica clínica según diferentes escenarios clínicos y genéticos en los que se presente el PPGL.
Radiofármacos empleados para el estudio diagnóstico de los PPGLsGammagrafía [123I] metayodobencilguanidina/ [123I] MIBGMIBG, un análogo de guanidina yodado que comparte una vía de transporte común a través del sistema transportador de la membrana celular. En el compartimento citoplásmico, MIBG se almacena en los gránulos neurosecretores a través de transportadores de monoaminas vesiculares (VMAT). Además, se concentra específicamente en tejidos y tumores secretores de catecolaminas, lo que permite su detección específica20. No obstante, la capacidad de detección de la gammagrafía con [123I] MIBG puede verse alterada por la interacción con ciertos fármacos como los opioides, antidepresivos tricíclicos u otros, simpaticomiméticos, antipsicóticos y algunos agentes antihipertensivos21 (tabla 1).
Principales características de los radionúcidos utilizados en el diagnóstico funcional del PPGL
| Radiofármaco | Características | Biodistribución | Interacciones | Adquisición imagenes | Costes |
|---|---|---|---|---|---|
| [123I] MIBG | -Aralquilguanidina radioyodada.-Su estructura contiene el grupo guanidina de la guanetidina unido a un grupo bencilo en el que se ha introducido yodo.-Similitud funcional con las neuronas adrenérgicas y las células cromafines de la médula suprarrenal | -Captación inicial rápida en el hígado (33% de la dosis administrada) y mucho menor en los pulmones (3%), miocardio (0,8%), bazo (0,6%) y en las glándulas salivales (0,4%) | -Disminución de la captación con la administración de fármacos antihipertensivos (reserpina, labetalol, bloqueantes de los canales del calcio), agentes simpaticomiméticos (fenilefrina, efedrina o fenilpropanolamina), cocaína, antidepresivos tricíclicos (amitriptilina y sus derivados, imipramina y sus derivados) y fenotiacina-Iniciar bloqueo tiroideo 24-48 h antes de administrar el iobenguano (123I) y continuar durante al menos tres días | -Imágenes planares y de SPECT se obtienen 24 horas después de su administración. | + |
| PET-TC [68Ga] DOTA-péptidos | -Se dirigen a subtipo 2 del receptor de somatostatina (SSTR), que es el más comúnmente sobreexpresado en los PPGLs | -Mayor captación fisiológica: bazo, seguido de los riñones.-Menor captación: hígado, hipófisis, tiroides y suprarrenales.-Puede observarse una elevada captación en el proceso unciforme del páncreas | -En paciente con análogos de la somatostatina (SSA), es preferible efectuar la adquisición de imágenes el día o días previos a la administración del SSA-Los corticoesteroides pueden inducir regulación a la baja de los SSTR2 | -Obtención de las imágenes a los 40 a 90 minutos después de la inyección.-La hora de inicio y la duración de la adquisición de las imágenes se adaptarán al equipo utilizado y a las características del paciente y del tumor | +++ |
| [18F]FDOPA PET-TC | -Análogo de un aminoácido aromático que se acumula rápidamente en los órganos diana, especialmente en el cuerpo estriado del cerebro humano y en las lesiones donde la [18F] FDOPA se convierte en [18F] fluorodopamina ([18F] FDA). | -Distribución generalizada de la actividad en todos los tejidos corporales.-Eliminación renal, el 50% se elimina después de 0,7 horas y el 50% restante después de 12 horas. | -Carbidopa: biodisponibilidad de la fluorodopa en el cerebro puede incrementarse-Glucagón: la captación de fluorodopa en el páncreas se ve afectada por el glucagón, por su interacción con la función de las células beta pancreáticas.-Haloperidol: aumento de la acumulación de fluorodopa (18F) en el cerebro.-Reserpina: puede vaciar el contenido de las vesículas intraneuronales e impedir de este modo la retención de fluorodopa en el cerebro.-Inhibidores MAO: su uso puede aumentar la captación de fluorodopa en el cerebro. | -Las imágenes se obtienen de 20 a 60 minutos después de la inyección,-Imágenes opcionales: adquisición temprana (10-20 minutos tras inyección del radiofarmaco) centrada sobre el abdomen (útil para la localización de lesiones abdominales ubicadas cerca del sistema hepatobiliar) | +++ |
| [18F] FDG PET-TC | -Análogo de la glucosa que se acumula en todas las células que utilizan glucosa como fuente primaria de energía.-Se acumula en tumores que tienen un alto nivel de intercambio de glucosa. Después de la inyección intravenosa, el perfil farmacocinético de la fludesoxiglucosa (18F) en el compartimento vascular es biexponencial | -La captación celular de la fludesoxiglucosa [18F] se realiza por un sistema transportador tisular específico, que es parcialmente insulino-dependiente y, por lo tanto, puede estar influenciado por la ingesta, las condiciones nutricionales y la existencia de diabetes mellitus. | -Todos los medicamentos que modifiquen las concentraciones séricas de glucosa pueden afectar a la sensibilidad de la exploración (p. ej., corticosteroides, valproato, carbamacepina, fenitoína, fenobarbital y catecolaminas).-La administración de factores estimulantes de colonias produce un incremento de la captación de fludesoxiglucosa [18F] en la médula ósea y el bazo durante varios días. | -La adquisición de imágenes comienza normalmente de 45 a 60 minutos después de la inyección de FDG.-Siempre que quede una actividad suficiente para una adecuada tasa de contaje, la PET con FDG puede realizarse también hasta dos o tres horas después de su administración | ++ |
PPGLs: paragangliomas y feocromocitomas; SSTR2: receptor de somatostatina tipo 2.
En pacientes con feocromocitoma, la sensibilidad y la especificidad de la gammagrafía con [123I] MIBG se estimó en un 83-100% y 95-100%, respectivamente22 (fig. 2). Estudios más amplios que incluyeron un gran número de PGLs extraadrenales, múltiples, recurrentes y hereditarios encontraron una sensibilidad del 52 al 75%23. Por otra parte, actualmente es bien conocido y se ha documentado repetidamente que la gammagrafía con [123I] MIBG no debe utilizarse en pacientes con PGLs asociados con mutación germinal de la subunidad B de succinato deshidrogenasa (SDHB) ya que la sensibilidad de la prueba en este contexto es menor del 50%24. En los casos que involucran PGLs de cabeza y cuello, la sensibilidad de la gammagrafía con 123I-MIBG es menor (18-50%) que la de otras modalidades de imágenes funcionales, particularmente aquellas que usan [68Ga] DOTA-SSA25. La gammagrafía con [123I] MIBG es muy útil para la selección de potenciales candidatos para la terapia con [131I] MIBG en casos de PPGLs malignos26,27.
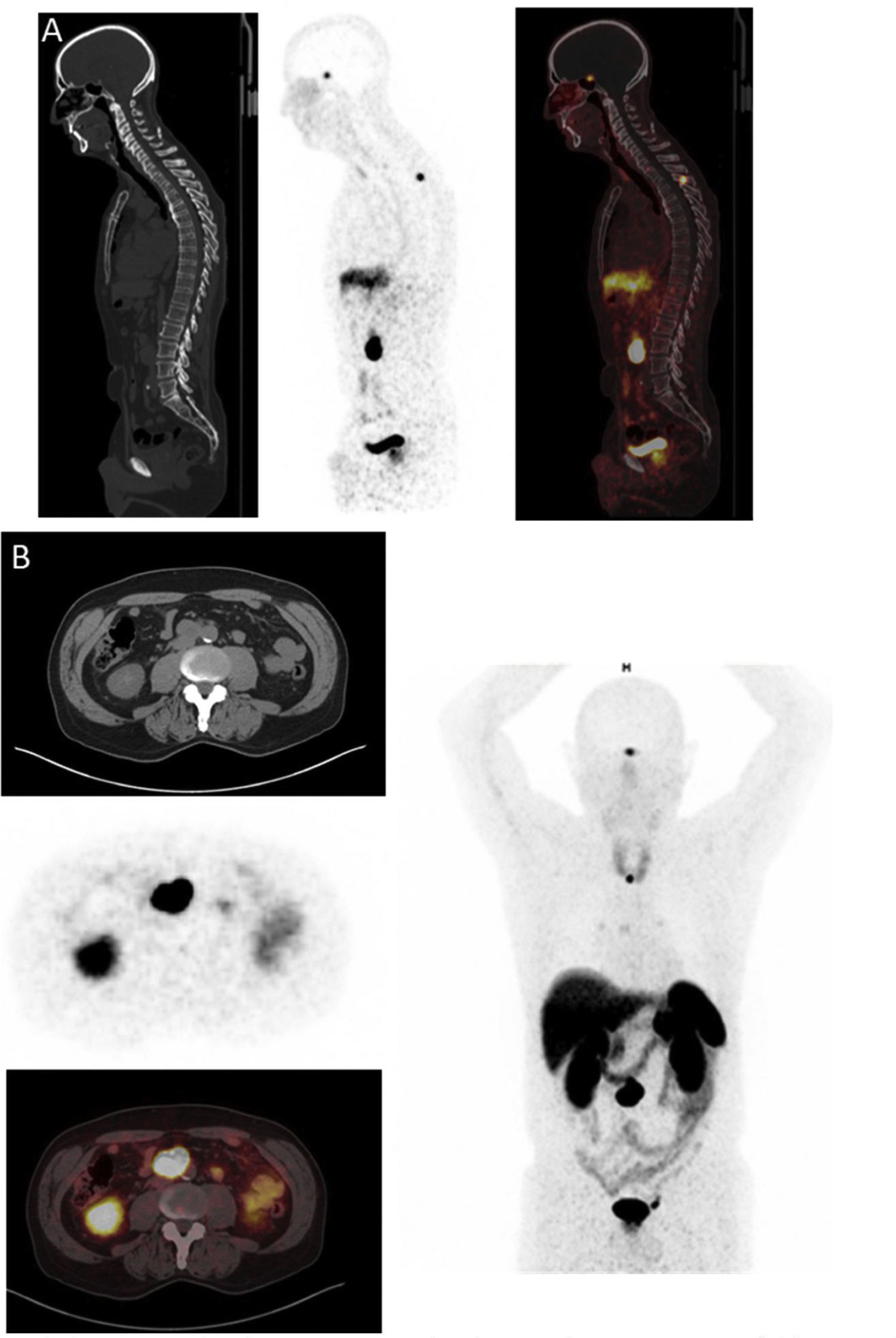
PET/TC [68Ga] DOTA-péptidos (fig. 3)Las imágenes de SSTR utilizando trazadores PET se han realizado con tres agonistas de somatostatina acoplados a DOTA (SSTas) diferentes, DOTA-Tyr3-octreotida (DOTATOC, edotreotida), DOTA-Tyr3-octreotato (DOTATATE, oxodotreotida) y DOTA-Nal3-octreotida (DOTANOC). [68Ga] SSTas se dirigen a subtipo tipo 2 de SSTR (SSTR2), que es el receptor más comúnmente sobreexpresado en los PPGLs y se internaliza en las células28. El subtipo 1 de SSTR (SSTR1) también se expresa fuertemente en algunos PPGLs, mientras que los otros subtipos son levemente o no son expresados. La baja expresión del subtipo 5 de SSTR (SSTR5) en los PPGL constituye una diferencia importante con algunos tumores neuroendocrinos que afectan al tracto gastrointestinal29. Un elemento muy importante a tener en cuenta es que el tratamiento con análogos de somatostatina (SSA) fríos puede afectar la acumulación del radiofármaco en diferentes órganos y sitios del tumor por lo que si fuera posible habría que suspenderlos previo a la realización de la prueba (tabla 1).
En una revisión sistemática y un metaanálisis reciente, la tasa de detección combinada de [68Ga] DOTA-SSA PET / TC fue del 93% [intervalo de confianza (IC) del 95%, 91-95%], que fue significativamente mayor (p < 0,001 para todo) que para la fluorodihidroxifenilalanina (FDOPAlanina) marcada con [18F] PET / TC (80%; IC 95%, 69-88%), [18F] FDG PET / TC (74%; IC 95%, 46-91%) y gammagrafía [123I/131I] MIBG (38%; IC 95%, 20-59%)30. Además, recientemente se amplió la utilidad de las imágenes funcionales con SSA, con el uso de SSA marcados como PRRT usando ya sea 177lutecio (177Lu) o 90 itrio (90Y)31 ().
99mTc-Hynic-TOC (Tectrotyd©) e 111In-octreoscanLa gammagrafía con análogos de la somatostatina se realizó por primera vez en 1987 en pacientes con tumores que expresaban SSTR. Actualmente contamos con dos radiofármacos, el más empleado ha sido el 111In-pentetreótida comercializado como Octreoscan®. La pentetreótida marcada con indio [111In] se une específicamente a SSRT. Tras la reconstitución y marcaje de la pentetreótida con cloruro de indio (111In), la solución obtenida está indicada para su uso como técnica complementaria para el diagnóstico y manejo de tumores neuroendocrinos gastroenteropancreáticos (TNEGEP), PPGLs y tumores carcinoides portadores de SSRT32. Se han desarrollado otros radiofármacos basados en el mismo análogo de la somatostatina que el 111In-pentetreótida. Debido a las propiedades físicas favorables del 99mTc, se desarrolló el 99mTc-N-α-(6-hidrazinonicotinoyl)-octreótida (99mTc-EDDA/HYNICTyr3 -octreótido), y se ha convertido en el isótopo más usado en medicina nuclear. El EDDA/HYNIC-TOC marcado con tecnecio [99mTc] se une con gran afinidad a los SSTR2 y SSTR5, y también al subtipo 3 pero con menor afinidad. Tras el marcaje radiactivo con la solución de pertecnetato [99mTc] de sodio, la solución de 99mTcEDDA/HYNIC-TOC obtenida está indicada en el estudio de localización de pacientes con TNE con expresión de SSTR.
La [111In] -pentetreotida puede ser útil para diagnosticar PPGLs, pero se considera inferior a MIBG en caso de PHEOs benignos33. No obstante, en pacientes con PPGLs metastásicos la sensibilidad del [111In] -pentetreotida parece ser mayor34.
[18F]FDOPA PET/TCLos PPGLs pueden absorber y descarboxilar aminoácidos como la dihidroxifenilalanina (DOPA). Esta propiedad depende de la actividad de la L-aminoácido aromático descarboxilasa (AADC). DOPA, el precursor de todas las catecolaminas endógenas y se capta a través de transportadores de aminoácidos de tipo L (LAT), principalmente LAT1. [18F] FDOPA se convierte en [18F] fluorodopamina ([18F] FDA) por AADC y se almacena en vesículas neurosecretoras. Los PPGLs absorben rápidamente [18F] FDOPA35. Para una captación máxima del tumor, la adquisición de imágenes PET clínicas estáticas de PPGLs con [18F] FDOPA debe comenzar preferiblemente a los 20 minutos después de la inyección (tabla 1).
Un metaanálisis reciente que incluyó 11 estudios en los que participaron 275 pacientes con PPGLs mostró que la sensibilidad y la especificidad combinadas en un análisis basado en lesiones de [18F] FDOPA PET/TC fueron 79%36. Una ventaja de la PET/TC con [18F] FDOPA sobre la gammagrafía con [123I] MIBG y otros radiofármacos es la captación limitada por las glándulas suprarrenales normales. Esto es muy útil en la detección de PPGLs de pequeño tamaño. La [18F] FDOPA PET/TC es una excelente herramienta de imagen de primera línea para PGLs de cabeza y cuello, con una sensibilidad mayor del 90%.
Con respecto a la enfermedad metastásica, se encontró que [18F] FDOPA PET/TC funciona mejor para los PGL SDHB negativos que para los PGL SDHB positivos (sensibilidad: 93% frente a 20%, respectivamente). [18F] FDOPA PET/TC muestra una sensibilidad muy alta para la detección de PPGLs asociados a mutaciones en VHL, EPAS1 (HIF2A) y FH, que a menudo son múltiples y recurrentes y ocasionalmente exhiben un potencial metastásico bastante alto37.
Hay una serie de consideraciones que se deben tener en cuenta en cuanto a interacciones cuando se emplea el PET con [18F] FDOPA. Entre las interacciones del PET con [18F] FDOPA con otros medicamentos y otras formas de interacción se encontrarían los siguientes38:
- •
La biodisponibilidad de la fluorodopa puede incrementarse por el tratamiento previo con inhibidores de la enzima aminoácido aromático descarboxilasa (AAAD), como carbidopa, que bloquean la conversión periférica de fluorodopa a fluorodopamina, o con inhibidores de la enzima catecol-O-metiltransferasa (COMT), como entacapona y nitecapona, que disminuyen la degradación periférica de fluorodopa a 3-O-metil-6-fluorodopa.
- •
Glucagón: la captación de fluorodopa (18F) en el páncreas se ve afectada por el glucagón por su interacción con la función de las células beta pancreáticas.
- •
Haloperidol: un aumento de la dopamina intracerebral causado por el haloperidol puede aumentar la acumulación de fluorodopa (18F) en el cerebro.
- •
Reserpina: la reserpina puede vaciar el contenido de las vesículas intraneuronales e impedir de este modo la retención de fluorodopa (18F) en el cerebro.
- •
Inhibidores MAO (Monoamine Oxidasa): el uso concomitante de inhibidores MAO puede aumentar la captación de fluorodopa (18F) en el cerebro.
[18F] FDG es captado por células tumorales a través de transportadores de membrana de glucosa y fosforilado por hexoquinasa. [18F] FDG-6P no sigue otras vías enzimáticas y muestra una acumulación proporcional a la tasa de glucolítico celular. Los PGLs con mutaciones de SDHx subyacentes son más ávidos por [18F]FDG que los otros subtipos, principalmente debido a la acumulación de succinato debido al bloqueo del ciclo de Krebs39 (fig. 4). La sensibilidad es alta (80 a 100%), mientras que la especificidad es baja, como se observa para cualquier otra malignidad40 (tabla 1).
De forma similar a la captación de otros radiofármacos específicos de PGL, la de [18F] FDG durante la PET / TC está influenciada por el componente genético. Aunque [18F]FDG PET/TC está bien aceptado para los PHEOs asociados a síndrome de neoplasia múltiple tipo 2 (MEN2), solo muestra positividad en aproximadamente el 40% de los pacientes. Sin embargo, muestra un fuerte potencial diagnóstico para los PGLs metastásicos, en particular los asociados con mutaciones en SDHB (sensibilidad por lesión: 83% para tumores positivos para SDHB vs. 62% para tumores SDHB negativos)41.
Tomografía por emisión de positrones combinada con resonancia magnética (PET/RM) en PPGLEl uso del PET/TC con radiofármacos que se dirigen a la localización y caracterización de PGGLs se ha demostrado útil en el manejo de estos pacientes. Desde su introducción en 2010, los sistemas de imágenes PET/RM han demostrado ser comparables a PET/TC para la obtención de imágenes oncológicas y tienen ventajas teóricas como un mejor contraste de tejidos blandos y delineación de la extensión del tumor local con una exposición reducida a la radiación ionizante al reemplazar el componente del TC42.
Si analizamos las características propias que tienen los PGLs en la RM, estos están muy vascularizados y tienen una alta intensidad de señal en las imágenes ponderadas en T2. La RM es más precisa para delinear la relación del PGL de cabeza y cuello con las estructuras vasculares y óseas circundantes y es más sensible que la TC para detectar pequeños PHEOs mientras que la TAC proporciona más información sobre la destrucción ósea por el PGLs de cabeza y cuello43. Por lo tanto, si utilizamos radiofármacos dirigidos para el estudio de estos pacientes con las potenciales ventajas de la imagen de RM con equipos híbridos, [68Ga]-DOTATATE PET/RM o [18F]FDOPA PET/RM, puede mejorar la exactitud diagnóstica y la delimitación de la neoplasia primaria en pacientes con sospecha de PGLs, así como mejorar la detección de metástasis ganglionares y de tejidos blandos. Los estudios multiparamétricos combinados con el uso de radiofármacos en equipos híbridos permitirían mejorar el diagnóstico de pacientes con síndromes hereditarios y PGLs de cabeza y cuello, particularmente en la población pediátrica, dada la menor exposición a la radiación en comparación con la PET/TC.
64Cu-DOTATATE y 18F-flubrobenguane PETCon el uso de compuestos marcados con emisores de positrones para la obtención de imágenes, se ha conseguido obtener una resolución espacial mejorada y tener la capacidad de cuantificar la radiactividad tisular. La experiencia más que acreditada de radiofármacos como PET/TC [68Ga] DOTA-péptidos y [18F]FDOPA PET/TC ha permitido que se desarrollasen otros radiofármacos similares. Una de estas novedades, como el [64Cu]-DOTATATE, se ha presentado como un nuevo trazador PET para la obtención de imágenes del SSRT. Comparado con 111In-DTPAoctreotide, es superior tanto en la dosis de radiación como en las tasas de detección de lesiones cuando se probó de manera directa en 112 pacientes44. El rango más bajo de energía del 64Cu (17% beta (β)+; energía máxima de positrones, 0,653 MeV) frente a 68Ga (88% β+; energía de positrones máxima, 1,899 MeV) teóricamente conduce a una mejor resolución espacial, y la vida media física de 12,7 h hace que 64Cu-DOTATATE sea atractivo para el uso rutinario en la imagen clínica de estos pacientes.
La diferencia en la tasa de detección de lesiones reportada se relaciona con que en el uso de [64Cu] el rango de positrones es sustancialmente más corto y se relaciona con una mejor detección de lesiones pequeñas. Sin embargo, la carga de radiación es mayor para [64Cu]-DOTATATE que para [68Ga]-DOTATOC, principalmente debido a las diferencias en la fracción de ramificación de positrones. La fracción de ramificación de positrones es 0,17 para [64Cu]-DOTATATE y 0,89 para [68Ga]-DOTATOC, lo que lleva a la necesidad de inyectar una dosis más alta de [64Cu]-DOTATATE para obtener el mismo número de recuentos que para [68Ga]-DOTATOC45,46.
Más recientemente se ha desarrollado el uso de [18F]F-Flubrobenguane, que podría cambiar el paradigma diagnóstico en sospecha de PPGLs debido a su similitud con MIBG y añadiendo las ventajas generales de la PET como son la resolución y calidad de imágenes33.
Indicaciones de los estudios de imagen molecularLas indicaciones principales que tenemos de la imagen funcional son9:
Estadificación inicialExisten algunos factores que se consideran importantes para la presencia de enfermedad metastásica, y por tanto la obtención de imágenes funcionales de cuerpo completo es preferible para todos los pacientes que cumplan con alguna de las siguientes características: SDHB, tumores grandes (> 5 cm), ubicación extraadrenal, fenotipo bioquímico noradrenérgico y, también se debería valorar un estudio funcional completo prequirúrgico en pacientes con un alto nivel de metoxitiramina7,9,47.
Los PGLs de cabeza y cuello son a menudo multifocales y ocasionalmente agresivos; por lo tanto, además de las pruebas funcionales es necesaria una evaluación anatómica detallada que incluya la correlación con las fases arterial y venosa de la TC o la RM, y en el caso de las técnicas de imagen híbridas (SPECT (tomografía computarizada por emisión de fotón único)-TC o PET/TC) el estudio selectivo detallado de la zona a estudio9.
Selección de pacientes para terapia molecular dirigidaActualmente disponemos con éxito de la PRRT con DOTA-Tyr3-octreotato (DOTATATE; oxodotreotida) marcado con lutecio-177 (177Lu) u otros SSA marcados con itrio-90 (90Y) en pacientes con TNEGEP inoperables/metastásicos y esto ha proporcionado un gran impulso hacia su uso para PPGLs inoperables/metastásicos. Hay cierta experiencia dilatada para el tratamiento de los tumores neuroendocrinos que acumulan la MIBG en su interior26,48.
Las imágenes nucleares (PET o SPECT) brindan información muy importante para planificar la terapia dirigida con radionúclidos con MIBG marcada con yodo-131 (131I) o PRRT con DOTATATE marcado con [177Lu] u otros agentes relacionados49. Además de confirmar la captación de la lesión, ayuda en la evaluación dosimétrica personalizada de órganos en riesgo y objetivos tumorales.
Planificación de radioterapiaLa integración de imágenes multimodales en la planificación de la radioterapia ha aumentado la precisión de la administración de radiación. Las imágenes moleculares pueden complementar a los estudios morfológicos en situaciones difíciles, en particular en la evaluación de extensiones venosas de PGLs yugulares grandes o recidivas de tumores en el lecho quirúrgico. Permite una definición más precisa de los volúmenes diana biológicos y potencialmente disminuir la probabilidad de complicaciones dentro de los tejidos normales circundantes y administrar una dosis biológicamente efectiva muy alta al tumor49
Para el manejo de los PPGLs se pueden utilizar diferentes radiofármacos, con características radioquímicas diferentes que les hacen adecuados para cada situación. La primera consideración que debemos tener en cuenta es diferenciar los radiofármacos y protocolos SPECT-TC frente a los PET/TC50.
Tanto la gammagrafía con [123I] MIBG como con [111In] pentetreótido son modalidades bien establecidas para la estadificación y reestadificación, así como el seguimiento de los PPGLs. SPECT-TC es una modalidad más disponible y ofrece la ventaja de la adquisición secuencial de datos morfológicos y funcionales, aumentando así la capacidad diagnóstica en términos de interpretación de imágenes y localización de enfermedades, al tiempo que mejora la sensibilidad. Estas técnicas tienen algunas limitaciones, ya que incluyen imágenes prolongadas, tiempos de captación relativamente prolongados antes de las imágenes y la presencia de algunos artefactos del tracto gastro-intestinal, así como bloqueo de tiroides o suspensión temporal de ciertos fármacos que pueden interferir con la interpretación adecuada de las imágenes. La baja resolución de las imágenes SPECT convencionales también puede limitar la detección de pequeñas lesiones51.
El uso de imágenes de PET/TC ha aumentado debido a algunas ventajas técnicas y clínicas sobre la SPECT. Actualmente, disponemos de radiofármacos más accesibles, por lo que juega un papel importante en la evaluación de estos tumores52.
Seguimiento a largo plazo con las pruebas funcionalesEn pacientes de alto riesgo (pacientes jóvenes y aquellos con enfermedad genética, tumores grandes y / o PGLs) se debe ofrecer un seguimiento anual de por vida53. Actualmente, el mejor método de imagen molecular para la detección de PPGL metastásicos es utilizar [68Ga] DOTA-SSA PET/TC, debido a su elevada sensibilidad11,54,55. [18F]FDG y [18F]FDOPA se reservan generalmente como segunda y terceras opciones, respectivamente. El uso de la combinación más de una prueba molecular puede considerarse en casos seleccionados, como el uso de [68Ga] DOTATATE y [18F] FDG PET/TC, en pacientes con lesiones pequeñas cuando existe una alta probabilidad de enfermedad metastásica y en pacientes con SDHx56. No obstante, en portadores de SDHx asintomáticos no se recomienda el estudio con pruebas de imagen molecular durante la infancia57.
Recomendaciones prácticas para el uso de la imagen funcional en PPGLsLa identificación precisa del contexto clínico y el estado genético de los pacientes permite el uso personalizado de modalidades de imágenes funcionales. En la tabla 2 se describen las recomendaciones de la Sociedad Europea de Medicina Nuclear en cuanto al estudio con pruebas de imagen con radionúclidos para los estudios de los PPGLs9.
Propuesta de algoritmo clínico para la uso de imágenes funcionales en casos de PPGLs según la Sociedad Europea de Medicina Nuclear9
| 1 Elección | 2 Elección | 3 Elección** | |
|---|---|---|---|
| PHEO esporádico | [18F]FDOPA o [123I]MIBG | [68Ga]SSA | [18F]FDG |
| PGL cabeza y cuello | [68Ga]SSA | [18F]FDOPA | [111In]SSA/[99mTc]SSA |
| PHEO hereditario (excepto SDHx): NF1/RET/VHL/MAX | [18F]FDOPA | [123I]MIBG o [68Ga]SSA | [18F]FDG |
| Afectación extradrenal multifocal y/o metastásica y/o SDHx | [68Ga]SSA | [18F]FDG si SDHB o [18F]FDOPA si no SHDB | [18F]FDG y [123I]MIBG o [18F]FDG y [111In]SSA/[99mTc]SSA |
PGL: paraganglioma; SDHx: succinato deshidrogensa.
La gammagrafía con [123I] MIBG o la PET/TC con [18F] FDOPA parecen ser adecuadas para confirmar el diagnóstico de los PHEOs esporádicos, incluidos los PHEOs no funcionantes que ocurren raramente. En comparación con la gammagrafía con [123I] MIBG, la obtención de imágenes por PET/TC con [18F] FDOPA tiene menos limitaciones prácticas y ninguna interacción farmacológica que pueda limitar la detección de feocromocitomas22.
PGLs de cabeza y cuello[18F] FDOPA y [68Ga] DOTA-SSA parecen ser los radiofármacos más sensibles para la obtención de imágenes por PET en casos esporádicos. En pacientes con tumores asociados a SDHx, [68Ga] DOTA-SSA PET/TC puede detectar lesiones muy pequeñas que pueden ser ignoradas por [18F] FDOPA PET/TC
Si [68Ga] DOTA-SSA PET/TC no está disponible, la gammagrafía SSTR (Tecktotryd/Octreoscan) se puede utilizar como una alternativa, considerando las limitaciones asociadas con la resolución espacial de SPECT. [18F]FDG PET muestra una alta sensibilidad en el contexto de estos pacientes relacionados con SDHx (especialmente con SDHB) y puede complementar [18F] FDOPA PET/TC para la detección de PGLs torácicos / abdominales54.
PGLs retroperitoneales, extraadrenales, no metastásicosLas imágenes funcionales permiten diferenciar los PGLs de los tumores neurogénicos, las enfermedades de los ganglios linfáticos y los tumores mesenquimales. Por lo tanto, la especificidad de las imágenes funcionales proporciona una contribución importante. Una vez que se ha establecido el diagnóstico de PGL, se debe considerar la multiplicidad de localizaciones extraadrenales. En este contexto, 18F-FDOPA y [68Ga] DOTA-SSA son más específicos que [18F] FDG y pueden identificar más lesiones. Por lo tanto, [68Ga] DOTA-SSA PET/TC es probablemente la modalidad de imagen preferida en la actualidad, en particular para pacientes con mutaciones SDHx58. La FDG puede proporcionar información genotípica estrechamente vinculada al comportamiento del tumor (SDHB)22.
PPGLs metastásicos[18F] FDOPA muestra muy buenos resultados en términos de detección de lesiones metastásicas en pacientes con PPGLs esporádicos. Sin embargo, su sensibilidad disminuye en presencia de mutaciones SDHx. [68Ga] DOTA-SSA ha mostrado mejores resultados en comparación con los de [18F] FDOPA, independientemente de los antecedentes genéticos [123I] MIBG puede conducir a una subestimación significativa de la enfermedad metastásica y resultar en un tratamiento inadecuado. Sin embargo, [123I] MIBG es un radiofármaco teragnóstico, y las imágenes de [123I]MIBG se pueden utilizar para determinar si un paciente es apto para la terapia con [131I] MIBG.
Papel de la terapia metabólica en los PPGLsLa terapia metabólica estaría indicada en pacientes con PPGLs metastásicos. Este tratamiento sistémico con radionúclidos emplea isótopos emisores de radiación beta que se acoplan a MIBG o a SSA.
Terapia metabólica con [I131] MIBGEl valor diagnóstico y terapéutico de MIBG se basa en su similitud estructural con la noradrenalina y una alta afinidad y absorción en las células cromafines. El yodo radiactivo (I131) unido a la molécula de MIBG produce iobenguano I-131, que funciona como un agente semi-selectivo para los PPGLs malignos. Este tratamiento se puede considerar para aquellos tumores que captan MIBG según lo determinado por la gammagrafía con I123, aunque sólo funciona para aproximadamente el 60% de estos casos13–15. Asimismo, un porcentaje menor de PPGLs secretores de dopamina captan iobenguano I-12359–61.
En pacientes con enfermedad metastásica cuyos tumores secretan catecolaminas y captan MIBG, el valor terapéutico de [131I]iobenguano para paliar los síntomas y lograr la regresión o estabilización del tumor ha sido demostrado en un gran número de series de casos15,62–71 (tabla 3). Cabe destacar que se consiguen mejores respuestas objetivas en pacientes con enfermedad limitada y en aquellos con metástasis en tejidos blandos en lugar de óseas64. Por otro lado, se debe tener en cuenta que la radioterapia de haz externo anula la capacidad de estos tumores para absorber MIBG, lo que hace que el tratamiento con [131I]iobenguano sea ineficaz en cualquier sitio irradiado62.
Eficacia del tratamiento con 131I-MIBG y PRRT (177Lu)-DOTATATE e 90Y-[177Lu]Lu-DOTA-TATE en PPGLs reportada en estudios con más de 20 pacientes incluidos
| Autor, año | Radionúclido | Número pacientes | Eficacia [RECIST] | Respuesta bioquímica |
|---|---|---|---|---|
| Severi S, 2021 [EC fase II]84 | [90Y]DOTATOC o [177Lu]DOTA-TATE | 46 | RP 8.7%, EE 71.7% | NR |
| Thorpe MP, 2020 [estudio retrospectivo unicéntrico]85 | [131I] MIBG | 125 | RC 1%, RP 33%, EE 53% | 59% |
| Zandee WT, 2019 [estudio retrospectivo unicéntrico]82 | [177Lu]DOTA-TATE | 30 | RP 23%, EE 67% | NR |
| Noto BR, 2018 [ensayo clínico fase I]15 | [131I] MIBG | 21 | RC 0%, RP 19%, EE 61.9% | 40% |
| Rutherford MA, 2014 [estudio retrospectivo unicéntrico]86 | [131I] MIBG | 22 | RC 5%, RP 14%, EE 59% | 20% |
| Van Hulsteijn, 2014 [meta-análisis]87 | [131I] MIBG | 243 | RC 11%, RP 27%, EE 52% | 51% |
| Fitzgerald PA, 2006[ensayo clínico fase II]62 | [131I] MIBG | 30 | RC 13%, RP 50%, EE 1% | NR |
| Forrer F, 2008 [ensayo clínico fase I]19 | [90Y]DOTATOC o [177Lu]DOTA-TATE | 28 | RP 25%, EE 46% | NR |
| Loh KC, 1997 [estudio retrospectivo multicéntrico]64 | [131I] MIBG | 116 | RC 4%, RP 26%, EE 57% | 45% |
EC: ensayo clínico; EE: enfermedad estable; NR: no reportada; RP: respuesta parcial; RC: respuesta completa.
El tratamiento con [131I] iobenguano puede repetirse, normalmente a intervalos de seis meses65. No se ha establecido la dosimetría óptima, existiendo variedad en las dosis utilizadas en estudios previos48,62,64–66,68–70. Generalmente los pacientes presentan buena tolerancia al tratamiento y los principales efectos secundarios son trombocitopenia y leucopenia leve transitoria. Se debe advertir a los pacientes sobre los riesgos potenciales a largo plazo de mielosupresión68,72,73 y un posible aumento de mielodisplasia y leucemia aguda62,73, aunque no está claro si estos riesgos se limitan a quienes reciben terapia con dosis altas. Por otro lado, se objetivó hipotiroidismo en 3 de 28 pacientes que recibieron dosis acumuladas de 111-916 milicurios (mCi) en una serie69, y en 2 de 10 pacientes en un segundo estudio con dosis acumulada promedio de 310 mCi71. Para prevenir la captación de [131I]iobenguano por la glándula tiroides, debe iniciarse el bloqueo tiroideo con yoduro de potasio 24 horas antes de la administración de iobenguano I-131 y continuar durante al menos cinco días. Existe evidencia de que los regímenes de dosis altas pueden resultar en una respuesta completa sostenida en un pequeño número de pacientes, pero con un mayor riesgo de toxicidad grave67,74.
En conclusión, se debe considerar el tratamiento con [131I]iobenguano en pacientes con adecuada captación en las pruebas de imagen con [123I]-MIBG con PPGL progresivo irresecable, con síntomas de una enfermedad que no es susceptible de métodos de control locorregionales, o con una alta carga tumoral y un número reducido de metástasis óseas. Sin embargo, para los pacientes con tumores de progresión rápida o enfermedad extensa con predominio óseo, la quimioterapia es generalmente una opción de tratamiento preferible incluso si la gammagrafía con [123I]-MIBG es positiva75.
Terapia con radionúclidos receptores de péptidos (PRRT)Los PPGLs expresan SSTR a un nivel similar al de otros tumores neuroendocrinos, incluidos los tumores neuroendocrinos gastroenteropancreáticos29,76–78. Por ello, los pacientes cuyos PPGL metastásicos expresen SSTR (según lo determinado por la captación en la gammagrafía con 111In-pentetreotida o, cuando esté disponible, PET con SSA marcados con galio-68 como Ga-68 DOTATATE79–81) pueden beneficiarse de la terapia con SSA radiomarcados como 177Lu-DOTATATE.
Los radionúclidos más comúnmente utilizados son DOTA-Tyr3-octreotato (DOTATATE; oxodotreotida) marcado con lutecio-177 (177Lu-DOTATATE) u otros SSA marcados con itrio-90 (90Y-DOTATOC). Los posibles efectos secundarios a largo plazo de la terapia con SSA radiomarcados pueden incluir deterioro de la función renal, pancitopenia y síndrome mielodisplásico/leucemia aguda72. La eficacia de [177Lu]Lu-DOTA-TATE y [90Y]Y-DOTA-TOC para los PPGLs malignos ha sido descrita en estudios de casos aislados y series pequeñas16–19 (tabla 3). En una serie de 28 pacientes con PPGLs progresivos, quirúrgicamente incurables, recibieron [90Y]Y-DOTA-TOC solo o secuencialmente con [177Lu]Lu-DOTA-TATE19. Se objetivaron dos remisiones parciales, cinco respuestas menores y 13 casos con enfermedad estable (tasa de control de la enfermedad, 71%). En un seguimiento medio de 19 meses, 10 de los 20 pacientes con respuesta objetiva o enfermedad estable todavía no habían progresado, y solo hubo dos casos de toxicidad hematológica leve. En otra serie de 30 pacientes con PPGLs inoperables o malignos (17 con PGL parasimpáticos, 10 con PGL simpáticos y tres con PHEOs) fueron tratados con hasta cuatro ciclos de [177Lu]Lu-DOTA-TATE con una dosis prevista de 7,4 Gb por ciclo82. Se observaron respuestas parciales en siete pacientes (23%) y enfermedad estable en 20 pacientes (67%), mientras que tres pacientes (10%) presentaron enfermedad progresiva. La mediana de supervivencia libre de progresión en los pacientes con PGL parasimpáticos, PGL simpáticos y PHEOs metastásicos fue de 91, 13 y 10 meses, respectivamente. Se produjo hematotoxicidad subaguda de grado 3 o 4 en seis pacientes (20%). Dos pacientes experimentaron un evento adverso subagudo reversible debido a insuficiencia cardíaca después de una posible liberación de catecolaminas82. Por último, en una reciente serie descrita de 15 pacientes con PPGLs metastásicos o irresecables que recibieron terapia PRRT con [177Lu]Lu-DOTA-TATE, con una mediana de duración de seguimiento de 27 meses desde el inicio de PRRT, se observó enfermedad progresiva en tres pacientes (20%), enfermedad estable en ocho pacientes (53%), respuesta parcial en un paciente (7%), respuesta menor en tres pacientes (20%) y enfermedad controlada en 12 pacientes (80%)83. Se observaron perfiles de seguridad alentadores sin nefrotoxicidad ni hematotoxicidad a largo plazo. Por tanto, la terapia con [177Lu]Lu-DOTA-TATE es una modalidad de tratamiento eficaz y segura para pacientes con PPGLs metastásicos/inoperables. Recientemente se han publicado los resultados de un ensayo clínico fase II, en el que de los 56 pacientes incluidos para tratamiento con [177Lu]Lu-DOTA-TATE o [90Y]DOTA-TATE, la tasa de control de la enfermedad tumoral fue del 80% [IC 95%: 68,9% a 91,9%]84.
[177Lu]Lu-DOTA-TATE recibió la aprobación por la Administración de Alimentos y Medicamentos (FDA) de los E.E. U.U. en enero de 2018 para el tratamiento de tumores neuroendocrinos gastroenteropancreáticos avanzados que expresan SSTR. Sin embargo, la aprobación no se extendió a PPGLs y su uso en este contexto sigue siendo en fase de investigación y solo debe considerarse en aquellos tumores que expresen receptores de somatostatina.
ConclusiónLas pruebas de imagen funcional de Medicina Nuclear juegan un papel importante en el diagnóstico, estadificación, planificación del tratamiento y tratamiento de los PPGLs. La selección de la modalidad diagnóstica más adecuada viene determinada por el contexto clínico, genético y las características del tumor (tamaño, localización). El tratamiento con [I131] MIBG o [177Lu]Lu-DOTA-TATE puede ser útil en pacientes con enfermedad metastásica no subsidiaria de tratamiento locorregional, y que muestren captación en las pruebas funcionales con MIBG o con expresión de receptores de somatostatina, respectivamente.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.





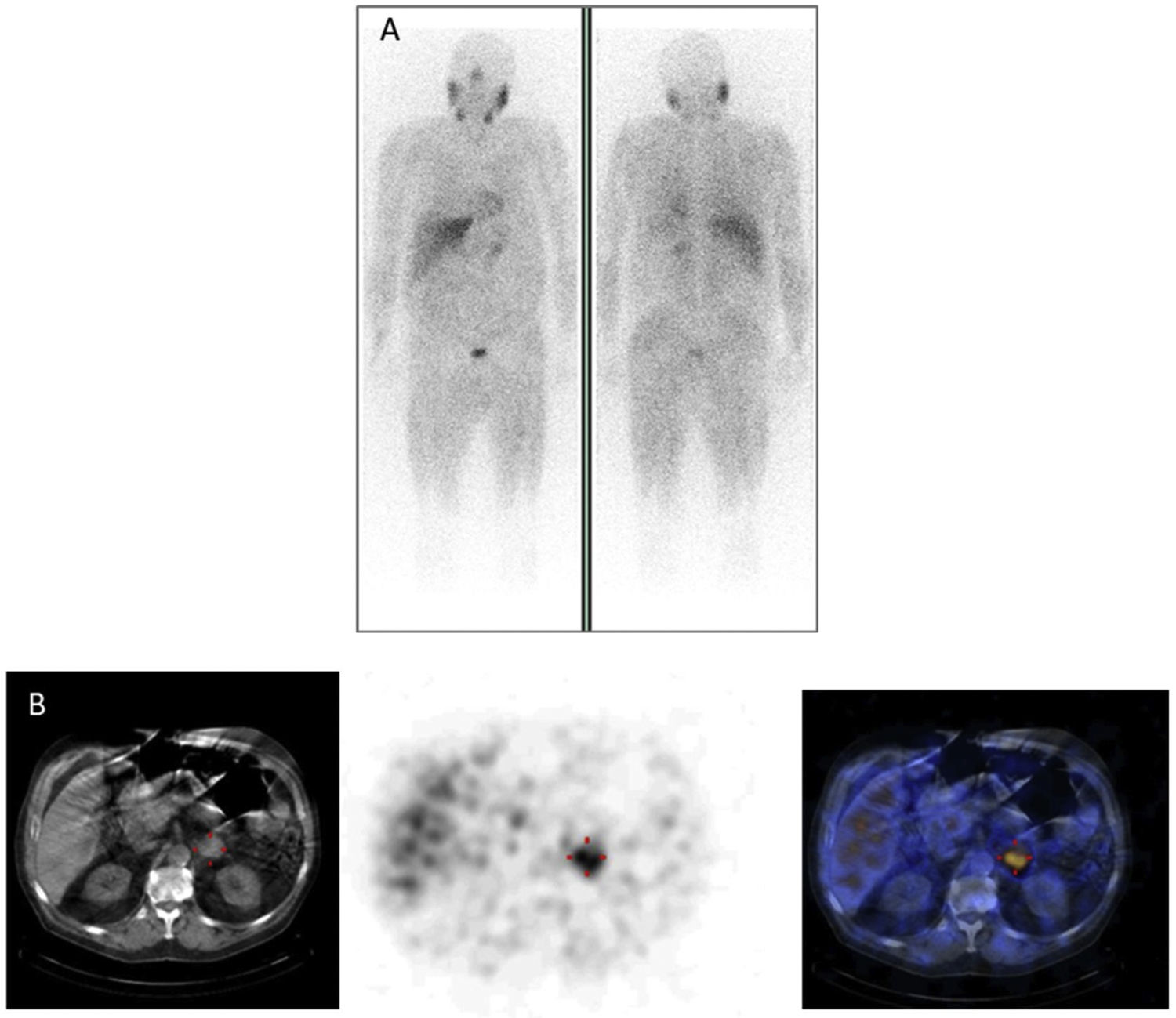

![Feocromocitoma izquierdo en la gammagrafía con [123I]MIBG. Feocromocitoma izquierdo en la gammagrafía con [123I]MIBG.](https://static.elsevier.es/multimedia/25300164/0000006900000008/v1_202209160915/S2530016421002792/v1_202209160915/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Lesión ósea en paciente con PGL metastásico visualizado en el [68Ga]DOTA-TOC PET-TC. Lesión ósea en paciente con PGL metastásico visualizado en el [68Ga]DOTA-TOC PET-TC.](https://static.elsevier.es/multimedia/25300164/0000006900000008/v1_202209160915/S2530016421002792/v1_202209160915/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)


