Los receptores CB2R han sido etiquetados como los receptores endocanabinoides periféricos por excelencia, y regulan diferentes procesos inflamatorios. Las variantes del gen CB2R podrían desempeñar un papel en los cambios metabólicos después de la pérdida de peso con diferentes intervenciones.
ObjetivoEvaluar el efecto de la variante genética (rs3123554) del gen CB2R en los cambios antropométricos y bioquímicos después de la pérdida de peso, secundaria a una dieta hipocalórica alta proteína/baja en hidratos de carbono vs. una dieta hipocalórica estándar durante 9 meses.
DiseñoDoscientos sesenta y ocho sujetos obesos fueron asignados al azar a una de 2 dietas durante 9 meses, dieta HP (dieta hipocalórica alta en proteínas y baja en hidratos de carbono) y dieta S (dieta hipocalórica estándar en proteínas). Se evaluaron parámetros bioquímicos y antropométricos al basal, a los 3 y a los 9 meses.
ResultadosUn total de 94 pacientes (35,1%) tenían el genotipo GG y 174 (64,9%) sujetos tenían los genotipos siguientes; GA (115 pacientes, 42,9%) o AA (59 sujetos de estudio, 18,0%) (segundo grupo). Después de ambas dietas y en ambos genotipos, el índice de masa corporal (IMC), la masa grasa, el peso, la circunferencia de la cintura y la presión arterial sistólica mejoraron sin diferencias entre ambas dietas. Antes y después de ambas dietas hipocalóricas, el peso corporal, el IMC, la masa grasa y la circunferencia de la cintura fueron mayores en los portadores del alelo A. Después de ambas dietas (HP y S), la glucosa, los niveles de insulina, HOMA-IR, los triglicéridos, el colesterol total y el colesterol-LDL disminuyeron en portadores de alelos no A. Estos parámetros se mantuvieron sin cambios en los portadores de alelos A. Los niveles de leptina disminuyeron después de las dietas HP y S en ambos genotipos.
ConclusiónLos no portadores del alelo A mostraron una mejor respuesta del colesterol total, colesterol LDL, triglicéridos, glucosa, HOMA-IR y niveles de insulina que los portadores A con ambas dietas hipocalóricas y con la misma pérdida de peso.
CB2R receptors has been referred to as the peripheral cannabinoid receptor isoform, and regulate inflammatory response in various settings. CB2R gene variants could play a role on metabolic changes after weight loss with different interventions.
ObjectiveTo assess the effect of the genetic variant (rs3123554) of the CB2R gene on anthropometric and biochemical changes after weight loss secondary to a high protein/low carbohydrate diet vs. a standard low-calorie diet during 9 months.
Design268 obese subjects were randomly allocated to one of two diets for 9 months, Diet HP (high protein-low carbohydrate low-calorie diet) and Diet S (standard protein low-calorie diet). Biochemical and anthropometric parameters were measured at baseline and at 3 and 9 months.
ResultsNinety-four patients (35.1%) had genotype GG and 174 (64.9%) subjects had the following genotypes; GA (115 patients, 42.9%) or AA (59 study subjects, 18.0%) (second group). After both diets, body mass index (BMI), fat mass, weight, waist circumference, and systolic blood pressure improved in both genotypes with no difference between diets. Before and after both low-calorie diets, body weight, BMI, fat mass, and waist circumference were higher in A allele carriers than in non-A allele carriers. After both diets (HP and S), levels of glucose, insulin, HOMA-IR, triglycerides, total cholesterol, and LDL cholesterol decreased in non-A allele carriers. These parameters remained unchanged in A allele carriers. Leptin levels decreased after HP and S diets in both genotypes.
ConclusionNon-A allele carriers showed a better response of total cholesterol, LDL cholesterol, triglycerides, glucose, HOMA-IR, and insulin levels than allele A carriers with both low-calorie diets and with the same weight loss.
La incidencia de la obesidad está aumentando dramáticamente en todo el mundo. La evidencia epidemiológica de este cambio en las tasas de obesidad y las enfermedades asociadas como la diabetes mellitus, la hipertensión y la dislipidemia ha llevado, en los últimos años, a un gran aumento de la investigación sobre el tejido adiposo como participante activo en esta situación1. La obesidad cursa con una inflamación sistémica de bajo grado y el tejido adiposo se ha considerado un órgano secretor activo, enviando y respondiendo a señales que modulan la sensibilidad a la insulina, el metabolismo de los lípidos y la inflamación. Este aumento dramático en las cifras de obesidad se debe tanto a factores ambientales como a genéticos2. La ingesta excesiva de calorías y la disminución de la actividad física podrían incluirse como los principales factores ambientales. En el capitulo de los factores genéticos, los polimorfismos de un solo nucleótido (SNP) en genes implicados en diferentes vías se han asociado con la obesidad. Algunas vías afectadas por estos SNP son por ejemplo los receptores de diferentes sistemas metabólicos; receptores de cannabinoides (CBR), receptor de melanocortina subtipo 4 (Mc4R)3.
El sistema de receptores de cannabinoides consta de 2 receptores CB1R y CB2R que pertenecen a la familia de los receptores acoplados a proteínas G y se unen a ligandos exógenos derivados de Cannabis sativa y endocannabinoides endógenos. CB1R se encuentra principalmente en el cerebro: su papel en el comportamiento alimentario está bien establecido y se ha empleado como diana terapéutica en el tratamiento de la obesidad4. Por el contrario, los receptores CB2R se han catalogado como la isoforma del receptor cannabinoide periférico que se expresa principalmente en los tejidos periféricos, como las células del sistema inmunitario, y regulan la respuesta inflamatoria en diversos entornos5. El rs3123554 es un SNP frecuente del gen CB2R. Ketterer et al.6 han demostrado que los portadores del alelo menor (A) de esta variante genética mostraron un menor peso corporal acompañado de una disminución de la pérdida de peso corporal durante una intervención sobre el estilo de vida. En 2 estudios de intervención a corto plazo de 3 meses, también se ha evaluado el papel de este polimorfismo7,8. En la interacción de 2 dietas hipocalóricas (moderada en hidratos de carbono vs. normal en composición de hidratos de carbono) con el rs3123554 del gen CB2R se evaluó en un ensayo clínico aleatorizado. En este estudio, los portadores del alelo A perdieron menos peso corporal durante ambas dietas hipocalóricas. La mejoría de los parámetros bioquímicos fue inferior en los portadores de alelos A que en los no portadores. En otro estudio8, los no portadores del alelo A tuvieron una mejoría en el peso corporal, la masa grasa, la resistencia a la insulina y el perfil lipídico superior que los portadores del alelo A después de la pérdida de peso secundaria a una dieta hipocalórica mediterránea durante 3 meses.
En el presente estudio evaluamos el efecto de la variante genética (rs3123554) del gen CB2R en los cambios antropométricos y bioquímicos después de la pérdida de peso secundaria a una dieta alta en proteínas/baja en hidratos de carbono vs. una dieta hipocalórica severa estándar durante 9 meses.
Pacientes y metodosPacientes y diseño experimentalUna muestra de 268 sujetos obesos de raza caucásica se analizó de forma prospectiva. Se obtuvo el consentimiento informado por escrito de todos los sujetos. El reclutamiento de sujetos fue mediante un método consecutivo de muestreo entre pacientes enviados por médicos de atención primaria. Este estudio se realizó de acuerdo con las directrices establecidas en la Declaración de Helsinki. Todos los participantes firmaron el consentimiento informado aprobado por la comisión de ensayos clinicos de nuestro centro. Los criterios de exclusión incluyeron la realización de una dieta durante los 12 meses previos al estudio, enfermedades cardiovasculares o cerebrovasculares inestables, motivación del paciente insuficiente y el uso de cualquiera de estos medicamentos: metformina, fármacos inhibidores de dipeptidil tipo IV, tiazolidinediona, análogos de GLP-1, inhibidores de sGLT2, insulina, glucocorticoides, bloqueadores de los receptores de angiotensina, inhibidores de la enzima convertidora de angiotensina, medicamentos psicoactivos, estatinas y otros fármacos lipídicos. Los criterios de inclusión fueron los siguientes: índice de masa corporal >30kg/m2 y >25 y <65 años.
ProcedimientoSe recogieron muestras de sangre venosa (10ml) en tubos tratados con EDTA tras un período rápido de 10h. Se determinaron los niveles de glucosa basal en ayunas, colesterol total, proteína C reactiva (PCR), insulina, resistencia a la insulina (HOMA-IR), colesterol LDL, colesterol HDL, triglicéridos plasmáticos y adipocitoquinas (leptina, resistina, adiponectina), al inicio del ensayo y repetido después de 3 y 9 meses de ambas intervenciones dietéticas. Las medidas de peso, altura y presión arterial se determinaron en los mismos tiempos que las determinaciones bioquímicas. Se realizó una impedancia tetrapolar para medir la masa grasa. También se determinó el genotipo del polimorfismo del gen del receptor CB2R.
Intervencion dieteticaUn total de 238 pacientes obesos fueron asignados aleatoriamente a una de las 2 dietas. Dieta HP (n=136) (dieta hipocalórica severa, alta en proteínas y baja en hidratos de carbono) consistió en una dieta de 1.050cal/día, 33% de grasas (39,0g/día), 33% de hidratos de carbono (86,1g/día) y 34% de proteínas (88,6g/día). La distribución de las grasas fue: 63,8% de grasas monoinsaturadas, 23,5% de grasas saturadas y 12,6% de grasas poliinsaturadas. La dieta S (n=132) (dieta hipocalórica severa, proteína estándar) consistió en una dieta de 1.093cal/día, 27% de grasas (32,6g), 53% de hidratos de carbono (144,3g/día) y 20% de proteínas (55,6g/día). La distribución de las grasas fue: 67,4% de grasas monoinsaturadas, 20,9% de grasas saturadas y 11,6% de grasas poliinsaturadas. Las recomendaciones de ejercicio fueron la realización de actividades físicas aeróbicas al menos 3 veces por semana (60min cada una). La adherencia de estas dietas se registró cada 7 días con una llamada telefónica para mejorar ambas dietas. Se utilizaron tablas de alimentos de composición nacional como referencia9.
Mediciones antropométricas y presión arterialEl peso se midió con una precisión de 0,1kg y el índice de masa corporal se calculó como el peso corporal (en kilogramos)/altura2 (en metros). La circunferencia de la cintura se midió en el diámetro más estrecho entre el proceso xifoides y la cresta ilíaca. La impedancia eléctrica del cuerpo se utilizó para determinar la composición corporal10 (Biodynamics Model 310e, Seattle, WA, EE. UU.). La presión arterial se midió 2 veces después de un descanso de 10min con un esfigmomanómetro de mercurio (Omrom, LA, CA, EE. UU.), y posteriormente se promedió.
Determinaciones de laboratorioLa insulina se determinó por radioinmunoanálisis (RIA Diagnostic Corporation, Los Ángeles, CA, EE. UU.) con una sensibilidad de 0,5mUI/l (rango normal: 0,5-30mUI/l)11, los niveles de glucosa en plasma se midieron usando una glucosa oxidasa automatizada. El método analizador de glucosa 2 (Beckman Instruments, Fullerton, CA, EE. UU.) y la evaluación del modelo de homeostasis para la resistencia a la insulina (HOMA-IR) se calcularon utilizando estos valores12. Las concentraciones séricas de colesterol total y triglicéridos se determinaron mediante un ensayo colorimétrico enzimático (Technicon Instruments, Ltd., Nueva York, NY, EE. UU.). El colesterol HDL se determinó enzimáticamente en el sobrenadante después de la precipitación de otras lipoproteínas con sulfato de magnesio de dextrano. Se utilizó sulfato de magnesio de dextrano a una concentración de 20g/l, en un volumen final de 0,025ml con diluciones 1: 1.1. El colesterol LDL se calculó utilizando la fórmula de Friedewald (colesterol LDL: colesterol total-colesterol HDL-triglicéridos/5)13.
La adiponectina se midió mediante un enzimo inmunoanálisis (ELISA) (R&D systems, Inc., Minneapolis, EE. UU.) (DRP300) con un CV% 3,8%14. La leptina se determinó mediante el ensayo de inmunoanálisis ligado a enzimas ELISA (Diagnostic Systems Laboratories, Inc., Texas, EE. UU.) Con un CV% 3,5%15. La resistina se midió por ELISA (Biovendor Laboratory, Inc., Brno, República Checa) con un CV% 3,2%16.
Genotipo del gen CB2RSe utilizaron células sanguineas para extraer ADN. Los cebadores y las sondas de oligonucleótidos se diseñaron con Beacon Designer 5.0 (Premier Biosoft International®, LA, CA, EE. UU.). La reacción en cadena de la polimerasa (PCR) se realizó con 50ng de ADN genómico, 0,5μl de cada cebador oligonucleotídico (cebador hacia adelante: 5’- ACGTTGGATGATTGTACCGAGGAGGGAACT-3’y reversa 5’- ACGTTGGATGGAGACACGTATTCTAGTCCC-3’ en un volumen final de 2μl (Thermocycler Life Tecnologies, LA, CA, EE. UU.). El ADN se desnaturalizó a 95°C durante 3min; esto fue seguido por 45 ciclos de desnaturalización a 95°C durante 15s, y recalentado a 59,3°C durante 45s). Las PCR se ejecutaron en un volumen final de 25μl que contenía 12,5μl de IQTM Supermix (Bio-Rad®, Hercules, CA, EE. UU.) con Taq ADN polimerasa. EL equilibrio de Hardy Weimberg se evaluó con una prueba estadística (Chi-cuadrado). La variante estaba en equilibrio Hardy Weimberg (p=0,33).
Análisis estadísticoEl tamaño de la muestra se calculó para detectar diferencias de más de 4kg en la pérdida de peso corporal con una potencia del 90% y una significación del 5% (n=130, en cada grupo de dieta). La distribución de variables se analizó con la prueba de Kolmogorov-Smirnov. Las variables cuantitativas con distribución normal se analizaron con una prueba de la t de Student de 2 colas. Se usó una prueba de Chi-cuadrado para evaluar el equilibrio de Hardy-Weinberg. Los parámetros no paramétricos se analizaron con la prueba de Wilcoxon. Se ha utilizado un modelo mixto dentro y entre sujetos para probar la interacción entre los grupos de polimorfismo y las variables, debido al diseño del estudio con medidas repetidas. Los parámetros cualitativos se analizaron con la prueba de Chi-cuadrado, con la corrección de Yates cuando fue necesario, y la prueba de Fisher. Un valor de p<0,05 se consideró significativo.
ResultadosUn total de 94 pacientes (35,1%) tenían el genotipo GG y 174 (64,9%) sujetos tenían los siguientes genotipos; GA (115 pacientes, 42,9%) o AA (59 sujetos de estudio, 18,0%) (segundo grupo). La edad promedio del grupo total (n=268) fue de 53,9±9,1 años. La distribución por género en todos los grupos fue del 26,1% varones y 73,9% mujeres. El IMC medio fue de 35,1±4,5kg/m2. No hubo diferencias estadísticas en estos parámetros entre ambos grupos de genotipos (tabla 1). La edad fue similar en ambos grupos de genotipos (tipo salvaje GG vs. tipo mutante [GA+AA]) (54,8±7,1 vs. 52,3±6,1 años; ns). La distribución por sexos fue similar en ambos genotipos, varones (27,9 vs. 24,2%; ns) y mujeres (72,1 vs. 75,8%; ns), el IMC medio fue mayor en los portadores de alelos A (35,3±4,8 vs. 34,6±4,1kg/m2; p=0,02). Todos los pacientes completaron el período de seguimiento de 9 meses sin abandonos.
La determinación basal de la ingesta alimentaria se realizó con un registro de alimentos escrito de 3 días. En los 136 sujetos (genotipo 45 GG y 91 portadores de alelos A) asignados al azar a la dieta HP mostraron los siguientes datos: ingesta de calorías basales de 2.078,8±431,1kcal/día, una ingesta de grasas de 91,2±21,3g/día (41,0% de las calorías), una ingesta de hidratos de carbono de 212,32±36,3g/día (40,9% de las calorías) y una ingesta de proteínas de 80,1±53,5g/día (27,1% de las calorías). Durante la intervención (9 meses), estos pacientes alcanzaron las recomendaciones de la dieta: 1.010,5±90,2 calorías (34,1% de hidratos de carbono, 32,7% de lípidos y 36,2% de proteínas). La actividad física fue similar en ambos grupos de genotipos (70,1±30,2 vs. 69,8±39,3min/semana; p=0,43).
La evaluación basal de la ingesta alimentaria con un registro de alimentos escrito de 3 días en los 132 sujetos (49 genotipos GG y 93 portadores de alelos A) asignados al azar a la dieta S, mostró los siguientes registros: ingesta de calorías basales de 2.016,1±392,9kcal/día, una ingesta de grasas de 91,2±18,3g/día (38,3% de calorías), una ingesta de hidratos de carbono de 210,3±28,1g/día (42,8% de las calorías) y un ingesta de proteínas de 90,1±10,3g/día (19,9% ??de las calorías). Durante el ensayo, estos pacientes alcanzaron las recomendaciones de la dieta; 1.001,4±92,1 calorías (51,6% de hidratos de carbono, 29,5% de lípidos y 18,9% de proteínas). Finalmente, la actividad física fue similar en ambos genotipos (69,1±40,1 vs. 68,5±30,3min/semana; p=0,43).
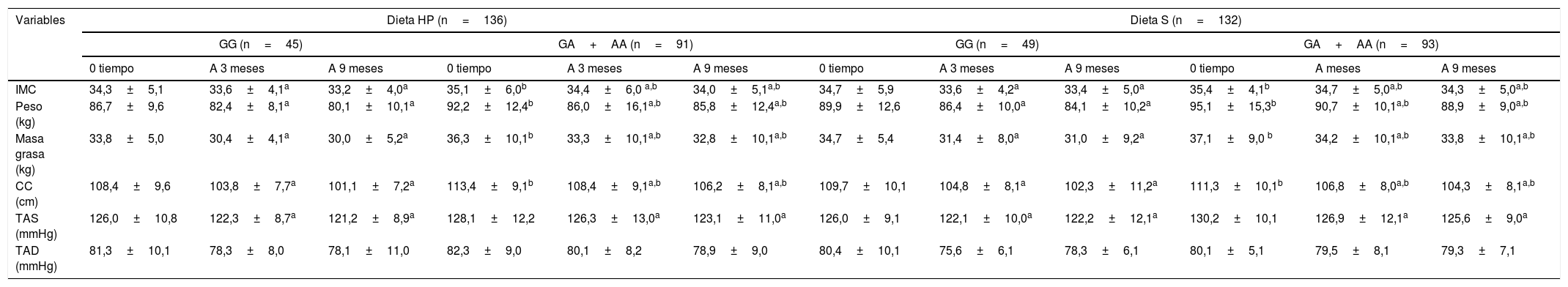
Los parámetros antropométricos y los niveles de presión arterial de los participantes con obesidad al inicio del estudio, a los 3 meses y a los 9 meses de intervención se muestran en la tabla 1. En ambos genotipos y con ambas intervenciones dietéticas, las siguientes variables: peso corporal, IMC, masa grasa, circunferencia de la cintura y presión arterial sistólica disminuyeron. Antes y después de ambas dietas hipocalóricas, el peso corporal, el IMC, la masa grasa y la circunferencia de la cintura fueron más altos en los portadores del alelo A que en los no portadores del alelo. La tabla 2 muestra que después de una intervención dietética con un alto contenido proteico/bajo en hidratos de carbono (dieta HP), los sujetos con ambos genotipos (GG vs. GA+AA) mostraron una disminución similar en el peso corporal (−6,5±2,2 vs. −6,4±2,1kg; p=0,12), IMC (−1,1±0,2 vs. −1,1±0,5kg/m2; p=0,23), masa grasa (−3,8±0,9 vs. −3,5±0,8kg; p=0,33), la circunferencia de la cintura (−7,3±1,2 vs. −7,2±1,9cm; p=0,41) y la presión arterial sistólica fue similar (−5,2±3,0 vs. −5,1±2,4mmHg; p=0,45). Después de una intervención dietética con una dieta hipocalórica estándar (dieta S), los sujetos con ambos genotipos (GG vs. GA+AA) mostraron una disminución similar en el peso corporal (−5,8±2,1 vs. −6,2±2,3kg; p=0,22), IMC (−1,3±0,4 vs. −1,1±0,2kg/m2; p=0,34), masa grasa (−3,7±0,8 vs. −3,5±0,9kg; p=0,46), circunferencia de la cintura (−7,6±1,4 vs. −7,0±2,1cm; p=0,53) y la presión arterial sistólica (−4,0±3,1 vs. −4,6±2,4mmHg; p=0,47).
Cambio en los parametros antropometricos (media+DE)
| Variables | Dieta HP (n=136) | Dieta S (n=132) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| GG (n=45) | GA+AA (n=91) | GG (n=49) | GA+AA (n=93) | |||||||||
| 0 tiempo | A 3 meses | A 9 meses | 0 tiempo | A 3 meses | A 9 meses | 0 tiempo | A 3 meses | A 9 meses | 0 tiempo | A meses | A 9 meses | |
| IMC | 34,3±5,1 | 33,6±4,1a | 33,2±4,0a | 35,1±6,0b | 34,4±6,0 a,b | 34,0±5,1a,b | 34,7±5,9 | 33,6±4,2a | 33,4±5,0a | 35,4±4,1b | 34,7±5,0a,b | 34,3±5,0a,b |
| Peso (kg) | 86,7±9,6 | 82,4±8,1a | 80,1±10,1a | 92,2±12,4b | 86,0±16,1a,b | 85,8±12,4a,b | 89,9±12,6 | 86,4±10,0a | 84,1±10,2a | 95,1±15,3b | 90,7±10,1a,b | 88,9±9,0a,b |
| Masa grasa (kg) | 33,8±5,0 | 30,4±4,1a | 30,0±5,2a | 36,3±10,1b | 33,3±10,1a,b | 32,8±10,1a,b | 34,7±5,4 | 31,4±8,0a | 31,0±9,2a | 37,1±9,0 b | 34,2±10,1a,b | 33,8±10,1a,b |
| CC (cm) | 108,4±9,6 | 103,8±7,7a | 101,1±7,2a | 113,4±9,1b | 108,4±9,1a,b | 106,2±8,1a,b | 109,7±10,1 | 104,8±8,1a | 102,3±11,2a | 111,3±10,1b | 106,8±8,0a,b | 104,3±8,1a,b |
| TAS (mmHg) | 126,0±10,8 | 122,3±8,7a | 121,2±8,9a | 128,1±12,2 | 126,3±13,0a | 123,1±11,0a | 126,0±9,1 | 122,1±10,0a | 122,2±12,1a | 130,2±10,1 | 126,9±12,1a | 125,6±9,0a |
| TAD (mmHg) | 81,3±10,1 | 78,3±8,0 | 78,1±11,0 | 82,3±9,0 | 80,1±8,2 | 78,9±9,0 | 80,4±10,1 | 75,6±6,1 | 78,3±6,1 | 80,1±5,1 | 79,5±8,1 | 79,3±7,1 |
CC: circunferencia cintura; DE: desviación estándar; Dieta HP: dieta hipocalórica alta en proteínas y baja en carbohidratos; Dieta S: dieta hipocalórica estándar en proteínas; IMC: índice de masa corporal; TAD tensión arterial diastólica; TAS: tensión arterial sistólica.
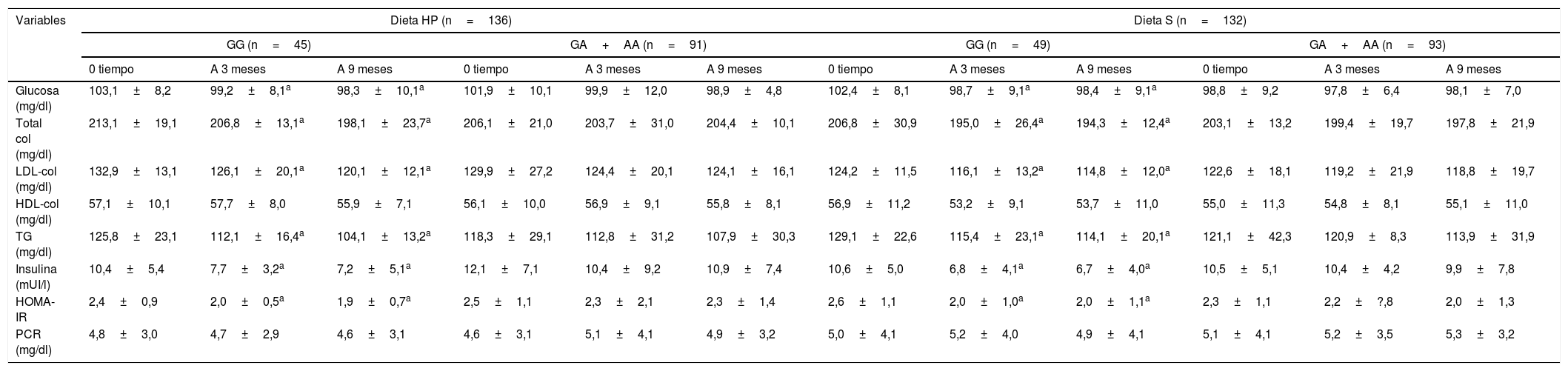
No se detectaron diferencias entre los valores basales y posteriores al tratamiento de los parámetros metabólicos entre ambos genotipos (tabla 3). Después de la intervención dietética con ambas dietas, los no portadores del alelo A mostraron una disminución significativa de los valores de colesterol total, colesterol LDL, triglicéridos, insulina y HOMA-IR. En los no portadores del alelo A después de ambas dietas, la disminución en los niveles de colesterol total fue mayor −14,1±2,9mg/dl (portadores de alelo A −1,2±1,1mg/dl; p=0,02 después de la dieta HP) y −12,5±3,3mg/dl (portadores de alelo A −4,3+1,1mg/dl; p=0,01 después de la dieta S) que portadores de alelos A. Los cambios en el colesterol HDL no mostraron diferencias estadísticas. Además, la disminución en los niveles de colesterol LDL fue mayor en los no portadores del alelo A −12,1±2,3mg/dl (portadores de alelo A −5,0±1,8mg/dl; p=0,01 después de la dieta HP) y −10,4±1,4mg/dl (portadores de alelo A −3,8±1,9mg/dl; p=0,02 después de la dieta S) que los portadores de alelos A. La disminución en los niveles de triglicéridos fue mayor en los no portadores de alelo A −21,1±4,1mg/dl (portadores de alelo A −5,0±1,9mg/dl; p=0,01 después de la dieta HP) y −10,4±3,2mg/dl (alelo A portadores −3,8±1,9mg/dl; p=0,02 después de la dieta S) que los portadores de alelos A. De manera similar, la disminución de los niveles de insulina en los no portadores del alelo A después de ambas dietas fue mayor −5,2±1,2 mUI/l (en el alelo A −1,2±0,8 mUI/l; p=0,01 después de la dieta HP) y −3,9±1,1mUI/l (portadores de alelo A −0,6±0,7mUI/l; p=0,02 después de la dieta S) que en los portadores de alelo A. Finalmente, la disminución de los niveles de HOMA-IR fue mayor en los no portadores de alelo A −0,5±0,1 unidades (grupo de alelo A −0,2±0,1; p=0,03 después de la dieta HP) y −0,6±0,2 unidades (portadores de alelo A −0,1±0,5mg/dl; p=0,03 después de la dieta S) que los portadores de alelo A.
Modificacion en parametros bioquimicos (media+DE)
| Variables | Dieta HP (n=136) | Dieta S (n=132) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| GG (n=45) | GA+AA (n=91) | GG (n=49) | GA+AA (n=93) | |||||||||
| 0 tiempo | A 3 meses | A 9 meses | 0 tiempo | A 3 meses | A 9 meses | 0 tiempo | A 3 meses | A 9 meses | 0 tiempo | A 3 meses | A 9 meses | |
| Glucosa (mg/dl) | 103,1±8,2 | 99,2±8,1a | 98,3±10,1a | 101,9±10,1 | 99,9±12,0 | 98,9±4,8 | 102,4±8,1 | 98,7±9,1a | 98,4±9,1a | 98,8±9,2 | 97,8±6,4 | 98,1±7,0 |
| Total col (mg/dl) | 213,1±19,1 | 206,8±13,1a | 198,1±23,7a | 206,1±21,0 | 203,7±31,0 | 204,4±10,1 | 206,8±30,9 | 195,0±26,4a | 194,3±12,4a | 203,1±13,2 | 199,4±19,7 | 197,8±21,9 |
| LDL-col (mg/dl) | 132,9±13,1 | 126,1±20,1a | 120,1±12,1a | 129,9±27,2 | 124,4±20,1 | 124,1±16,1 | 124,2±11,5 | 116,1±13,2a | 114,8±12,0a | 122,6±18,1 | 119,2±21,9 | 118,8±19,7 |
| HDL-col (mg/dl) | 57,1±10,1 | 57,7±8,0 | 55,9±7,1 | 56,1±10,0 | 56,9±9,1 | 55,8±8,1 | 56,9±11,2 | 53,2±9,1 | 53,7±11,0 | 55,0±11,3 | 54,8±8,1 | 55,1±11,0 |
| TG (mg/dl) | 125,8±23,1 | 112,1±16,4a | 104,1±13,2a | 118,3±29,1 | 112,8±31,2 | 107,9±30,3 | 129,1±22,6 | 115,4±23,1a | 114,1±20,1a | 121,1±42,3 | 120,9±8,3 | 113,9±31,9 |
| Insulina (mUI/l) | 10,4±5,4 | 7,7±3,2a | 7,2±5,1a | 12,1±7,1 | 10,4±9,2 | 10,9±7,4 | 10,6±5,0 | 6,8±4,1a | 6,7±4,0a | 10,5±5,1 | 10,4±4,2 | 9,9±7,8 |
| HOMA-IR | 2,4±0,9 | 2,0±0,5a | 1,9±0,7a | 2,5±1,1 | 2,3±2,1 | 2,3±1,4 | 2,6±1,1 | 2,0±1,0a | 2,0±1,1a | 2,3±1,1 | 2,2±?,8 | 2,0±1,3 |
| PCR (mg/dl) | 4,8±3,0 | 4,7±2,9 | 4,6±3,1 | 4,6±3,1 | 5,1±4,1 | 4,9±3,2 | 5,0±4,1 | 5,2±4,0 | 4,9±4,1 | 5,1±4,1 | 5,2±3,5 | 5,3±3,2 |
Col: colesterol; Dieta HP: dieta hipocalórica alta en proteínas y baja en carbohidratos; Dieta S: dieta hipocalórica estándar en proteínas; HDL: high density lipoprotein; HOMA-IR: homeostasis model assessment; HP: high protein/low carbohydrate; LDL: low density lipoprotein; PCR: proteína C reactiva; S: standard; TG: triglicéridos.
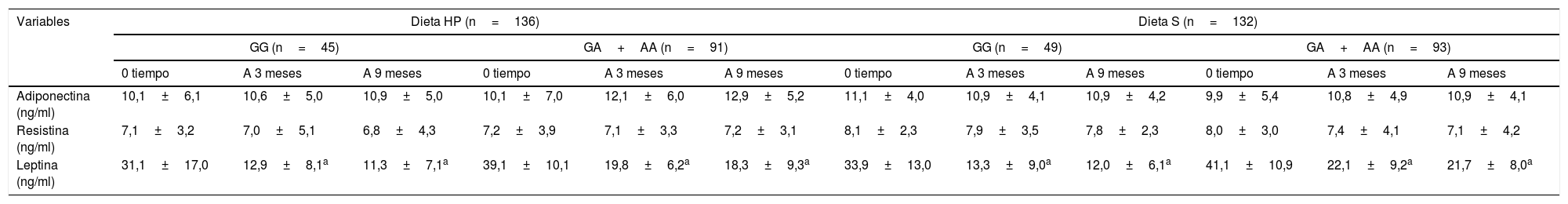
La tabla 4 muestra los niveles de adipocitoquinas. Las adipocitoquinas y los marcadores inflamatorios no mostraron diferencias estadísticamente significativas entre ambos genotipos. Los niveles de leptina disminuyen en ambos genotipos después de las dietas HP y S (tabla 4).
Acipocitoruinas circulantes (media+DE)
| Variables | Dieta HP (n=136) | Dieta S (n=132) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| GG (n=45) | GA+AA (n=91) | GG (n=49) | GA+AA (n=93) | |||||||||
| 0 tiempo | A 3 meses | A 9 meses | 0 tiempo | A 3 meses | A 9 meses | 0 tiempo | A 3 meses | A 9 meses | 0 tiempo | A 3 meses | A 9 meses | |
| Adiponectina (ng/ml) | 10,1±6,1 | 10,6±5,0 | 10,9±5,0 | 10,1±7,0 | 12,1±6,0 | 12,9±5,2 | 11,1±4,0 | 10,9±4,1 | 10,9±4,2 | 9,9±5,4 | 10,8±4,9 | 10,9±4,1 |
| Resistina (ng/ml) | 7,1±3,2 | 7,0±5,1 | 6,8±4,3 | 7,2±3,9 | 7,1±3,3 | 7,2±3,1 | 8,1±2,3 | 7,9±3,5 | 7,8±2,3 | 8,0±3,0 | 7,4±4,1 | 7,1±4,2 |
| Leptina (ng/ml) | 31,1±17,0 | 12,9±8,1a | 11,3±7,1a | 39,1±10,1 | 19,8±6,2a | 18,3±9,3a | 33,9±13,0 | 13,3±9,0a | 12,0±6,1a | 41,1±10,9 | 22,1±9,2a | 21,7±8,0a |
DE: desviación estándar; Dieta HP: dieta hipocalórica alta en proteínas y baja en carbohidratos; Dieta S: dieta hipocalórica estándar en proteínas.
En nuestro estudio, encontramos una asociación del alelo A de SNP rs3123554 del gen CB2R con un IMC más alto y otros parámetros de adiposidad. Además, los no portadores del alelo A mostraron una mejor respuesta de los niveles de colesterol LDL, colesterol total, triglicéridos, glucosa, HOMA-IR e insulina que los portadores del alelo A con ambas dietas hipocalóricas después de una pérdida de peso similar.
El sistema endocannabinoide es conocido por su relación con diferentes vías inflamatorias y la obesidad17, por otra parte el papel de la inflamación en la patogénesis de las alteraciones metabólicas en sujetos obesos está bien establecido18,19. Aunque CB2R se ha definido como la isoforma periférica del receptor cannabinoide, en la actualidad existe evidencia de la expresión de CB2R en diferentes áreas del sistema nervioso central20. Quizás, la presencia en el tejido cerebral de CB2R puede explicar los datos de nuestro diseño que relacionan este polimorfismo con parámetros de adiposidad en los portadores del alelo A. Podríamos especular con 2 hipótesis: en primer lugar, CB2R se ha demostrado que interviene en la regulación de los niveles de endocannabinoides que podrían modular los comportamientos de recompensa y ansia a través de circuitos neuronales relevantes21 y, en segundo lugar, la activación de CB2R en humanos influye en el comportamiento alimentario22. Estas 2 hipótesis podrían explicar las diferencias encontradas a través de un efecto sobre la ingesta de energía a través de los alimentos.
El porcentaje observado de sujetos portadores del alelo menores de más del 50% es similar al que se encontró en estudios previos6-8. Sorprendentemente, encontramos que el alelo menor de rs3123554 se asoció con un peso corporal significativamente mayor que condujo a una menor mejoría en los parámetros metabólicos durante ambas intervenciones dietéticas. La asociación del alelo menor del SNP rs3123554 con el peso corporal se ha descrito ya previamente23. Para explicar este hecho, podemos postular una hipótesis periférica y otra central. La hipótesis periférica se basa en que CB2R se ha aislado en algunos tejidos diana relacionados con el control del metabolismo, como el tejido adiposo, el hígado y el músculo esquelético24. Estos 3 tejidos son los que tradicionalmente se han relacionado con la resistencia a la insulina existente en pacientes obesos. Es de destacar que la estimulación de CB2R por agonistas activa la vía de señalización de la serina/treonina proteína quinasa Akt, que está implicada en la proliferación y el metabolismo. Además de esta hipótesis periférica, también pueden esperarse efectos nocivos de CB2R sobre la secreción de insulina a la luz de la inhibición de la secreción de insulina desencadenada por los receptores CB2R expresados ??en las células beta pancreáticas25. Finalmente, se ha demostrado el efecto fisiológico de CB2R en dos tejidos diferentes (tejido gonadal y tejido óseo). Los SNP de los genes CB2R (rs3003336, rs2501431, rs2502992, rs2501432) influyen en la etiología de la osteoporosis y sugieren que CB2R puede desempeñar un papel importante en la densidad mineral ósea26 y el polimorfismo CB2R rs35761398 está relacionado con la edad más temprana de la menarquia en sujetos portadores de la Q63 alelo27.
Para explicar la segunda hipótesis (hipótesis central); algunos autores6 han encontrado que los sujetos portadores del alelo A mostraron una menor sensibilidad a la insulina cerebral y es necesario tener en cuenta que la sensibilidad a la insulina cerebral facilita la pérdida de peso corporal durante la restricción calórica19. Teniendo en cuenta que la sensibilidad a la insulina cerebral determina la efectividad de la intervención dietética en términos de pérdida de peso28, podríamos postular que la sensibilidad disminuida a la insulina cerebral en los portadores del alelo A puede estar relacionada por su incapacidad para mejorar los parámetros metabólicos relacionados con el metabolismo de la glucosa y los lípidos como en los no portadores del alelo A. Por ejemplo, los portadores del alelo A mostraron una menor actividad theta después de la administración de insulina nasal29, lo que representa una disminución de la sensibilidad a la insulina cerebral. Esta sensibilidad a la insulina cerebral determina por tanto la eficacia de la pérdida de peso en los cambios metabólicos28.
Los cambios metabólicos después de la pérdida de peso en los no portadores del alelo A encontrados en nuestro estudio son similares a los reportados en diseños anteriores de menor duración (3 meses). En un estudio previo8, los portadores del alelo A perdieron menos peso corporal durante 2 diferentes dietas hipocalóricas (moderadas en hidratos de carbono vs. normales en la composición de hidratos de carbono). La mejoría de los parámetros bioquímicos fue peor en los portadores de alelos A que en los no portadores del alelo A. En otro estudio9, los no portadores del alelo A tuvieron una mejoría superior en el peso corporal, la masa grasa, la resistencia a la insulina y el perfil lipídico que los portadores de alelos A después de la pérdida de peso secundaria a una dieta hipocalórica mediterránea durante 3 meses. Los resultados de los parámetros bioquímicos de estos 2 estudios8,9 son similares a los encontrados en nuestro trabajo actual. La única diferencia entre los estudios anteriores y el actual es la pérdida de peso similar con la dieta HP y S en nuestro estudio en los 2 genotipos. Quizás la intervención más prolongada (9 meses) en comparación con las realizadas en los estudios previos8,9 de 3 meses puede explicar esta pérdida de peso similar en ambos genotipos. Quizás también, estas diferentes respuestas de pérdida de peso podrían estar relacionadas con los criterios de inclusión y la heterogeneidad de los sujetos en estos estudios de intervención, el origen étnico variable, la distribución de nutrientes de las dietas hipocalóricas, el curso temporal de la intervención dietética y la interacción con otros polimorfismos en el gen CBR. Los autores no tienen una explicación mecanicista clara para explicar esta respuesta diferente entre el portador y no portador del alelo A.
Las limitaciones de nuestro estudio incluyen que nuestros datos no son generalizables más allá de una población obesa sin eventos cardiovasculares establecidos. En segundo lugar, hay muchos factores no controlados que podrían influir en nuestros resultados (epigenética, estado hormonal, otros factores ambientales desconocidos,...). Tercero, solo analizamos un SNP de esta vía CB2R, por lo que otras variantes genéticas en este receptor u otro como CB1R podrían estar implicadas en estos resultados. Finalmente, la ingesta dietética autoinformada no es fiable y los pacientes podrían subestimar o sobreestimar la ingesta dietética. Sin embargo, nuestro estudio también tiene puntos fuertes. Por ejemplo, el diseño de un ensayo clínico aleatorizado. Y, en segundo lugar, la duración de la intervención durante 9 meses, siendo superior a las realizadas previamente en la literatura.
En conclusión, los no portadores del alelo A mostraron una mejor respuesta de los niveles de colesterol total, colesterol LDL, triglicéridos, glucosa, HOMA-IR e insulina que los portadores A con ambas dietas hipocalóricas severas después de 9 meses. Este es un hallazgo importante para aplicar la medicina personalizada porque las interacciones genético-ambientales son cada vez más interesantes en esta área de trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.