La monitorización continua de glucosa (MCG) ha demostrado su utilidad en pacientes con diabetes mellitus tipo1 (DM1). Sin embargo, la hemoglobina glucosilada sigue siendo el gold standard para evaluar el manejo de la enfermedad.
Material y métodosEstudio descriptivo y retrospectivo que incluyó a 252 pacientes, el 40,5% varones, con una media de edad de 44,91±14,57años y tiempo de evolución de la enfermedad 22,21±13,12años. El 88,1% se encontraban en régimen de insulina bolo-basal, y el 11,9% eran usuarios de infusión subcutánea continua de insulina (ISCI). Se obtuvieron datos glucométricos, analíticos y antropométricos para su relación.
ResultadosEl tiempo en rango (TIR) medio fue del 60,18±15,60% y se relacionó con la A1c tras ajustar por la edad, el sexo, la duración de la enfermedad, el IMC, el tratamiento insulínico, el %CV y el tiempo por debajo de rango (TBR) (β: −0,548; p<0,01). El índice de gestión de glucosa (GMI) fue de 7,19±0,69% e igualmente se asoció a la A1c (β: 0,957; p<0,01), independientemente de la edad, el sexo, la duración de la enfermedad, el IMC, el tratamiento insulínico, el %CV y el TIR. La diferencia media entre la A1c y el GMI es de 0,17±0,65% (−2,70-3,40%), siendo mayor a medida que aumentaba la A1c de manera lineal y significativa sin verse influenciada por el tiempo de evolución de la enfermedad o del CV.
ConclusionesAunque observamos una buena correlación entre los parámetros glucométricos derivados de la MCG y la A1c, no existe evidencia suficiente para poder sustituir un parámetro por otro.
Despite continuous glucose monitoring having been proven useful in patients with type1 diabetes mellitus, A1c remains the gold standard for assessing disease management.
Material and methodsDescriptive, retrospective study which included 252 patients, 40.5% male, mean age 44.91±14.57 years, mean duration of diabetes 22.21±13.12 years, 88.1% on basal-bolus insulin therapy and 11.9% users of continuous subcutaneous insulin infusion. Glucose measurement, analytical and anthropometric data were obtained.
ResultsThe mean time in range was 60.18±15.60% and was associated with A1c after adjusting for age, gender, duration of diabetes, BMI, insulin regimen, %CV and time below range (β: −0.548; P<.01). The glucose management indicator (GMI) was 7.19±0.69% and was also associated with A1c (β: 0.957; P<.01) regardless of age, gender, duration of diabetes, BMI, insulin treatment, %CV and time in range. The average difference between A1c and GMI was 0.17±0.65% (−2.70-3.40%), being higher as A1c increased, in a linear and significant manner, without being influenced by the duration of diabetes or CV.
ConclusionsAlthough we found a positive correlation between continuous glucose monitoring glucose measurement parameters and A1c, there is still not enough evidence to replace one parameter with another.
La hemoglobina glucosilada (A1c) es considerada la prueba de referencia para evaluar el control glucémico1. Además, es un importante marcador de riesgo para el desarrollo de complicaciones vasculares2,3 y predictor de mortalidad4. Por todo ello, las principales guías de manejo de la diabetes continúan usando la A1c como el indicador a seguir a la hora de ajustar el tratamiento hipoglucemiante5. Sin embargo, sabemos que la A1c presenta una serie de limitaciones. Las determinaciones de la A1c pueden verse afectadas por la anemia, por el embarazo, por hemoglobinopatías o por factores raciales6. Además, la A1c no refleja fluctuaciones, como episodios de hipoglucemia o excursiones de hiperglucemia que pueden condicionar el óptimo control glucémico de nuestros pacientes7.
La monitorización flash de glucosa mediante el sistema FreeStyle Libre ([FSL] Abbott DiabetesCare, Witney, Reino Unido) permite la lectura de niveles de glucosa intersticial, sin necesidad de calibración, durante un período de 14días. El uso de este sistema ha demostrado ser de utilidad en pacientes con diabetes mellitus tipo1 (DM1) y diabetes mellitus tipo2 (DM2), reduciendo el tiempo en hipoglucemia8, los ingresos hospitalarios por hipoglucemia9 y los niveles de la A1c10,11, principalmente en pacientes con mal control12, así como una mejora en la calidad de vida13.
En el año 2019, el Grupo de Consenso Internacional sobre el Tiempo en Rango14 definió cuáles deben ser los parámetros glucométricos que todo sistema de monitorización continua debe aportar. El informe Average Glucose Profile (AGP) debe recoger datos como: glucosa promedio, variabilidad medida por el % coeficiente de variación (%CV), tiempo en rango (TIR: 70-180mg/dl), tiempo por debajo de rango (TBR: <70mg/dl), tiempo por encima de rango (TAR: >180mg/dl) e índice de gestión de glucosa (Glucose Management Index [GMI]). El GMI ha superado al antiguo término de la A1c estimada, ya que este último podría confundir en el manejo del paciente diabético15. El GMI se calcula en función de los niveles de glucosa obtenidos en los últimos 14días de monitorización continua de glucosa. Estudios recientes han demostrado, por otro lado, que los datos glucométricos durante un período de 14días son una buena estimación de períodos de tiempo más largos, de hasta 3meses16.
Aunque son pocos los estudios que han determinado la relación de estos índices con la A1c, un mejor entendimiento de la asociación entre el GMI y la A1c permitiría un manejo del control de glucemia más práctico.
Material y métodosSe diseñó un estudio descriptivo y retrospectivo que incluyó a los pacientes en seguimiento en las consultas externas de Endocrinología y Nutrición del Hospital Central de Asturias entre diciembre de 2018 y enero 2021, con el diagnóstico de DM1, en tratamiento con insulina y que utilizaban como medidor de glucosa el sistema FreeStyle Libre y compartían su información a través de la plataforma Libreview. Los datos de la plataforma se obtuvieron de los informes AGP cuyo porcentaje de información para 14días fuera igual o superior al 70%.
Se excluyó a los pacientes con diabetes secundaria u otro tipo de diabetes, menores de 14años, mayores de 85años, con complicaciones metabólicas agudas (cetoacidosis o hipoglucemia graves que precisaron asistencia médica), procesos intercurrentes que produjeran hiperglucemia, con anemia u otras hemoglobinopatías que pudieran modificar los niveles de la A1c.
Extrajimos de la historia clínica electrónica los datos antropométricos (peso y talla para cálculo de índice de masa corporal [IMC]), así como la última analítica de la A1c (medida mediante cromatografía liquida de alta resolución [HPLC], Analizador Jokoh HS-10), estandarizada según criterios IFCC (JDS/JSCC A1c=0,927 [IFCC A1c]+1,73).
Del mismo modo, obtuvimos los datos de monitorización flash de glucosa desde la plataforma Libreview. La plataforma Libreview es una aplicación informática on line donde se descargan los datos obtenidos de la monitorización continua de glucosa y donde tanto el usuario como el personal sanitario, tras el consentimiento para compartir los datos por parte del usuario, pueden consultar los valores de glucosa intersticial. Existe un formato estandarizado llamado AGP. Este informe, según las recomendaciones del último consenso14, debe incluir las siguientes variables: glucemia promedio, %CV, TIR, TBR, TAR, GMI. Para que los datos puedan ser representativos, según dicho consenso, se exige un porcentaje de información válido superior al 70% en un periodo de 14días.
La fecha de descarga debía coincidir con la de la analítica de la A1c y los datos antropométricos de la fecha de consulta más cercana a la fecha de descarga.
Clasificamos a los pacientes en dos grupos en función de la diferencia entre la A1c y el GMI (menor o igual de 0,2% o mayor de 0,5%) de manera arbitraria. Así mismo, subdividimos la muestra en función del control glucémico dividiéndola en tres grupos (A1c menor de 7%, entre 7-8% o mayor de 8%) y en función del tiempo de evolución de la enfermedad en terciles (menos de 15años de evolución, entre 15 y 30años y más de 30años) y según su CV en función del punto de corte recomendado por último consenso14 (menor del 36% o mayor del 36%).
Para el estudio estadístico utilizamos el software SPSS versión 20 para Windows (SPSS, Inc., Chicago, IL, Estados Unidos). Se utilizó la prueba t de Student o ANOVA para variables cuantitativas, además de Bonferroni como análisis post hoc tras realizar test de normalidad de la muestra. Para variables cualitativas utilizamos la prueba χ2 y las correlaciones se realizaron con el test de Pearson. Además, se realizaron estudios de regresión lineal teniendo como variables confusoras la edad, el sexo, la duración de la enfermedad, el IMC, el tratamiento insulínico, el %CV, el TBR o el TIR. El nivel de significación se fijó en p<0,05 a 2 colas y los datos se expresaron como media ±desviación estándar y entre paréntesis el rango, a no ser que se indique de otra manera.
ResultadosSe seleccionaron 252 pacientes con DM1, el 40,5% varones, con una edad de 44±14años (rango: 15-79) y un tiempo de evolución de la enfermedad de 22,21±13,12años (1-65) en tratamiento con insulina (88,1% con pauta bolo-basal y 11,9% con infusión subcutánea continua de insulina [ISCI]). El IMC medio fue 25,8±3,9kg/m2 (18,2-41,6). El resto de las características se muestran en la tabla 1. Todos los pacientes habían recibido educación diabetológica en nuestro servicio y habían sido instruidos en el uso y la descarga del sistema de monitorización.
Características de la muestra
| n=252 | |
|---|---|
| Sexo (H/M) % | 40,5/59,5 |
| Edad (años) | 44,91±14,58 (15-79) |
| Evolución (años) | 22,21±13,12 (1-65) |
| % Menos de 15 años de evolución | 32,5% |
| % entre 15-30 años de evolución | 38,6% |
| % Más de 30 años de evolución | 28,9% |
| IMC (kg/m2) | 25,81±3,96 (18,23-41,66) |
| A1c (%) | 7,36±0,94 (5,4-10,6) |
| % A1c <7% | 37,3 |
| % A1c 7-8% | 40,9 |
| %A1c >8% | 21,8 |
| Tabaco (%) | 21,2 |
| HTA (%) | 20,6 |
| Dislipemia (%) | 31,3 |
| Retinopatía (%) | 33,7 |
| Nefropatía (%) | 8,8 |
| Terapia bolo-basal (%) | 88,1 |
| ISCI (%) | 11,9 |
H/M: hombre/mujer; HTA: hipertensión arterial; IMC: índice de masa corporal; ISCI: infusión subcutánea continua de insulina.
Los datos se expresan como media ±desviación estándar y rango entre paréntesis o porcentaje en los casos indicados.
La A1c media fue de 7,36±0,94% (5,4-10,6%), y solo el 37,3% de los pacientes conseguían un buen control metabólico (A1c≤7%) (tabla 1). En cuanto al estudio glucométrico, el porcentaje de información válida de las descargas medio fue del 95,06±7,21% del tiempo. El TIR medio fue del 60,18±15,60% y solo el 28,6% de los pacientes consiguieron un objetivo de TIR superior al 70%. En cuanto al tiempo de hipoglucemia, el 57,9% de los pacientes consiguieron un TBR menor del 4%. El GMI fue de 7,19±0,69%, inferior a la A1c (tabla 2).
Resultados glucométricos de la muestra
| n=252 | |
|---|---|
| Porcentaje de información (%) | 95,06±7,21 (70-100) |
| Glucemia promedio (mg/dl) | 161,85±29,04 (102-276) |
| Coeficiente de variación (%) | 37,35±6,23 (21,70-55,80) |
| % Coeficiente variación <36 | 44 |
| Tiempo en rango (%) 70-180 mg/dl | 60,18±15,60 (13-97) |
| % Tiempo en rango >70% | 28,6 |
| Tiempo debajo de rango (%) ≤70mg/dl | 5,00±4,90 (0-35) |
| % Tiempo debajo de rango <4% | 57,9 |
| Tiempo encima de rango (%)>180 mg/dl | 34,86±16,89 (0-85) |
| GMI (%) | 7,19±0,69 (5,70-9,90) |
GMI: glucose management index o índice de gestión de glucosa.
Los datos se expresan como media ±desviación estándar y rango entre paréntesis o porcentaje en los casos indicados.
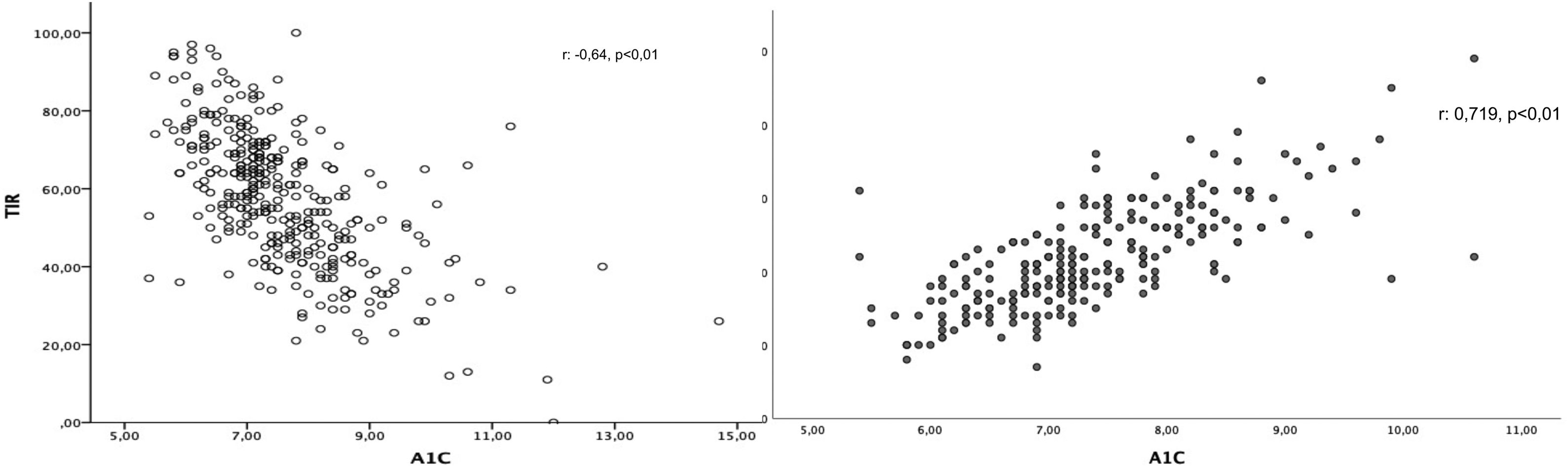
El TIR se relacionó con la A1c (r: −0,623; p<0,01) (fig. 1a), y esta asociación se mantenía tras ajustar por la edad, el sexo, la duración de la enfermedad, el IMC, el tratamiento insulínico, el %CV y el TBR (β: −0,548; p<0,01). Del mismo modo, encontramos una asociación positiva entre la A1c y el GMI (r: 0,719; p<0,01) (fig. 1b). En el estudio multivariante esta asociación se mantenía (β: 0,957; p<0,01) independientemente de la edad, el sexo, la duración de la enfermedad, el IMC, el tratamiento insulínico, el %CV y el TIR.
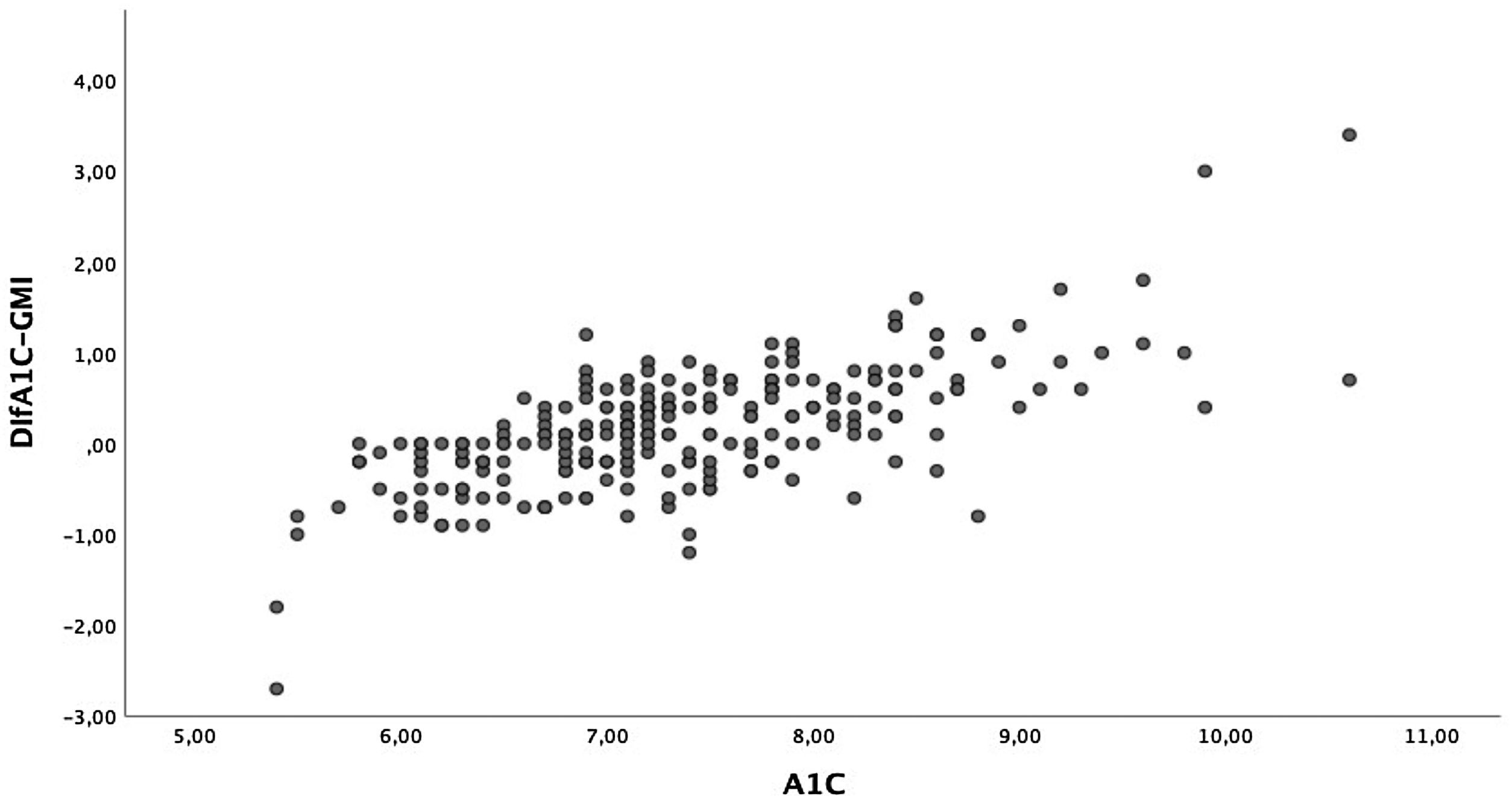
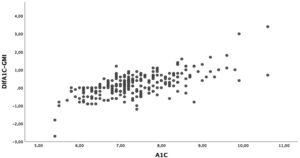
La diferencia media entre la A1c y el GMI fue de 0,17±0,65% (−2,70-3,40). En el 7,6% de los pacientes la diferencia entre la A1c y el GMI fue del 0%, y en el 57,4% la A1c era mayor que el GMI. Dado el intervalo tan amplio de esta diferencia, comparamos aquellos cuya diferencia entre la A1c y el GMI era igual o inferior al 0,2% y aquellos cuya diferencia era superior al 0,5%. Observamos que los pacientes con mayor diferencia eran pacientes de mayor edad, aunque el tiempo de la evolución fuese similar. Conjuntamente presentaban un peor control glucémico, mayor tasa de hiperlipemia y de complicaciones microangiopáticas en forma de retinopatía diabética. No se obtuvieron diferencias en cuanto al tipo de tratamiento. En cuanto a los datos de glucometría, los pacientes con mayor diferencia presentaban menor TIR a expensas de pasar más tiempo en hiperglucemia. No observamos diferencias en el TBR. En la tabla 3 se describen el resto de las características.
Características generales y datos de glucometría de los pacientes en función de la diferencia entre A1c y GMI
| Diferencia A1c-GMI ≤0,2%(n=87) | Diferencia A1c-GMI>0,5%(n=95) | p | |
|---|---|---|---|
| Sexo (H/M) % | 42,5/57,5 | 34,7/62,3 | 0,28 |
| Edad (años) | 42,51±12,59 | 48,06±15,40 | 0,09 |
| Evolución (años) | 21,56±12,03 | 24,68±13,52 | 0,10 |
| IMC (kg/m2) | 25,46±3,65 | 26,32±4,11 | 0,16 |
| A1c (%) | 6,95±0,63 | 7,7±1,15 | <0,01 |
| Tabaco (%) | 18,6 | 21,7 | 0,64 |
| HTA (%) | 16,1 | 25,3 | 0,13 |
| Dislipemia (%) | 20,7 | 38 | 0,011 |
| Retinopatía (%) | 33,1 | 41 | 0,082 |
| Nefropatía (%) | 7 | 8,4 | 0,72 |
| Terapia bolo-basal (%) | 86,2 | 85,3 | 0,86 |
| ISCI (%) | 13,8 | 14,7 | 0,86 |
| Porcentaje de información (%) | 94,74±7,09 | 95,31±7,11 | 0,59 |
| Glucemia promedio (mg/dl) | 152,93±25,77 | 167,58±31,20 | 0,01 |
| CV (%) | 36,18±5,85 | 37,77±6,59 | 0,87 |
| % CV <36 | 50,6 | 45,3 | 0,75 |
| TIR (%) | 65,41±15,02 | 56,44±15,66 | <0,01 |
| % TIR >70% | 41,4 | 22,1 | <0,01 |
| TBR (%) | 5,17±4,74 | 5,24±5,57 | 0,93 |
| % TBR <4% | 52,9 | 61,1 | 0,26 |
| TAR (%) >180mg/dl | 29,34±16,28 | 38,51±17,17 | <0,01 |
| GMI (%) | 6,97±0,62 | 7,33±0,74 | <0,01 |
CV: coeficiente de variación; GMI: glucose management index o índice de gestión de glucosa; H/M: hombre/mujer; HTA: hipertensión arterial; IMC: índice de masa corporal; ISCI: infusión subcutánea continua de insulina; TAR: tiempo por encima de rango; TBR: tiempo por debajo de rango; TIR: tiempo en rango.
Los datos se expresan como media ±desviación estándar y rango entre paréntesis o porcentaje en los casos indicados. Para comparar variables cuantitativas se utilizó la prueba t de Student tras realizar test de normalidad de la muestra. Para variables cualitativas utilizamos prueba χ2.
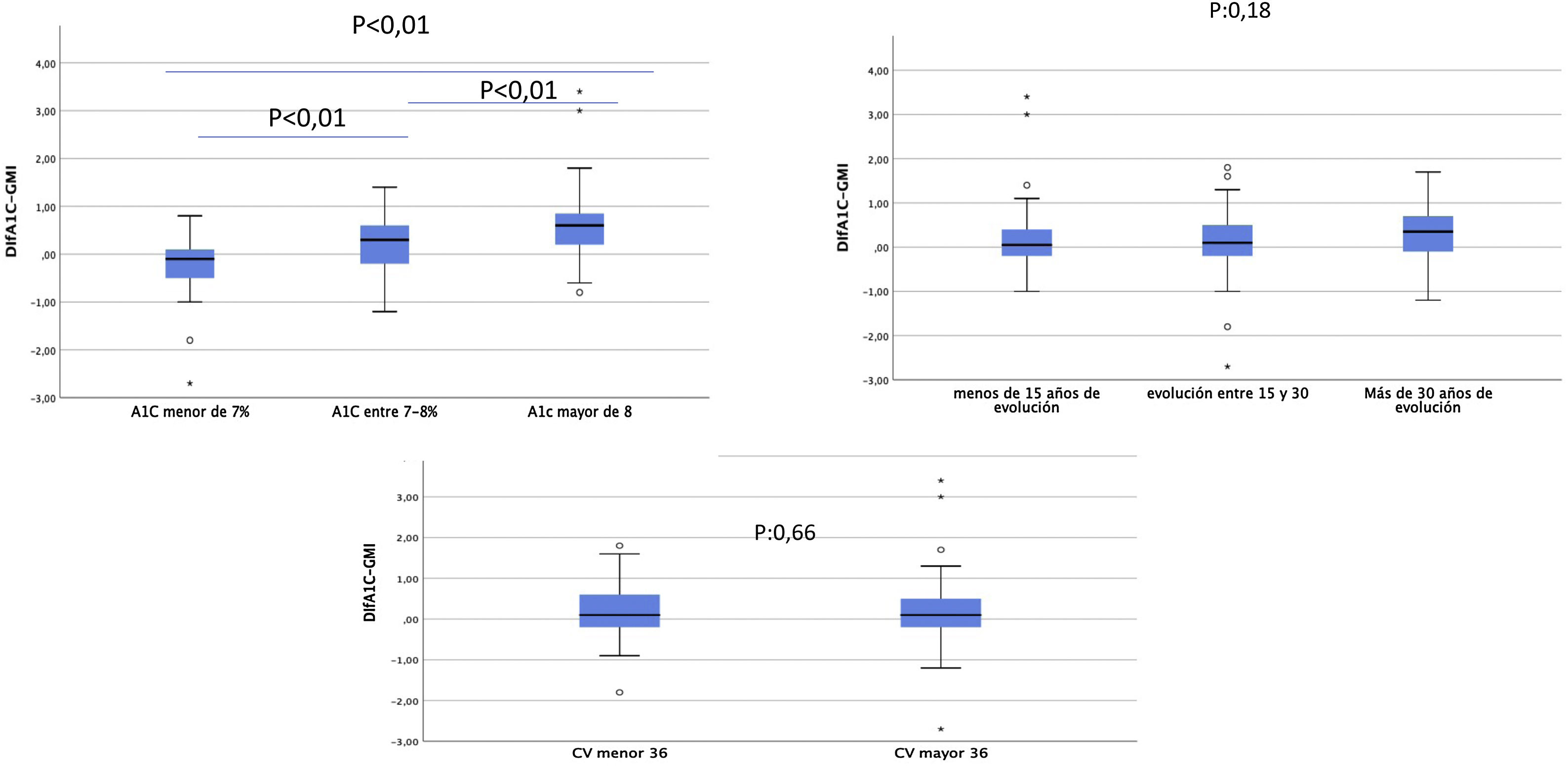
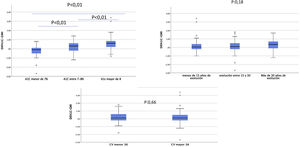
Por otro lado, las diferencias obtenidas entre estas dos variables presentan un amplio rango. Así, los pacientes con la A1c entre 7 y 8%, que en nuestra muestra representan el grupo mayoritario, presentan unas diferencias menores que aquellos con la A1c mayor del 8% (fig. 2). Las diferencias entre la A1c y el GMI eran mayores a medida que aumentaba la A1c de manera lineal y significativa (fig. 3a), lo que indica que en pacientes con mal control el GMI infraestima el tiempo en hiperglucemia. Sin embargo, cuando establecimos grupos en función del tiempo de evolución (fig. 3b) o del CV (fig. 3c), no se obtuvieron diferencias significativas.
Diferencias A1c-GMI en función de: a)HbA1; b)años de evolución de la enfermedad; c) coeficiente de variación.
a) y b)ANOVA para comparar medias; c)t de Student para comparar muestra independiente.
A1c: hemoglobina glucosilada (%); CV: coeficiente de variación; GMI: glucose management index o índice de gestión de glucosa (%).
Los resultados de este estudio muestran la relación de los datos glucométricos derivados del sistema FSL y las cifras de la A1c. El estudio Exchange T117 ha puesto de manifiesto el aumento progresivo del uso de tecnología en la DM1 en los últimos años. Sin embargo, este mismo informe advierte de este aumento en la tecnificación, aunque los porcentajes de pacientes con DM1 y buen control son escasos. En nuestro país, el estudio SED118 ha puesto de manifiesto que solo el 33% alcanzan un objetivo de buen control. Estos datos concuerdan con los de nuestra muestra, donde apenas el 37% consiguen una cifra de A1c<7%, siendo todos ellos usuarios de tecnología de monitorización continua con FSL.
En el estudio realizado por Gómez-Peralta et al.19, realizado en usuarios de FSL en España, se observó que el porcentaje de pacientes con TIR objetivo oscilaba entre el 47,8 y el 65,5%. En este estudio no se discriminó por tipo de diabetes, y esto podría explicar las diferencias con nuestro estudio, donde menos del 30% de los pacientes consiguen un TIR mayor del 70% del tiempo.
En cuanto a la correlación de la A1c y los parámetros glucométricos en la DM1, son varios los índices que se han propuesto, principalmente el TIR y el GMI (o previamente llamado A1c estimada). En cuanto al TIR, el estudio de Petersson et al.20, realizado en 133 niños y adolescentes con DM1 en Suecia, observó una relación lineal y significativa entre el TIR y la A1c. En este mismo sentido, en el estudio REALISM-T1D (REAL-Life glucoSe Monitoring in Type 1 Diabetes)21, realizado en adultos con DM1, se observó esta misma relación positiva del mismo modo. Finalmente, Vigersky y McMahon22 publicaron recientemente un metaanálisis con 18 diferentes estudios donde confirman esta correlación lineal entre el TIR y la A1c. Estos datos les hacen plantearse la verdadera utilidad del TIR como sustituto de la determinación venosa de la A1c. Sin embargo, en el estudio de Díaz-Soto et al.23, publicado recientemente, se observa que esta relación entre el TIR y la A1c queda condicionada a la variabilidad glucémica. Así, los pacientes con un CV mayor presentan una peor correlación entre ambas variables.
En nuestro estudio encontramos una relación entre TIR y la cifra de la A1c de manera significativa y lineal, sin verse modificada por el tipo de tratamiento o por el tiempo de evolución, entre otros factores. Sin embargo, esta relación es débil y concuerda con los datos publicados con Beck et al.24, donde, a pesar de encontrar una relación débil entre el TIR y la A1c, plantean que, para un mismo TIR, las cifras de la A1c encontradas son muy dispares. A diferencias del estudio de Díaz-Soto et al.23, nuestra relación es independiente del CV. No incluir pacientes pediátricos, o el hecho de que nuestra muestra presenta un mayor porcentaje de pacientes con un CV≤36%, podrían explicar estas diferencias.
Por esto mismo, decidimos utilizar el GMI. El GMI es un índice calculado que utiliza la glucemia promedio. Esto implica el uso de todos los valores de glucemia y no solo los acotados a un rango. En nuestra muestra, observamos una correlación más fuerte del GMI con la A1c que con el TIR, y de igual manera este efecto es independiente de la edad, del sexo, de la duración de la enfermedad, del IMC, del tratamiento insulínico, del %CV y del TIR. En este mismo sentido, Hu et al.25 realizaron un estudio en DM2 donde comparaban la relación entre la A1c y el GMI, observando de igual manera una asociación positiva. Del mismo modo, Yamada et al.26 encuentran una correlación positiva entre la A1c y la glucemia promedio también en pacientes con DM1.
Sin embargo, cuando analizamos las diferencias entre la medición de la A1c y el GMI, vemos un amplio rango. Cuando exploramos qué factores pueden explicar estas discrepancias, solo encontramos diferencias en la cifra de la A1c, de tal modo que a medida que aumentamos la A1c la diferencia con el GMI es mayor, siendo menor cuando la A1c se encuentra entre el 7 y el 8%. En nuestro estudio, alrededor del 50% de los pacientes se encuentran en este rango, y esto podría explicar la buena correlación obtenida. La media del GMI es inferior a los de la A1c, siendo esta infraestimación mayor en aquellos pacientes en los que la A1c es mayor del 8%, lo que podría infravalorar el riesgo vascular de estos pacientes mal controlados. Los datos extraídos del registro DPV (Alemania, Austria Suiza y Luxemburgo) demuestran de igual modo las diferencias entre estas dos variables en función de la cifra de la A1c, de tal forma que en el 75% de los pacientes con la A1c≥7,5% el GMI es inferior27. Por este motivo, algunos autores25 advierten de utilizar el GMI como parámetro de control, ya que su tendencia a mostrar valores más bajos frente a la A1c en pacientes mal controlados puede infravalorar el efecto crónico de la hiperglucemia en el desarrollo de las complicaciones.
Clásicamente, la mayoría de los estudios realizados en los que se ha observado correlación entre el control glucémico y la aparición de complicaciones vasculares han usado la A1c como parámetro de referencia2. Sin embargo, cada vez más se buscan otros parámetros glucométricos que nos permitan estratificar el riesgo cardiovascular en nuestros pacientes, sinérgicamente con la A1c o como método de referencia en aquellos pacientes en los que los valores de la A1c no son valorables (anemia, infecciones, patología aguda, etc.). Algunos estudios han intentado relacionar algunos parámetros glucométricos con el desarrollo de complicaciones28. Así, Lu et al.29 han observado una relación directa entre el TIR y la presencia de ateromatosis carotídea y con el desarrollo de retinopatía en pacientes con DM2. Sin embargo, son necesarios más estudios para determinar si los parámetros derivados del informe AGP podrán sustituir el valor de la A1c en la predicción del desarrollo de complicaciones.
En conclusión, nuestro estudio muestra la relación de los datos glucométricos derivados del sistema FSL libre y la A1c en pacientes con DM1 donde observamos una correlación positiva del GMI con la A1c. En el futuro, una mayor aproximación de los parámetros analíticos glucométricos a la A1c podría ser una herramienta de utilidad en el paciente con diabetes, con el subsecuente ahorro derivado de algunas determinaciones analíticas.
FinanciaciónNo ha existido ninguna fuente de financiación para la realización de este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.