El desarrollo de diabetes mellitus en pacientes afectos de fibrosis quística (DRFQ) se relaciona con peor estado nutricional y función pulmonar y aumento de mortalidad. La relevancia del diagnóstico de los estados «prediabéticos» es desconocida, cuestionándose la utilidad clínica de la HbA1c en estos pacientes.
ObjetivoEstudiar y caracterizar las alteraciones del metabolismo hidrocarbonado en pacientes pediátricos afectos de FQ.
Pacientes y métodosCaracterización antropométrica, clínica y genética y estudio de prevalencia de las alteraciones del metabolismo hidrocarbonado en 50 pacientes pediátricos afectos de FQ, mediante determinación de glucosa e insulina en test de tolerancia oral (TTOG) y monitorización continua de glucosa subcutánea (MCGS).
ResultadosUn 6% de pacientes presentaron DRFQ, 26% intolerancia a los hidratos de carbono, 10% alteración indeterminada de la glucosa y 2% alteración de glucemia en ayunas. La gravedad de la alteración glucémica se correlacionó positivamente con la edad y, negativamente, con la talla de los pacientes (p < 0,05), observándose diferencias intergrupos en HbA1c (p < 0,01), correlacionándose esta con el tiempo de hiperglucemia en MCGS, pero no en las mutaciones subyacentes, parámetros de función respiratoria, estado nutricional ni número de exacerbaciones en el año previo. Existía una correlación de las necesidades enzimáticas con el área bajo la curva (AUC) de glucemia (p < 0,05), pero no con AUC-insulinemia.
ConclusionesUna mayor edad y necesidad de aportes enzimáticos se relacionan con mayor afectación del metabolismo hidrocarbonado y menor talla estandarizada en pacientes afectos de FQ, siendo la HbA1c útil en la estimación del tiempo de hiperglucemia. El estudio del AUC de glucemia/insulinemia no aporta información adicional frente a la determinación de glucemia a los 120 min.
Development of cystic fibrosis-related diabetes (CFRD) is associated with worsening of nutritional status and lung function, as well as increased mortality. The relevance of diagnosing the «pre-diabetic» status in these patients has not been addressed and the utility of HbA1c measurement in these patients is under discussion.
AimTo study and characterise the different categories of carbohydrate metabolism impairment in paediatric patients with cystic fibrosis.
Patients and methodsA transversal study for characterisation of carbohydrate metabolism impairment according to clinical and anthropometric status and genetic background in 50 paediatric patients with cystic fibrosis (CF) was undertaken. Oral glucose tolerance tests (OGTT) for determination of glucose and insulin levels measurement and continuous subcutaneous glucose monitoring (CSGM) were performed.
Results6% of patients presented with CFRD, 26% impaired glucose tolerance, 10% an indeterminate glucose alteration and 2% impaired fasting glucose. The severity of glycaemic impairment correlated positively with age and negatively with standardised height (p < 0.05) with intergroup differences in HbA1c levels (p < 0.01), with the latter correlating with the duration of hyperglycaemia throughout CSGM. No intergroup differences in mutation prevalence, pulmonary function test, nutritional status or disease exacerbations in the previous year were found. The daily enzyme replacement dose correlated with the glucose area under the curve (AUC, p < 0.05) but not with insulin-AUC.
ConclusionsAn older age and greater enzyme replacement need are correlated with more severe carbohydrate metabolism impairment and lower standardized height in paediatric CF patients, with HbA1c correlating with the duration of hyperglycaemia. The study of the full glucose/insulin AUCs throughout the OGTT affords no additional information compared to glucose determination at 120min in these patients.
La fibrosis quística (FQ) es la enfermedad autosómica recesiva más frecuente en población caucásica, aunque la prevalencia reportada en nuestro país (1/2.810-1/3.743 recién nacidos)1 parece sobreestimada, pues el despistaje neonatal ha demostrado influencia de la etnia y país de origen sobre dicha prevalencia. Es debida a mutaciones en el gen CFTR (siendo ΔF508 la mutación predominante), que codifica la proteína cystic fibrosis transmembrane conductance regulator (CFTR), cuya disfunción ocasiona una alteración del transporte de cloro y sodio en las células secretoras epiteliales, ocasionando manifestaciones clínicas multisistémicas, especialmente en el tracto respiratorio (afectación pulmonar progresiva) y en el sistema digestivo (insuficiencia pancreática exocrina y hepatopatía)2.
La progresión de la enfermedad induce una fibrosis progresiva del páncreas que genera inicialmente una insuficiencia exocrina. La insuficiencia endocrina suele ser más tardía y produce una alteración del metabolismo de los hidratos de carbono (HC) que puede culminar en el desarrollo de un tipo particular de diabetes mellitus (DM), denominada diabetes relacionada con FQ (DRFQ). La DRFQ suele desarrollarse a partir de la segunda década de vida3, afectando hasta a un 20% de los adolescentes y a un 50% de los adultos con FQ4, por lo que al incrementarse la supervivencia de estos pacientes, el estudio y tratamiento de la DRFQ ha aumentado su relevancia.
Pese a ciertas similitudes con la DM tipo 1 (DM1), la DRFQ constituye una entidad clínica singular. La reducción del número de células beta pancreáticas comienza en edades tempranas5,6 y su fisiopatología implica múltiples mecanismos de acción sinérgica, como son el daño celular directo, la alteración genética subyacente y la propia hiperglucemia, que induce un daño a los islotes pancreáticos y contribuye a la resistencia insulínica periférica, por medio de un proceso denominado glucotoxicidad5.
La importancia de la DRFQ, así como de las alteraciones del metabolismo HC que pueden precederla (denominados «estados prediabéticos»), radica en su influencia sobre la evolución clínica global del paciente con FQ7. Se ha observado cómo niveles de glucemia superiores a 144 mg/dL (8 mmol/L) aumentan la excreción de glucosa en la vía aérea8, favoreciendo el crecimiento de microorganismos y, por tanto, el número de infecciones respiratorias que, posteriormente, pueden determinar un empeoramiento de la función pulmonar. Se ha observado que el tratamiento con insulina mejora el perfil nutricional9, contribuyendo a disminuir la mortalidad en los pacientes con DRFQ10,11, por lo que su detección precoz es clínicamente relevante.
El diagnóstico inicial de DRFQ se establece generalmente en periodos con aumento de resistencia a la insulina (infecciones pulmonares o uso de corticoides sistémicos)11 y es comúnmente precedido por pérdida de peso, disminución del crecimiento (en periodo infanto-juvenil) y declive de la función pulmonar. La presencia de síntomas clásicos de DM (polidipsia, poliuria) o el desarrollo de cetoacidosis son excepcionales en la DRFQ5,6, al ser la instauración de la deficiencia insulínica más paulatina que en la DM1.
El test de tolerancia oral de glucosa (TTOG) se considera la prueba de referencia para su diagnóstico6,12, ya que hasta dos tercios de los pacientes con DRFQ no presentan hiperglucemia en ayunas10, sugiriéndose que la presencia de hiperglucemia en puntos intermedios del test podría tener utilidad como predictor clínico10,13,14.
La monitorización continua de glucosa subcutánea (MCGS) permite detectar periodos posprandiales intermitentes de hiperglucemia en pacientes en los que la glucemia en ayunas y el TTOG muestran resultados normales. En consecuencia, algunos autores consideran que es más sensible para la detección precoz de estas alteraciones previas al establecimiento de DRFQ15,16. No obstante, la relevancia clínica de estos periodos de hiperglucemia no está bien establecida13,17 y la MCGS no está actualmente recomendada como método de despistaje18.
La HbA1c es un marcador poco fiable para el diagnóstico de DRFQ, en general, y en niños en particular, argumentándose que su valor se puede encontrar falsamente disminuido, por dos motivos19. A saber: 1) los periodos de hiperglucemia posprandiales intermitentes no parecen afectar significativamente a la glicosilación de la hemoglobina20; 2) el descenso en la vida media de los hematíes, característico en pacientes con fibrosis quística, determinaría un resultado más bajo de HbA1c para un determinado valor de glucemia21. Diferentes autores han demostrado que la sensibilidad de la HbA1c para el diagnóstico de DRFQ es únicamente del 50%, comparada con el TTOG, sugiriendo que su valor no se correlaciona con el de glucemia plasmática22.
La American Diabetes Association (ADA) y la International Society for Paediatric and Adolescent Diabetes (ISPAD) recomiendan la realización de cribado anual de DRFQ mediante TTOG, a partir de los 10 años en todos los pacientes afectos de FQ4,6. Sin embargo, la instauración de las alteraciones glucémicas acontece de forma progresiva, habiéndose documentado alteraciones en el metabolismo de los hidratos de carbono entre 42-78% de los niños por debajo de este límite empírico establecido para su despistaje23,24.
Ni las recomendaciones de la ADA ni las de la ISPAD hacen referencia a la eventual relevancia de la determinación de la insulinemia a lo largo del TTOG, aunque esta podría ser útil para evaluar la capacidad de la reserva insulínica en estados previos a la instauración de DRFQ25.
Los objetivos de este estudio fueron: 1) investigar la prevalencia de las alteraciones del metabolismo hidrocarbonado en pacientes pediátricos afectos de FQ en relación con su caracterización antropométrica, estado clínico y variantes en CFTR; 2) evaluar la eventual utilidad de la HbA1c como indicador indirecto del tiempo en hiperglucemia en estos pacientes; 3) explorar si el estudio de las AUC de glucosa e insulina a lo largo del TTOG aporta información adicional a la determinación aislada de la glucemia a los 120 minutos de de la ingesta de glucosa.
Pacientes y métodosSe estudiaron 50 pacientes (23 niñas [46%] y 27 niños [54%]), con una edad media de 12,27 (± 3,72 años) afectos de FQ, sin otras patologías concomitantes o subyacentes conocidas y que se encontraban en una fase estable de su enfermedad, sin procesos intercurrentes ni tratamiento con corticoides sistémicos en las ocho semanas previas, y sin tratamiento con fármacos estimuladores de la función de CFTR. De los 50 pacientes, 16 eran prepuberales, 24 se encontraban en fase de desarrollo puberal y 10 habían completado su pubertad.
Se registraron sus datos demográficos y antropométricos (edad, sexo, peso, talla estandarizada), parámetros de estado nutricional y crecimiento (mediante cálculo de índices de Waterlow y de la velocidad de crecimiento estandarizada en el año previo), así como estado de la función pulmonar, mediante espirometría forzada, a través de la capacidad vital forzada (CVF) y el volumen espiratorio forzado en el primer segundo (FEV1), expresados en z-score del porcentaje de valor predictivo para el sexo y la talla, de acuerdo con las ecuaciones de referencia de la Global Lung Initiative26.
Se realizó una estimación indirecta de la gravedad de su insuficiencia pancreática exocrina, mediante sus necesidades diarias de enzimas pancreáticas (ajustadas por kilogramo de peso) en el momento del estudio y se analizó la evolución clínica en el año previo al estudio (número de ingresos y exacerbaciones de la enfermedad, entendiéndose estas como cualquier infección respiratoria que hubiera requerido una modificación en el tratamiento habitual del paciente). Asimismo, se registraron los microorganismos aislados en muestras de esputo recogidas en el año previo al estudio.
A todos los pacientes se les realizó un TTOG tras 12 h de ayuno con determinación de glucemia e insulinemia (1,75 g/kg, máximo 75 g). De acuerdo con los resultados se clasificaron los pacientes en los grupos de tolerancia normal a glucosa (TNG), de alteración de la glucemia en ayunas (AGA), de intolerancia a los hidratos de carbono (IHC) o DRFQ, en función de los niveles de glucemia en situación basal y a los 120 min (120’), de acuerdo con los criterios establecidos por la ADA4. Se estableció asimismo el diagnóstico de alteración indeterminada de glucosa (AIG), en aquellos pacientes en los que, en ausencia de otra categoría diagnóstica, se había objetivado en el TTOG una glucemia igual o superior a 200 mg/dL a los 30 o 60 min4.
Adicionalmente, se consideró la inclusión de un nuevo grupo de alteración glucémica en pacientes con fibrosis quística, propuesto recientemente, caracterizado por elevaciones de glucemia en el TTOG superiores a 140 mg/dL, pero inferiores a 200 mg/dL y denominado AGT14027.
Se calculó el área bajo la curva (AUC) de glucemia e insulinemia en el TTOG, de acuerdo con la fórmula: AUC = 0,25x (valor basal) + 0,5x (valor 30’) + 0,75x (valor 60’) + 0,5x (valor 120’).
En la extracción basal (en ayunas) se estudiaron los niveles de HbA1c, así como otros parámetros metabólicos (vitaminas liposolubles, marcadores de inflamación, perfil lipídico, proteínas y albúmina).
A todos aquellos pacientes que presentaron alguna alteración en el TTOG, se les ofreció la posibilidad de realizar una MCGS durante siete días [Medtronic iPro2®]. Esta fue aceptada por 16 pacientes, de los cuales 11 (68,75%) habían sido clasificados previamente como IHC, dos (12,5%) como AIG, uno (6,25%) como AGA y dos (12,5%) como DRFQ. En ellos se valoró el porcentaje medio de tiempo que presentaron una glucosa superior a 144 mg/dL8 y el número total de eventos de glucemia superior a 200 mg/dL diarios.
El protocolo de estudio fue aprobado por el Comité de Ética e Investigación del Hospital Infantil Universitario Niño Jesús de Madrid y se desarrolló de acuerdo con los «Ethical Principles for Medical Research Involving Human Subjects» adoptados en la Declaración de Helsinki por la World Medical Association (64th WMA General Assembly, Fortaleza, Brazil, October 2013) y la ley de protección de datos personales (Ley Orgánica de protección de datos personales del 5 de diciembre de 2018). Los padres o tutores legales de todos los pacientes otorgaron consentimiento informado escrito y los pacientes mayores de 12 años asentimiento informado tras la explicación completa del estudio y los procedimientos contemplados en el mismo.
Se realizó el análisis estadístico de los datos utilizando el software SPSS para Windows, versión 23 (IBM Corp., Armonk, NY, EE. UU.). Se exploró el ajuste a distribución normal de las variables cuantitativas a estudio mediante el test de Kolmogorov-Smirnov y se establecieron comparaciones entre las diferentes categorías diagnósticas establecidas. Cuando estas comparaciones se refirieron a variables que se ajustan a una distribución normal, el análisis de diferencias se realizó empleando el test de la t de Student en el caso de comparación entre dos grupos o el de análisis de la varianza (ANOVA) para comparaciones entre más de dos grupos. En el caso de variables que no se ajustaron a una distribución normal, el análisis de diferencias se realizó empleando el test de U de Mann-Whitney en el caso de comparación entre dos grupos o el de Kruskal-Wallis para comparaciones entre más de dos grupos. Los estudios de correlación se realizaron empleando la r de Pearson en el caso de variables de distribución normal o la rho de Spearman para las de distribución no normal.
ResultadosUn 56% de los pacientes (n = 28) no presentaron alteraciones glucémicas (TNG). En un 6% (n = 3) se diagnosticó DRFQ. El 26% (n = 13) presentaba IHC, el 10% (n = 5) AIG y un único paciente AGA (excluido de las comparaciones intergrupales). Dentro del grupo de los 28 pacientes con TNG, 23 de ellos (82%) presentaban una glucemia máxima en el TTOG superior a 140, pero inferior a 200 mg/dL antes de los 120 min; pudiendo, por tanto, ser incluidos dentro del grupo AGT140. De este modo, si la AGT140 se considerase una condición de alteración inicial del metabolismo de los HC, solamente cinco de los 50 pacientes de la cohorte estudiada (10%), no se encuadrarían en ninguna de las categorías patológicas propuestas.
Ninguno de los pacientes con DRFQ precisó tratamiento insulínico al diagnóstico. Se hallaron diferencias significativas en la prevalencia global de alteraciones del metabolismo hidrocarbonado en relación con el germen colonizador, en los casos en que estaba caracterizado (χ2 46,94; p < 0,05), estando estas presentes en el 100% de los pacientes colonizados por Staphylococcus aureus resistente a meticilina (SARM).
El 30% de los pacientes presentaban la mutación ΔF508 en homocigosis, 46% la presentaban en heterocigosis, y 24% presentaban otras combinaciones de mutaciones. No se encontró diferencia estadísticamente significativa en la prevalencia de las mutaciones subyacentes en CFTR entre los grupos de pacientes establecidos, según las alteraciones glucémicas (TNG/AIG/IHC/AIG). Tampoco se hallaron diferencias intergrupales en FEV1 z-score y CVF z-score (tabla 1), ni el número de ingresos o exacerbaciones en el año previo.
Comparación de las variables estudiadas (media±desviación estándar) entre grupos, según el estado del metabolismo de los hidratos de carbono de los pacientes
| TNG | IHC | AIG | DRFQ | p | |
|---|---|---|---|---|---|
| Edad | 10,9±3,7 | 13,3±3,0 | 14,6±2,6 | 14,9±3,6 | 0,034* |
| Talla (SDS) | - 0,11±1,00 | - 0,16±1,00 | - 1,10±1,00 | - 1,63±0,70 | 0,047* |
| Velocidad de crecimiento (SDS) | - 0,87±2,50 | 1,53±2,64 | 1,77±2,10 | - 1,71±2,70 | 0,067 |
| I. Waterlow talla (%) | 98,7±4,9 | 99,1±4,1 | 96,0±3,7 | 92,0±2,7 | 0,079 |
| FEV1 (z-score) | - 1,98±1,49 | - 1,65±1,02 | - 2,05±2,00 | - 1,08±1,37 | 0,566 |
| CVF (z-score) | - 1,51±1,45 | - 0,84±0,97 | - 1,02±0,78 | - 0,79±0,76 | 0,457 |
| Exacerbaciones año previo | 3,7±2,7 | 2,7±2,1 | 2,8±2,1 | 2,3±0,9 | 0,930 |
| Dosis enzimas pancreáticas (103 UI/kg/día) | 3,83±2,69 | 4,16±2,28 | 3,61±2,04 | 4,94±2,79 | 0,369 |
| Ferritina (ng/mL) | 29,1±10,9 | 28,1±11,8 | 43,2±19,0 | 34,0±12,0 | 0,343 |
| PCR (mg/dL) | 0,44±0,30 | 0,40±0,10 | 1,52±2,00 | 0,33±0,23 | 0,673 |
| HbA1c (%) | 5,52±0,30 | 5,80±0,25 | 5,58±0,32 | 6,43±0,37 | 0,002* |
| Glucemia basal (mg/dL) | 82,15±7,60 | 89,15±5,80 | 85,80±11,60 | 98,67±13,90 | 0,016* |
| Insulinemia basal (μU/mL) | 5,45±2,40 | 8,94±5,60 | 6,60±2,90 | 9,03±1,40 | 0,075 |
| AUC de glucemia | 260,2±31,6 | 328,4±37,9 | 322,5±47,3 | 381,5±35,8 | 0,000* |
| AUC de insulinemia | 60,3±28,7 | 100,5±63,6 | 71,1±43,2 | 87,5±26,9 | 0,148 |
Estadísticamente significativo p < 0,05.
AIG: alteración indeterminada de glucosa; AUC: área bajo la curva; CVF: capacidad vital forzada, expresada en z-score; DRFQ: diabetes relacionada con fibrosis quística; FEV1: volumen espiratorio máximo en el primer segundo expresado en z-score; HbA1c: hemoglobina glicosilada; IHC: intolerancia a los hidratos de carbono; I. Waterlow talla: índice de Waterlow para la talla; p: nivel de significación estadística; PCR: proteína C reactiva; SDS: standard deviation score (z-score); TNG: tolerancia normal a glucosa.
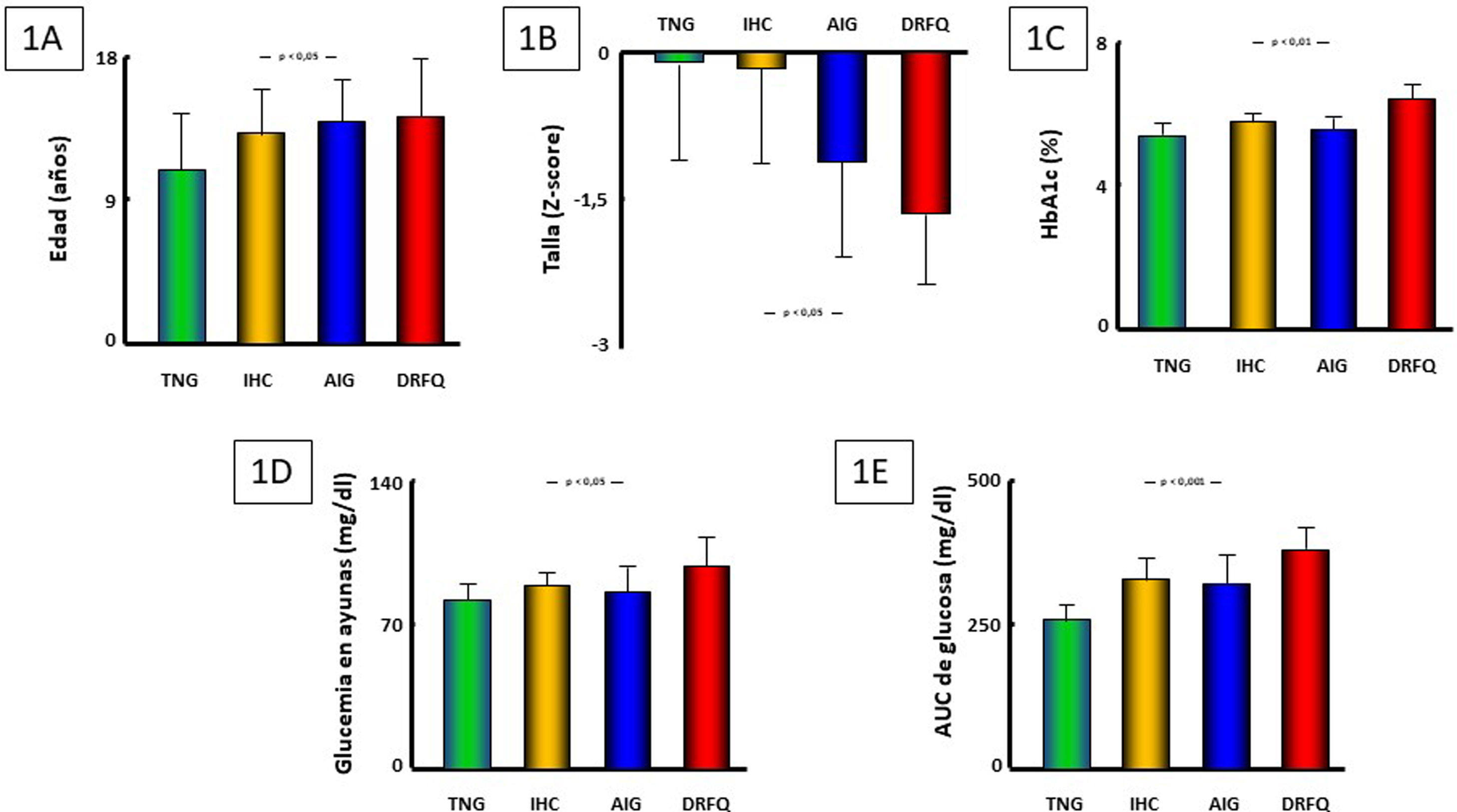
Se observó una mayor edad y mayor afectación de talla en función de la gravedad de la alteración del metabolismo hidrocarbonado (p < 0,05 ambas) (tabla 1, fig. 1A y 1B), acercándose a la significación estadística, aunque sin alcanzarla, la velocidad de crecimiento en el año previo (p = 0,07). No se hallaron diferencias en función del sexo ni en cuanto a la velocidad de crecimiento de acuerdo con su estadio de desarrollo puberal.
Comparación entre los grupos establecidos, según alteración del metabolismo hidrocarbonado presentada por los pacientes (excluyendo alteración de la glucemia en ayunas [n = 1]).
AIG: alteración indeterminada de glucosa; AUC: área bajo la curva; DRFQ: diabetes relacionada con fibrosis quística; IHC: intolerancia a los hidratos de carbono; TNG: tolerancia normal a glucosa.
Se hallaron diferencias entre grupos en los niveles de HbA1c (p < 0,01), glucemia en ayunas (p < 0,05) y AUC de glucosa (p < 0,001), pero no en los niveles de insulinemia basal ni en el AUC de insulina (tabla 1 y fig. 1C-E). Existían, asimismo, correlaciones directas de los niveles de HbA1c con el AUC de glucemia (r = +0,49; p < 0,001) y la glucemia a 120 min en el TTOG (r = +0,54; p < 0,001). Por el contrario, no se observó correlación entre los valores de HbA1c con los de glucemia ni insulinemia en ayunas, ni con el AUC de insulina. En los pacientes con registro de MCGS, la glucosa media intersticial (GMI) fue 101,1±11,6 mg/dL y la HbA1c estimada 5,1±0,4%, sin observarse correlación significativa entre esta y la HbA1c capilar. Sin embargo; sí se objetivó correlación directa entre el porcentaje medio de tiempo de glucemias superiores a 144 mg/dL (que fue el 4,87±4,36%) y los valores de HbA1c (r = +0,57; p < 0,05), mientras que la media diaria de eventos de glucemia > 200 mg/dL fue extremadamente baja (0,63±0,95).
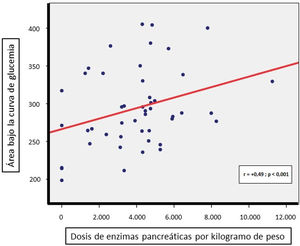
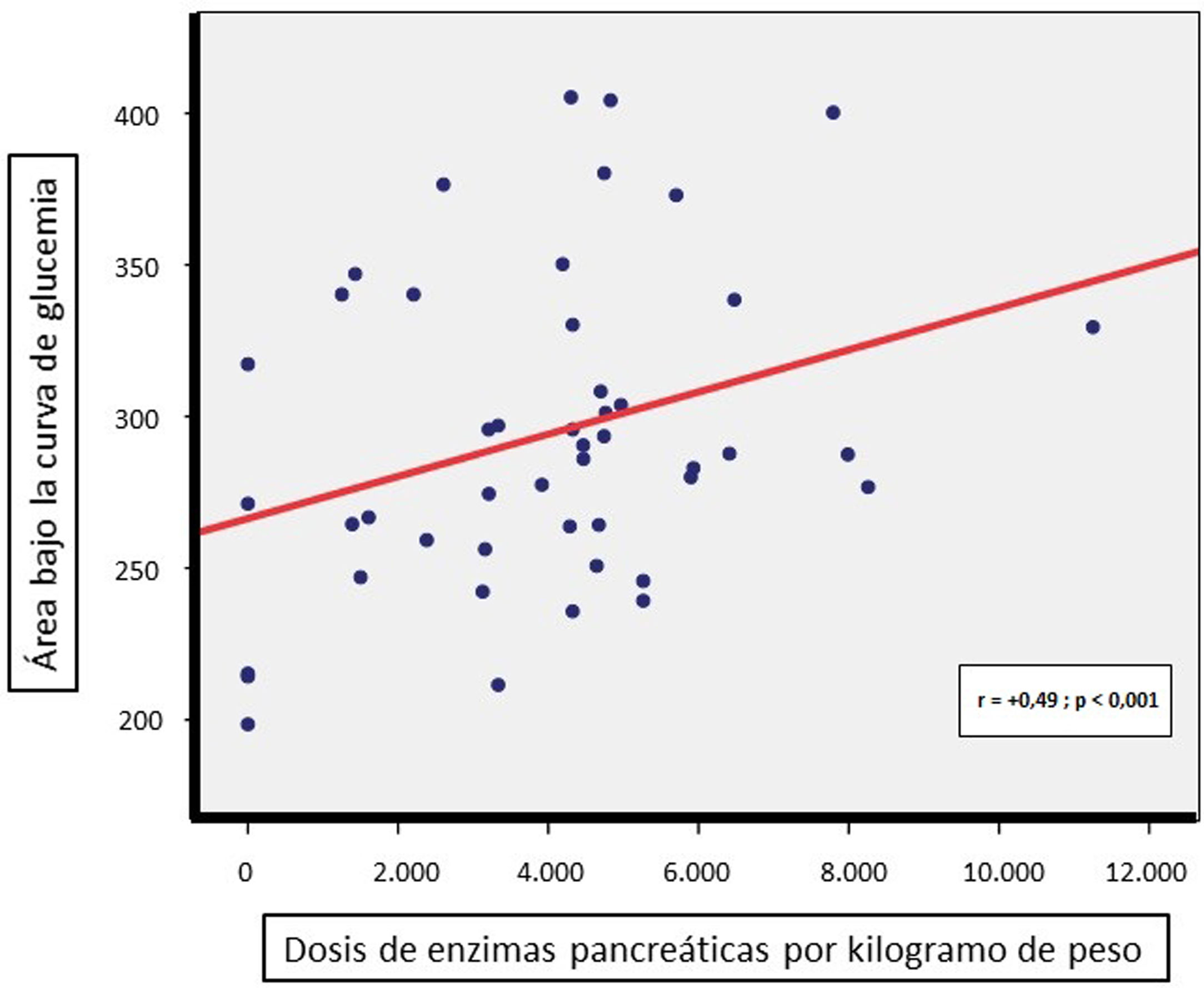
Las comparaciones intergrupales de parámetros referentes al estado nutricional (índice de Waterlow para el peso, vitaminas liposolubles, albúmina y perfil lipídico), marcadores inflamatorios (ferritina y PCR) o los requerimientos totales de enzimas pancreáticas (por kg de peso) no mostraron diferencias significativas (tabla 1). Sin embargo, sí se detectó una correlación directa entre la dosis diaria de enzimas pancreáticas (por kilogramo de peso) precisada por los pacientes y su AUC de glucemia (r = +0,49, p < 0,001, fig. 2); no así con el AUC de insulinemia.
DiscusiónEn este estudio, aproximadamente la mitad de los pacientes pediátricos afectos de FQ (y hasta un 90% si consideramos las alteraciones definidas como AGT14027) presentaron algún tipo de alteración glucémica en el TTOG que determinaba una glucemia superior al límite que ocasiona su secreción bronquial, pudiendo favorecer la colonización bacteriana e influir sobre el devenir clínico global de la enfermedad, incluyendo el crecimiento somático. Asimismo, una mayor edad y necesidad de aportes enzimáticos se relacionaron con afectación más grave del metabolismo hidrocarbonado. La HbA1c demostró su utilidad en la estimación del tiempo de hiperglucemia, sin que el estudio de la glucemia o insulinemia basal (ni sus AUC en el TTOG) aportasen información adicional frente a la determinación de glucemia a los 120 min.
Nuestro estudio confirma datos previamente comunicados referentes a la prevalencia de las alteraciones glucémicas en pacientes afectos de FQ, siendo la intolerancia a los hidratos de carbono la más frecuentemente hallada, así como las relaciones entre la edad, la afectación de la talla y la gravedad de las alteraciones del metabolismo hidrocarbonado23,24,28. En nuestra muestra, el paciente más joven con DRFQ tenía 12,5 años, pero encontramos pacientes menores de 10 años con IHC (el menor 6,58 años). En consecuencia, pese a que tanto la ADA como la ISPAD recomiendan el cribado de DRFQ a partir de los 10 años en los pacientes con FQ, estos niños de menor edad con IHC podrían constituir un grupo de riesgo para el desarrollo precoz de diabetes, como se ha sugerido previamente23,24. Un metaanálisis reciente establece que estos estados de prediabetes no son infrecuentes por debajo de los 10 años de edad, suponiendo un factor predictor para el desarrollo de DRFQ y contribuyendo a un peor pronóstico en estos pacientes29.
Adicionalmente, la eventual consideración de la AGT140 como alteración inicial del metabolismo de los HC en la FQ, si bien la reciente propuesta de esta categoría no ha permitido su aval por las sociedades para el estudio de la diabetes hasta la fecha, determinaría que el porcentaje de pacientes sin ninguna alteración en el metabolismo hidrocarbonado sería muy escaso, incluso por debajo de los 10 años. Sin embargo, en nuestro estudio, el limitado número de pacientes en este último subgrupo (5/28) no permitió establecer diferencias significativas entre estos cinco pacientes y los 23 pacientes con AGT140, lo que no nos permite especular acerca de la eventual relevancia clínica de la AGT140.
La correlación directa hallada entre la dosis de enzimas pancreáticas por kilogramo de peso y el AUC de glucemia durante el TTOG apoya la relación existente entre un mayor deterioro de la secreción pancreática exocrina y el inicio de la alteración endocrina3. Así, en estos pacientes, la evaluación de los cambios en sus necesidades diarias de enzimas podría ser útil para sospechar el posible empeoramiento de su alteración glucémica preexistente.
La ausencia de relación entre la gravedad de la alteración glucémica y la afectación de la función respiratoria, determinada por los valores de FEV1 z-score y CVF z-score, corrobora los resultados de estudios previos23,24,28, si bien los datos existentes en la literatura sobre esta asociación no resultan concluyentes, pues otros grupos postulan la existencia de dicha asociación14,30. Esto puede verse influido, al menos en parte, por la escasa prevalencia de DRFQ en nuestra cohorte y su ausencia de necesidad de tratamiento insulínico (estadio inicial de la DRFQ con escasa afectación metabólica). Igualmente, la relación entre la presencia de IHC o DRFQ y la prevalencia de las mutaciones subyacentes en CFTR descrita por otros autores30,31 no ha sido reproducida en este estudio, si bien el tamaño muestral limita la posibilidad de establecer esta asociación.
En relación con el crecimiento somático, la coexistencia de una mayor afectación del mismo y de una mayor edad en función de la gravedad de la afectación del metabolismo de los HC puede permitir especular que la progresión de la enfermedad podría afectar al pico de crecimiento puberal, determinando un empeoramiento del z-score de talla conforme avanza la pubertad de los pacientes. Sin embargo, esta aseveración requeriría del estudio de grupos más numerosos de pacientes durante un periodo más prolongado.
El estudio de la glucemia a los 30 y 60 min durante el TTOG y el cálculo del AUC de glucemia en este estudio no ha demostrado ventajas adicionales sobre la determinación de glucemia a los 120 min, excepción hecha de la identificación de los pacientes con AIG. La tendencia (aunque no significativa) a presentar valores de PCR y ferritina más elevados de los pacientes con AIG podría sugerir que estas hiperglucemias transitorias podrían estar influidas por una resistencia a la insulina puntual inducida por inflamación u otros factores, sin existir realmente una alteración glucémica subyacente. La determinación de insulinemia tanto basal como durante el TTOG y el cálculo del AUC de insulina tampoco aportaron información adicional, lo cual refrenda observaciones previas31 y sugiere que estos estudios no deben ser aconsejados en la práctica clínica habitual. Asimismo, la determinación de glucemia en ayunas se ha demostrado poco informativa en nuestra cohorte, sin correlación con los parámetros estudiados y siendo la presencia de AGA excepcional, lo que le confiere dudosa significación clínica, como se ha sugerido en otras poblaciones pediátricas32.
Los resultados de nuestro estudio sugieren que en aquellos pacientes con IHC, la monitorización subcutánea continua de glucosa podría orientar sobre la frecuencia o cronología de las excursiones hiperglucémicas. Sin embargo, el porcentaje de tiempo con glucemia superior a 144 mg/dL en estos pacientes fue muy limitado y no se correlaciona con peor función respiratoria o estado clínico, por lo que no aportó información adicional. Más aún, no se observó correlación entre la GMI y la HbA1c estimada con la HbA1c real, probablemente influido por un tiempo insuficiente (siete días) del registro de la monitorización continua de glucosa y el limitado número de pacientes que accedieron a su implantación, lo cual constituye una de las limitaciones de este estudio. Sobre esta base, y aunque la MCGS se ha propuesto como un método más sensible que el TTOG para detectar el riesgo de progresión a DRFQ en pacientes con IHC4, los resultados de este estudio no permiten especular acerca de su potencial utilidad como método de despistaje.
La determinación de HbA1c se considera un parámetro poco sensible para el diagnóstico de DRFQ4. Sin embargo, en nuestro estudio existían diferencias significativas en HbA1c entre las distintas categorías de alteración glucémica, así como correlaciones directas tanto con el AUC de glucemia, como con la glucemia a los 120 min post-TTOG y con el porcentaje de tiempo de glucemia superior a 144 mg/dL en MCGS. Consecuentemente, la HbA1c en pacientes afectos de FQ, aun considerando las limitaciones referidas tanto en esta como en otras patologías pediátricas con potencial afectación del metabolismo hidrocarbonado32, podría aportar información sobre la duración e intensidad de los periodos de hiperglucemia a lo largo del seguimiento, así como orientar sobre la posible existencia de alteraciones glucémicas subyacentes, aunque no constituya el parámetro diagnóstico más sensible de DRFQ.
En conclusión, los resultados de este estudio sugieren que una mayor edad y la necesidad de aportes enzimáticos se relacionan con mayor afectación del metabolismo glucídico y de la talla en niños afectos de FQ, siendo la HbA1c útil en la estimación del tiempo de hiperglucemia. Nuestros resultados no avalan el estudio de la insulinemia en estos pacientes, ya que no aporta información adicional. La glucemia a los 120 min en el TTOG constituye la determinación más eficiente para el despistaje de las alteraciones del metabolismo glucídico asociadas a fibrosis quística, siendo la glucemia en ayunas poco informativa.
Contribución de los autoresTodos los autores han realizado contribuciones sustanciales al desarrollo de este manuscrito. GAMM y JA desarrollaron la concepción y el diseño del estudio, JEG, GAMM y AUP realizaron la atención a los pacientes y la adquisición de datos, JEG, AMR, VSS, JA y GAMM desarrollaron el análisis y la interpretación de los datos y el borrador del artículo. Todos los autores han participado en la revisión crítica del contenido intelectual y han otorgado la aprobación definitiva de la versión del trabajo que se presenta.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores desean expresar su agradecimiento al personal auxiliar y de enfermería de la Sección de Neumología y del Servicio de Endocrinología, especialmente a María José Vergara, por su inestimable colaboración en los procedimientos diagnósticos de los pacientes.





![Comparación entre los grupos establecidos, según alteración del metabolismo hidrocarbonado presentada por los pacientes (excluyendo alteración de la glucemia en ayunas [n = 1]). AIG: alteración indeterminada de glucosa; AUC: área bajo la curva; DRFQ: diabetes relacionada con fibrosis quística; IHC: intolerancia a los hidratos de carbono; TNG: tolerancia normal a glucosa. Comparación entre los grupos establecidos, según alteración del metabolismo hidrocarbonado presentada por los pacientes (excluyendo alteración de la glucemia en ayunas [n = 1]). AIG: alteración indeterminada de glucosa; AUC: área bajo la curva; DRFQ: diabetes relacionada con fibrosis quística; IHC: intolerancia a los hidratos de carbono; TNG: tolerancia normal a glucosa.](https://static.elsevier.es/multimedia/25300164/0000006900000008/v1_202209160915/S2530016421002457/v1_202209160915/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)