Editado por: Meritxell Gracia
Última actualización: Enero 2023
Más datosEl sangrado uterino anormal (SUA) es una de las patologías ginecológicas más comunes en mujeres en edad reproductiva. El sistema de clasificación de la Federación Internacional de Ginecología y Obstetricia (PALM-COEIN) armoniza las definiciones de los síntomas de hemorragia normal y anormal y clasifica las posibles causas subyacentes en causas estructurales y no estructurales. El objetivo de este manuscrito es revisar el diagnóstico radiológico de cada una de las causas estructurales de sangrado uterino anormal, examinar las indicaciones de las técnicas de radiología vascular intervencionista en el manejo del SUA y conocer el procedimiento de embolización de arterias uterinas, así como sus posibles complicaciones y contraindicaciones.
Abnormal uterine bleeding is one of the most common gynaecological pathologies in women of reproductive age. The classification system of the International Federation of Gynaecology and Obstetrics (PALM-COEIN) harmonizes the definitions of normal and abnormal bleeding symptoms and classifies possible underlying causes as structural and non-structural. The aim of this manuscript is to review the radiological diagnosis of each of the structural causes of abnormal uterine bleeding, to examine the indications for interventional vascular radiology techniques in the treatment of abnormal uterine bleeding, and to learn about the uterine artery embolization procedure, as well as its possible complications and contraindications.
El sangrado uterino anormal (SUA) es una patología frecuente en ginecología, con una prevalencia de entre el 3 y el 30% de las mujeres en edad reproductiva1. Es un término amplio, que describe las irregularidades del ciclo menstrual en cuanto a su frecuencia, regularidad, duración y volumen fuera del embarazo.
En 2011, el grupo de expertos de la Federación Internacional de Ginecología y Obstetricia (FIGO) propuso una clasificación de los trastornos causantes del SUA en pacientes no gestantes, con el objetivo de armonizar las definiciones de los síntomas de hemorragia normal y anormal y clasificar las posibles causas subyacentes de la hemorragia para facilitar la investigación, la educación y la atención clínica2.
Este esquema se conoce como PALM-COEIN, en el que cada letra indica una de las etiologías de la hemorragia. Las causas estructurales incluyen: pólipo uterino [P], adenomiosis [A], leiomioma [L], lesiones precursoras y malignas del cuerpo uterino [M]; y las causas no estructurales incluyen: coagulopatías [C], disfunción ovulatoria [O], disfunción endometrial [E], iatrogénica [I] y no clasificado [N]1.
La embolización de arterias uterinas (EAU) fue descrita por primera vez en 19953 como tratamiento alternativo seguro y eficaz del sangrado uterino en el leiomioma uterino. Desde entonces, las aplicaciones de la EAU en el tratamiento de las hemorragias ginecológicas han sido estudiadas como una alternativa mínimamente invasiva a la cirugía y sus indicaciones han ido aumentando. El objetivo de este manuscrito es revisar el papel de las técnicas de radiología vascular intervencionista en el manejo del SUA.
Técnicas de imagen y papel de la radiología vascular e intervencionista en el SUAEl estudio de una paciente con SUA comienza con una historia clínica completa, revisión ginecológica, examen de laboratorio y puede incluir pruebas de imagen para evaluar alteraciones estructurales4. En 2016, Taslakian et al. describieron un abordaje sistemático para la atención del paciente previo al procedimiento intervencionista, destacando la necesidad de un enfoque multidisciplinar5.
PóliposDiagnósticoEn ecografía transvaginal, los pólipos endometriales aparecen como una masa ecogénica con áreas quísticas o engrosamiento endometrial inespecífico que pueden confundirse con miomas submucosos. La aplicación de color-Doppler aumenta la sensibilidad y típicamente muestran un pedículo vascular único6. Aunque los pólipos endometriales son relativamente comunes y mayoritariamente asintomáticos, pueden estar acompañados de SUA, siendo la presentación clínica más frecuente7.
Manejo endovascularHasta el 30% de los pólipos pueden remitir espontáneamente. Las indicaciones de tratamiento de los pólipos endometriales incluyen pacientes sintomáticas; pólipos con alto riesgo de malignidad y aunque todavía es controvertido el efecto de la polipectomía sobre la fertilidad, se puede ofrecer en pacientes infértiles8. El tratamiento es quirúrgico, con diferentes modalidades, no estando recogido el manejo endovascular en las diferentes guías8,9. La evidencia es limitada, existen publicados en la literatura casos aislados de embolización de arterias uterinas en casos de pólipos placentarios hipervasculares para minimizar el sangrado de la polipectomía y preservar la fertilidad10–12.
AdenomiosisDiagnósticoLa adenomiosis se define como la invasión benigna del endometrio en el miometrio13. La ecografía transvaginal es la modalidad de imagen inicial para el diagnóstico. Se han reportado unas tasas de sensibilidad y especificidad de la ecografía transvaginal para el diagnóstico de adenomiosis del 53-89% y 67-98%, respectivamente14. Algunas de las características ecográficas consideradas actualmente como típicas en la adenomiosis son: el engrosamiento miometral asimétrico, la presencia de quistes, focos hiperecogénicos, sombras, líneas subendometriales hiperecogénicas, aumento de la vascularización intralesional e irregularidad o discontinuidad de la zona de unión. En la práctica clínica y en la investigación, el informe estandarizado de los hallazgos ecográficos, con respecto al miometrio es esencial para reducir la variabilidad intra e interobservador, evaluar el efecto del tratamiento médico o quirúrgico y para comparar las imágenes ecográficas con otras técnicas de imagen15.
La resonancia magnética (RM) es también un método no invasivo para el diagnóstico de la adenomiosis. Se ha reportado una tasa de sensibilidad de entre 78-88% y de especificidad de entre 67-93%, con el valor añadido de determinar la localización y la extensión de la enfermedad, monitorizar de forma más objetiva el seguimiento e identificar lesiones uterinas adicionales14.
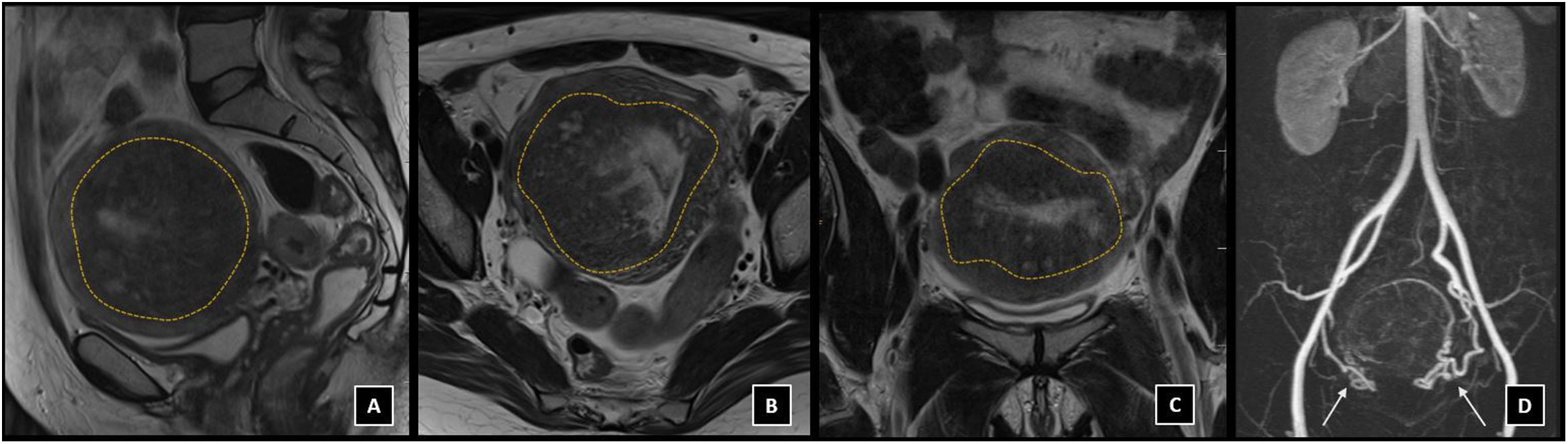
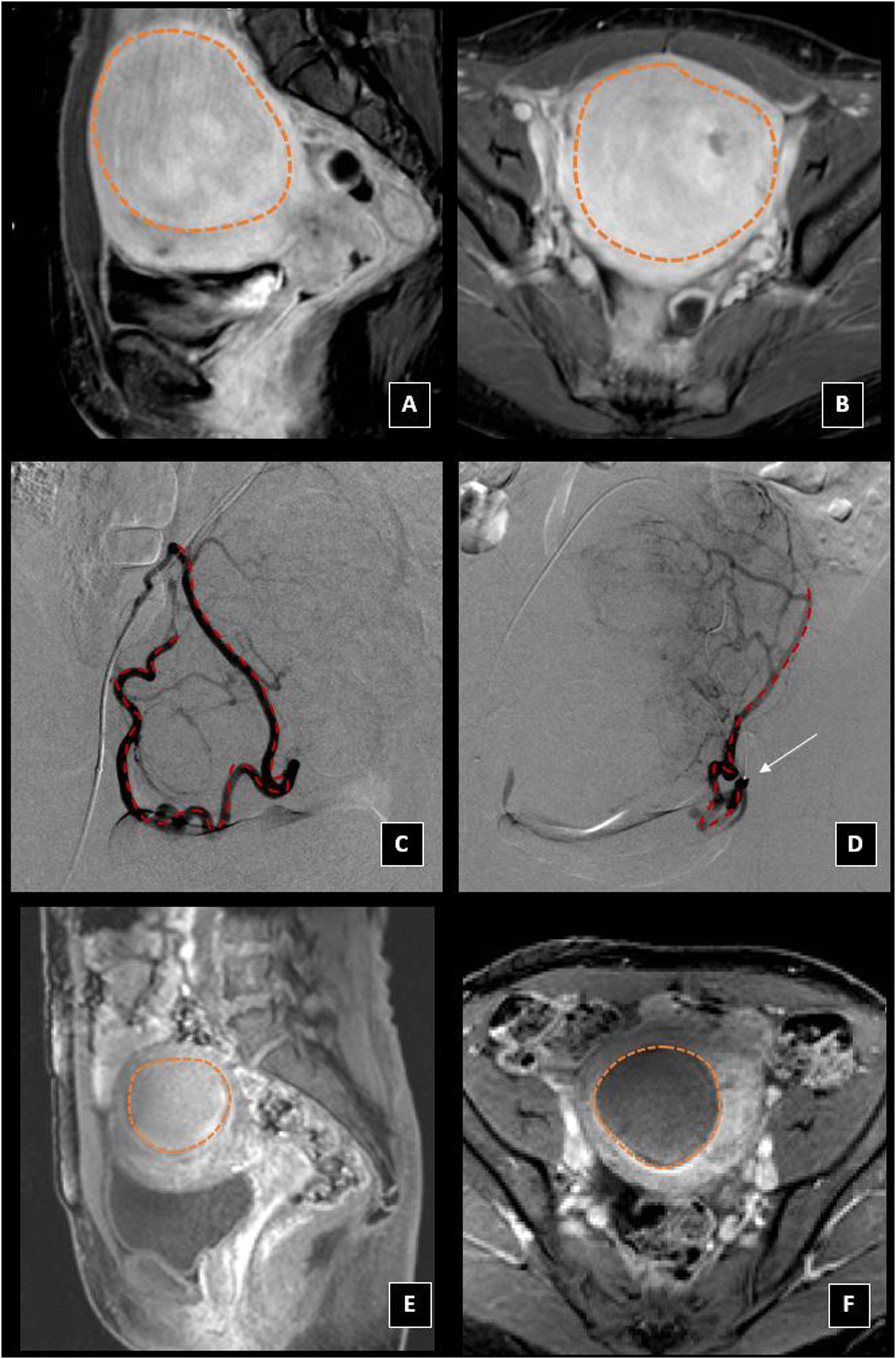
La adenomiosis frecuentemente se localiza en el fundus uterino y de forma predominante en la pared posterior. El aspecto típico por RM es un útero aumentado de tamaño y asimétrico, con un aumento difuso o global del grosor de la zona de unión, que se encuentra mal delimitada y muestra baja intensidad en T216. El hallazgo más frecuente para el diagnóstico de adenomiosis es el engrosamiento de la zona de unión, siendo un grosor superior a 12 mm altamente predictivo del diagnóstico16 (fig. 1).
Adenomiosis. RM de pelvis en secuencia potenciada en T2, cortes sagital (A), axial (B) y coronal (C), donde se observa útero aumentado de tamaño, con un aumento difuso del grosor de la zona de unión (líneas discontinuas) subendometrial, que se encuentra mal delimitada y muestra baja intensidad en T2, compatible con adenomiosis. D) angio-RM donde se aprecia hipertrofia de arterias uterinas de forma bilateral (flechas).
Para el tratamiento de la adenomiosis deben tenerse en cuenta factores como la edad, gravedad de los síntomas, el deseo gestacional y la presencia de comorbilidades asociadas. La elección del tratamiento es individualizado, siendo la histerectomía el tratamiento definitivo. La EAU podría indicarse en pacientes sintomáticas, en las que ha fallado el tratamiento conservador médico y desean evitar la cirugía o en aquellas con alto riesgo quirúrgico.
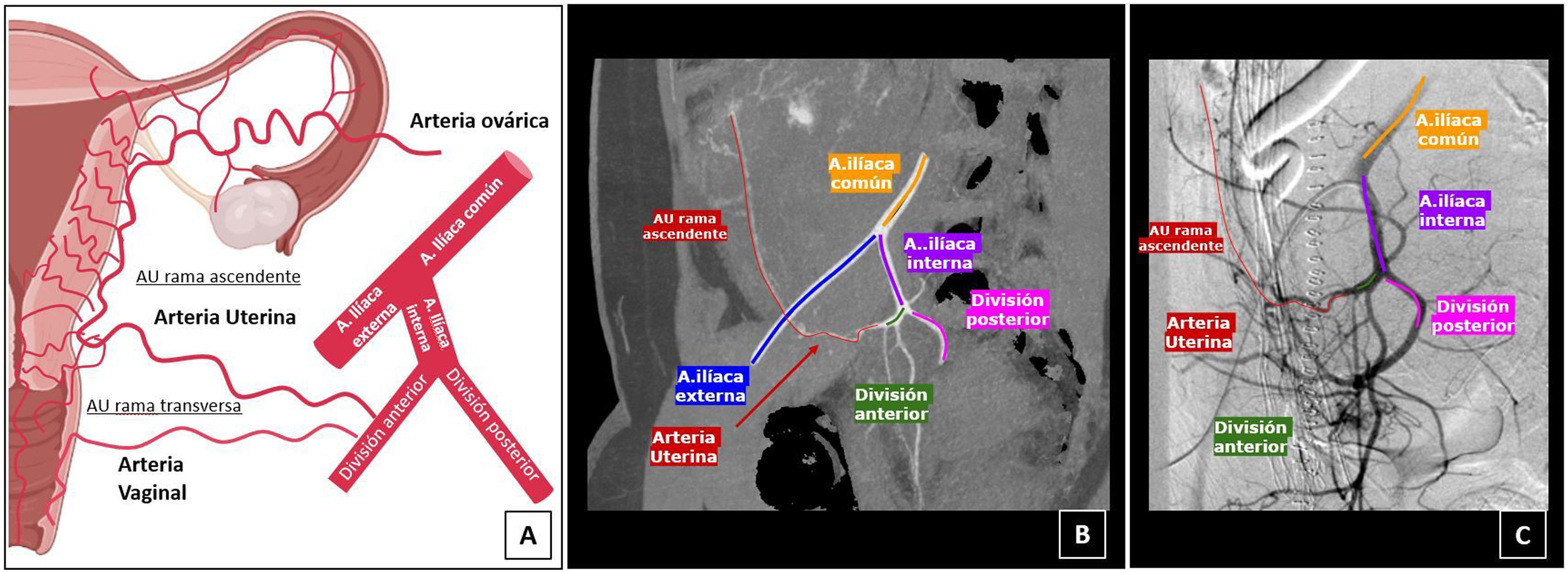
Procedimiento EAUEl conocimiento de la anatomía vascular de la pelvis femenina y sus anastomosis es fundamental para evitar complicaciones (fig. 2). El procedimiento se puede realizar bajo sedación consciente. El acceso arterial se consigue a través de la punción de la arteria femoral común o arteria radial, utilizando un introductor de 4-6 French (Fr) para el acceso femoral y de 4-5 Fr para el acceso radial. Bajo fluoroscopia se realiza una aortografía y arteriografías selectivas con catéteres de 4-5 Fr de las arterias iliacas internas y arteriografías superselectivas con microcatéteres de 2-3 Fr para la arteria uterina (AU) y sus ramas. La embolización de la AU se realiza de forma bilateral, para el SUA con agentes permanentes, generalmente con partículas. Fundamental identificar las ramas cervicovaginales y las conexiones con la arteria ovárica para evitar complicaciones. La embolización selectiva reduce el riesgo de necrosis vaginal y el reflujo no deseado de partículas hacia la arteria ovárica17 (fig. 3).
Anatomía. A) Diagrama anatomía arteria uterina (AU). Adaptado de «Female Reproductive system anatomy», por BioRender.com (2022). Obtenido de https://app.biorender.com/biorender-templates. La arteria iliaca interna (AII) se divide en una división posterior y una anterior. La AU se origina de la división anterior y se divide en una rama ascendente, y otra rama transversa. Rama ascendente: morfología en U, con una trayectoria a lo largo del útero y las trompas de Falopio, de la que se originan múltiples ramas cortas intramurales y distalmente con conexiones con la arteria ovárica (originada directamente de la aorta abdominal) y la arteria del ligamento redondo (originada de la arteria epigástrica inferior, rama de la arteria iliaca externa). Rama transversa: origina las ramas cervicovaginales que suplen el cuello uterino y la vagina. La vagina recibe irrigación por múltiples ramas, formando una compleja red arterial en la que intervienen: la arteria vaginal, la arteria vesical inferior, la arteria pudenda interna y la arteria rectal media. Hay que tener en cuenta todas estos aportes y anastomosis para evitar complicaciones en la embolización. B) Representación de la anatomía de la AU por Angio-TC y C) por arteriografía.
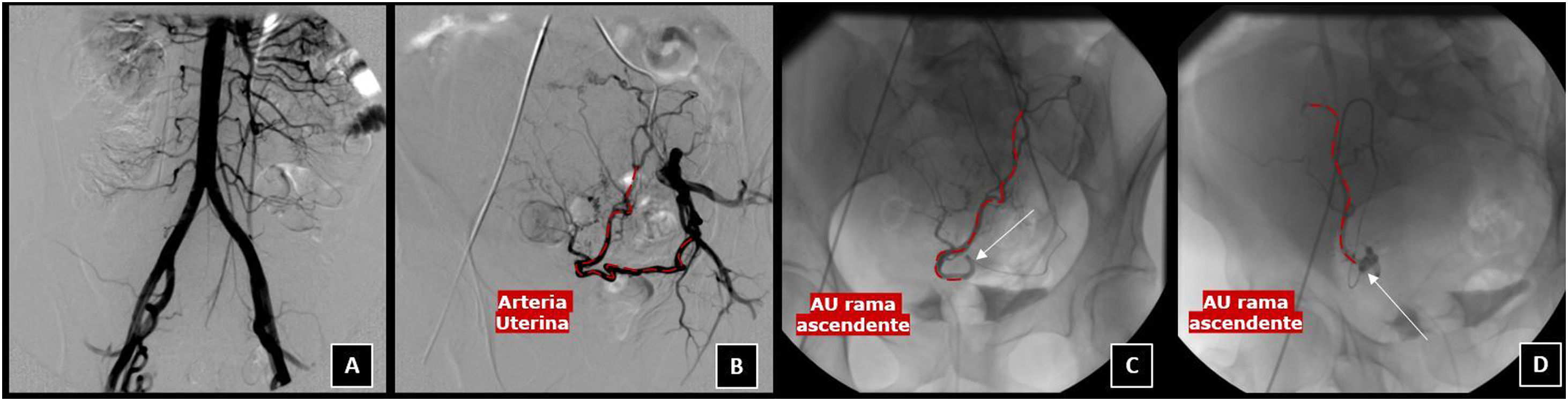
Procedimiento EAU bilateral en paciente con leiomiomas uterinos sintomáticos. A) Aortografía inicial a través acceso arterial femoral derecho para planificación vascular. B) Arteriografía selectiva desde la division anterior de la arteria ilíaca interna izquierda, donde se identifica AU hipertrófica (línea discontínua roja). C) Arteriografía superselectiva con microcatéter (flecha señalando la punta del microcatéter), donde se observa la rama ascendente de AU (línea discontínua roja), desde donde se llevó a cabo la embolización con partículas. D) Arteriografía superselectiva (flecha señalando la punta del microcatéter) desde rama ascendente de AU derecha desde donde se completó la embolización.
En la literatura existe una gran variedad de agentes embolizantes utilizados para la EAU en adenomiosis (partículas de alcohol polivinílico [PVA], microesferas de gelatina de trisacrilo [TGM], microesferas de alginato de sodio [KMG] y espuma de gelatina [GFP]), siendo las partículas de PVA el agente más utilizado. En cuanto al tamaño de las partículas utilizadas, existe también una gran variabilidad, habiéndose reportado tamaños de partículas que van desde 200 a 900 μm en las diferentes series18. Dicha variabilidad en la técnica dificulta su comparación y hace que no haya suficiente evidencia para proporcionar una recomendación en cuanto a cuál es el mejor agente embolizante19.
DiscusiónLa EAU fue descrita por primera vez en 19953 y desde entonces, basándose en los resultados positivos obtenidos como tratamiento de los leiomiomas uterinos, este procedimiento se ha investigado como posible herramienta terapéutica para tratar la adenomiosis.
En el año 2011, el grupo de Popovic19 publicó una revisión sobre el tratamiento de la adenomiosis con EAU, que incluyó todos los estudios relevantes desde 1999 hasta 2010. Observaron una mejoría de los síntomas a corto plazo en pacientes con adenomiosis pura o combinada con leiomiomas del 83,3 y 92,9%, respectivamente, y una mejoría de los síntomas a largo plazo del 64,5% en los casos con adenomiosis pura y del 82,4% en los casos combinados con leiomiomas.
Más recientemente, en 2017 el equipo de de Brujin llevó a cabo una revisión sistemática con metaanálisis de la EAU en el tratamiento de la adenomiosis, incluyendo un total de 30 estudios, con más de 1.000 pacientes. El objetivo primario fue evaluar la mejoría de los síntomas tras la EAU, para ello se analizaron cuatro grupos: adenomiosis pura a corto plazo (< 12 meses), adenomiosis combinada con leiomiomas a corto plazo (< 12 meses), adenomiosis pura a largo plazo (> 12 meses) y adenomiosis combinada con leiomiomas a largo plazo (> 12 meses). El objetivo secundario fue evaluar la evolución en los controles radiológicos tras la EAU18.
Se observó una mejoría en la sintomatología a corto plazo (< 12 meses) tanto en el grupo de adenomiosis pura del 89,6% como en el grupo de adenomiosis combinada del 94,3. La mejoría clínica a largo plazo (> 12 meses) fue del 74% en el grupo adenomiosis pura y del 85,4% la combinada. Un 14,2% de las pacientes se sometieron a histerectomía a largo plazo (> 12 meses), comparado con un 4% a corto plazo (< 12 meses).
En cuanto a la reducción del volumen uterino, la reducción media del volumen uterino a los tres meses fue significativamente mayor en el grupo de adenomiosis pura que en el grupo combinado (p < 0,01). El infarto tras la EAU se describió en siete estudios con tasas de entre el 44,2 al 82,5% y seis estudios describieron una reducción de la zona de transición del 13,7 al 38%.
De acuerdo con los resultados obtenidos concluyeron que la EAU tiene resultados favorables a corto y largo plazo, tanto si se aplica en la adenomiosis pura como en la combinada, pudiendo ser una alternativa al tratamiento quirúrgico, aunque destacan la necesidad de ensayos controlados y randomizados para alcanzar conclusiones clínicas sólidas respecto al tratamiento.
El ensayo controlado aleatorizado y multicéntrico actualmente en desarrollo Quality of life after Embolization vs Hysterectomy in Adenomyosis (QUESTA) tiene el objetivo de evaluar el impacto de la EAU en la calidad de vida en comparación con la histerectomía en pacientes con adenomiosis sintomática y espera proporcionar mayor evidencia para el uso de la EAU como opción de tratamiento en la adenomiosis20.
LeiomiomasDiagnósticoSegún diferentes series hasta un 20-30% de mujeres en edad reproductiva puede presentar leiomiomas uterinos que tienden a regresar después de la menopausia. La gran mayoría de los casos son asintomáticos, por lo que la prevalencia real es desconocida, pero podría alcanzar hasta un 70%. En los casos sintomáticos el sangrado uterino anormal es la presentación clínica más frecuente, seguido de clínica de presión pélvica, dolor y dificultad para la concepción21.
La evaluación inicial por imagen se realiza mediante ecografía transvaginal con una alta sensibilidad (95-100%), aunque en úteros mayores o polimiomatosos puede estar limitada. Por ecografía, los leiomiomas típicos se visualizan como lesiones redondeadas bien definidas dentro del miometro o adheridas a él, mostrando a menudo sombras en los bordes de la lesión y/o sombras internas. La ecogenicidad es variable y puede haber hiperecogenicidad interna. En el estudio de eco Doppler es a menudo visible el aumento de flujo circunferencial alrededor de la lesión15.
Mediante histeroscopia es posible evaluar el componente submucoso intracavitario y esta técnica también ofrece una potencial vía de tratamiento. La RM por su alta resolución espacial es la mejor técnica para valorar tamaño y localización de las lesiones, así como evaluar su relación con el miometrio. Asimismo, ofrece la posibilidad de diferenciar de otro tipo de lesiones uterinas benignas o malignas o lesiones anexiales22.
Manejo endovascularIndicacionesSegún las guías de buena práctica clínica de Cardiovascular and Interventional Radiological Society of Europe (CIRSE), la EAU está indicada en los leiomiomas uterinos sintomáticos que alteran el estilo de vida de la paciente, en concreto hemorragias menstruales abundantes, dismenorrea grave o anemia. La EAU también está indicada en leiomiomas que condicionan molestias mecánicas como dolor, presión, dispareunia, urgencia y frecuencia urinaria23. A toda paciente sintomática con leiomiomas que precise tratamiento, se le debería ofrecer la EAU como tratamiento alternativo a la histerectomía/miomectomía (fig. 4).
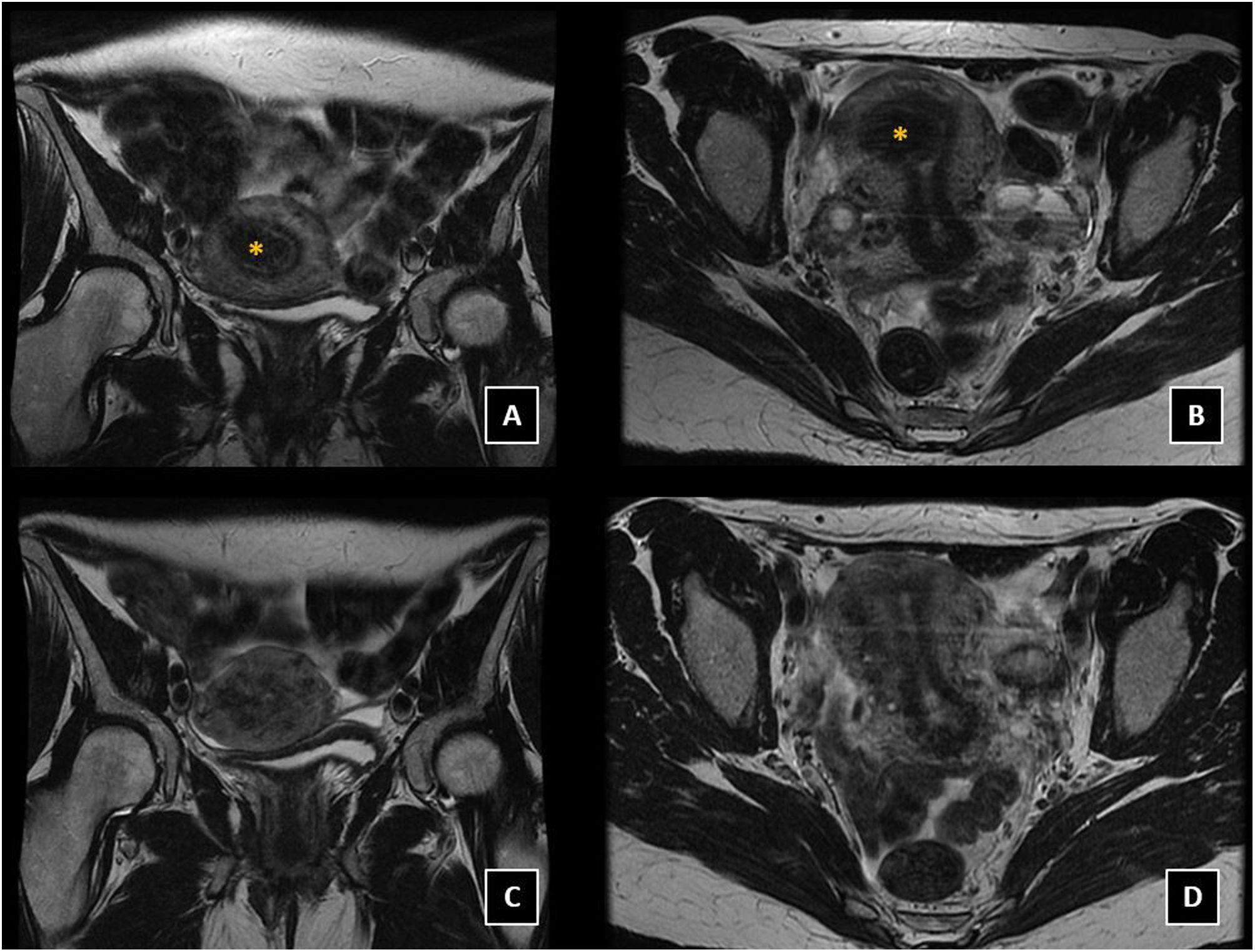
Leiomioma subseroso. A-B) RM de pelvis previa a la embolización. Secuencias potenciadas en T2, cortes coronal (A) y axial (B) donde se observa lesión nodular hipointensa en fundus uterino (asteriscos), en relación con leiomioma subseroso. Mismas secuencias y cortes coronal (C) y axial (D) RM de pelvis control 12 meses después de EAU bilateral con partículas, donde se observa resolución del leiomioma subseroso descrito en RM previa al procedimiento.
El procedimiento de EAU para el tratamiento del leiomioma es el mismo detallado en el apartado de adenomiosis. Se ha descrito el uso de diferentes agentes para la embolización y distintos tamaños de partículas. La naturaleza de cada material explica las diferencias en el efecto de la embolización sobre el leiomioma, lo que ha dado lugar a un debate sobre qué agente embólico es el más eficaz para la EAU24.
Existen algunas series en la literatura que comparan los agentes embólicos utilizados en la EAU, sin pruebas de superioridad de ninguno de los agentes. En 2013, el grupo de Raj Das desarrolló una revisión sistemática y metaanálisis en el que compararon los diferentes agentes embolizantes para la EAU, sin encontrar evidencia de superioridad de ningún agente embolizante. Aunque hubo una tendencia a mayor reducción del tamaño uterino y del leiomioma predominante al utilizar microesferas de TGM, comparado con partículas esféricas de PVA, las diferencias no fueron estadísticamente significativas25.
Posteriormente, la revisión sistemática llevada a cabo por el grupo de Jiang comparó el uso de PVA y TGM para la EAU en el tratamiento de leiomiomas sintomáticos. Incluyeron un total de seis estudios aleatorizados con un total de 351 mujeres con leiomiomas. En los estudios incluidos, se utilizó partículas de TGM de 500-700 μm o partículas de PVA de entre 355-900 μm. En comparación con PVA, TGM mostró un beneficio significativo en la mejoría de calidad de vida, la reducción del volumen uterino a los tres y seis meses y la gravedad de los síntomas a los seis y 12 meses26.
Es importante tener en cuenta que la EAU puede causar dolor importante tras el procedimiento, probablemente debido a los cambios isquémicos en los leiomiomas y en el miometrio adyacente. Hay que tener en cuenta que el dolor suele comenzar después de la EAU y es más intenso durante las primeras 24 h después del procedimiento23. El síndrome postembolización se define como aparición de dolor pélvico, fiebre, náuseas, vómitos, pérdida de apetito y/o malestar general en los primeros días después de la EAU. Es un aspecto esperado del procedimiento, con un grado de intensidad variable y probablemente sea el resultado de la liberación de citoquinas relacionadas con la isquemia del leiomioma. No debe considerarse una complicación de la EAU, a menos que requiera un tratamiento médico no planificado o una hospitalización prolongada27.
DiscusiónDurante la última década, la EAU se ha estudiado como tratamiento mínimamente invasivo alternativo a la cirugía para reducir los síntomas del SUA causado por leiomiomas y se han desarrollado varios estudios controlados aleatorizados en los que se compara los efectos de la EAU y la cirugía. Los resultados del ensayo «The Ontario Uterine Fibroid Embolization Trial», un registro multicéntrico y prospectivo, demostraron una mediana de reducción del volumen medio del útero y de los leiomiomas dominantes del 35 y el 42%, respectivamente. Además observaron mejoría clínica significativa en las pacientes con sangrado uterino (83%), dismenorrea (77%) y frecuencia urinaria (86%) a los tres meses del procedimiento28.
El metaanálisis realizado en 2012 por el grupo de Gupta en el que incluyeron seis estudios controlados aleatorizados con un total de 732 pacientes para evaluar los riesgos y beneficios de la EAU vs. otros tratamientos médicos o quirúrgicos. Observaron que la EAU mostró menor pérdida sanguínea durante el procedimiento, una estancia hospitalaria más corta y una reincorporación más rápida. La EAU se asoció con más reingresos no programados tras el alta, la mayoría relacionadas con dolor y fiebre, probablemente asociados a síndrome postembolización. Al analizar en este metaanálisis la calidad de vida a los 12 y 24 meses después del procedimiento entre el grupo de EAU y subgrupo miomectomía, no encontraron diferencias significativas29.
Más recientemente, en 2021, el grupo de Haijun Gao desarrolló un metaanálisis para revisar y comparar la seguridad y eficacia entre la EAU, la cirugía y el ultrasonido focalizado de alta intensidad (HIFU) en el tratamiento de los leiomiomas uterinos30. Incluyeron un total de 11 estudios con 3.646 pacientes. La incidencia de complicaciones graves de los pacientes del grupo de EAU y del grupo de HIFU fue menor que la de los pacientes del grupo de cirugía en el plazo de un año tras el tratamiento. Al igual que en el metaanálisis expuesto anteriormente, observaron que la tasa de reintervenciones en el grupo de EAU y HIFU fue mayor que en el grupo de pacientes sometidos a cirugía (p < 0,05). Además, concluyeron que los pacientes de EAU e HIFU tuvieron una mayor mejora de la calidad de vida (seguimiento de un año), mayor en la EAU (p < 0,05).
Los resultados en cuanto a la mejora en la calidad de vida en los estudios encabezados por Haijun Gao y Gupta son discordantes con los obtenidos en el estudio prospectivo, aleatorizado multicéntrico FEMME31. En él se evaluó la calidad de vida en pacientes con leiomiomas sintomáticos tras el tratamiento con EAU o con miomectomía. Observaron que la magnitud de mejora en la puntuación del score de calidad de vida a los dos años después del tratamiento fue mejor en el grupo de miomectomía que en el de EAU. Hay que destacar que en el metaanálisis del grupo de Gupta29 solo uno de los estudios incluidos (prospectivo aleatorizado32) comparaba EAU y miomectomía y que en 26% de las pacientes que se sometieron a EAU con leiomiomas de > 5 cm a los seis meses, se les practicó además miomectomía. Por otra parte, en el del grupo de Haijun Gao30 el grupo de cirugía estaba compuesto por pacientes sometidas a histerectomía o miomectomía, conjuntamente. Son necesarios estudios controlados y randomizados para evaluar el impacto de las diferentes opciones terapéuticas sobre la calidad de vida de las pacientes con leiomioma.
Existe incertidumbre sobre la durabilidad del alivio de los síntomas con la EAU, en general, hay una incidencia del 20-25% de recurrencia de los síntomas entre cinco y siete años después de la EAU, aunque las pacientes explican seguir teniendo scores altos de calidad de vida33.
Identificar qué pacientes tendrán mejores resultados clínicos tras la EAU es difícil. En cuanto al tamaño del leiomioma, la EAU ha sido utilizada tradicionalmente para tratar leiomiomas de tamaño relativamente pequeño, habiéndose descrito casos con complicaciones en miomas más grandes (> 8 cm). Sin embargo, estudios recientes no mostraron diferencias clínicas ni tasas de complicaciones diferentes tras la EAU de miomas grandes (> 10 cm) en un total de 100 pacientes23 (fig. 5).
Leiomioma. A-B) RM de pelvis previa a la embolización. Secuencias T1 con saturación grasa después de la administración de contraste, cortes sagital (A) y axial (B) donde se observa voluminosa (> 10 cm) lesión nodular hipercaptante en fundus uterino (línea discontinua), en relación con leiomioma mural. C) Arteriografía selectiva de la AU derecha (flecha discontinua roja). D) Arteriografía superselectiva con microcatéter (flecha señalando punta del microcatéter) de la AU izquierda (línea discontinua roja) por abordaje femoral derecho. E-F) RM de pelvis control 12 meses después de EAU bilateral con partículas. Mismas secuencias (T1 saturación grasa tras contraste) cortes sagital (E) y axial (F), donde se observa disminución del tamaño e hipocaptación por necrosis del leiomioma mural (línea discontínua).
La presencia de leiomiomas subserosos pedunculados (definidos como aquellos con un diámetro del pedículo mayor al 50% del diámetro mayor del leiomioma), se ha considerado una contraindicación potencial para la EAU, basándose en el primer caso descrito en el que se produjo una necrosis del pedículo del leiomioma, con su desprendimiento en pelvis que requirió histerectomía34.
Varios estudios recientes han abordado específicamente los resultados clínicos tras la EAU en pacientes con leiomiomas pedunculados. En 2018, el equipo de Kim evaluó la seguridad y eficacia de la EAU en leiomiomas subserosos pedunculados35. No encontraron complicaciones (0%) relacionadas con la EAU en leiomiomas subserosos pedunculados en una mediana de seguimiento de 96 días. Además, no hubo diferencias estadísticamente significativas entre las reducciones del volumen medio entre los leiomiomas subserosos pedunculados y los no pedunculados dominantes (reducción del volumen de 38,2% en los subserosos pedunculados y del 38,4% en los no pedunculados, p = 0,953). Por tanto, la mayor incidencia de complicaciones inicialmente descrita de la EAU en los leiomiomas subserosos no se ha confirmado, por ello, este tipo de leiomiomas no debe considerarse una contraindicación para la EAU27.
Lesiones malignas, iatrogenia, no clasificadoLesiones malignasLa hiperplasia de endometrio con o sin atipias con potencial progresión a neoplasia maligna y el cáncer endometrial son causas infrecuentes de SUA36.
Existen otros tumores malignos a tener en cuenta que raramente causan SUA: cáncer de cérvix sarcoma uterino, rabdomiosarcoma, tumores malignos de ovario y tumores de vulva y vagina.
Ante la sospecha clínica de hiperplasia o carcinoma endometrial (SUA y un grosor miometrial ecográfico > 4 mm en posmenopausia), el diagnóstico se establece mediante histeroscopia y biopsia endometrial.
Lesiones iatrogénicasVarios tratamientos o dispositivos médicos pueden causar o contribuir al SUA, incluyendo dispositivos intrauterinos, agentes farmacológicos que afectan directamente al endometrio o interfieren con los mecanismos de coagulación o influyan en el control sistémico de la ovulación2.
Lesiones no clasificadasExisten varias entidades que pueden contribuir o causar SUA (trauma, endometritis crónica, malformaciones arteriovenosas [MAV], hipertrofia miometrial), sin embargo, dichas condiciones todavía no se han definido claramente ni se han examinado de forma adecuada. Estas entidades (y futuras entidades aun no identificadas) engloban la categoría denominada «todavía no clasificada»2.
Manejo endovascularGeneralmente las lesiones malignas se tratan quirúrgicamente o mediante radioterapia. En ocasiones, en enfermedades en estado avanzado, la hemorragia puede ser difícil de controlar quirúrgicamente o con medidas conservadoras, en estos casos, podría estar indicada la embolización con agentes permanentes con fines paliativos37 (fig. 6).
Carcinoma cérvix estadio IV. A-B) RM de pelvis en paciente con carcinoma de cérvix estadío IV. Secuencias potenciadas en T2 axial (A) y sagital (B), donde se observa masa cervical (cuadrado). La paciente acude a urgencias por metrorragia y anemización. C-D-E) Se realiza angio-TC urgente donde se observa masa necrótica con foco de extravasación de contraste en las sucesivas fases del angio-TC (círculos) fases: C) sin contraste, D) arterial y E) portal, compatible con sangrado activo en lecho tumoral (círculo). F) Arteriografía de arteria iliaca interna derecha por abordaje femoral derecho, donde se confirma foco de sangrado activo (flecha).
Las MAV uterinas y las fístulas arteriovenosas (FAV) pueden ser congénitas o adquiridas; las adquiridas suelen ser postinstrumentación o traumáticas, al igual que los pseudoaneurismas, normalmente secundarios a iatrogenia o a infiltración por lesiones malignas. Tanto los pseudoaneurismas como las MAV y FAV pueden causar SUA y pueden tratarse con éxito utilizando la embolización38, la planificación del tratamiento endovascular en estos casos será individualizada, con embolizaciones selectivas en la mayoría de ocasiones.
Otra opción descrita en la literatura para el manejo mínimamente invasivo de los pseudoaneurismas de AU es la inyección ecoguiada de trombina por acceso transvaginal39.
Contraindicaciones y complicacionesLas contraindicaciones absolutas incluyen embarazo, infección activa y la presencia de lesiones malignas uterinas u ováricas, a menos que el procedimiento se realice con fines paliativos o como complemento de la cirugía. Las contraindicaciones relativas incluyen la coagulopatía, alergia al contraste yodado y función renal alterada23. Algunas guías además aconsejan contraindicar la EAU en pacientes con irrigación común entre la arteria uterina y la arteria ovárica38.
Las tasas de complicación de la EAU son bajas, ocurriendo complicaciones mayores en el 3% de los casos. Más común es el reingreso posterior al procedimiento para el control del dolor. La amenorrea puede producirse hasta en un 10% de las pacientes después de la EAU, siendo más frecuente en pacientes de > 45 años40.
Fertilidad y embarazo tras la EAULa fertilidad después de la EAU sigue siendo un área de controversia, el impacto sobre la fertilidad futura y el parto sigue siendo incierto. Varios estudios han obtenido resultados dispares sobre la fertilidad tras la EAU.
Un metaanálisis reciente41 en el que se evalúo el embarazo y sus efectos en pacientes después de la EAU, concluyó que es posible un embarazo seguro después de la EAU, comparable con las tasas tras miomectomía. Las complicaciones obstétricas (aborto, parto prematuro y bajo peso al nacer) son similares a las de la población general. Por otra parte, el aborto es mayor en comparación con la población general, lo que podría deberse a la mayor edad de las pacientes que se sometieron a la EAU. La evidencia que sugiera que la miomectomía pueda estar asociada con mejores tasas de fertilidad que la EAU es baja, y es necesaria una investigación más exhaustiva.
Una reciente revisión sistemática y metaanálisis realizada por el grupo de El Shamy en 2021, investigó el efecto de la EAU en la reserva ovárica en 353 mujeres, determinando los niveles de hormona antimulleriana sérica. La revisión concluyó que la EAU no parece tener efectos perjudiciales sobre la reserva ovárica42.
Debido a los hallazgos contradictorios, el tratamiento debe ser personalizado, explorando el deseo gestacional de cada paciente. En pacientes sin intervenciones previas, con leiomiomas resecables y con deseo gestacional, la miomectomía puede ser preferible. Sin embargo, dada la escasa evidencia que favorece la miomectomía sobre la tasa de fertilidad, debe respetarse la preferencia de la paciente, siempre que esté bien informada. En pacientes no candidatas a cirugía, casos de leiomiomas no resecables, pacientes que se han sometido a varias miomectomías o por preferencia personal, la EAU es una opción aceptable27.
ConclusionesLa EAU es una alternativa a la histerectomía en el tratamiento del SUA. En comparación a la histerectomía, a corto plazo, la EAU presenta menor pérdida de sangre, estancias hospitalarias más cortas y reincorporación más rápida a las actividades diarias. A toda paciente sintomática con diagnóstico de leiomioma uterino se le debería ofrecer la EAU como tratamiento alternativo a la cirugía. La EAU debería incorporarse como alternativa en las guías ginecológicas23.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.