Editado por: Meritxell Gracia
Última actualización: Enero 2023
Más datosEl Patient Blood Management (PBM) es un enfoque centrado en el paciente, sistemático y basado en la evidencia, destinado a mejorar los resultados de las pacientes mediante el manejo y la preservación de la propia sangre. Consta de tres pilares clásicos que se llevan a cabo de forma multidisciplinar y multimodal: optimización de la masa eritrocitaria, reducción de la hemorragia y mejoría de la tolerancia a la anemia. La optimización de la masa eritrocitaria incluye el diagnóstico precoz de la anemia y su tratamiento con hierro (oral o intravenoso), siendo el déficit de hierro la causa más frecuente de anemia en el contexto de sangrado uterino anómalo (SUA). La reducción de la hemorragia incluye estrategias destinadas a tratar la causa del SUA, sea de forma quirúrgica, médica o ambas. La mejoría en la tolerancia a la anemia incluye el umbral de transfusión restrictivo en pacientes sin hemorragia activa, administrando el mínimo número de unidades de hematíes para paliar los síntomas (Single Unit Transfusion).
En el presente texto se realiza una revisión de la evolución y de la situación actual del PBM en sus tres pilares, centrándose en los aspectos concretos más directamente aplicables al sangrado uterino anómalo.
Patient Blood Management (PBM) is a systematic, evidence-based, patient-centred approach aimed at improving patient outcomes through the management and preservation of their own blood. It consists of three classic pillars performed in a multidisciplinary and multimodal way: optimization of erythrocyte mass, reduction of haemorrhage, and improvement of tolerance to anaemia. Optimization of erythrocyte mass includes the early diagnosis of anaemia and its treatment with iron (oral or intravenous), with iron deficiency being the most frequent cause of anaemia in the context of abnormal uterine bleeding (AUB). Bleeding reduction includes strategies aimed at treating the cause of AUB either surgically, medically, or both. The improvement in tolerance to anaemia includes the restrictive transfusion threshold in patients without active bleeding, administering the minimum number of red blood cell units to alleviate symptoms (single unit transfusion).
This text reviews the evolution and current situation of the three pillars of PBM, focusing on the specific aspects most directly applicable to abnormal uterine bleeding.
Las bases del Patient Blood Management (PBM) existen desde hace ya muchos años. Antes del advenimiento de la transfusión de sangre alogénica los médicos ya utilizaban diversas estrategias para intentar preservar la propia sangre del paciente tratando la anemia y poniendo especial atención en la prevención y la detención del sangrado1. Cuando la transfusión no era una opción, la anemia debía ser prevenida. Con el inicio de las transfusiones a principios del sigloxx se pasó al otro extremo, considerándolas un tratamiento fácil, rápido y eficaz para la anemia y el sangrado y desbancando las anteriores estrategias, que llegaron a ser consideradas como obsoletas2. En los años sesenta el cirujano cardiovascular Dr. Denton Cooley inició la que luego sería conocida como «cirugía sin sangre» para acomodarse a la petición de los pacientes Testigos de Jehová. Cooley et al. adoptaron así un manejo en 3 pasos que son los que posteriormente han ido evolucionando hasta convertirse en los 3 pilares del PBM: optimización de la masa roja eritrocitaria prequirúrgica; utilización de técnicas quirúrgicas, anestésicas y farmacológicas para minimizar la pérdida de sangre, y tolerancia a la anemia postoperatoria3,4. Esta modalidad de medicina y cirugía sin sangre basada en gran parte en las preferencias del paciente se fue expandiendo rápidamente y diversos estudios confirmaron que los resultados eran equivalentes o incluso mejores que en los pacientes transfundidos5-7. La evidencia empezó a demostrar que la transfusión alogénica per se es un factor de riesgo independiente y dosis-dependiente relacionado con un aumento de la morbimortalidad y de la estancia hospitalaria8.
La Organización Mundial de la Salud (OMS), en su Resolución de la Asamblea WHA63.12, incluye el PBM como un objetivo estratégico para optimizar la práctica clínica de la transfusión en un marco de acción para avanzar el acceso universal a productos sanguíneos seguros, efectivos y de garantía de calidad 2020-20239. La comisión europea también ha publicado documentos para ayudar en la implementación del PBM en los hospitales10 y también a las autoridades sanitarias11. Además, otras publicaciones científicas nos ayudan a analizar y a elaborar los pasos a seguir para su implementación12.
La medicina actual debe ir encaminada a la integración de la medicina basada en la evidencia y la experiencia clínica, teniendo además en cuenta las preferencias y los valores del paciente. A pesar de que la transfusión es un tratamiento adecuado y efectivo para el manejo del sangrado agudo potencialmente mortal, nuestros esfuerzos deben ir destinados a identificar preventivamente los riesgos de pérdida de sangre e implementar estrategias preventivas para reducir este riesgo. Para ello, debemos aplicar los principios de buena medicina clínica, que incluyen el diagnóstico, las consideraciones terapéuticas específicas para cada paciente en función del diagnóstico, con el compromiso del paciente, la toma de decisiones compartida, el consentimiento informado y el seguimiento13.
Entendiendo el dinamismo del PBM a lo largo de la historia podemos entender también el dinamismo en su definición y aplicación. A pesar de que los principios del PBM están en la actualidad ampliamente extendidos, no existe aún una definición clara y unificada del mismo, y ello puede afectar a la implementación del PBM en diversos escenarios clínicos. La definición de un concepto es importante, ya que hace que todos los que aplicamos y trabajamos con ese concepto hablemos el mismo idioma y nos sitúa en la misma página y visión del mismo. Es por ello que, tras años de definiciones y revisiones por diversas sociedades, se ha creado un Grupo de Trabajo integrado por expertos en PBM de diferentes organizaciones para establecer una definición global y unificada del PBM, que afirma que13:
El Patient Blood Management es un enfoque centrado en el paciente, sistemático y basado en la evidencia, destinado a mejorar los resultados de los pacientes mediante el manejo y la preservación de la propia sangre, al tiempo que promueve la seguridad y el empoderamiento del paciente.
Beneficios del PBMLa mayor parte de los beneficios del PBM se encuentran incluidos en la definición global y parten de la base de que la sangre del propio paciente es un recurso que debe ser conservado y manejado apropiadamente.
Enfoque centrado en el pacienteLa toma de decisiones centrada en el paciente es crucial para determinar un plan de actuación individualizado e implica una buena comunicación de los riesgos y beneficios de las potenciales intervenciones a realizar. Además, mejora significativamente la calidad asistencial y la satisfacción de los pacientes.
Enfoque basado en la evidenciaLa medicina basada en la evidencia aporta ventajas para el profesional, ventajas para el paciente, al ofrecerle la mejor alternativa existente, y beneficios para el sistema sanitario en su conjunto, al optimizar recursos y desestimar tratamientos ineficaces.
Mejora de los resultados de los pacientesTanto la transfusión como la anemia en sí son factores de riesgo independientes para un mal resultado clínico, sea cual sea la patología de base14. El PBM mejora los resultados de los pacientes mediante:
- •
Disminución de las transfusiones innecesarias con la consecuente disminución de infecciones y efectos adversos15.
- •
Disminución de las complicaciones derivadas de la anemia crónica16.
Ambos puntos son importantes, ya que, además, ambos derivan en una reducción de costes por disminución de la estancia hospitalaria y de complicaciones postoperatorias. Por otro lado, no debemos olvidar que las reservas de hemoderivados son limitadas, y que existe una brecha no despreciable entre la oferta y la demanda14,16,17. Por último, es importante remarcar el contexto actual de pandemia por la COVID-19, en el que se ha experimentado una disminución de donantes y un aumento de las dificultades en la cadena de suministro de sangre que ha llevado a los expertos a enfatizar aún más la necesidad de adoptar este tipo de estrategias18.
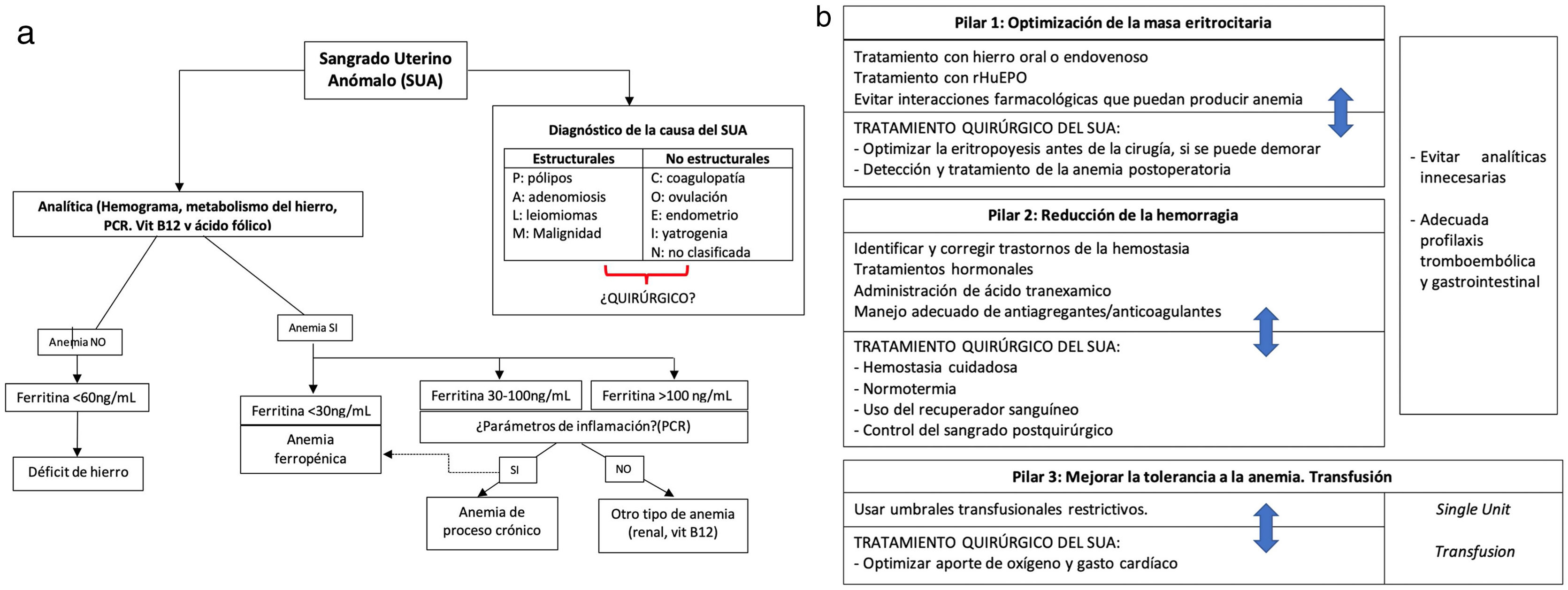
Pilares del PBMEl PBM se basa en 3 pilares fundamentales que deben ser abordados por un equipo multidisciplinar y de forma multimodal4 que, en el caso del sangrado uterino anómalo (SUA) quirúrgico, pueden verse resumidos en la tabla 1.
- •
Optimización de la masa eritrocitaria aumentando la producción de la propia sangre (corrección de la anemia).
- •
Reducción de la hemorragia.
- •
Optimización de la tolerancia a la anemia mejorando las condiciones de salud de las pacientes para poder ser más restrictivo en la transfusión.
Acciones multidisciplinarias de optimización en la paciente con sangrado uterino anómalo (SUA) quirúrgico
| Pilar IOptimizar la masa eritrocitaria | Pilar IIReducción de la hemorragia | Pilar IIIOptimizar la reserva fisiológica | |
|---|---|---|---|
| Preoperatorio | • Detección precoz de la anemia• Determinar ferritina para la detección precoz de la deficiencia de hierro• Iniciar tratamiento con hierro | • Identificar y corregir los trastornos de hemostasia• Reducir el sangrado (tratamientos hormonales/ácido tranexámico)• Evitar analíticas innecesarias• Manejo adecuado de antiagregantes/anticoagulantes• Donación autóloga en casos seleccionados | • Valorar el riesgo de máxima tolerancia a la anemia• Utilizar umbrales transfusionales restrictivos |
| Intraoperatorio | • Considerar la anemia como una contraindicación para la cirugía electiva potencialmente sangrante• Proceder a la cirugía una vez optimizada la eritropoyesis | • Utilizar técnicas quirúrgicas con una hemostasia meticulosa• Mantener normotermia• Recuperador de sangre intraoperatorio si está indicado• Antifibrinolíticos y agentes hemostáticos | • Optimizar el aporte de oxígeno• Optimizar el gasto cardíaco• Utilizar umbrales transfusionales restrictivos |
| Postoperatorio | • Detección y tratamiento de la anemia postoperatoria• Evitar interacciones farmacológicas que puedan producir anemia | • Control del sangrado postoperatorio• Recolección y reinfusión de sangre propia si se ha usado recuperador• Adecuada profilaxis tromboembólica• Adecuada reintroducción de antiagregantes/anticoagulantes• Profilaxis de la hemorragia gastrointestinalEvitar analíticas innecesarias | • Optimizar el aporte de oxígeno.• Disminuir el consumo de oxígeno• Utilizar umbrales transfusionales restrictivos• Transfusión adecuada y ajustada al objetivo, de unidad en unidad: Single Unit Transfusion |
En los casos en los que el SUA no sea quirúrgico los pilares son más o menos iguales, sin separarlos en las 3 fases del perioperatorio (pre-intra-post-operatorio).
Este capítulo está centrado principalmente en el PBM de las pacientes con anemia ferropénica, independientemente de la causa del sangrado, sea un mioma o sea una neoplasia, y dejando aparte los trastornos de hemostasia, que serán tratados ampliamente en otro capítulo. Obviamente, la causa desencadenante del sangrado y, por lo tanto, de la anemia, deberá ser tratada mediante cirugía o tratamiento médico, pero todos ellos también serán ampliamente desarrollados a lo largo de este número especial.
Según la OMS, en personas adultas no embarazadas la anemia se define como la presencia de un valor de hemoglobina (Hb) <13g/dl en el hombre y <12g/dl en la mujer menstruante19. La anemia puede ser debida a múltiples causas, entre las que encontramos hemoglobinopatías, déficits nutricionales o fallo renal, pero una de las causas más frecuentes es el déficit de hierro, absoluto o funcional.
Por otro lado, debemos tener en cuenta las diferentes causas del SUA que la Federación Internacional de Ginecología y Obstetricia (FIGO) en 2011 clasificó en entidades estructurales (PALM: pólipos, adenomiosis, leiomiomas y neoplasias) y no estructurales (COEIN: coagulopatías, trastornos de la ovulación, trastornos del endometrio, iatrogenia o idiopática/no clasificada) según la clasificación PALM-COEIN20. Esta clasificación se ve facilitada por una historia completa de la paciente combinada con imágenes apropiadas, análisis histopatológicos o evaluación de laboratorio para garantizar enfoques precisos de diagnóstico y tratamiento del SUA. Es importante identificar la causa, porque nos ayudará con el diagnóstico de anemia y permitirá realizar un PBM individualizado considerando las opciones terapéuticas más apropiadas y específicas para esa paciente.
Optimización de la masa eritrocitariaDiagnóstico de déficit de hierro y anemia ferropénicaLa anemia es un factor de riesgo independiente de morbimortalidad perioperatoria en cirugía cardíaca y no cardíaca, siendo considerada no solo un valor de laboratorio, sino una enfermedad per se. Por ello, diversas guías y recomendaciones enfatizan la detección precoz de la misma, y para ello sugieren una evaluación con la antelación suficiente para poder diagnosticarla y, en su caso, optimizar la Hb antes de la eventual cirugía21-23. Algunos autores proponen incluso optimizar la Hb a 13g/dl independientemente del sexo; esta afirmación se basa en la hipótesis de que hombres y mujeres pierden aproximadamente la misma cantidad de sangre, pero, al tener la mujer menos volumen circulante, proporcionalmente tiene más pérdidas sanguíneas14.
El déficit de hierro tiene una prevalencia alta, estando presente en aproximadamente el 30% de las mujeres en edad fértil y en el 38% de las embarazadas, y continúa siendo una de las causas más frecuentes de anemia en el mundo. Las pérdidas sanguíneas crónicas, como es el caso del SUA, es una de las causas más frecuentes de anemia por déficit de hierro en los países desarrollados24,25. El diagnóstico del déficit de hierro sin anemia y de la anemia ferropénica se realiza mediante test de laboratorio tradicionales, siendo el nivel de ferritina y el nivel de saturación de transferrina los parámetros más relevantes (tabla 2). Cabe destacar que el diagnóstico del déficit de hierro funcional (cuando la movilización del hierro no es suficientemente rápida para satisfacer el aumento de la demanda) o de anemia ferropénica en el contexto de una inflamación puede ser más complejo (tabla 3)24.
Evaluación del estado del hierro
| Parámetro | Concepto | Significado | Valores en la anemia ferropénica |
|---|---|---|---|
| Hierro (valor normal 10-30mmol/l) | Concentración de hierro en sangre | Valora carencia o sobrecarga del mineral en el organismo | Bajo (en el déficit funcional de hierro los valores pueden ser normales) |
| Ferritina (F) (valor normal 20-200mg/l) | Depósito de hierro tisular o hierro bloqueado | Proteína de fase aguda. Sus niveles aumentan con la edad | Bajo (normal o alto: anemia de enfermedad crónica/inflamatoria; normal: déficit funcional de hierro) |
| Saturación de la transferrina (valor normal >16-<45%) | Hierro unido a la transferrina | Influenciado por la alta variabilidad en el hierro sérico y la transferrina | Bajo (amplio margen de valores de normalidad causado por la variabilidad del hierro sérico y la capacidad de unión al hierro) |
| Receptor soluble de la transferrina (sTFR, en mg/l)) | Cuantifica la demanda celular de hierro y la proliferación eritroide | Indicador de déficit funcional de hierro | Elevado (útil en pacientes anémicos con ferritina elevada). Técnica no estandarizada |
| % hematíes hipocrómicos (Hypo) | Hemoglobinización de los hematíes en los últimos 90días | Indicador de déficit funcional de hierro | Elevado |
| Contenido de Hb reticulocitaria (CHr) | Hemoglobinización de los hematíes en los últimos 2días | Indicador precoz del déficit funcional de hierro | Bajo |
Tipos de déficits de hierro
| Parámetro | Déficit absoluto de hierro | Déficit funcional de hierro | Anemia ferropénica | Anemia de enfermedades crónicas o inflamatorias |
|---|---|---|---|---|
| Hierro | ↓ | ↓ - normal | ↓ | ↓ |
| Ferritina | ↓ (<30) | Normal | ↓ (>10) | ↑ |
| Hb | Normal | Normal | ↓ | ↓ |
| Saturación de la transferrina (%) | <16 | ↓ - normal | <16 | ↓ - normal |
| Receptor soluble de la transferrina | ↑ | ↑ | ↑ | ↓ |
| % hematíes hipocrómicos | ↑ | ↑ | ↑ | Normal |
| Contenido de Hb reticulocitaria | ↓ | ↓ | ↓ | ↓ |
Las pacientes con anemia por déficit de hierro deben recibir tratamiento con hierro, así como aquellas pacientes con SUA y déficit de hierro que aún no manifiestan anemia. La recomendación actual sobre el tipo de hierro y la vía de administración es que debe ser individualizada y basada en el grado de anemia o déficit de hierro, la capacidad de absorción y de tolerancia al hierro oral y al tiempo que queda antes de la cirugía, en el caso que sea una paciente quirúrgica23.
- •
Hierro oral. Es el tratamiento de elección en el caso de déficit de hierro o anemia ferropénica no complicada, al ser un tratamiento fácil y barato y que ha demostrado ser efectivo, aumentando la Hb y disminuyendo la proporción de pacientes que requieren transfusión26. Existen situaciones en las que resulta inefectivo (cirugía bariátrica, SUA grave o algún trastorno de coagulación hereditario, como la telangiectasia hemorrágica hereditaria) o incluso potencialmente dañino, como en el caso de la enfermedad inflamatoria intestinal. Presenta diversas desventajas que hay que tener en cuenta a la hora de prescribirlo. Por un lado, la biodisponibilidad es solo del 10-15% y puede verse reducida en condiciones de inflamación. La absorción por vía enteral es solo de 2-16mg/día, por lo que la recuperación con este tipo de suplemento es un proceso a largo plazo. Por otro lado, tiene una alta incidencia de efectos secundarios a nivel gastrointestinal (náuseas, irritación gástrica, diarrea o estreñimiento y sabor metálico), que tiene como consecuencia una alta tasa de abandono y no adherencia al tratamiento25,27. Normalmente se administra en forma de sulfato ferroso, porque se absorbe mejor en el intestino, pero existen en el mercado diferentes sales ferrosas bivalentes, como el sulfato, el gluconato, el citrato o el fumarato ferroso. También hay formas trivalentes, como el hierro polimaltosa, el proteinsuccinilato férrico o el hierro liposomado. Se sugiere preguntar a la paciente si ha tolerado previamente un tipo de hierro oral y prescribir el mismo. La dosis recomendada para el tratamiento del déficit de hierro es de 100-200mg de hierro elemental al día24,28. La respuesta al tratamiento empieza a observarse a la semana o diez días de su inicio, aumentando la Hb en 1g/dl en 2 semanas. Una vez corregida la anemia se debe continuar el tratamiento durante 4-6 meses para rellenar los depósitos.
- •
Hierro intravenoso. Las principales indicaciones del hierro intravenoso son la baja adherencia al tratamiento oral por intolerancia gástrica, la mala absorción intestinal (p.e., by-pass gástrico), la falta de tiempo antes de una cirugía y las pacientes ginecológicas anémicas o con alta probabilidad de desarrollar anemia perioperatoria grave (pacientes con sangrado uterino abundante o con cáncer de origen ginecológico en tratamiento quimioterápico). Este tratamiento tiene como objetivo mejorar los valores de Hb y reducir la tasa transfusional (recomendación GRADE 2B)25. Diversos estudios asocian también el tratamiento con hierro intravenoso a una disminución del daño renal agudo, de las infecciones y a una reducción de la estancia hospitalaria29,30. El coste del hierro intravenoso es elevado, pero diversos estudios encuentran que es el tratamiento con más coste-efectividad para las pacientes con anemia ferropénica o déficit de hierro31-33. Las actuales posologías del hierro intravenoso se adaptan mejor a las necesidades más frecuentes de las pacientes, siendo la dosis máxima de cada preparado lo que determinará el fármaco a prescribir (tabla 4). En pacientes ingresados puede administrarse, por ejemplo, hierro sacarosa, 200mg cada 48horas, hasta un máximo de 600mg a la semana. En los pacientes atendidos en el hospital de día, en cambio, es más coste-efectivo la administración de la dosis total de hierro en una sola administración. El hierro intravenoso también tiene efectos adversos, los cuales son transitorios y se resuelven dentro de las primeras 48horas. Los más frecuentes son nauseas, vómitos, prurito, dolor de cabeza y flushing facial, así como mialgias, artralgias y dolor de espalda y pecho34. Las reacciones de hipersensibilidad (incluida la anafilaxia) son muy infrecuentes con las actuales formulaciones; aun así, la fisiopatología no está del todo clara24,35. Para minimizar el riesgo se recomienda una administración lenta y en aquellos lugares que cuenten con disponibilidad inmediata de personal capacitado para evaluar y tratar reacciones anafilácticas, en un entorno en el que se pueda garantizar un dispositivo completo de reanimación. Se aconseja vigilar al paciente al menos durante 30minutos tras la administración, prestando especial atención a aquellos con alergias conocidas a otros medicamentos o con enfermedades inmunológicas o inflamatorias, como son los pacientes con antecedentes de asma, eccema o pacientes atópicos. Los preparados de hierro intravenoso están contraindicados en pacientes con hipersensibilidad a alguno de los componentes del medicamento y tampoco se deben utilizar en pacientes que han sufrido reacciones de hipersensibilidad graves a otro preparado de hierro intravenoso diferente al que se va a administrar.
Tabla 4.Compuestos de hierro parenteral y pauta de dosificación
Dosis habitual y dosis máxima por sesión Tiempo de administración Hierro sacarosa (Venofer®, Feriv®) Habitual: 100mg. Máxima: 200mgSi la dosis necesaria total supera la dosis máxima única permitida, habrá que dividir la administración en varias sesiones Dosis 100mg: mínimo 15minDosis 200mg: mínimo de 30 mina Hierro carboximaltosa (Ferinject®) Habitual: 500mg. Máxima: 1.000mg(máximo 20 mg/kg en infusión, 15 mg/kg si es en bolus) Dosis de 500mg: mínimo 8minDosis de 1.000mg: mínimo 15minb - •
Eritropoyetina humana recombinante (rHuEPO). La mayoría de las mujeres con SUA son mujeres sanas con una función inmunitaria normal y una respuesta endógena eritropoyética máxima a la anemia por pérdidas sanguíneas. Esto explica la ausencia de respuesta al tratamiento con eritropoyetina exógena, por lo que no hay evidencia para recomendar en estos casos el uso rutinario de rHuEPO. Solo la cirugía ortopédica mayor tiene esta indicación aprobada en ficha técnica, pero deberíamos tenerla en cuenta en casos de SUA en pacientes más complejas (testigos de Jehová, insuficiencia renal crónica, procesos inflamatorios)25.
La reducción de la hemorragia en las pacientes con SUA incluye tratamientos médicos (hormonales y no hormonales) y quirúrgicos (histeroscopia, ablación endometrial, miomectomía, histerectomía y embolización de arteria uterina). Todos ellos se comentan en los diferentes capítulos de este número. La selección de una o más de las diferentes opciones vendrá determinada por sus ventajas y sus posibles efectos adversos, influida por el estado de salud y reproductivo de la paciente, sus preferencias personales y la existencia de comorbilidades que pudieran desaconsejar alguno de los tratamientos36.
La detección y el tratamiento precoz del SUA o del sangrado menstrual abundante (SMA) es clave para la prevención de unas pérdidas sanguíneas que van a conllevar una pérdida del depósito de hierro y, en último lugar, una anemia que puede llegar a ser grave. Esta situación puede desembocar, en algunos casos, en una transfusión de hematíes por una anemia carencial prevenible en la mayoría de las situaciones. La determinación analítica de la ferritina nos permitirá detectar unos depósitos de hierro exhaustos, antes de que se produzca una anemia. El tratamiento precoz con hierro ante una ferritina baja, junto a un tratamiento para frenar la hemorragia (cerrar el grifo abierto), permitirá detener la evolución a una anemia.
El tratamiento de primera línea no hormonal para la reducción de la hemorragia uterina incluye37:
- •
Ácido tranexámico. Es un fármaco antifibrinolítico, análogo sintético de la lisina, que inhibe competitivamente la unión del plasminógeno a los residuos de lisina en la superficie de fibrina, evitando la conversión del plasminógeno a plasmina. La terapia con ácido tranexámico reduce entre un 40 y un 50% la pérdida sanguínea en mujeres con SMA, mejorando la calidad de vida en un 80% de las usuarias38. También es efectivo en pacientes con trastorno hemorrágico subyacente. Se administra a dosis de 1gramo vía oral cada 6horas durante 3 a 5días, consiguiendo disminuir el sangrado a las 2-3horas de su administración. En el SMA agudo puede ser útil la administración por vía intravenosa39. Los efectos secundarios del uso de ácido tranexámico son náuseas, vómitos y diarreas, las cuales disminuyen con la reducción y el alargamiento de los períodos entre dosis. Se han descrito alteraciones visuales para los colores. Aunque no se ha podido evidenciar un incremento de complicaciones tromboembólicas, se ha descrito un riesgo del 15% de necrosis y trombosis de los miomas uterinos, en relación con un 4% en mujeres no expuestas al ácido tranexámico40.
- •
Inhibidores de las prostaglandinas. Los antiinflamatorios no esteroides (AINE) reducen un 30% el sangrado menstrual39. Los AINE más utilizados son el ácido mefenámico, el naproxeno, el ibuprofeno, el flurbiprofeno, el meclofenato y el diclofenaco. Una de sus ventajas es la absorción oral rápida y un efecto clínico también muy rápido. Actúan por inhibición de la ciclooxigenasa en la cascada del ácido araquidónico, con la consiguiente inhibición de la síntesis de las prostaglandinas y el incremento de los niveles del tromboxanoA2. Todo ello conduce a una vasoconstricción y a un incremento de la agregación plaquetaria que deriva en una reducción de la hemorragia.
- •
Etamsilato. Reduce el sangrado menstrual un 20%. Su acción es hemostática, reduciendo el tiempo de sangría (corrige una función adhesiva plaquetaria anormal) y tiende a mejorar la fragilidad y la permeabilidad capilar alteradas. Está contraindicado en la porfiria39.
El procedimiento de histerectomía abdominal se asocia a una tasa transfusional baja. Los datos publicados, refieren que el 4,7% de pacientes son transfundidas con una media de 2,5 concentrados de hematíes por paciente41. En un estudio de benchmarking realizado en 2.707 pacientes intervenidas de histerectomía abdominal por laparoscopia o abierta durante el año 2020 en 43 hospitales españoles, se transfundió un 5,2% de las pacientes, con 2,3 concentrados de hematíes por paciente transfundida42. Aunque la variabilidad de la práctica transfusional fue elevada, es importante destacar que el 20% de las pacientes tenían anemia previa a la cirugía. En un estudio publicado recientemente (POISE-3), los pacientes intervenidos de cirugía no cardíaca con riesgo de sangrado y de complicaciones cardiovasculares tuvieron una menor incidencia de sangrado grave con ácido tranexámico que con placebo (1gramo al inicio +1 gramo al finalizar la cirugía)43. Sin embargo, solo el 3,5% de las cirugías no cardíacas incluidas fueron ginecológicas.
A pesar de que las tasas transfusionales a priori parecen bajas, la transfusión no debería producirse por una falta de detección y tratamiento de déficit de hierro y/o anemia. La mayor parte de las pacientes ginecológicas son pacientes jóvenes y sanas, y las consecuencias derivadas de la anemia y de la transfusión innecesaria deben evitarse. La transfusión de hematíes debería ser un tratamiento a una anemia aguda, grave y no prevista que ponga en riesgo la homeostasis de las pacientes.
Mejorar la tolerancia a la anemia. Criterios transfusionales en ginecologíaLa mejora de la tolerancia a la anemia en las pacientes quirúrgicas incluye aquellas medidas destinadas a optimizar el aporte y el consumo de oxígeno, tema que sale del ámbito de este capítulo, puesto que no todas las pacientes con SUA tendrán esta indicación.
Fuera del ámbito quirúrgico, las medidas irían dirigidas a mejorar los hábitos de vida y a reducir la demanda de oxígeno adecuando la actividad a la tolerada por el nivel de Hb de la paciente, lo cual no siempre será factible habida cuenta de que, en muchas ocasiones, son mujeres en edad fértil y en época laboral activa.
El otro aspecto de este pilar, y que ha venido siendo foco de estudio, es el umbral transfusional. Existe consenso entre las sociedades científicas en la práctica de una política transfusional restrictiva en pacientes anémicos sin hemorragia activa23,44,45. De esta forma, se considera el umbral transfusional en 7g/dl de Hb para aquellos pacientes críticos, quirúrgicos y traumáticos. Esta cifra suele ser bien tolerada por las pacientes ginecológicas, dependiendo de su reserva fisiológica. En caso de presentar patología cardiológica o del sistema nervioso central, podría ser necesario aumentar el umbral a 8-9g/dl. En cualquier caso, la decisión siempre debería ser individualizada.
Por otra parte, en caso de considerar la trasfusión de hematíes, esta debería realizarse con el menor número de unidades necesarias para aliviar los síntomas de la anemia o alcanzar nuevamente el rango seguro de Hb. En este sentido, surge el concepto de single-unit transfusión (SUT), que se refiere a un esquema de dosificación estandarizada de una unidad de concentrado de hematíes, plaquetas o plasma en paciente no sangrante, seguido de una valoración del paciente (clínica y/o analítica).
Aunque no existen ensayos clínicos aleatorizados en los que se compare exclusivamente la estrategia SUT frente a una política liberal, esta es la lógica consecuencia de la reducción de los triggers y objetivos transfusionales en diversos escenarios clínicos y de racionalizar la transfusión evitando la práctica rutinaria que se ha venido llevando a cabo durante décadas de transfundir los concentrados de hematíes de dos en dos. Los estudios de cohorte retrospectivos, aunque son inconsistentes en los informes de resultados, sugieren una mejora en la administración de concentrados de hematíes46.
La utilización de umbral transfusional restrictivo, si bien reduce el riesgo de recibir transfusión, no ha demostrado mejorar la evolución de los pacientes respecto a políticas liberales (umbral transfusional 9-10g/dl) tanto en lo referente a reducción de mortalidad a los 30días como a episodios cardiacos, ictus o trombosis47. Por ello, si una política liberal es equivalente a una más restrictiva, esta debería considerarse la estándar, dada las reservas limitadas de hemoderivados y las complicaciones inherentes a la transfusión.
ConclusionesLa transfusión de hematíes debería ser un recurso a utilizar cuando todos los tratamientos y estrategias fallan y no un comodín por la falta de diagnóstico, planificación y tratamiento adecuado. En ginecología la mayoría de pacientes son sanas y jóvenes, y esto puede llevar a los profesionales a minimizar los efectos secundarios tanto de la anemia como de la transfusión48-50. Es por ello que los autores hacen hincapié en los pilares fundamentales que definen el PBM, para lo que se propone un algoritmo de acciones a realizar ante una paciente con SUA/SMA (fig. 1), garantizando así a nuestras pacientes un enfoque global, seguro e individualizado y mejorando los resultados clínicos.
Algoritmo del PBM en el sangrado uterino anómalo (SUA).
Ante una paciente con SUA, las primeras acciones a seguir son, paralelamente, diagnóstico de la causa del sangrado y evaluación analítica del hemograma y valores del metabolismo del hierro. Lo más frecuente es encontrar un déficit de hierro con o sin anemia, pero hay que tener en cuenta que puede haber otras causas de anemia que pueden también superponerse a la anemia ferropénica, según las causas del SUA menos frecuentes (p.ej., neoplasias).
No existe financiación para la realización de este artículo.
Conflicto de interesesNo existen conflictos de intereses.