Editado por: Dr. Francisco Carmona y Dra. MªÁngeles Martínez Zamora
Última actualización: Julio 2023
Más datosLa ecografía transvaginal se considera la prueba diagnóstica de elección en el estudio de la mujer con miomas, adenomiosis y endometriosis ovárica y profunda. Se recomienda realizar dicha ecografía siguiendo la sistemática exploratoria propuesta tras el consenso Morphological Uterus Sonographic Assessment (MUSA) para la patología miometrial, y el consenso IDEA para la endometriosis.
Para realizar el diagnóstico de la adenomiosis, es necesario identificar como mínimo un criterio «directo» (islotes, yemas hiperecogénicas o quistes intramiometriales), así como uno o varios criterios indirectos (aspecto globuloso del útero, sombras «en abanico», asimetría de paredes miometriales o zona de transición endometrio-miometrio irregular). También definir si afecta a la capa externa uterina, o bien a la interna (zona de transición). La vascularización translesional de la adenomiosis es distinta a la circunferencial que presentan los miomas, de los que también debemos medir sus tres diámetros, describir su ecogenicidad y definir el número y la localización según la clasificación de la International Federation of Gynecology and Obstetrics (FIGO).
La ecografía de la endometriosis se realiza mediante la exploración sistemática del útero y los ovarios (identificar y describir endometriomas), los marcadores menores o soft markers (pseudoquistes adherenciales perianexiales, líquido libre tabicado en Douglas, ovarios fijos, zonas sensibles a la presión y útero en forma de coma), el signo del deslizamiento (anterior, retrouterino y retrocervical) y la detección y descripción de los nódulos de endometriosis profunda en compartimento anterior (vejiga, uréteres) o posterior (ligamentos uterosacros, parametrios, fórnix vaginal, tabique rectovaginal y cara anterior de rectosigma).
Transvaginal ultrasound is considered the first-line imaging diagnostic test in the study of women with fibroids, adenomyosis, and ovarian and deep endometriosis. It is recommended that the ultrasound should follow the MUSA consensus for myometrial pathology, and the IDEA consensus for endometriosis.
To diagnose adenomyosis, it is necessary to identify at least one «direct» criterion (hyperechogenic buds or island or intramyometrial cysts), as well as one or several «indirect» criteria (globulous uterine morphology, «fan-shaped» shadowing, asymmetry, or non-defined junctional zone). It is recommended to specify if the adenomyosis is internal or external. Translesional vascularization of adenomyosis is different from circumferential vascularization of fibroids, of which the measurement of the 3 diameters should be reported, the echogenicity should be described, and the number and location defined according to the FIGO classification.
Ultrasound for endometriosis is performed by systematic examination of the uterus and ovaries (endometriomas), soft markers (periadnexal pseudocysts, tabicated fluid in the pouch of Douglas, fixed ovaries, tenderness-guide areas, and comma-shaped uterus), sliding sign (anterior, retrouterine, and retrocervical) and the detection and description of deep endometriotic nodules in the anterior (bladder, ureters) or posterior compartment (uterosacral ligaments, parametria, vaginal fornix, rectovaginal septum, and rectosigma).
Tanto los miomas como la adenomiosis constituyen hallazgos frecuentes en la valoración uterina. El diagnóstico de ambas entidades recae fundamentalmente en la valoración ecográfica. La valoración sistemática y adecuada de ambas entidades facilitará al clínico el manejo adecuado de dicha patología y permitirá el desarrollo de estudios homogéneos que puedan agruparse y compararse con los de otros autores.
Ecografía de la adenomiosisLa adenomiosis se diagnostica por histología (presencia de glándulas y estroma endometrial en el interior del miometrio, junto con hipertrofia e hiperplasia del miometrio circundante1). Sin embargo, y a pesar de ello, hoy en día la adenomiosis se diagnostica y se trata por imagen a partir de hallazgos ecográficos y/o de resonancia magnética.
La ecografía transvaginal se considera, por su rendimiento diagnóstico y su bajo coste el método diagnóstico inicial, mientras que la resonancia magnética se reserva para aquellos casos dudosos2.
La enfermedad presenta dos fenotipos y a su vez estos se asocian con un perfil clínico diferente. De un lado existe una adenomiosis que podríamos denominar «externa», relacionada con la endometriosis y con un perfil de paciente más joven que la denominada adenomiosis «interna», que sería aquella entidad en la que el trastorno se va originando de forma gradual por fuga de células endometriales que infiltran la zona de transición endometrio-miometrio y que afectaría por lo general a pacientes de mayor edad3,4.
Se ha relacionado la adenomiosis interna con cirugías (miomectomías previas, cesáreas), en pacientes con mayor índice de masa corporal y que sufren hipermenorrea a consecuencia de la misma, mientras que la adenomiosis externa estaría más relacionada con infertilidad. Ambos tipos compartirían una mayor incidencia de dolor pélvico crónico no cíclico y dispareunia.
La existencia de dos fenotipos en la enfermedad concuerda con las dos principales teorías etiopatogénicas acerca del origen de la adenomiosis. La primera de ellas, la más aceptada, se refiere a la invaginación de células endometriales hacia el miometrio, tanto por la actividad peristáltica cíclica incesante del miometrio interno, como por la compresión extrínseca del miometrio externo, que aumentaría la presión intracavitaria y facilitaría el éxodo de células endometriales y la invasión del miometrio interno5. Sería un fenómeno por tanto de peristalsis (hiperperistalsis) influida por el hiperestrogenismo.
La segunda teoría6 se refiere la metaplasia celómica originada a partir de los remanentes müllerianos existentes en el miometrio, y que explicaría algunas lesiones intramiometriales distantes tanto del miometrio interno como de la superficie externa. Finalmente, en el contenido menstrual existen células madre adultas capaces de colonizar desde el peritoneo (fondo de saco de Douglas principalmente) y esto hace que, mediante la menstruación retrógrada, estas células puedan llegar al peritoneo y a continuación invadir el miometrio uterino desde fuera hacia adentro (adenomiosis externa).
Desde el punto de vista anatómico, el miometrio interno (también llamado «junction zone», arquimetra o arquimiometrio), presenta una disposición circular de sus fibras y, al igual que el endometrio, tiene un origen mülleriano. El miometrio externo, formado por fibras largas de disposición longitudinal más grueso se deriva de un tejido no mülleriano.
El miometrio interno es rico en receptores de estrógenos y de progesterona y su actividad cíclica varía en función de las contracciones relativas de estos. Ecográficamente, el miometrio interno se visualiza como un nítido ribete hipoecoico mientras que su actividad cíclica contráctil puede valorarse en el plano sagital dejando la sonda quieta y observando los movimientos peristálticos.
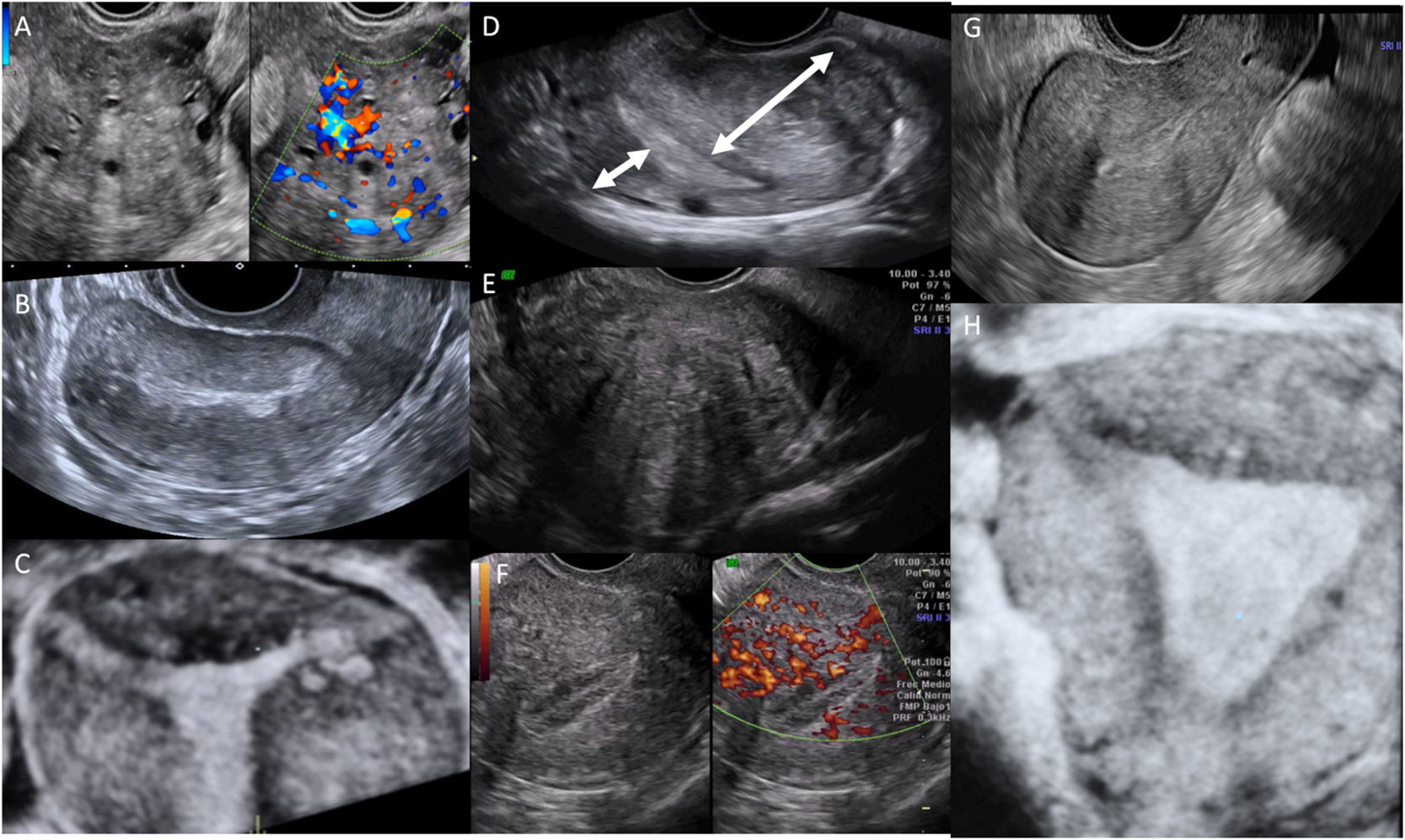
Se han descrito varios criterios ecográficos asociados a adenomiosis7, no existiendo acuerdo en si son necesarios uno solo o varios de ellos. Sin embargo, resulta importante distinguir entre criterios «directos», es decir, aquellos que reflejan invasión glandular (islotes, yemas hiperecogénicas o quistes intramiometriales) y criterios «indirectos», derivados tanto de la invasión endometrial como de la hipertrofia-hiperplasia miometrial asociada (aspecto globuloso del útero, sombras «en abanico», asimetría de paredes miometriales o zona de transición endometrio-miometrio irregular8) (fig. 1).
Signos directos (A, B y C) e indirecto s de adenomiosis. A: Quistes intramiometriales; B: Líneas o yemas subendometriales; C: Islotes hiperecogénicos; D: Asimetría uterina; E: Sombras «en abanico»; F: Vascularización translesional; G: Útero globuloso; H: Zona de transición endometrio-miometrio irregular.
Los criterios ecográficos de adenomiosis datan de la década de 1990. Previamente se describió mediante ecografía transabdominal el agrandamiento uterino junto con engrosamiento asimétrico de la pared anterior o posterior9. Posteriormente, y mediante ecografía transvaginal, se comenzaron a describir lagunas anecoicas o quistes de tamaño variable10–12, agrandamiento uterino que no se explica por la presencia de leiomiomas13, asimetría de paredes miometriales13,14,ausencia de anomalías de contorno, efecto de masa, y zonas heterogéneas y mal circunscritas dentro del miometrio15.
Hoy en día empleamos la nomenclatura propuesta por el grupo MUSA en 20157, junto con la revisión posterior realizada en 2022 (tabla 1). En esta última se distingue entre criterios directos e indirectos.
Criterios ecográficos de adenomiosis
| Criterios directos | Descripción |
|---|---|
| Quistes intramiometriales | Espacios quísticos redondeados u ovalados de cualquier tamaño dentro del miometrio |
| Islotes hiperecogénicos | Áreas hiperecogénicas dentro del miometrio que no tienen conexión con el endometrio (sin distancia mínima, sin número mínimo). Pueden ser regulares, irregulares o mal definidos |
| Yemas y líneas subendometriales | Las líneas subendometriales hiperecogénicas son (casi) perpendiculares a la cavidad endometrial y están en continuidad con el endometrio. |
| Criterios indirectos | |
| Útero globuloso | La serosa del miometrio diverge del cuello uterino en al menos dos direcciones (anterior/posterior/lateral), en lugar de seguir una trayectoria paralela al endometrio, y los diámetros medidos (longitud/anchura/profundidad) del cuerpo uterino son aproximadamente iguales. |
| Asimetría | Diferencia de grosor entre la pared anterior y la posterior del miometrio supera los 5 mm, o cuando la relación entre el grosor de la pared anterior y posterior sea muy superior a 1 o muy inferior a 1. |
| Sombras en abanico | Presencia de franjas hipoecogénicas detrás de la lesión miometrial, a veces alternando con franjas lineales hiperecogénicas (leves/moderadas/fuertes). Esta Esta característica se evalúa mejor en las imágenes en escala de grises sin utilizar el Doppler en color. |
| Vascularización translesional | Presencia de vasos perpendiculares a la cavidad/serosa uterina que atraviesan la lesión (islas hiperecogénicas en el miometrio). |
| Junction zone irregular | La junction zone puede ser irregular debido a la presencia de áreas quísticas, puntos hiperecogénicos y brotes y líneas hiperecogénicas. La medición ecográfica del grosor de la junction zone no tiene actualmente no tiene ningún papel en la práctica clínica. |
| Junction zone interrumpida | Hay interrupción de la junction zone cuando una parte de ella no puede ser visualizada en valoración transvaginal 2D o 3D en cualquier plano. Una junction zone ininterrumpida significa que se ve claramente en todos los planos en la ecografía 2D o en todos los planos en la ecografía 3D. |
Desde el punto de vista de la reproducibilidad de dichos criterios, se han publicado varios estudios utilizando ecografía 2D y 3D, logrando un buen nivel de concordancia entre experto y no experto en 2D. Sin embargo, en 3D los resultados son algo más discordantes, y dependen del grado de experiencia del explorador que adquiere el volumen ecográfico16,17.
Con el fin de homogeneizar la información y facilitar la comparación de estudios, se aconseja describir en el informe ecográfico18:
- •
Localización (anterior, posterior, lateral derecho/izquierdo, fúndico)
- •
Diferenciación (en plano sagital)
- ∘
Focal: rodeada > 25% por miometrio normal.
- ∘
Difusa: rodeada < 25% por miometrio normal, o imagen poco clara.
- ∘
Mixta: existen criterios de adenomiosis focal y difusa.
- ∘
Adenomioma: adenomiosis focal rodeada por miometrio hipertrófico.
- •
Tipo
- •
Quística
- •
No quística
- •
Capa miometrial afectada
- ∘
Zona de transición endometrio-miometrio o miometrio interno
- ∘
Miometrio medio (hasta la arcada vascular)
- ∘
Miometrio externo (por fuera de la arcada vascular hasta serosa)
- •
Extensión de la adenomiosis.
- ∘
Leve (< 25%)
- ∘
moderada (25-50%)
- ∘
Severa (> 50%)
La adenomiosis se ha relacionado con dismenorrea, sangrado anómalo, dolor pélvico crónico e infertilidad. En todas estas circunstancias debemos tenerla presente en nuestra exploración ecográfica19.
Desde el punto de vista de la fertilidad, la adenomiosis actúa a varios niveles, desde la implantación hasta el desarrollo posterior embrionario. Existe consenso en afirmar que reduce la tasa de implantación y gestación clínica en las técnicas de reproducción asistida. También afecta al desarrollo inicial (aborto precoz) o incluso posterior, con alteraciones derivadas de una mala placentación (retraso en el crecimiento intrauterino y prematuridad). No hay unanimidad entre autores y los estudios son muy heterogéneos, por lo que es necesario el desarrollo de más estudios que clarifiquen la influencia relativa de este factor y permitan asesorar de forma adecuada a la paciente en consulta20,21.
Ecografía de los miomasLos miomas se definen como tumores derivados del miometrio que presentan una abundante matriz extracelular, rodeados de una fina pseudocápsula de tejido conectivo y fibras musculares comprimidas.
Desde el punto de vista práctico, en el diagnóstico ecográfico de los miomas debemos seguir una sistemática exploratoria y emplear una terminología de consenso establecida por los distintos grupos de trabajo (MUSA7). La sonohisterografía puede ayudar a clasificar con más precisión el tipo de mioma submucoso. El empleo de ecografía 3D junto con sonohisterografía permite definir mejor los bordes del mioma, su relación con las paredes laterales del útero y ofrece ventaja adicional en el ámbito clínico docente, al permitir analizar las imágenes a posteriori.
Los sarcomas uterinos son tumores con una incidencia muy baja pero que debemos tener presente en la valoración ecográfica de mioma. Aunque no existen signos patognomónicos, aparecen con una mayor frecuencia como tumores con ecoestructura no homogénea y bordes irregulares con score color 3-4, ausencia de calcificaciones internas, áreas quisticas (irregulares) ausencia de sombra acústica y aspecto cocinado (cooked aspect)22.
Signos ecográficos de miomaSegún el consenso MUSA7, el mioma se aprecia como una lesión dependiente del miometrio, de bordes redondeados, con sombra acústica en los bordes de la lesión y/o sombras internas en abanico, contenido isoecogénico con respecto al miometrio (si bien puede ser hipo o hiperecogénico) y vascularización predominantemente periférica. Sin embargo, no todos los miomas muestran estas características. El aspecto ecográfico de los miomas es variable y viene influenciado por la proporción relativa de células musculares y estroma.
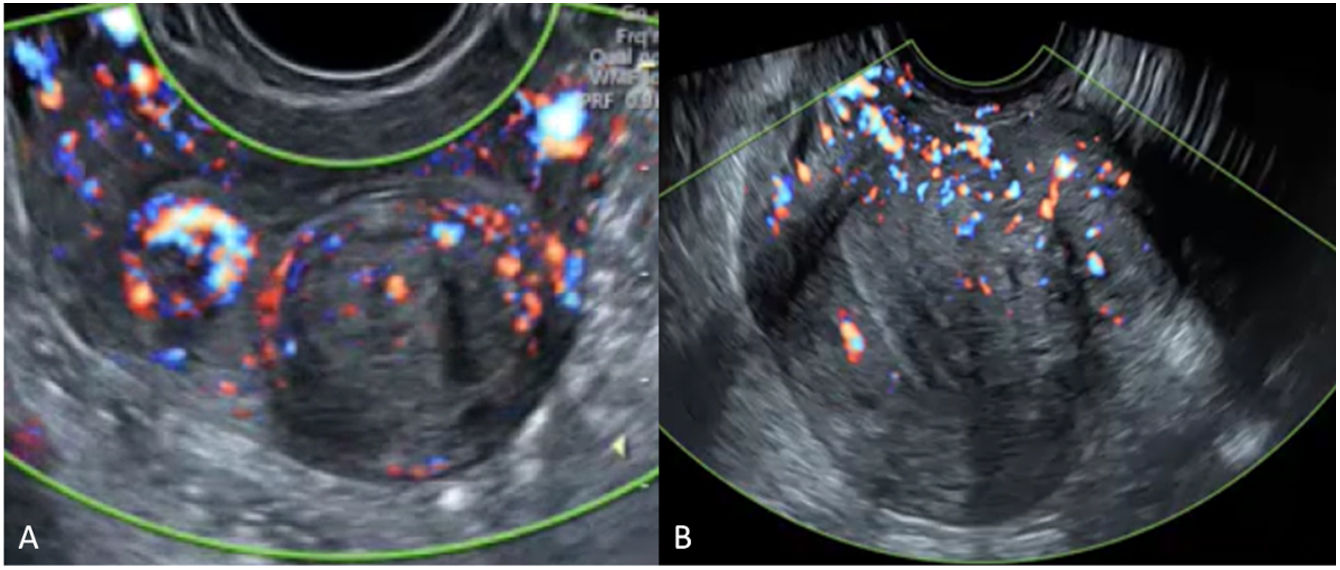
Dentro de la sistemática ecográfica descrita por las diferentes guías publicadas, el diagnóstico se basa en la ecografía transvaginal, siendo recomendable realizar de forma complementaria una ecografía transabdominal con el fin de excluir miomas no accesibles por vía transvaginal y valorar potenciales complicaciones de estos (hidronefrosis). Debemos medir los tres diámetros del mismo y precisar su localización empleando el sistema de clasificación de la FIGO23. En la literatura hay pocas guías o documentos de consenso que expliciten de forma clara cómo debe medirse el mioma. El mioma posee una pseudocápsula formada por tejido miometrial comprimido que lo rodea del miometrio sano y que es muy rica en vasos (fig. 2). El empleo de Doppler facilita la identificación de la pseudocápsula y la medición del mioma colocando los cálipers justo por debajo de esta. Recientemente se ha elaborado un tutorial para optimizar el empleo de Power Doppler en la evaluación de los miomas24.
La evolución natural de los miomas hace que en algunos casos los miomas sufran procesos de degeneración. La degeneración hialina es la más frecuente, y puede presentarse hasta en el 65% de todos los miomas. En ella se sustituyen las células musculares por un material proteico amorfo acelular.
Endometriosis ovárica y profundaEn la actualidad, múltiples publicaciones respaldan en uso de técnicas de imagen en el diagnóstico de la endometriosis ovárica y profunda25,26, que sustituyen, incluso superan a la laparoscopia diagnóstica.
La ecografía y la resonancia magnética nuclear serían las dos pruebas de imagen más adecuadas para el diagnóstico de esta enfermedad. Teniendo en cuenta que ambas pruebas tienen una precisión diagnóstica parecida27, la ecografía es la prueba de imagen de elección debido a su mayor accesibilidad y su menor coste.
En 2016 se publicó una propuesta de sistemática exploratoria de la endometriosis uterina, ovárica y profunda28, basado en cuatro pasos:
- -
Exploración sistemática del útero y los ovarios
- -
Marcadores menores o soft markers
- -
Signo del deslizamiento o sliding sign
- -
Detección de nódulos de endometriosis profunda
Siguiendo este consenso y la Guía de Asistencia Práctica de la Sección de Ecografía de la Sociedad Española de Ginecología y Obstetricia (SEGO). A continuación, se comentarán trucos y recomendaciones para realizar una correcta exploración ecográfica de la endometriosis ovárica y profunda.
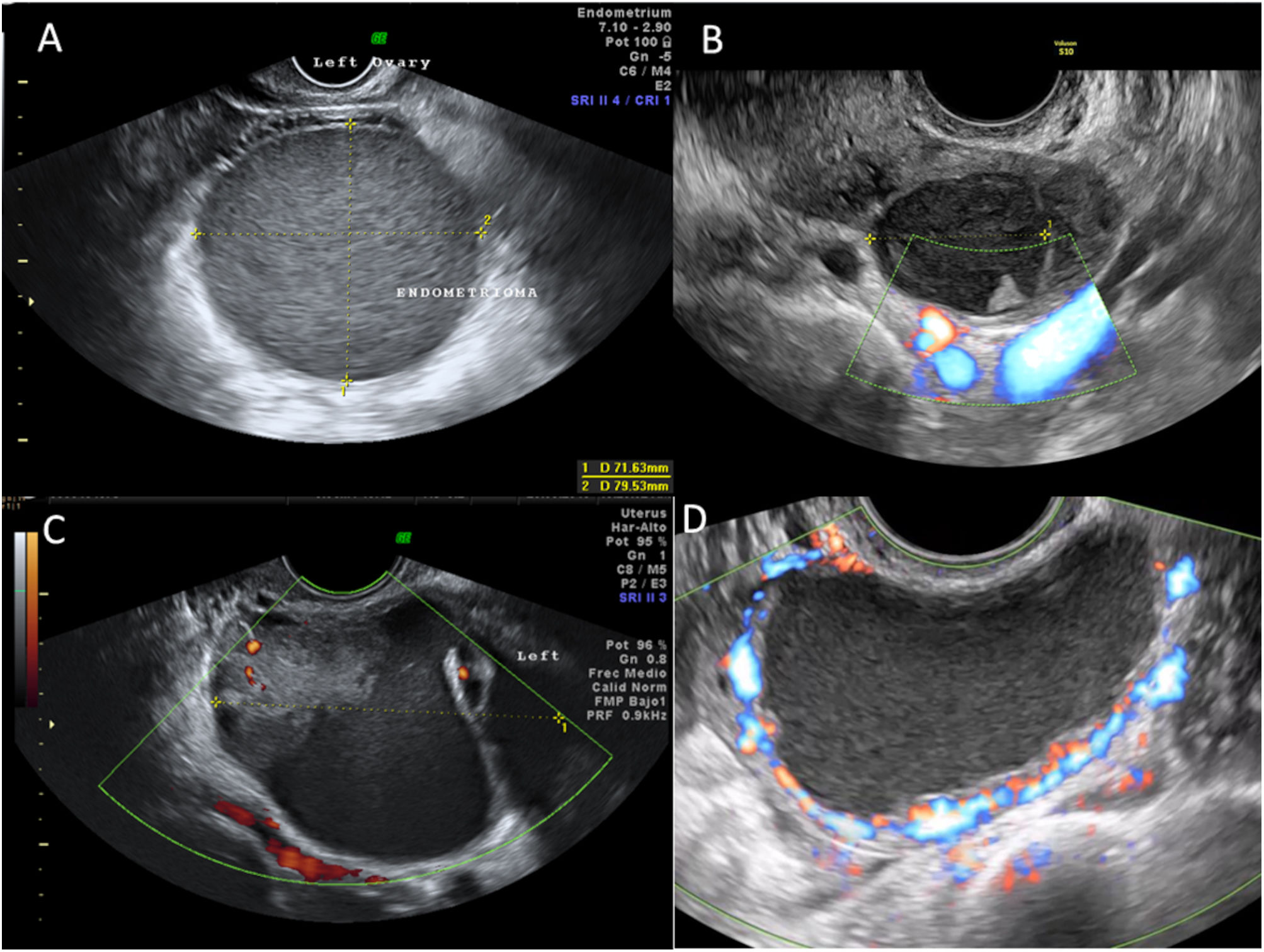
Ecografía de la endometriosis ováricaLa endometriosis ovárica supone la presencia de endometriomas. Un endometrioma típico se describe como una tumoración quística uni o bilateral, de pared gruesa y contenido homogéneo con ecos de intensidad media (patrón en vidrio esmerilado o ground glass). Puede ser multitabicada y tener focos ecogénicos parietales. Su patrón de vascularización es periférico (score 1-3)29.
Sin embargo, no todos los endometriomas siempre se presentan con su patrón típico. Existen los endometriomas atípicos, que se describen como masas uniloculares sólidas, pues presentan depósitos ecogénicos o papilas no vascularizadas. El patrón de vascularización debe de ser periférica y escasa en estos tumores, pues si las papilas presentan vascularización central, es imprescindible descartar malignidad complementado el estudio con resonancia magnética y marcadores tumorales. Es importante recordar que la endometriosis eleva los marcadores Ca 125 y Ca 19.9. por lo que otros marcadores ováricos, como el HE4, podrían ser de mucha mayor utilidad para descartar malignidad ante estas situaciones30.
Un caso especial sería el de un endometrioma decidualizado, que se puede observar durante la gestación, con papilas vascularizadas de contorno liso y crecimiento rápido (fig. 3).
Además de los ovarios, es necesario explorar las trompas. En condiciones normales, las trompas no suelen ser visibles por ecografía si no inyectamos sustancias ecorrefringentes para estudiar su permeabilidad. Pero existen implantes de endometriosis tubáricos que pueden causar hidrosálpinx o hematosálpinx, incluso piosálpinx si existe una sobreinfección de la misma. Los hidrosálpinx presentan paredes gruesas con tabiques incompletos. Es necesario diferenciarlos de los pseudoquistes adherenciales perianexiales, uno de los marcadores menores que se comentarán a continuación.
Marcadores menores o soft markersPodemos describir los marcadores menores o soft markers como marcadores indirectos que permiten sospechar la presencia de una endometriosis profunda. El consenso International Deep Endometriosis Analysis group (IDEA)28 describe los siguientes marcadores menores: pseudoquistes adherenciales perianexiales, líquido libre tabicado en Douglas, ovarios fijos, zonas sensibles a la presión, y útero en forma de coma.
Los pseudoquistes adherenciales perianexiales son colecciones quísticas de paredes finas, que se adaptan a estructuras adyacentes (diagnóstico diferencial con el hidrosálpinx). Suelen tener tabiques completos, laxos. Es importante describirlos en el informe ecográfico, tanto para indicar al clínico que lo hemos evaluado y no nos parece un hidrosálpinx, como porque se ha demostrado que pueden englobar a las trompas sin causar hidrosálpinx31.
En pacientes con endometriosis, es frecuente encontrar pequeñas cantidades de líquido en Douglas, con tabiques completos laxos, que a veces traducen un pequeño bolsillo peritoneal causado por un foco de endometriosis superficial.
El tercer marcador menor sería la evaluación de la movilidad ovárica respecto a las estructuras adyacentes. Un ovario puede estar completamente libre, si se desliza tanto en su lado medial (con el útero), como en el lateral (con las asas intestinales); puede tener una movilidad reducida, si los movimientos de deslizamiento están algo restringidos; o bien puede estar completamente adherido al útero, retrocérvix o a las asas intestinales. Estas adherencias pueden ser causadas por una cirugía previa (por ejemplo, una quistectomía de cualquier estirpe histológica), o bien por la propia endometriosis superficial y/o profunda, con antecedentes quirúrgico o no.
Un área sensible es que la causa dolor o molestia de forma selectiva a la paciente en ser explorada con la sonda ecográfica. Este dato puede ser un marcador indirecto de enfermedad y debe ser reportado en el informe ecográfico32.
Finalmente, focos de endometriosis profunda, sobre todo en compartimento posterior, pueden retraer el útero, de forma que se asemeje a un útero en retroversión cuando su posición congénita es la anteversión. Este útero en forma de «coma», con cérvix en anteversión y cuerpo retraído hacia posterior, constituye el último marcador menor de sospecha de endometriosis (fig. 4).
Se ha demostrado que la presencia de estos marcadores en la ecografía incrementa la probabilidad de tener endometriomas, endometriosis superficial, endometriosis profunda, de que la eventual cirugía sea más compleja, y de tener patología tubárica sin hidrosálpinx31–35.
Signo del deslizamiento o sliding signEl signo de deslizamiento no es más que un marcador menor (indirecto) que, por su alta rentabilidad diagnóstica36, ocupa un escalón específico en la exploración sistemática.
Consiste en objetivar que existe un correcto deslizamiento del útero respecto los órganos adyacentes, y se divide en:
- -
Sliding signanterior: se considera positivo cuando existe un correcto deslizamiento entre la cara anterior uterina y la posterior de la vejiga urinaria; y negativo cuando se identifican adherencias a nivel de plica vesicouterina.
- -
Sliding singposterior retrouterino: se considera positivo cuando existe un correcto deslizamiento entre la cara posterior del cuerpo uterino y la anterior del rectosigma; y negativo cuando se identifican adherencias a este nivel.
- -
Sliding singposterior retrocervical: se considera positivo cuando existe un correcto deslizamiento entre la cara posterior del cérvix uterino y la anterior del recto; y negativo cuando se identifican adherencias a nivel de los ligamentos uterosacros.
Se sabe que la presencia de signos del deslizamiento negativos es tres veces superior en mujeres con endometriosis que en mujeres sin la enfermedad37, y que las adherencias en cara posterior aumentan significativamente la probabilidad de tener enfermedad intestinal, con una sensibilidad de 81%. Pero, interesante también, que la especificidad es de 95%, suponiendo que un correcto deslizamiento posterior prácticamente excluye la presencia en enfermedad intestinal asociada38.
Detección de nódulos de endometriosis profundaEl cuarto escalón de la exploración sistemática descrita por el grupo IDEA28 es la identificación directa y la descripción de los nódulos de endometriosis profunda, que pueden encontrarse en las siguientes localizaciones:
- -
Compartimento anterior: vejiga y uréteres.
- -
Compartimento posterior: torus uterino, ligamentos uterosacros, fórnix vaginal, pared vaginal, tabique rectovaginal y cara anterior del rectosigma.
La endometriosis vesical se define como la presencia de tejido endometriósico que invade el músculo detrusor de la vejiga. Se trata de lesiones hipoecogénicas lineales o nodulares, esféricas o en forma de coma, con escasa captación en el estudio Doppler. Para poder explorar las paredes vesicales, es necesario colocar la sonda en el fórnix vaginal anterior y desplazarse de lado a lado. La identificación de eventuales nódulos a este nivel se facilita si existe una pequeña cantidad de orina en vejiga.
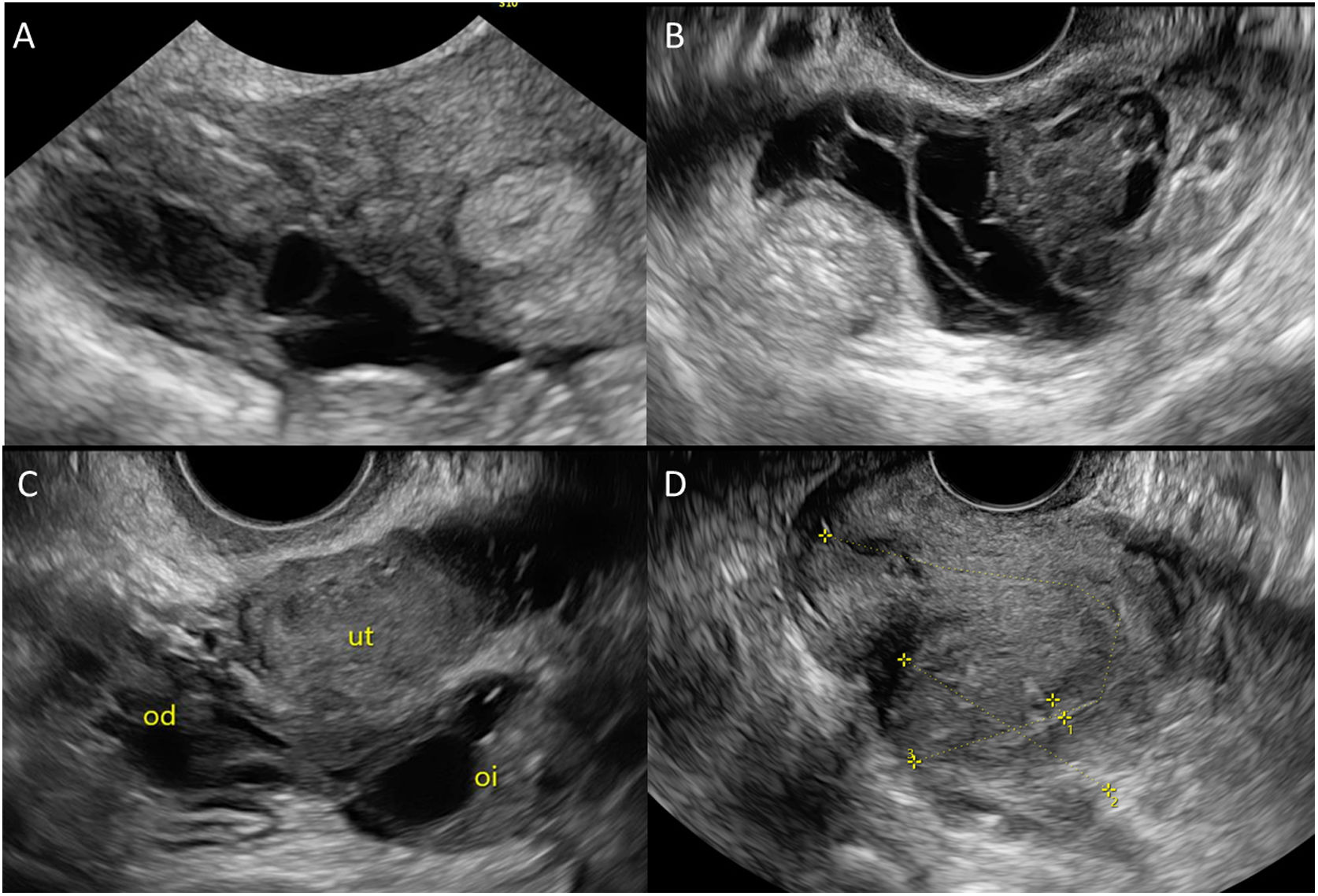
Si se identifica un nódulo sospechoso de endometriosis, es necesario describirlo indicando sus medidas (tres diámetros), la localización (base, cúpula, trígono o extraperitoneal), el grado de infiltración (parcial o total) y la distancia a meatos ureterales. Las localizaciones más frecuentes son la base y la cúpula vesical, que se separan por el pliegue peritoneal vesicouterino (fig. 5).
Si comparamos la ecografía transvaginal con otras pruebas para el diagnóstico de la endometriosis vesical, podemos concluir que su precisión es parecida a la resonancia magnética, siendo la especificidad excelente39. Respecto a la infiltración y la evaluación de los meatos ureterales, la ecografía coincidió con la cistoscopia en la totalidad de los casos40, siendo incluso superior en el diagnóstico y planificación de la cirugía41. Aunque las reconstrucciones de la ecografía 3D fueron más precisas que las imágenes 2D en la estimación del volumen del nódulo vesical, no existieron diferencias entre ambas técnicas ecográficas en la detección de nódulos, medición ni identificación de uréteres distales42. Por lo tanto, hasta el momento, la ecografía transvaginal debe considerarse como la herramienta de primera línea en el diagnóstico de la endometriosis vesical.
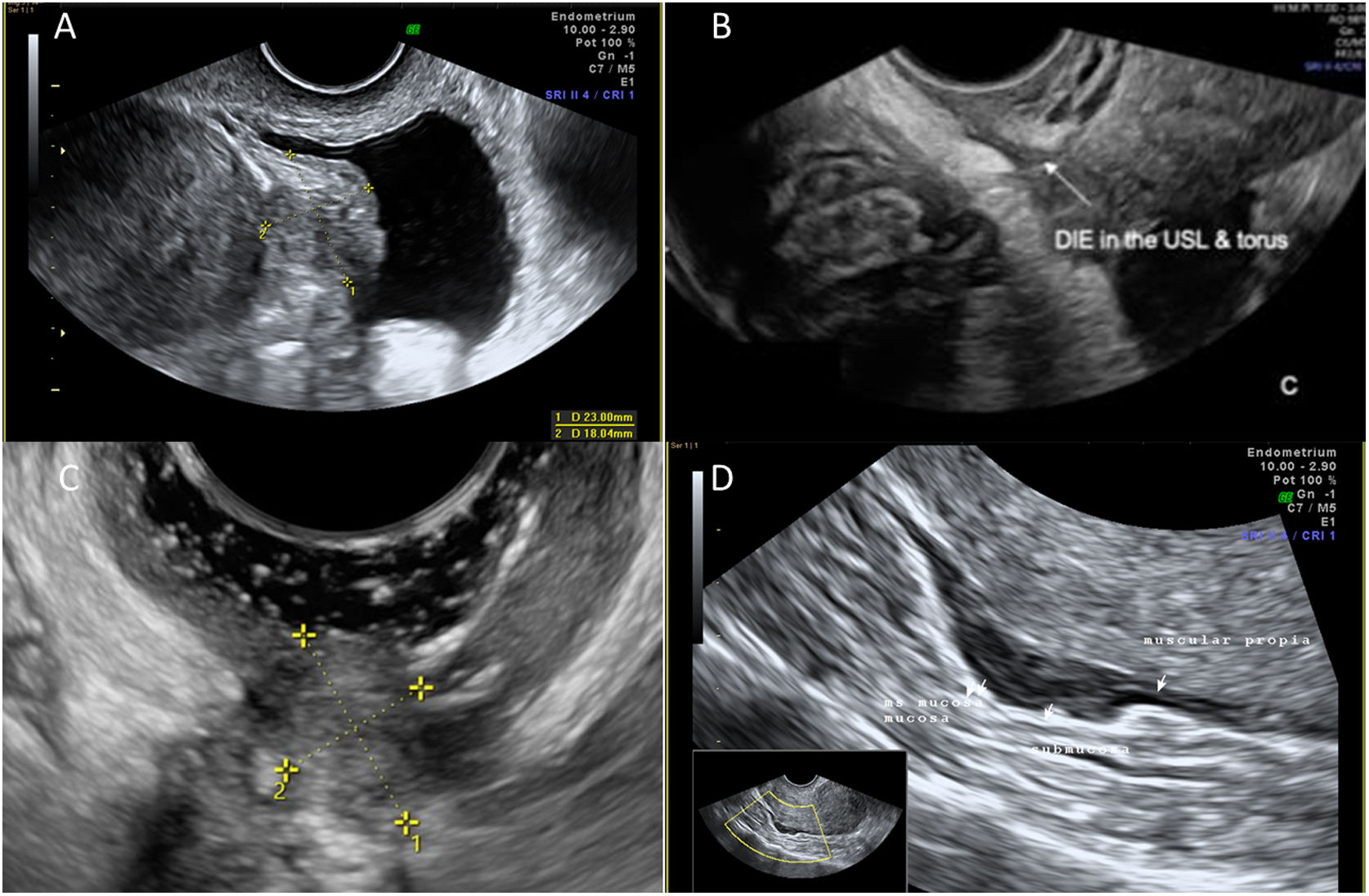
El torus uterino y los ligamentos uterosacros son las localizaciones más frecuentes de los nódulos de endometriosis profunda. A este nivel, se pueden identificar nódulos hipoecoicos espiculados o de bordes regulares colocando la sonda vaginal en el fórnix vaginal derecho, y desplazándola hacia el izquierdo por la parte posterior de la vagina43. Con este movimiento de la sonda, la detección de los nódulos fue muy precisa, comparando la ecografía con los hallazgos laparoscópicos44. Si el foco hipoecoico se dirige hacia lateral, es posible que englobe el parametrio, mucho menos frecuentemente afectado que los ligamentos uterosacros. A nivel parametrial, la sensibilidad diagnóstica de la ecografía es baja (31%), mientras la especificidad es muy elevada (98%)45. Es importante recordar, que son los nódulos parametriales los que tiene más riesgo de provocar una obstrucción ureteral en el cruce de ambas estructuras, con la consecuente hidronefrosis46. Así, se aconseja la valoración de ambos riñones por vía abdominal ante la presencia de patología en compartimento posterior.
Los nódulos a nivel de uterosacro pueden llegar a infiltrar el fórnix vaginal, incluso las parades vaginales (nódulos asociados a otros del compartimento posterior, o aislados). Para facilitar la detección de los nódulos vaginales, es útil introducir unos 20 cm3 de gel del ecógrafo en la vagina para crear el contraste adecuado, o bien en un dedo de guante. Cuando se asocian un nódulo de fórnix vaginal, uterosacro y rectal anterior se forma el «signo del reloj de arena» o diabolo-like (fig. 5).
Se considera un nódulo de endometriosis profunda de rectosigma cuando afecta como mínimo la muscularis propia rectal anterior. Si solo afecta la serosa, se considera una adherencia intestinal. Los nódulos se identifican como engrosamientos hipoecoicos de la muscularis propia (capa hipoecogénica bajo la serosa hiperecogénica). Ante dicho engrosamiento, se debe describir su medida (tres diámetros), la distancia al ano, el porcentaje de circunferencia que ocupa el nódulo y su grado de infiltración (afectación de submucosa o no). Una manera de definir la localización del nódulo respecto al ano es medir la distancia desde la segunda curvatura del intestino, que se encuentra a 8 cm del ano, al borde caudal del nódulo26 (fig. 5).
El tabique rectovaginal es la membrana hiperecoica que se encuentra entre la pared vaginal posterior, y la serosa rectal anterior en su parte más caudal, es decir, caudal al cérvix uterino. La endometriosis a este nivel es excepcional, a pesar de que de forma errónea si suele describir la endometriosis del compartimento posterior como endometriosis del tabique rectovaginal.
En un reciente metaanálisis, la sensibilidad de la ecografía transvaginal (89%) para la detección de la endometriosis rectal parece ser ligeramente mejor que la de la resonancia magnética (86%). La especificidad de ambas técnicas fue excelente. Por lo tanto, por su simplicidad, rapidez y accesibilidad, la ecografía se considera la herramienta de diagnóstico de primera línea para las mujeres con sospecha de endometriosis profunda en compartimento posterior47.
ConclusionesLa ecografía transvaginal se considera la primera prueba diagnóstica en el estudio de la mujer con miomas, adenomiosis y endometriosis ovárica y profunda. Iguala e incluso supera a la laparoscopia diagnóstica, por lo que se considera imprescindible solicitar un estudio de imagen previo a un tratamiento quirúrgico. Se recomienda realizar la ecografía siguiendo la sistemática exploratoria propuesta tras el consenso MUSA7 para la patología miometrial, y el consenso IDEA26 para la endometriosis.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónLa redacción del presente artículo no ha requerido ninguna financiación.
Conflicto de interesesLos autores no presentan conflictos de intereses.