Editado por: Dr. Francisco Carmona y Dra. MªÁngeles Martínez Zamora
Última actualización: Julio 2023
Más datosEl objetivo del tratamiento de los miomas es: control de los síntomas, revertir la anemia (si existe) y restaurar la calidad de vida. En caso de deseo genésico futuro se añade el objetivo de conseguir la restauración anatómica del útero, fundamentalmente en lo que se refiere a la cavidad uterina.
El tratamiento profiláctico para prevenir futuras complicaciones de los miomas no se recomienda salvo algunas excepciones, como mujeres con miomas submucosos resecables por histeroscopia que desean gestación o mujeres con grandes úteros miomatosos con extensión lateral que condicionan la compresión ureteral y provocan hidronefrosis moderada o severa.
Existe un amplio consenso en que la aproximación a esta patología se debe realizar centrada en la paciente, con una toma de decisiones compartida y basada en la información adecuada, cumpliendo los objetivos de la mujer a corto y a largo plazo. La información ofrecida debe abarcar todas las opciones posibles y el balance riesgo/beneficio de cada una de ellas. Todas las opciones disponibles tienen eficacia demostrada, pero no disponemos de estudios de calidad que comparen unas opciones con otras.
Se exponen en este artículo las opciones de tratamiento médico disponibles actualmente y las opciones emergentes.
The goal of treating fibroids is symptom control, reversing anaemia (if present), and restoring quality of life. In the event of future reproductive desire, the objective is also to achieve anatomical restoration of the uterus, fundamentally with regard to the uterine cavity.
Prophylactic treatment to prevent future complications of fibroids is not recommended with a few exceptions, such as women with hysteroscopically resectable submucosal fibroids who wish to become pregnant or women with large fibroid uteri with lateral extension causing ureteral compression and moderate or severe hydronephrosis.
There is a broad consensus that the approach to this pathology should be patient-centred, with shared decision-making based on adequate information, meeting the short and long-term objectives of the woman. The information offered must cover all possible options and the risk/benefit balance of each. All the available options have proven efficacy, but we do not have quality studies comparing the options.
Presently available medical treatment options and emerging options are discussed in this article.
En el presente artículo intentaremos recoger los datos y las ideas lanzadas en la ponencia del mismo título presentada en el ICongreso de la Sociedad Española para el estudio de los Miomas y la Endometriosis (SEEME), que tuvo lugar en la ciudad de Toledo los pasados 22 y 23 de septiembre de 2022.
Dada la gran prevalencia de los miomas uterinos, la afectación de la calidad de vida que conllevan y la creciente demanda de procedimientos no invasivos para el tratamiento de esta patología, estamos obligados a desarrollar nuevas alternativas terapéuticas en el manejo de los miomas uterinos1-3.
Recogiendo estas ideas, ha sido una seña de identidad de nuestro servicio de ginecología cambiar el paradigma clásico de la cirugía como terapia habitual en el manejo de los miomas hacia un manejo prioritariamente médico y recurrir solo a procedimientos intervencionistas (quirúrgico o no) cuando el tratamiento médico resulta insuficiente o ha fracasado. La aparición del acetato de ulipristal (AUP) en 2012 parecía darnos el arma definitiva para este cambio, preguntándonos, nosotros y otros, dónde quedaba la cirugía4. Los procedimientos de la Agencia Europea del Medicamento (EMA) en torno a la seguridad del AUP parecían dejarnos huérfanos de un fármaco realmente eficaz en gran parte de las situaciones asociadas a los miomas uterinos. Todo esto pertenece al pasado, lo que nos ha quedado define el presente y lo que pueda venir abre el futuro, de ahí el título de la ponencia. Me ha parecido pertinente incluir a toda la sección de patología orgánica benigna de nuestro servicio como coautores de este artículo: el trabajo en equipo de todos estos años permite plantear ahora modos de manejo de los miomas, basados en la evidencia científica, y en la experiencia acumulada de un grupo de profesionales.
Planteamiento general del tratamiento de los miomasEl objetivo del tratamiento de los miomas es: control de los síntomas, revertir la anemia (si existe) y restaurar la calidad de vida. En caso de deseo genésico futuro se añade el objetivo de conseguir la restauración anatómica del útero, fundamentalmente en lo que se refiere a la cavidad uterina5.
El tratamiento profiláctico para prevenir futuras complicaciones de los miomas no se recomienda salvo algunas excepciones, como mujeres con miomas submucosos resecables por histeroscopia que desean gestación6 o mujeres con grandes úteros miomatosos con extensión lateral que condicionan compresión ureteral y provocan hidronefrosis moderada o severa5.
En caso de sospecha clínica y/o ecográfica de malignidad no se recomienda la cirugía para descartar malignidad (grado de recomendación1B), debiéndose realizar una RNM y actuar según los hallazgos de la misma7.
Existe un amplio consenso en que la aproximación a esta patología se debe realizar centrada en la paciente, con una toma de decisiones compartida y basada en la información adecuada, cumpliendo los objetivos de la mujer a corto y a largo plazo. La información ofrecida debe abarcar todas las opciones posibles y el balance riesgo/beneficio de cada una de ellas8. Todas las opciones disponibles tienen eficacia demostrada, pero no disponemos de estudios de calidad que comparen unas opciones con otras9.
Tipos de tratamientos médicosEn la tabla 1 aparecen reflejadas las diferentes opciones de tratamiento médico disponibles en el año 2015, fecha de publicación de la última Guía de Asistencia Práctica de la SEGO, algunas clásicas, otras emergentes con fuerza en aquel momento y las posibilidades a futuro5.
Tratamientos médicos de los miomas5
| AINE | Si síntoma principal dismenorrea |
| Antifibrinolíticos | Si síntoma principal menorragia |
| Estrógenos / Gestágenos | Si síntoma principal menorragia |
| Análogos Gn-RH | Disminuye tamaño mioma. Inhibe sangrado. Importantes efectos secundarios |
| Antagonistas Gn-RH | Requieren más estudios para su uso clínico |
| SERM | Requieren más estudios para su uso clínico |
| Inhibidores de la aromatasa | Disminuye tamaño mioma. Inhibe sangrado. Requieren más estudios para su uso clínico |
| Antiprogestágenos (acetato ulipristal) | Disminuye tamaño mioma. Inhibe sangrado. Mejora el dolor. Pocos efectos secundarios |
| Fármacos androgénicos | Los estudios actuales no recomiendan su uso clínico en el tratamiento de los miomas |
| DIU liberador levonorgestrel | Si síntoma principal menorragia |
| Tratamientos no hormonales | En estudio |
A día de hoy, ante la falta de estudios que los avalen, podemos decir que los moduladores selectivos del receptor estrogénico (selective estrogen receptor modulators [SERM]), los inhibidores de la aromatasa y los fármacos androgénicos no son una alternativa viable. Los fármacos de los que disponemos hoy en día, y las posibles terapias emergentes, podemos dividirlos en dos grupos9,10:
- 1.
Tratamientos sintomáticos: aquellos cuyo mecanismo de acción se limita a controlar los síntomas de los miomas (generalmente sangrado o dolor):
- -
Antiinflamatorios no esteroideos (AINE).
- -
Antifibrinolíticos.
- -
Estrógenos/gestágenos.
- -
DIU-LVNG.
- 2.
Tratamientos específicos: los que controlan estos síntomas actuando también sobre el mioma, reduciendo el volumen y normalizando el sangrado menstrual:
- -
Agonistas de Gn-RH.
- -
Acetato de ulipristal (AUP).
- -
Antagonistas de Gn-RH.
- •
Ferroterapia. Imprescindible desde el momento inicial en caso de anemia, se pauta de manera crónica para mantener los niveles de hemoglobina estables. La vía habitual es la oral, y también se puede administrar por vía intravenosa si fuese necesario.
- •
Ácido tranexámico. Se recomienda su uso en miomas, aunque la evidencia no es tan clara como en el caso de sangrado uterino anómalo (SUA) de origen funcional (disovulatorio). La necrosis y la trombosis de los miomas son más frecuentes en usuarias de ácido tranexámico (15%) que en no usuarias (4%).
- •
AINE. Están indicados como analgésicos o para controlar la dismenorrea; su utilidad para el control del sangrado en caso de existencia de miomas es limitada
Están dirigidos a controlar la clínica de sangrado, habitualmente sangrado menstrual abundante (SMA). Estos tratamientos, en general, no influyen sobre la evolución en el crecimiento/involución del volumen de los miomas. Podemos decir que los tratamientos médicos hormonales que se usan en el manejo del SUA de origen funcional resultan útiles en el manejo de los síntomas hemorrágicos asociados a la presencia de miomas uterinos12,13.
Los resultados, a nivel de control de síntomas hemorrágicos, de los tratamientos sintomáticos son muy similares a los específicos en caso de miomas menores de 3-5cm y cavidades uterinas no deformadas o con mínimas deformidades11,14,15.
- •
Anticonceptivos. Especialmente indicados en caso de cavidades normales o con leves distorsiones de estas y deseo de anticoncepción. La pauta de valerato de estradiol y dienogest en pauta cuatrifásica se considera de primera línea en el manejo del SUA en general (grado de recomendación A)11,16,17.
- •
Gestágenos. Al igual que en el SUA de origen no estructural, se recomiendan pautas de gestágenos continuas (o al menos de más de 21 días/mes) por su mayor eficacia y adherencia11,18.
- •
El DIU LVNG, también considerado de primera línea en el manejo del SUA de origen funcional11, se ha demostrado útil en mujeres seleccionadas con miomas19 y se ha visto que el porcentaje de expulsión en mujeres con miomas y adenomiomas es mayor que cuando se usa como anticonceptivo (25% vs. 10%); este porcentaje aumenta conforme la cavidad se encuentra más distorsionada y en úteros de mayor tamaño20. Se consigue reducir significativamente el porcentaje de expulsión con la comprobación ecográfica de la correcta situación del dispositivo inmediatamente postinserción20.
En pacientes tratadas con acetato de medroxiprogesterona (AMP) depot trimestral se han descrito reducciones de volumen de los miomas de hasta el 35-45%18.
Tratamientos específicosAgonistas Gn-RHIndicados en el tratamiento de los miomas durante un tiempo limitado (entre 4-6 meses), no se recomienda prolongar su uso debido a los efectos secundarios derivados de la situación de deprivación estrogénica creada (sofocos, alteración del sueño, sequedad vaginal, depresión y pérdida de masa ósea)5. Por todo ello, suelen emplearse como tratamiento preoperatorio. Existen varios preparados y vías de administración. Son de uso frecuente los preparados trimestrales de administración depot.
Se busca conseguir cirugías menos agresivas en lo que se refiere a vías de abordaje (laparotomía-laparoscopia-vaginal) y facilitar la realización de miomectomías. Existe evidencia de que se consiguen cirugías con menos complicaciones gracias a la reducción de volumen y vascularización de los miomas y a la recuperación de la anemia preoperatoria. En lo que se refiere específicamente a la histerectomía se ha objetivado: menor sangrado, menor tiempo quirúrgico y menor tasa de complicaciones21. Se pauta el tratamiento durante 3 meses y después se reevalúa la obtención de los objetivos propuestos.
El uso de agonistas de Gn-RH como tratamiento a largo plazo de los miomas es una indicación fuera de ficha técnica, por lo que se debe reservar a casos muy concretos donde otras opciones no sean recomendables. Este tipo de administración está limitado en el tiempo debido a los secundarismos derivados del hipoestrogenismo, por lo que su mantenimiento debería ir acompañado de terapia add-back (gestágenos, estro-progestágenos, raloxifeno o tibolona), controlando los efectos adversos sin disminuir la efectividad22,23.
Acetato de ulipristal (AUP)Esta indicado, en ficha técnica, para el tratamiento intermitente de los síntomas de moderados a graves de los miomas uterinos en mujeres adultas que no han alcanzado la menopausia en edad fértil que no son candidatas a cirugía cuando la embolización de miomas uterinos y/o las opciones de tratamiento quirúrgico no son adecuadas o han fracasado24.
Consigue un rápido control de los síntomas y una progresiva reducción de volumen que puede llevar a restaurar la anatomía uterina. La respuesta al tratamiento es similar independientemente del tamaño inicial de los miomas, con efectos comparables en úteros miomatosos de hasta 20 semanas y sin límite de tamaño en lo que se refiere a los miomas por separado25-32. El tratamiento inicial estándar consiste en 2-4 ciclos trimestrales con AUP (tratamiento de choque). Los datos de eficacia se recogen en la tabla 3.
Comparativa entre los tratamientos específicos aceptados por la EMA
| Tratamientos crónicos específicos de los miomas uterinos | |||
|---|---|---|---|
| Acetato de ulipristal | Relugolix+add-back | Linzagolix | |
| Pauta | Intermitente repetidoCiclos trimestralesTerapia de choque (2-4 ciclos)Tratamiento de mantenimiento (ciclos según la respuesta) | Crónico | Crónico, si se añade add-back |
| Restricciones | La cirugía y/o la embolización no son adecuadas o han fracasado | No | No uso continuado (más de 6 meses) sin añadir add-back o control de DMO |
| Controles hepáticos sistemáticos | Sí | No | No |
| Anticoncepción asegurada | No demostrada | Sí, después del primer mes | No demostrada |
| Control rápido del SUA | 1 semana: reducción del 80%Amenorrea: 80% | 24 semanasNormalización sangrado (<80ml) en 71-80%Amenorrea: 50-60% | 24 semanasNormalización sangrado (<80ml) en 66%-93% (100-200 mg+add back)Amenorrea: 38-60% (100-200 mg+add-back) |
| Control del volumen progresivo del mioma dominante | 3-4 ciclos: reducción del 60-70% | 12-17% | <10-25% (100-200mg+add-back) |
| Efecto postratamiento | Mantenido después de los ciclos | Recuperación rápida de los síntomas y el volumen uterino | Recuperación rápida de los síntomas y el volumen uterino |
Al terminar un ciclo trimestral se debe esperar a la presencia de dos menstruaciones antes de iniciar el siguiente ciclo en el inicio de la segunda menstruación.
Después del tratamiento de choque se detiene la administración de AUP y se espera a la evolución de los síntomas para administrar nuevos ciclos (tratamiento de mantenimiento); la periodicidad de los ciclos vendrá marcada por la respuesta clínica.
La EMA ha evaluado el balance riesgo/beneficio del AUP como consecuencia de la posible asociación del fármaco con casos raros (1/200.000), pero graves, de alteración hepática que pueden conducir a un trasplante hepático. «La decisión sobre si la cirugía es la mejor opción, incluida la histerectomía, debe tomarse entre el médico responsable del tratamiento y la paciente en un contexto de toma de decisiones informadas33.»
En el momento actual se desconoce el eventual mecanismo de alteración hepática en asociación a AUP. Con el objetivo de minimizar el riesgo de alteración hepática severa se ha contraindicado AUP en caso de historia previa de hepatopatía y se han propuesto una seria de controles. La realización estricta de estas medidas no permite descartar absolutamente la posibilidad de aparición de fallo hepático33:
- •
Evaluar la aparición de clínica compatible con fallo hepático; en ese caso, suspender el tratamiento y solicitar pruebas hepáticas.
- •
Control clínico entre ciclos.
- •
Controles de transaminasas (GOT y GPT) en diferentes momentos del tratamiento con AUP:
- -
Previo al inicio de cada ciclo, si los valores basales duplican el límite superior de los valores normales se debe contraindicar el tratamiento.
- -
Durante los dos primeros ciclos se deben controlar las transaminasas mensualmente. Si los valores triplican el límite superior de los valores normales se debe suspender el tratamiento.
- -
Después de cada ciclo se debe solicitar nueva analítica, que serviría como la previa del siguiente ciclo.
En una reciente revisión sistemática se recogen las posibles nuevas opciones farmacológicas para el manejo de los miomas uterinos. Dicha revisión recoge los resultados de mifepristona (27 estudios), vilaprisan (4 estudios), relugolix (4 estudios), elagolix (4 estudios) y linzagolix (4 estudios). Tras el análisis, los autores concluyen que, en base a la alta evidencia, a la eficacia terapéutica y a los efectos adversos leves, los antagonistas de Gn-RH (relugolix, elagolix y vinzagolix) y el vilaprisan representarían las opciones futuras del tratamiento oral en el manejo de los miomas uterinos10.
Un breve comentario sobre vilaprisan: a pesar de los prometedores resultados iniciales, el hecho de que este fármaco forme parte de la familia de los moduladores selectivos de los receptores de progesterona (SPRM), grupo al que pertenece el AUP, ha hecho que los estudios en marcha hayan sido paralizados y no parece que pueda convertirse en una opción de manejo real a corto-medio plazo; por ello no insistiremos en este preparado.
Pasamos a centrarnos en los antagonistas de Gn-RH, que, como expondremos a continuación, aparecen como la terapia emergente más prometedora, especialmente en ciertos perfiles de pacientes.
El mecanismo de acción de los antagonistas de la Gn-RH se basa en el bloqueo reversible de los receptores de la Gn-RH a nivel de hipófisis. A diferencia de los agonistas, donde el estímulo continuado inicial llevaba a la inhibición final por agotamiento, determinando la aparición de un efecto inicial estimulador (flare-up)23, en estos fármacos se produce una inhibición rápida y dosis-dependiente del eje hipofisario-ovárico con reducción rápida de los niveles circulantes de estrógenos y sin la aparición del efecto flare-up34.
El desarrollo de antagonistas de Gn-RH no peptídicos (Elagolix, Relugolix, Linzagolix) nos ofrece la posibilidad de administrar estos fármacos por vía oral, en diferentes pautas según su vida media plasmática. La vía de administración oral ofrece una mayor facilidad de uso respecto a las presentaciones depot, obteniendo una rápida reversibilidad de los efectos una vez suspendido el tratamiento, tanto de los secundarismos como de los efectos beneficiosos34.
La principal limitación de estos medicamentos, al igual que con los agonistas Gn-RH, son los efectos derivados del hipoestrogenismo que se produce, y debido a ello se debe administrar en tratamientos a largo plazo (por encima de 4-6 meses) terapia add-back (TAB). Los estudios fase3 se han realizado asociando TAB de baja dosis hormonal (etinilestradiol 1mg +acetato de noretisterona 0,5mg cada 24h), demostrando excelentes resultados en el control clínico, sin diferencias significativas respecto al control observado con antagonistas de Gn-RH en monoterapia. La adición de TAB ofrece una reducción considerable de los efectos secundarios, al mismo tiempo que mantiene la pérdida de masa ósea a un nivel equivalente a placebo aun en tratamientos a largo plazo. Los efectos secundarios más frecuentemente asociados son cefalea, náuseas y sofocaciones. No se han reportado elevaciones significativas de enzimas hepáticos o alteraciones endometriales con ningún antagonista de Gn-RH.
- •
Elagolix. Se encuentra disponible en Estados Unidos desde mayo de 2020, pero no ha sido aceptado por la EMA a fecha actual. Una revisión sistemática y metaanálisis35 sobre el uso de esta molécula para el tratamiento del SMA asociado a miomas uterinos incluyó 4 RCT, concluyendo que Elagolix mejora el sangrado menstrual asociado a miomas, disminuye el volumen de estos, mejora la calidad de vida cuando se compara con placebo y ofrece un perfil de tolerancia adecuado si se combina con add back.
- •
Relugolix. A dosis de 40mg/24horas ha demostrado ser no inferior al tratamiento con leuprorelina mensual en la mejora del sangrado asociado a miomas uterinos, ofreciendo una mayor rapidez en conseguir dicho control36. Se han publicado estudios fase 3 (LIBERTYI yII)37 de tratamiento mantenido con add-back, con buenos resultados en términos de eficacia (control de sangrado y reducción de volumen), escasos secundarismos y seguridad a nivel óseo, y se observó que la densidad mineral ósea se mantiene en el grupo tratado con Relugolix +TAB sin diferencias significativas respecto al grupo placebo en tratamientos de hasta 52 semanas. El tratamiento con Relugolix +TAB es un tratamiento crónico, efectivo mientras se mantiene el tratamiento, pero cuyos efectos revierten al finalizarlo. La combinación diaria de Relugolix 40mg y TAB (hemihidrato de estradiol 1mg con 0,5mg de acetato de noretisterona) por vía oral ya ha sido aceptada por la EMA para el tratamiento crónico de los síntomas moderados a graves de los miomas uterinos en mujeres adultas en edad reproductiva38 y está pendiente de ser comercializada en nuestro país. Esta combinación va a estar disponible en un solo comprimido diario, lo que se espera mejore el cumplimiento terapéutico. Los datos sobre eficacia se incluyen en la tabla 3.
- •
Linzagolix. También ha demostrado eficacia en el control del SMA. Los estudios fase3 (PRIMROSEI yII)39 demostraron dicha eficacia con dosis de 100 y 200mg/24horas con y sin TAB. Los datos de efectividad pueden verse en la tabla 3. Este compuesto también ha sido recientemente autorizado por la EMA para su comercialización en Europa40.
No trataremos de desarrollar ahora un protocolo para el manejo de las pacientes con miomas, simplemente queremos ubicar el tratamiento médico entre todas las posibilidades existentes. La presentación clínica de la miomatosis uterina es extremadamente heterogénea, y serán una serie de características las que definan los perfiles de paciente existentes. Esas características son: tipo de clínica presente, deseo gestacional completado o pendiente, edad y características de los miomas. En base a esto podemos distinguir varios perfiles de paciente.
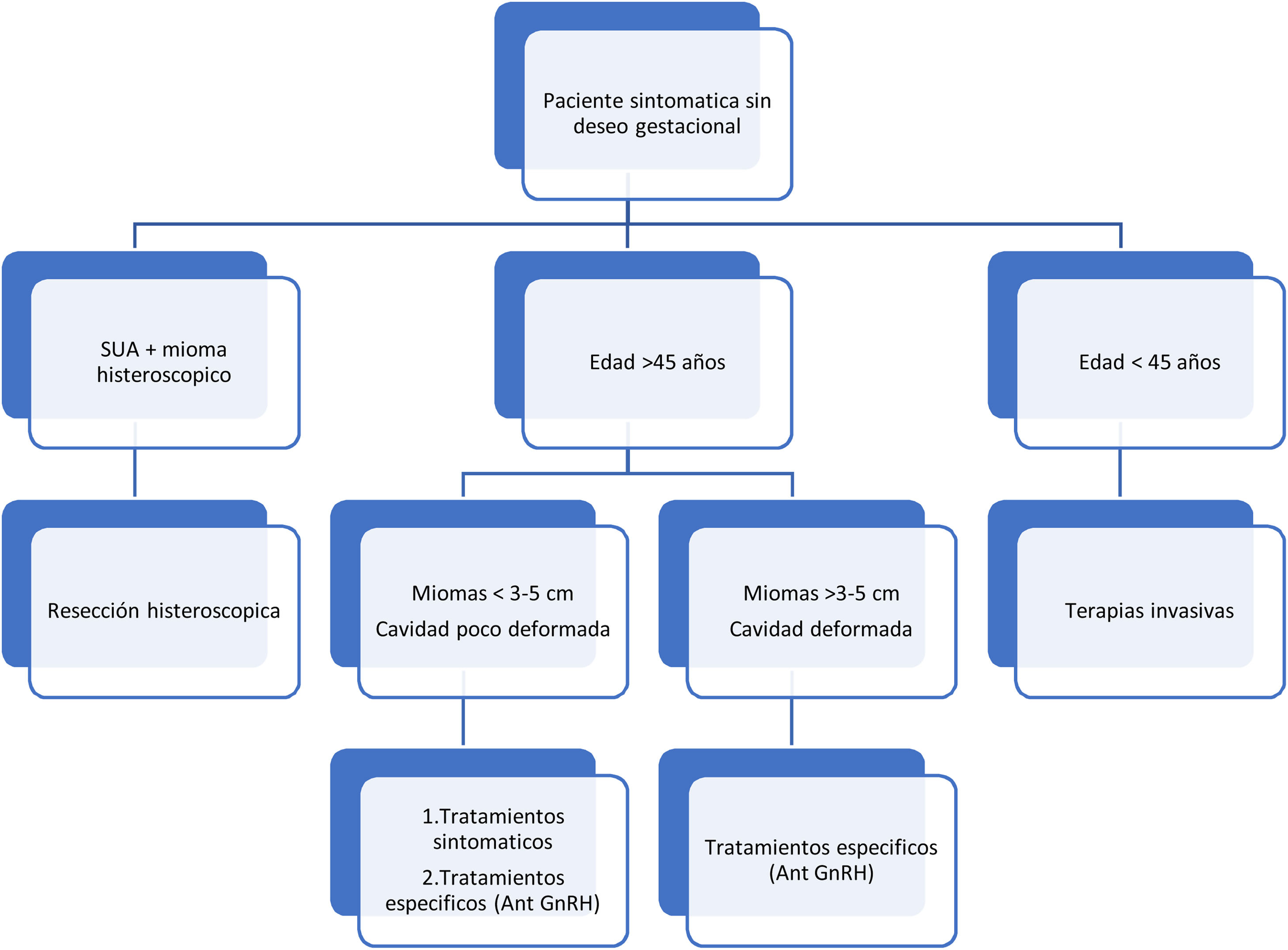
Paciente sintomática (sangrado menstrual abundante [SMA] y/o clínica compresiva) y no deseo gestacional (Algoritmo 1)El objetivo fundamental en estas pacientes consistirá en controlar los síntomas y alcanzar la menopausia libre de síntomas5,13. No podemos establecer un límite de edad para orientar hacia un tratamiento médico de manera prioritaria o considerar las terapias invasivas como de elección, no disponemos de evidencia científica a este respecto. Llegar hasta la menopausia con tratamiento médico (edad media en España: 52años) parece más sencillo desde una edad más cercana a la misma. El límite de 45años podría ser una buena opción para orientar el tratamiento, planteando tratamientos médicos a partir de esa edad y orientando hacia la terapia más invasiva por debajo de ese límite. Debido a esta arbitrariedad, recordar que es esta una decisión que se debe enmarcar dentro del ámbito de decisiones informadas y consensuadas con la paciente8, ofreciendo otras alternativas, sin excluir ninguna únicamente por criterios de edad. La única excepción a este supuesto sería la de los miomas resecables por histeroscopia, donde esta técnica sigue siendo el tratamiento de elección6,13.
Con miomas menores de 3-5cm y ausencia o mínima deformación de la cavidad los tratamientos sintomáticos son altamente efectivos en el control del SMA. Miomas mayores o con gran deformidad de la cavidad suelen necesitar la terapia con fármacos con indicación específica de tratamiento de los miomas11,15. Debido a las restricciones impuestas al AUP por motivos de seguridad33, los antagonistas Gn-RH parecen ser la alternativa futura para el tratamiento médico a largo plazo de las pacientes que precisan control rápido de síntomas y reducción volumétrica progresiva, de cara a alcanzar la menopausia sin necesidad de realizar una intervención quirúrgica.
Respecto a si existe un límite de tamaño para descartar el uso del tratamiento médico, la evidencia científica nos dice en qué tipos de miomas sabemos que el tratamiento es efectivo, lo que no implica que en tamaños superiores no lo sea (tabla 4)25,26,31,32,37,39.
Criterios de exclusión (tamaño) en estudios fase III
| Acetato de ulipristal | Relugolix+add back | Linzagolix |
|---|---|---|
| 2012 PEARL: mioma <10 cm / útero <16 semanas2018 VENUS: no límite de cm mioma / útero <20 semanas | No límite de tamañoVolumen uterino medio: 400 (±350) cm3Excluyen los miomas en crecimiento «en opinión del investigador» | Mioma <12cm |
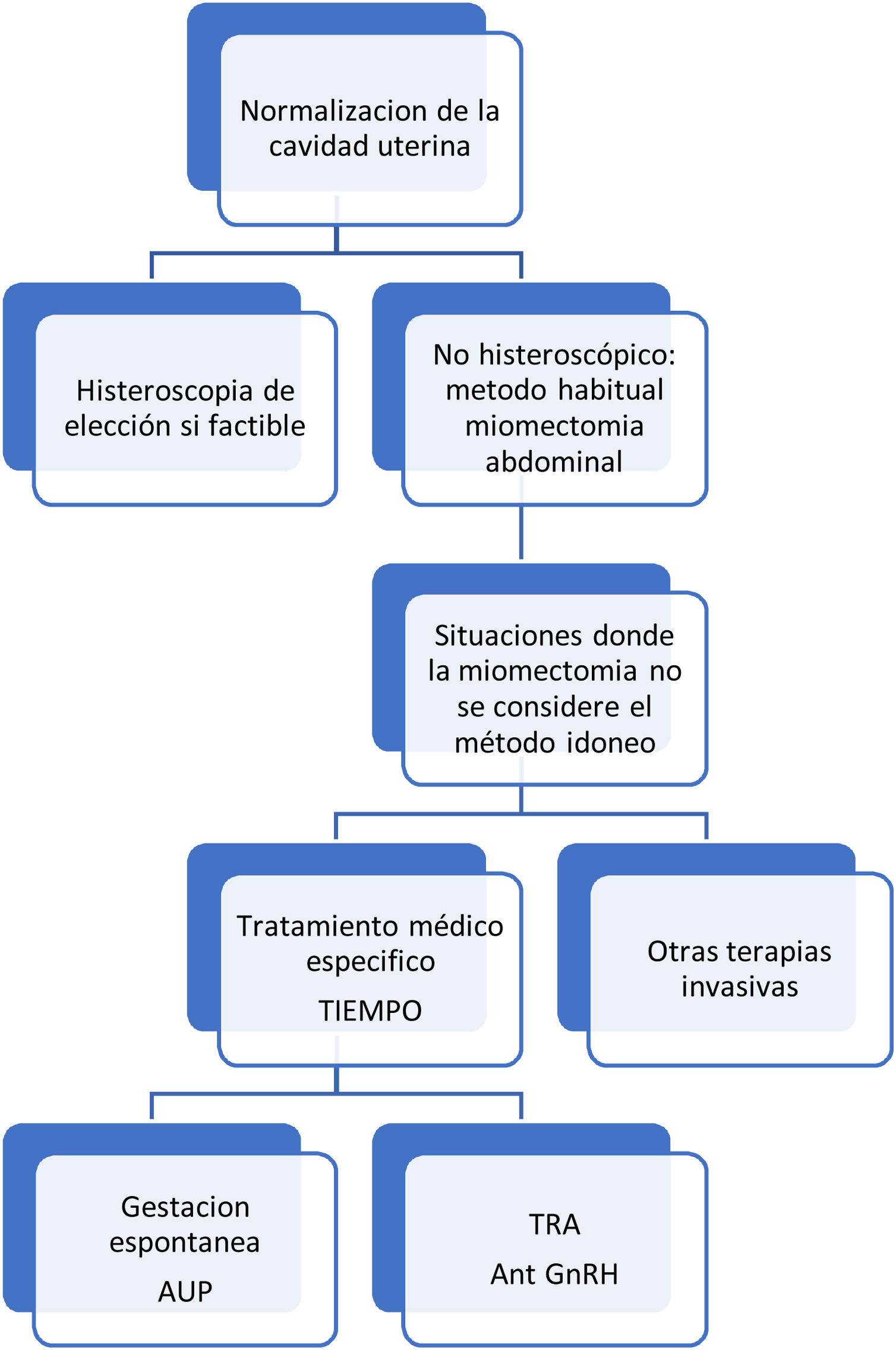
Nos referimos aquí a las pacientes que buscan una gestación de manera espontánea, ya sea de forma inmediata o diferida. Debemos recordar que los el tratamiento activo con fármacos específicos para el control de los miomas (AUP, agonistas y antagonistas de Gn-RH) es incompatible con la búsqueda de gestación. El objetivo del tratamiento médico es doble13: 1) control sintomático (si existe clínica) hasta llegar al momento donde el deseo gestacional sea inmediato; y 2) normalización anatómica del útero, especialmente en lo que se refiere a la distorsiones de la cavidad uterina provocadas por miomas submucosos, ya que son estos los que condicionan una disminución de la fertilidad41. La resección histeroscópica de los miomas submucosos sigue siendo el tratamiento de primera línea para normalizar la cavidad6. En determinados miomas submucosos (tipos II/III), no resecables por histeroscopia y que no provocan grandes distorsiones de la cavidad, se podría intentar la reducción del volumen del mioma con tratamientos médicos específicos y así conseguir la restauración anatómica uterina.
El factor que limita este planteamiento es el tiempo. Los tratamientos médicos específicos en general, consiguen reducciones de volumen progresivas, pudiendo ser necesarios varios meses para conseguir reducciones de volumen moderadas (tabla 3). Dicha reducción puede ser insuficiente cuando buscamos rapidez o una gran disminución del volumen del mioma. El mecanismo de acción de los antagonistas de la GN RH,hace que su efecto sobre los miomas desaparezca rápidamente con una recuperación del volumen al detener el tratamiento. Por ambos motivos consideramos que en este perfil de pacientes los antagonistas tendrán un papel limitado, a pesar de que pueden tener un papel relevante cuando se plantea éste tratamiento previamente a técnicas de reproducción asistida, como se expone en el siguiente apartado.
El AUP es el único fármaco que mantiene su efecto después de finalizada su administración, abriendo así ventanas de tiempo (de hasta 6-12 meses)27-30 en las que buscar la gestación de manera espontánea. A pesar de esta ventaja, dado el perfil de efectos secundarios y las restricciones en las indicaciones de AUP, su uso será limitado.
En la búsqueda de gestación espontanea la reducción del volumen del mioma se debe mantener después de finalizado el tratamiento. En pacientes susceptibles de ténicas de reproducción asistida (TRA) los antagonistas podrían tener un papel más relevante. En este grupo de pacientes el planteamiento sería similar al del grupo anterior, pero con la ventaja de no precisar mantener la normalización tan a largo plazo, ya que la TRA se puede programar inmediatamente después de finalizar el tratamiento. Asimismo, persisten las mismas limitaciones sobre el tiempo necesario para la reducción de tamaño y el volumen que podamos llegar a reducir.
Respecto a los miomas intramurales (tipos 3 a 6), donde no hay una evidencia de su efecto negativo sobre la fertilidad espontánea, sí se recomienda tratarlos, especialmente en caso de TRA fallidas42. Donnez plantea manejo expectante en miomas de menos de 3cm, tratamiento médico (3-6meses) y luego TRA (o incluso búsqueda de gestación) si se consigue reducción del mioma, y cirugía si no se consigue un tamaño menor de 4-5cm.
Conclusiones- •
La decisión sobre el tipo de tratamiento se debe basar en la información y el consenso con la paciente en base a sus expectativas.
- •
El presente del tratamiento médico de los miomas están conformado por tratamientos sintomáticos y tratamientos específicos. Entre estos últimos disponemos del AUP para el tratamiento crónico y de los agonistas de Gn-RH para tratamientos cortos, habitualmente con función preoperatoria.
- •
En un futuro inmediato los antagonistas orales de Gn-RH +TAB aparecen como tratamientos de primera línea. El perfil de paciente sin deseo genésico, mayor de 45años, sintomática y mioma no resecable por histeroscopia (en caso de SUA) parece un perfil ideal para este tipo de terapias.
- •
En el caso de la fertilidad, las restricciones sobre AUP dificultan el manejo médico, y quizás en estas pacientes los tratamientos médicos deban ir encaminados a ganar tiempo (en caso de deseo gestacional a medio-largo plazo) buscando el momento idóneo para otras terapias.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNo se ha recibido ningún tipo de financiación para la redacción del presente artículo.
Conflicto de interesesEl Dr. Mikel Goitia ha recibido honorarios por diferentes ponencias en torno al tema de los miomas uterinos por parte de Gedeon Richter.
Los demás autores declaran no tener ningún conflicto de intereses.