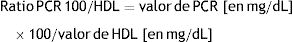La valoración del riesgo cardiovascular aparece en las guías clínicas como medida de prevención de enfermedades cardiovasculares, cuya etiología fundamental es la arteriosclerosis. Una de las herramientas que se utiliza para estimar el riesgo en práctica clínica son los índices aterogénicos (IA), cocientes entre fracciones lipídicas con rangos de referencia bien establecidos. A pesar de su uso extendido, existe todavía información limitada sobre su utilidad clínica. En los últimos años, algunas investigaciones han reforzado el papel de la inflamación en la etiología y cronicidad del proceso aterosclerótico. La inclusión de parámetros inflamatorios en el cálculo de IA podría mejorar su rendimiento diagnóstico en la detección de arteriosclerosis. Nos propusimos evaluar un nuevo IA en forma de ratio entre los valores de proteína C reactiva (PCR) no ultrasensible y las cifras de colesterol unido a lipoproteínas de alta densidad (HDL).
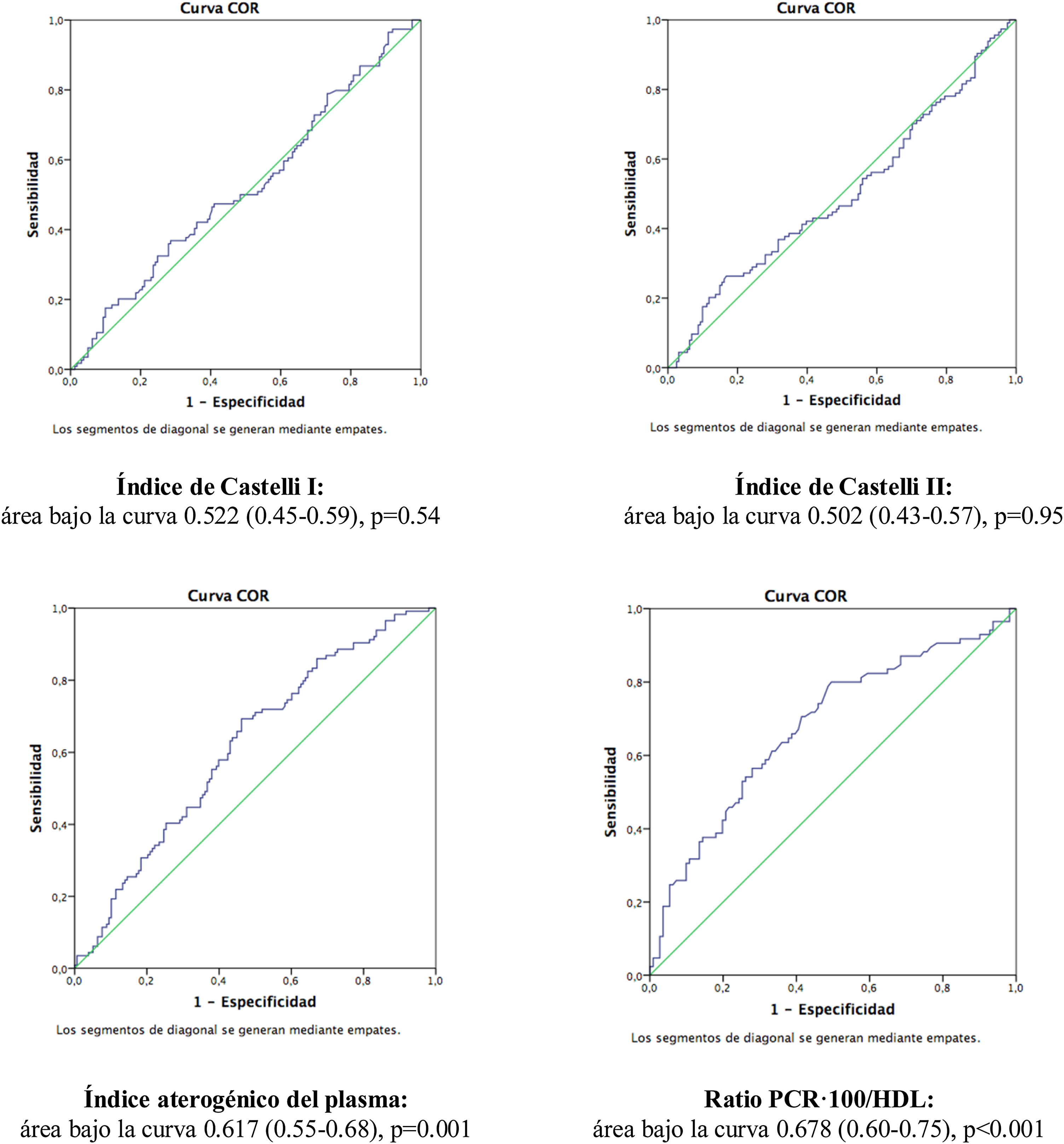
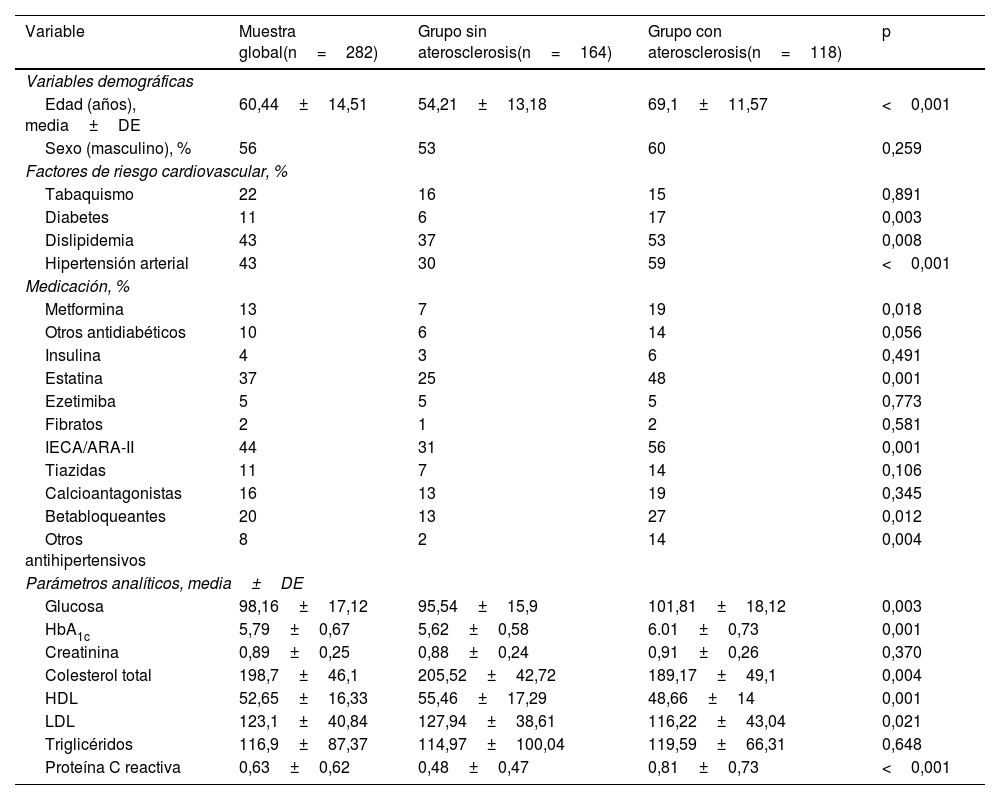
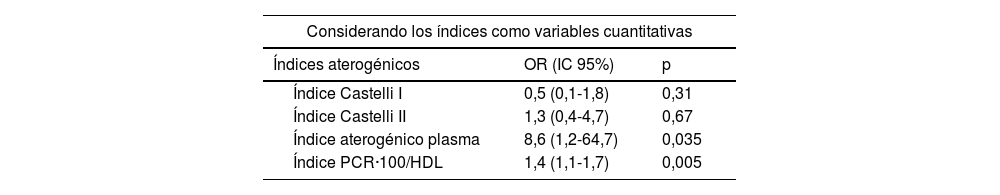
MétodosSe incluyeron en el estudio 282 pacientes, asintomáticos, y sin historia de enfermedad cardiovascular. Se realizó en todos ellos analítica con perfil lipídico y PCR, y en el plazo inferior a un mes, ecografía carotídea para evaluar la presencia de ateromatosis. El nuevo IA se estableció como el cociente entre el valor de PCR no ultrasensible en mg/dL (multiplicado por 100) y el valor de HDL en mg/dL. Se comparó con los índices de Castelli I y II, y el índice aterogénico del plasma. La curva ROC determinó que el punto de corte óptimo del nuevo IA fue valor=1, con un área bajo la curva de 0,678 (IC 95% 0,60-0,75; p<0,001).
ResultadosLa edad media de la muestra fue 60,4±14,5 años. Un total de 118 pacientes (41,8% del total) tenían arteriosclerosis carotídea. Al evaluar el rendimiento diagnóstico de los IA, encontramos que la ratio PCR·100/HDL mostró los valores más elevados de sensibilidad y valor predictivo positivo (0,73 y 0,68, respectivamente) en comparación con los índices de Castelli I y II, y el índice aterogénico del plasma. Además, fue el único predictor de ateromatosis carotídea tanto al considerar sus valores de forma cuantitativa (con OR 1,4 [IC 95% 1,1-1,7]; p=0,005), como cualitativa (con OR 2,9 [IC 95% 1,5-5,5]; p<0,001) en pacientes con ratio PCR·100/HDL>1.
ConclusionesEl nuevo índice PCR·100/HDL mostró el mejor rendimiento diagnóstico en la detección de ateromatosis carotídea en comparación con otros IA clásicos, en una población española de pacientes asintomáticos.
Current guidelines recommend cardiovascular risk assessment as a preventive measure for cardiovascular diseases, whose fundamental etiology is arteriosclerosis. One of the tools used to estimate risk in clinical practice are atherogenic indices (AI), ratios between lipid fractions with well-established reference ranges. Despite its widespread use, there is still limited information on its clinical utility. In recent years, some research has reinforced the role of inflammation in the etiology and chronicity of the atherosclerotic process. The inclusion of inflammatory parameters in the AI calculation could improve its diagnostic performance in the detection of arteriosclerosis. We sought to evaluate a new AI as a ratio between C-reactive protein (CRP) values and high-density lipoprotein cholesterol (HDL) values.
MethodsA total of 282 asymptomatic patients with no history of cardiovascular disease were included in the study. Laboratory tests with lipid profile and CRP, and carotid ultrasound to assess the presence of atheromatosis were performed in all of them. The new AI is established as the ratio between non-ultrasensitive CRP value in mg/dL (multiplied by 100) and HDL value in mg/dL. It was compared with the Castelli I and II indices, and the plasma atherogenic index. The optimal cut-off point of the new AI was value=1 as determined by ROC curve, with an area under the curve of 0.678 (95% CI 0.60-0.75; p<0.001).
ResultsMean age of patients was 60.4±14.5 years. A total of 118 patients (41.8% of total) had carotid arteriosclerosis. When evaluating the diagnostic performance of different AIs, we found that CRP·100/HDL ratio showed the highest values of sensitivity and positive predictive value (0.73 and 0.68, respectively) compared to the Castelli I and II indices, and the plasma atherogenic index. It was also the only predictor of carotid atheromatosis both when considering its values quantitatively (with OR 1.4 [95% CI 1.1-1.7]; p=0.005), and qualitatively (with OR 2.9 [95% CI 1.5-5.5]; p<0.001) in patients with a CRP·100/HDL ratio>1.
ConclusionsThe new PCR·100/HDL index showed the best diagnostic performance in the detection of carotid atheromatosis compared to other classic AIs in this Spanish population of asymptomatic patients.
A lo largo de los últimos años la valoración del riesgo cardiovascular (RCV) se ha introducido en las guías clínicas como medida de prevención de la enfermedad cardiovascular, considerada como una de las principales causas de morbimortalidad en países occidentales1-3.
La etiología fundamental de la cardiopatía isquémica y la enfermedad cerebrovascular es el desarrollo de arterioesclerosis, proceso inflamatorio crónico complejo, de etiología multifactorial, que se caracteriza por el deterioro de la función vascular y supone un engrosamiento progresivo de la capa íntima y media de las arterias. Su lesión histológica básica es la placa de ateroma4,5.
Es bien conocido que la dislipidemia, y en especial la elevación de lipoproteínas de baja densidad (LDL, por low density lipoprotein), es un factor de riesgo relevante en la aparición prematura de aterosclerosis, y así es tenido en cuenta en la valoración global del RCV mediante determinaciones analíticas del perfil lipídico6,7. Sin embargo, el empleo de las concentraciones aisladas de las fracciones lipídicas (colesterol total y triglicéridos [TG]), las diferentes lipoproteínas (lipoproteínas de muy baja densidad [VLDL, por very low density lipoprotein], LDL y lipoproteínas de alta densidad [HDL, por high density lipoprotein], principalmente) o incluso las apolipoproteínas (apo-B, apo-AI, apo-AII y apo-C, fundamentalmente) aportan valor cuantitativo pero no informan acerca del equilibrio entre lipoproteínas aterogénicas y antiaterogénicas. Por tanto, la evaluación del RCV basado exclusivamente en la concentración de lipoproteínas (colesterol unido a LDL y/o HDL) no es óptima, especialmente en los individuos con RCV de moderado a muy alto8.
Con objeto de mejorar la evaluación del RCV en práctica clínica se han utilizado los índices aterogénicos (IA). Estos cocientes están formados, generalmente, por un numerador que contiene una variable lipídica con asociación positiva con el RCV (por ejemplo, colesterol total o LDL) y un denominador que tiene una asociación negativa con el mismo (por ejemplo, HDL). Los más conocidos son Castelli I (colesterol total/HDL) y Castelli II (LDL/HDL). El índice de Castelli I es el más empleado para determinar el RCV y es conocido también como ratio de riesgo cardiaco9. Su origen proviene del estudio Framingham, cuyo director, el Dr. Castelli, observó la persistencia de RCV elevado en sujetos con colesterol total controlado si asociaban niveles bajos de HDL. Por otro lado, el índice TG/HDL, que en los últimos años se ha popularizado como índice aterogénico del plasma (IAP), en forma de log(TG/HDL), ha adquirido un papel preponderante en la evaluación de RCV, especialmente en pacientes con síndrome metabólico8. En todos los IA, cuanto mayor sea el valor de los cocientes, mayor será el RCV. Tal aumento podría deberse, por tanto, a un incremento de las variables aterogénicas contenidas en el numerador, a un descenso de la variable antiaterogénica del denominador, o a la suma de ambos.
Sin embargo, a pesar de la amplia bibliografía al respecto, todavía existe información limitada sobre la verdadera utilidad clínica de los IA en la estimación de RCV y sus valores de referencia más adecuados10,11.
En años recientes, algunas investigaciones han reforzado el papel de la inflamación en la etiología y perpetuación del proceso aterosclerótico12, tras la publicación de varios ensayos clínicos que han mostrado el rol fundamental de fármacos antiinflamatorios en el pronóstico de pacientes con enfermedad cardiovascular13,14. Es evidente, por tanto, que la teoría lipídica se ha visto extendida con un enfoque fisiopatológico más amplio que incluye factores de respuesta inmune. En este contexto, la introducción de parámetros inflamatorios de práctica clínica habitual en el cálculo de IA podría mejorar el rendimiento diagnóstico y pronóstico de los mismos. Dos estudios han evaluado previamente IA que correlacionan los valores de proteína C reactiva (PCR) ultrasensible, como marcador inflamatorio, y HDL, aunque con resultados dispares. Si bien Luo et at.15 encontraron que la ratio PCR/HDL se correlacionaba con el grado de severidad de las lesiones en pacientes asiáticos sometidos a angiografía por sospecha de enfermedad coronaria, en el estudio de Jialal et al.16 en población afroamericana la ratio PCR/HDL no fue superior al índice TG/HDL como predictor diagnóstico de síndrome metabólico.
En este contexto, y con el objetivo de analizar su rendimiento diagnóstico en pacientes del área mediterránea, nos propusimos evaluar un nuevo IA en forma de ratio que relacionara los valores de PCR, en este caso no ultrasensible (en el numerador), y las cifras de HDL (en el denominador). De esta forma, a mayor grado de inflamación sistémica de bajo grado (y por tanto, mayor valor de PCR no ultrasensible), en relación al menor valor de HDL (frecuente en diabetes tipo 2 y síndrome metabólico), mayor sería el riesgo estimado por este nuevo IA.
La fórmula para su cálculo fue la siguiente:
Se utilizó esta fórmula por 2 motivos fundamentales. Por un lado, su simplicidad de cálculo, que solo incluye 2 variables y permite una estimación rápida. Por otro lado, los parámetros de la ecuación (PCR no ultrasensible y HDL) se solicitan de forma rutinaria en controles analíticos tanto en atención primaria como especializada, y además muchos pacientes están familiarizados con su valores.
Para evaluar el rendimiento del nuevo IA, se estudió la asociación de sus cifras con la presencia de aterosclerosis carotídea determinada mediante ecografía de troncos supraaórticos (TSA), en pacientes asintomáticos atendidos en consulta para valoración de RCV.
El uso de ultrasonidos en TSA es un método rápido, fiable y coste-efectivo de estimación de arteriosclerosis17. Tanto la presencia de placas de ateroma como el incremento del grosor del complejo íntima-media de la pared arterial se han mostrado útiles en identificar arteriosclerosis subclínica18. Aunque otras técnicas como la tomografía computarizada coronaria o de TSA permiten un diagnóstico más preciso del grado de afectación arterial, el uso de la ecografía de TSA se considera el patrón oro en la determinación no invasiva de lesión vascular en pacientes con elevado RCV (como método de cribado), por su accesibilidad y nulos efectos adversos.
Material y métodosPoblación de estudioSe incluyeron en el estudio 282 pacientes atendidos en el servicio de cardiología del hospital IMED Valencia desde mayo de 2017 a mayo de 2021 para evaluación de RCV. Todos los pacientes estaban asintomáticos y ninguno tenía historia médica personal de enfermedad cardiovascular. Se realizó en todos ellos analítica con perfil lipídico y PCR, y en un plazo inferior a un mes, ecografía de TSA para evaluar la presencia de ateromatosis.
Variables clínicasSe registraron las variables demográficas y la presencia de factores de riesgo cardiovascular clásicos, como tabaquismo, dislipidemia, diabetes e hipertensión arterial. También se consideró la medicación en relación con dichos factores.
Variables analíticasSe analizaron el perfil lipídico completo (colesterol total, HDL, LDL y TG), el perfil glucémico (glucosa, hemoglobina glucosilada) y la PCR no ultrasensible.
Índices aterogénicosPara contrastar el rendimiento de la nueva ratio PCR·100/HDL, se evaluó su sensibilidad y especificidad en la detección de ateromatosis en TSA respecto a los siguientes IA, ampliamente utilizados en práctica clínica y con suficiente evidencia científica al respecto:
- •
Índice de Castelli I: cociente entre colesterol total y HDL.
- •
Índice de Castelli II: cociente entre LDL y HDL.
- •
IAP: logaritmo del cociente entre TG y HDL.
Para la comparación de los diferentes IA en su capacidad diagnóstica de ateromatosis en TSA, se realizó un análisis por regresión binaria. Se evaluaron los distintos IA como variables cuantitativas continuas en un primer análisis. Posteriormente, también se testaron los IA, considerándose como variables categóricas, utilizando los puntos de corte óptimos en nuestra muestra, y que coincidían con los aceptados en la literatura19. Estos valores de corte fueron: >4 en índice de Castelli I; >3 en Castelli II; y >0,24 en IAP.
Estudio de imagenLa ecografía de TSA se realizó en el servicio de radiología del hospital IMED Valencia según práctica habitual20. La exploración se realizó con el paciente en decúbito supino con cuello en hiperextensión y rotación de 45° hacia el lado contrario del lado explorado.
Se utilizó una sonda lineal de alta frecuencia y ecógrafo General Electric modelo Vivid E95 (GE HealthCare, Chicago, Illinois, EE. UU.).
Se evaluó la luz de los TSA y su pared vascular, analizando tanto el grosor del complejo íntima-media como la existencia de placas de ateroma. El grosor del complejo íntima-media se midió en la pared posterior de la arteria carótida común (a 1cm de la bifurcación) y se consideraron patológicos valores superiores a 1mm. Las placas de ateroma se identificaron como engrosamientos parietales de extensión focal y diámetro superior a 1,5mm.
Análisis estadísticoLas variables categóricas se expresaron utilizando valores absolutos y porcentajes, y las variables continuas mediante la media±desviación estándar. El test de Kolmogorov-Smirnov se utilizó para evaluar la normalidad de la distribución.
Se consideró ateromatosis carotídea (como variable principal del estudio) la presencia de una o más placas ateromatosas en la evaluación ecográfica de los TSA. Se dividió la muestra en 2 grupos con base en la presencia o ausencia de placas ateromatosas en TSA.
Se estimó mediante curva ROC el valor del índice PCR·100/HDL con mayor rendimiento diagnóstico para la predicción de ateromatosis en TSA, y mediante regresión binaria se comparó con otros índices aterogénicos de uso común utilizando este valor como punto de corte.
Se consideraron significativos los resultados con valor p<0,05. Se utilizó el software IBM® SPSS® Statistics, versión 22.0, para el análisis estadístico.
Aspectos éticosEl estudio siguió las recomendaciones éticas internacionales según lo convenido en la Declaración de Helsinki y la actual legislación europea en investigaciones médicas, así como la legislación vigente en relación con la Ley de Protección de Datos: Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales. El estudio fue aprobado por el comité ético local.
ResultadosGrupos muestrales según la presencia de aterosclerosis carotídeaLa edad media de los 282 pacientes fue 60,4±14,5 años, con un 56% de sexo masculino. Al analizar la muestra según la presencia o no de placas de ateroma en TSA, se encontró que 118 pacientes (41,8% del total) tenían enfermedad carotídea. Las características generales de ambos grupos se muestran en la tabla 1.
Características generales de la muestra según la presencia de aterosclerosis en la ecografía de troncos supraaórticos
| Variable | Muestra global(n=282) | Grupo sin aterosclerosis(n=164) | Grupo con aterosclerosis(n=118) | p |
|---|---|---|---|---|
| Variables demográficas | ||||
| Edad (años), media±DE | 60,44±14,51 | 54,21±13,18 | 69,1±11,57 | <0,001 |
| Sexo (masculino), % | 56 | 53 | 60 | 0,259 |
| Factores de riesgo cardiovascular, % | ||||
| Tabaquismo | 22 | 16 | 15 | 0,891 |
| Diabetes | 11 | 6 | 17 | 0,003 |
| Dislipidemia | 43 | 37 | 53 | 0,008 |
| Hipertensión arterial | 43 | 30 | 59 | <0,001 |
| Medicación, % | ||||
| Metformina | 13 | 7 | 19 | 0,018 |
| Otros antidiabéticos | 10 | 6 | 14 | 0,056 |
| Insulina | 4 | 3 | 6 | 0,491 |
| Estatina | 37 | 25 | 48 | 0,001 |
| Ezetimiba | 5 | 5 | 5 | 0,773 |
| Fibratos | 2 | 1 | 2 | 0,581 |
| IECA/ARA-II | 44 | 31 | 56 | 0,001 |
| Tiazidas | 11 | 7 | 14 | 0,106 |
| Calcioantagonistas | 16 | 13 | 19 | 0,345 |
| Betabloqueantes | 20 | 13 | 27 | 0,012 |
| Otros antihipertensivos | 8 | 2 | 14 | 0,004 |
| Parámetros analíticos, media±DE | ||||
| Glucosa | 98,16±17,12 | 95,54±15,9 | 101,81±18,12 | 0,003 |
| HbA1c | 5,79±0,67 | 5,62±0,58 | 6.01±0,73 | 0,001 |
| Creatinina | 0,89±0,25 | 0,88±0,24 | 0,91±0,26 | 0,370 |
| Colesterol total | 198,7±46,1 | 205,52±42,72 | 189,17±49,1 | 0,004 |
| HDL | 52,65±16,33 | 55,46±17,29 | 48,66±14 | 0,001 |
| LDL | 123,1±40,84 | 127,94±38,61 | 116,22±43,04 | 0,021 |
| Triglicéridos | 116,9±87,37 | 114,97±100,04 | 119,59±66,31 | 0,648 |
| Proteína C reactiva | 0,63±0,62 | 0,48±0,47 | 0,81±0,73 | <0,001 |
Significativo si p<0,05.
ARA-II: antagonistas de los receptores de la angiotensina ii; DE: desviación estándar; HbA1c: hemoglobina glucosilada; HDL: lipoproteínas de alta densidad; IECA: inhibidores de la enzima convertidora de la angiotensina; LDL: lipoproteínas de baja densidad.
Los pacientes con ateromatosis en TSA tenían mayor edad (69,1±11,6 vs. 54,2±13,2 años, p<0,001) y mayor prevalencia de diabetes (17 vs. 6%, p=0,003), dislipidemia (53 vs. 37%, p=0,008) e hipertensión arterial (59 vs. 30%, p<0,001). No se encontraron diferencias en relación con el hábito tabáquico.
En consonancia con una mayor prevalencia de factores de RCV, el uso de fármacos antidiabéticos como metformina, hipolipidemiantes como las estatinas, y la mayoría de los antihipertensivos fue significativamente superior en el grupo de pacientes con ateromatosis.
Al analizar los parámetros analíticos, también se observaron mayores cifras de glucosa basal (101,8±18,1 vs. 95,5±15,9mg/dL, p=0,003), hemoglobina glucosilada (6,01±0,7 vs. 5,62±0,6%, p=0,001) y PCR (0,81±0,73 vs. 0,48±0,47mg/dL, p<0,001) en estos pacientes. Los valores de HDL fueron inferiores en este grupo (48,7±14,0 vs. 55,4±17,3mg/dL, p=0,001). Sin embargo, no hubo diferencias en las cifras de TG (69,1±11,6 vs. 54,2±13,2mg/dL, p=0,64). Curiosamente, y probablemente debido al mayor uso de estatinas en el grupo de pacientes con ateromatosis, los valores de colesterol total y LDL fueron inferiores (189,2±49,1 vs. 205,5±42,7mg/dL, p=0,004, y 116,2±43,0 vs. 127,9±38,7mg/dL, p=0,021, respectivamente).
Estimación del punto de corte óptimo del nuevo índice para la estimación del riesgo de ateromatosis carotídeaLa curva ROC determinó que el punto de corte óptimo para estimar un mayor riesgo de ateromatosis según el nuevo índice era un valor superior a 0,92. Dado que los valores de sensibilidad y especificidad fueron muy similares con el valor de 1, es el que se utilizó para las comparaciones.
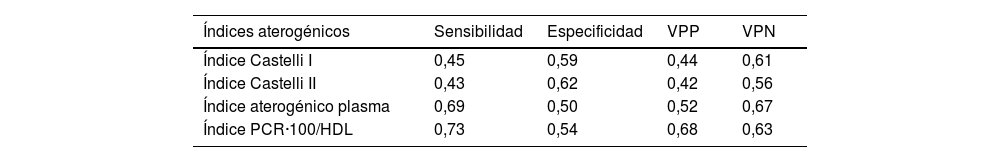
En la figura 1 se muestran las curvas ROC y las áreas bajo la curva de los cuatro IA analizados en el estudio. La ratio PCR·100/HDL mostró la mejor asociación con presencia de placas ateromatosas en TSA, con un área de 0,678 (para un intervalo de confianza de 95% [IC 95%] de 0,60-0,75, con p<0,001).
Rendimiento diagnóstico de los diferentes índices aterogénicosAl evaluar el rendimiento de cada IA para la detección de ateromatosis carotídea, encontramos que la ratio PCR·100/HDL mostró los valores más elevados de sensibilidad y valor predictivo positivo (0,73 y 0,68, respectivamente), y fue globalmente el IA con mejor perfil diagnóstico (tabla 2).
Sensibilidad, especificidad y valores predictivos positivo y negativo de los diferentes índices aterogénicos
| Índices aterogénicos | Sensibilidad | Especificidad | VPP | VPN |
|---|---|---|---|---|
| Índice Castelli I | 0,45 | 0,59 | 0,44 | 0,61 |
| Índice Castelli II | 0,43 | 0,62 | 0,42 | 0,56 |
| Índice aterogénico plasma | 0,69 | 0,50 | 0,52 | 0,67 |
| Índice PCR·100/HDL | 0,73 | 0,54 | 0,68 | 0,63 |
HDL: lipoproteínas de alta densidad; PCR: proteína C reactiva; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Se consideraron para el análisis todos los IA tanto como variables cuantitativas como categóricas, considerando en este caso los puntos de corte de riesgo previamente descritos: índice de Castelli I>4; índice de Castelli II>3; IAP>0,24, e índice PCR·100/HDL>1 (tabla 3).
Predicción de ateromatosis carotídea según los diferentes índices aterogénicos
| Considerando los índices como variables cuantitativas | ||
|---|---|---|
| Índices aterogénicos | OR (IC 95%) | p |
| Índice Castelli I | 0,5 (0,1-1,8) | 0,31 |
| Índice Castelli II | 1,3 (0,4-4,7) | 0,67 |
| Índice aterogénico plasma | 8,6 (1,2-64,7) | 0,035 |
| Índice PCR·100/HDL | 1,4 (1,1-1,7) | 0,005 |
| Considerando los índices como variables categóricas | ||
|---|---|---|
| Índices aterogénicos | OR (IC 95%) | p |
| Índice Castelli I>4 | 0,9 (0,4-2,5) | 0,94 |
| Índice Castelli II>3 | 0,9 (0,3-2,3) | 0,91 |
| Índice aterogénico plasma>0,24 | 1,7 (0,9-3,4) | 0,11 |
| Índice PCR·100/HDL>1 | 2,9 (1,5-5,5) | <0,001 |
HDL: lipoproteínas de alta densidad; IC 95%: intervalo de confianza del 95%; LDL: lipoproteínas de baja densidad; OR: odds ratio; PCR: proteína C reactiva; TG: triglicéridos.
Al comparar los diferentes IA por regresión binaria con un IC 95%, la nueva ratio PCR·100/HDL fue el único predictor de ateromatosis carotídea tanto al considerar sus valores de forma cuantitativa como categórica, con OR 1,4 (IC 95% 1,1-1,7; p=0,005) y OR 2,9 (IC 95% 1,5-5,5; p<0,001). Los índices de Castelli no mostraron asociación significativa con la presencia de ateromatosis en TSA, y el índice aterogénico del plasma sólo al considerarse como variable cuantitativa (OR 8,6 [IC 95% 1,2-64,7]; p=0,035).
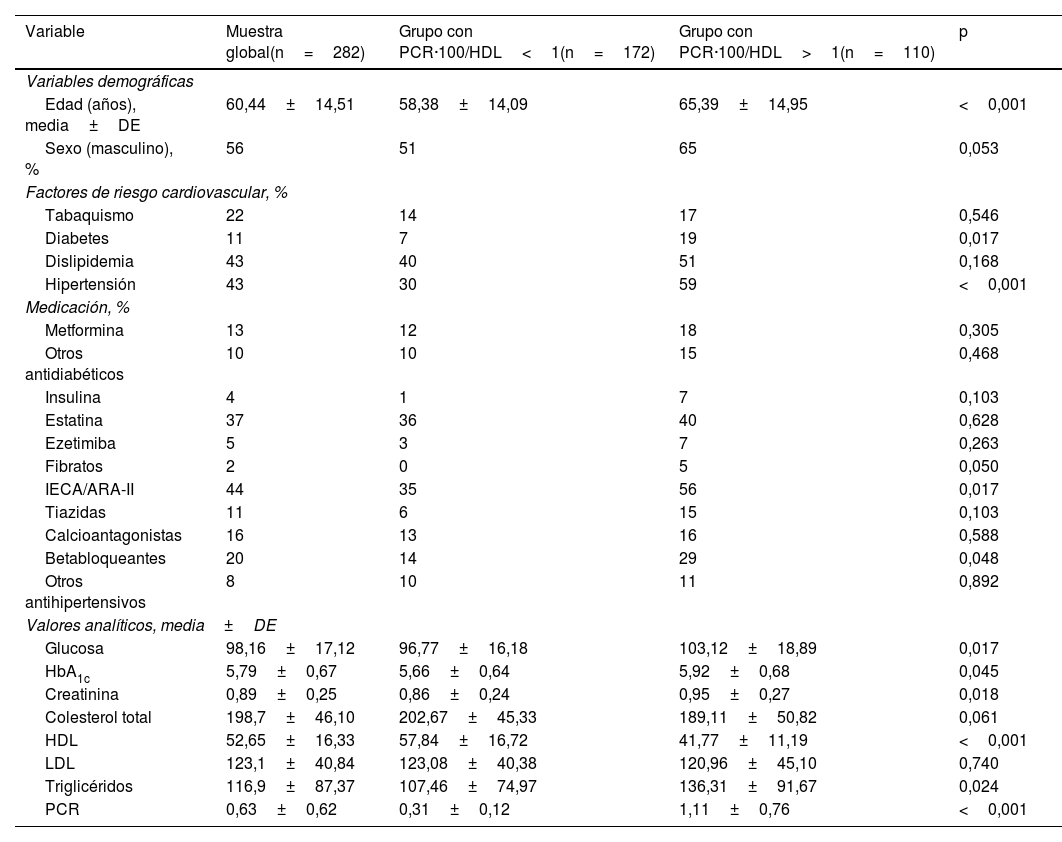
Grupos muestrales según la ratio PCR·100/HDLLas características de la muestra en función de la ratio PCR·100/HDL (con punto de corte=1) se muestran en la tabla 4. Los pacientes con ratio≥1 eran mayores (65,4±14,9 vs. 58,4±14,1 años, p<0,001) y presentaban mayor prevalencia de diabetes e hipertensión arterial. De forma significativa, se encontró un menor valor de HDL y cifras más elevadas de TG y PCR, pero sin diferencias en los valores de colesterol total y LDL. En este caso, el uso de estatinas fue similar en ambos grupos (40 vs. 36%, p=0,62).
Características generales de la muestra según ratio PCR·100/HDL
| Variable | Muestra global(n=282) | Grupo con PCR·100/HDL<1(n=172) | Grupo con PCR·100/HDL>1(n=110) | p |
|---|---|---|---|---|
| Variables demográficas | ||||
| Edad (años), media±DE | 60,44±14,51 | 58,38±14,09 | 65,39±14,95 | <0,001 |
| Sexo (masculino), % | 56 | 51 | 65 | 0,053 |
| Factores de riesgo cardiovascular, % | ||||
| Tabaquismo | 22 | 14 | 17 | 0,546 |
| Diabetes | 11 | 7 | 19 | 0,017 |
| Dislipidemia | 43 | 40 | 51 | 0,168 |
| Hipertensión | 43 | 30 | 59 | <0,001 |
| Medicación, % | ||||
| Metformina | 13 | 12 | 18 | 0,305 |
| Otros antidiabéticos | 10 | 10 | 15 | 0,468 |
| Insulina | 4 | 1 | 7 | 0,103 |
| Estatina | 37 | 36 | 40 | 0,628 |
| Ezetimiba | 5 | 3 | 7 | 0,263 |
| Fibratos | 2 | 0 | 5 | 0,050 |
| IECA/ARA-II | 44 | 35 | 56 | 0,017 |
| Tiazidas | 11 | 6 | 15 | 0,103 |
| Calcioantagonistas | 16 | 13 | 16 | 0,588 |
| Betabloqueantes | 20 | 14 | 29 | 0,048 |
| Otros antihipertensivos | 8 | 10 | 11 | 0,892 |
| Valores analíticos, media±DE | ||||
| Glucosa | 98,16±17,12 | 96,77±16,18 | 103,12±18,89 | 0,017 |
| HbA1c | 5,79±0,67 | 5,66±0,64 | 5,92±0,68 | 0,045 |
| Creatinina | 0,89±0,25 | 0,86±0,24 | 0,95±0,27 | 0,018 |
| Colesterol total | 198,7±46,10 | 202,67±45,33 | 189,11±50,82 | 0,061 |
| HDL | 52,65±16,33 | 57,84±16,72 | 41,77±11,19 | <0,001 |
| LDL | 123,1±40,84 | 123,08±40,38 | 120,96±45,10 | 0,740 |
| Triglicéridos | 116,9±87,37 | 107,46±74,97 | 136,31±91,67 | 0,024 |
| PCR | 0,63±0,62 | 0,31±0,12 | 1,11±0,76 | <0,001 |
Significativo si p<0,05.
ARA-II: antagonistas de los receptores de la angiotensina ii; DE: desviación estándar; HbA1c: hemoglobina glucosilada; HDL: lipoproteínas de alta densidad; IECA: inhibidores de la enzima convertidora de la angiotensina; LDL: lipoproteínas de baja densidad; PCR: proteína C reactiva.
Con el objeto de evaluar si el uso de estatinas se comportaba como factor de confusión al sobredimensionar el rendimiento del nuevo índice PCR·100/HDL (ya que en los pacientes que reciben tratamiento con estatinas el valor de colesterol total y LDL se encuentra farmacológicamente disminuido), se estudió el perfil lipídico y los IA en el subgrupo de pacientes que no tomaban estatinas (164 pacientes [58,1% del total]).
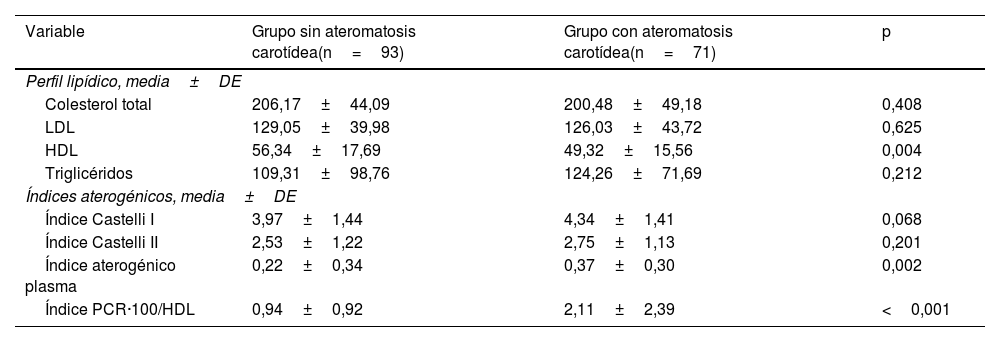
En estos pacientes, los valores de colesterol total, LDL y TG fueron similares según la presencia o no de ateromatosis en TSA, con diferencias únicamente en las cifras de HDL (49,3±15,5 vs. 56,3±17,7; p=0,004) (tabla 5).
Características en pacientes sin estatinas
| Variable | Grupo sin ateromatosis carotídea(n=93) | Grupo con ateromatosis carotídea(n=71) | p |
|---|---|---|---|
| Perfil lipídico, media±DE | |||
| Colesterol total | 206,17±44,09 | 200,48±49,18 | 0,408 |
| LDL | 129,05±39,98 | 126,03±43,72 | 0,625 |
| HDL | 56,34±17,69 | 49,32±15,56 | 0,004 |
| Triglicéridos | 109,31±98,76 | 124,26±71,69 | 0,212 |
| Índices aterogénicos, media±DE | |||
| Índice Castelli I | 3,97±1,44 | 4,34±1,41 | 0,068 |
| Índice Castelli II | 2,53±1,22 | 2,75±1,13 | 0,201 |
| Índice aterogénico plasma | 0,22±0,34 | 0,37±0,30 | 0,002 |
| Índice PCR·100/HDL | 0,94±0,92 | 2,11±2,39 | <0,001 |
Significativo si p<0,05.
DE: desviación estándar; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; PCR: proteína C reactiva.
En relación con el valor de los diferentes IA, se asociaron significativamente los valores del IAP (0,37±0,29 vs. 0,22±0,34; p=0,002) y de la ratio PCR·100/HDL (2,11±2,39 vs. 0,93±0,92; p<0,001) con la presencia de enfermedad aterosclerótica carotídea. El valor de los índices de Castelli fue similar en ambos grupos.
Al comparar por regresión binaria los 4 IA en este subgrupo, los valores de OR fueron similares a los descritos en la muestra global: Castelli I, OR 0,89 (IC 95% 0,18-4,36; p=0,89); Castelli II, OR 0,87 (IC 95% 0,18-4,18; p=0,89); IAP, OR 5,9 (IC 95% 0,53-66,5; p=0,147), y ratio PCR·100/HDL, OR 1,59 (IC 95% 1,13-2,22; p=0,07). Por tanto, fue significativa la asociación con ateromatosis en TSA sólo en el caso del IAP y la nueva ratio PCR·100/HDL.
DiscusiónEn este estudio de pacientes del área mediterránea con evaluación de RCV, asintomáticos y sin historia cardiovascular previa, el índice PCR·100/HDL se mostró como el único predictor de ateromatosis carotídea en TSA en comparación con IA clásicos como Castelli I y II, e incluso comparado con el IAP, que ha mostrado una sólida evidencia en los últimos años, fundamentalmente en pacientes con síndrome metabólico. El nuevo índice PCR·100/HDL se asoció significativamente con placas de ateroma carotídeas tanto al considerar sus valores de forma continua (en este caso, también lo hizo el IAP) como de manera categórica, con un punto de corte redondeado a 1 por su fácil estimación.
Es bien conocido que el RCV puede predecirse en parte mediante las concentraciones de las lipoproteínas y el colesterol total, con base en el hecho de que las alteraciones del metabolismo lipídico son un factor de riesgo fundamental para el desarrollo de aterosclerosis y representan, según algunos estudios, hasta el 50% del riesgo atribuible para presentar enfermedad cardiovascular21. Por este motivo, las guías de práctica clínica siguen centrando sus esfuerzos en el control de la dislipidemia, aunque fundamentalmente todavía lo hacen mediante el análisis de cifras objetivo centradas en LDL y colesterol total. Otros parámetros, como el HDL o los TG, quedan asumidos en variables como el colesterol no-HDL, sin objetivos específicos de tratamiento por el momento22.
Sin embargo, cada vez existe más evidencia respecto al riesgo residual procedente de toda la fracción no-HDL y el colesterol remanente23. Esto es debido a que aquellas lipoproteínas ricas en TG, especialmente las VLDL, son capaces también de promover y mantener el proceso crónico de arteriosclerosis, situación que se da de forma predominante en individuos con síndrome metabólico e hipertrigliceridemia. La suma, por tanto, de LDL y VLDL, que se correspondería con el colesterol no-HDL (si sumamos la pequeña proporción que suponen sus remanentes y la lipoproteína A), podría ser un excelente indicador de colesterol aterogénico y debería ser un objetivo terapéutico en la siguiente actualización de las guías clínicas.
En el mismo sentido, la disminución del colesterol «antiaterogénico», esto es, el colesterol HDL, podría identificarse como factor de RCV incluso en pacientes con nivel de LDL en objetivo terapéutico24. La tendencia en el análisis de RCV en los últimos años trata, pues, de aunar ambos efectos (aterogénico vs. antiaterogénico) con el objeto de ofrecer una valoración de RCV más completa. En este contexto, se entiende que el uso de IA que formulen con el uso de variables aterogénicas y antiaterogénicas tendría su valor diagnóstico y pronóstico. Su empleo supondría, así, una herramienta sencilla para evaluar las concentraciones de fracciones lipídicas ponderando la relación contrapuesta entre algunas de ellas y, en consecuencia, permitir la evaluación del RCV del paciente de forma más integral. A pesar de lo expuesto, las recomendaciones actuales no incluyen todavía el empleo de IA de forma sólida, o lo hacen con un nivel de recomendación bajo25,26.
Ante lo expuesto, una de las formas de aproximar la situación de inflamación de bajo grado como parte del proceso de arteriosclerosis se encontraría en incluir variables inflamatorias en la ecuación, que permitirían ampliar el espectro de RCV del paciente27. Nos propusimos, pues, incluir una variable de uso común como es la PCR no ultrasensible, al alcance de todo profesional sanitario y los mismos pacientes, para construir una nueva fórmula de RCV. Utilizando un punto de corte «redondeado», fácil de recordar y aplicar, encontramos que los pacientes con un valor superior a 1 presentaban una asociación positiva con ateromatosis en TSA, con una sensibilidad superior al 70% y unos valores predictivos positivo y negativo superiores al 60%, lo que lo convertiría en una excelente herramienta de cribado. La ratio PCR·100/HDL mostró ser en nuestra población el IA con mejor rendimiento diagnóstico y el único predictor de ateromatosis tanto al considerar los valores de los IA variables cuantitativas (continuas) como categóricas (con punto de corte óptimo).
Los valores de PCR se relacionaron de forma evidente con el RCV hace más de 2 décadas28-30, y especialmente tras la publicación del estudio JUPITER31 en 2008, que supuso una revolución en el mundo de la cardiología clínica. En este ensayo clínico, pacientes con buen control lipídico, determinado por valores de LDL inferiores a 130mg/dL pero con elevación ligera de los valores de PCR ultrasensible (por encima de 2,0mg/L), fueron aleatorizados a rosuvastatina o placebo y monitorizados hasta un primer evento cardiovascular mayor (infarto de miocardio, ictus, angina, muerte cardiovascular). El estudio se detuvo precozmente por el incremento de eventos en el grupo placebo. Se concluyó que sujetos aparentemente sanos, sin dislipidemia pero con una elevación ligera de PCR, se beneficiaban de la toma de estatinas al reducir la incidencia de eventos cardiovasculares graves.
Otros estudios, como el ensayo CANTOS13, que evaluó el papel de canakinumab (inhibidor selectivo de la interleucina 1-beta) en la reducción de eventos cardiovascular mayores, o el ensayo COLCOT14, que estudió el rol del tratamiento con colchicina tras infarto agudo de miocardio, han reforzado el papel de la respuesta inmune en la fisiopatología de la arteriosclerosis. En este contexto, la inclusión de una variable inflamatoria en el IA PCR·100/HDL adquiriría un valor especial en el contexto actual, por 2 motivos fundamentales. Por un lado, por la creciente población en tratamiento con estatinas, que presentan disminuciones farmacológicas de los niveles de LDL y, por tanto, podrían restar valor a IA clásicos como Castelli I y II. Por otro lado, el número de individuos con diabetes tipo 2 y síndrome metabólico ha crecido exponencialmente en los últimos años32. En estos pacientes, la inflamación de bajo grado, el descenso de HDL y el incremento de TG son una constante, por lo que incluir dichas alteraciones metabólicas en el IA resultó crucial para definir la nueva ratio.
La ratio PCR·100/HDL es, por tanto, un nuevo IA con cierto carácter transgresor, pues no incluye parámetros de perfil lipídico tradicionales como colesterol total, LDL o TG. Sin embargo, aúna 2 variables analíticas de uso rutinario que trasladan a la ecuación 2 situaciones fisiopatológicas que son frecuentes en muchos pacientes hoy en día: la inflamación de bajo grado, crónica, relacionada con trastornos metabólicos; y los valores bajos de HDL, comúnmente encontrados en pacientes con diabetes tipo 2. Ambos condicionantes, potenciados en una ratio de sencillo cálculo, permiten detectar con mayor rendimiento respecto a otros IA la ateromatosis subclínica en TSA de pacientes con riesgo cardiovascular elevado.
LimitacionesSon limitaciones importantes del estudio el reducido tamaño muestral, el carácter unicéntrico y el análisis de los datos (estudio analítico observacional). La evaluación de resultados basada en una recogida de datos anonimizada, con variables que proceden de la práctica clínica habitual y no de un protocolo prefijado, podría favorecer la aparición de sesgos por la heterogeneidad de la muestra y los procedimientos.
Por otro lado, el cálculo de la ratio PCR·100/HDL podría verse limitado en aquellos pacientes sin cuantificación del valor de PCR no ultrasensible por encontrarse en el rango de normalidad, como ocurre en algunos centros.
El presente estudio se llevó a cabo como cohorte de derivación y, por tanto, sería necesario comprobar los resultados observados en una segunda cohorte de validación.
ConclusionesEl nuevo índice PCR·100/HDL mostró el mejor rendimiento diagnóstico en la detección de ateromatosis carotídea en comparación con otros IA clásicos, en una población española de pacientes asintomáticos y sin historia cardiovascular previa.
Se consideraron, además, las siguientes conclusiones secundarias:
- •
La prevalencia de ateromatosis carotídea fue elevada (>40%) en esta población de pacientes del área mediterránea.
- •
Los factores de riesgo más frecuentes fueron la hipertensión arterial y la dislipidemia (43% en ambos casos).
- •
El índice PCR·100/HDL fue predictor independiente de ateromatosis carotídea, independientemente del tratamiento con estatinas.
Ninguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses en la elaboración de este manuscrito.