La arteriosclerosis es una enfermedad inflamatoria. La interleucina 18 (IL-18) es una molécula inflamatoria que se ha relacionado con el desarrollo de arteriosclerosis y enfermedad cardiovascular.
ObjetivoEvaluar la posible relación entre los niveles plasmáticos de IL-18 y la presencia de arteriosclerosis evaluada a nivel carotídeo, así como analizar la posible modulación por diferentes polimorfismos en una población mediterránea.
Material y métodosSe incluyeron 746 individuos procedentes del área metropolitana de Valencia, reclutados durante un período de 2 años. Se determinaron parámetros del metabolismo hidrocarbonado y lipídico mediante metodología estándar e IL-18 mediante ELISA. Además, se realizó ecografía carotídea y se analizó el genotipo de 4 Single Nucleotide Polymorphisms (SNPs) relacionados con la vía de señalización de IL-18.
ResultadosLos pacientes con niveles plasmáticos más elevados de IL-18 presentaron otros factores de riesgo cardiovascular asociados. Los niveles elevados de IL-18 se asociaron de forma significativa con un mayor GIM carotídeo y con la presencia de placas de ateroma. El genotipo con el alelo A del SNP rs2287037 se asoció con mayor prevalencia de placa de ateroma carotídea. Por el contrario, el genotipo con el alelo C del SNP rs2293224 se asoció con una menor prevalencia de placa de ateroma.
ConclusionesLos niveles elevados de IL-18 se asociaron de forma significativa con un mayor GIM carotídeo y con la presencia de placas de ateroma, que parecen estar influenciados por factores genéticos, como lo demuestran las asociaciones entre los SNPs en el gen del receptor de IL-18 y la presencia de placa de ateroma.
Atherosclerosis is an inflammatory disease. Interleukin 18 (IL-18) is an inflammatory molecule that has been linked to the development of atherosclerosis and cardiovascular disease.
ObjectiveTo evaluate the possible relationship between plasma levels of IL-18 and the presence of atherosclerosis evaluated at the carotid level, as well as to analyze the possible modulation by different polymorphisms in a Mediterranean population.
Material and methodsSeven hundred and forty-six individuals from the metropolitan area of Valencia were included, recruited over a period of 2 years. Hydrocarbon and lipid metabolism parameters were determined using standard methodology and IL-18 using ELISA. In addition, carotid ultrasound was performed and the genotype of four SNPs related to the IL-18 signaling pathway was analyzed.
ResultsPatients with higher plasma levels of IL-18 had other associated cardiovascular risk factors. Elevated IL-18 levels were significantly associated with higher carotid IMT and the presence of atheromatous plaques. The genotype with the A allele of the SNP rs2287037 was associated with a higher prevalence of carotid atheromatous plaque. On the contrary, the genotype with the C allele of the SNP rs2293224 was associated with a lower prevalence of atheromatous plaque.
ConclusionsHigh levels of IL-18 were significantly associated with a higher carotid IMT and the presence of atheromatous plaques, which appear to be influenced by genetic factors, as evidenced by associations between SNPs in the IL-18 receptor gene and the presence of atheroma plaque.
La arteriosclerosis es una enfermedad inflamatoria crónica1. Estudios en animales de experimentación han demostrado la importancia de diferentes mediadores inflamatorios tanto en el inicio como en el desarrollo de la arteriosclerosis2. Múltiples estudios en humanos han mostrado la estrecha asociación entre marcadores inflamatorios y el desarrollo de enfermedad cardiovascular3. Además, recientemente se ha demostrado que el uso de fármacos capaces de reducir el estado inflamatorio, sin modificar otros factores de riesgo cardiovascular, disminuye la incidencia de enfermedad cardiovascular4–6.
El grado de inflamación, así como el desarrollo de arteriosclerosis y la subsecuente enfermedad cardiovascular, están modulados tanto por factores ambientales como genéticos. La regulación del proceso inflamatorio por factores genéticos podría explicar la gran variabilidad existente en la respuesta inflamatoria7. Sin embargo, la contribución genética tanto al desarrollo de inflamación como de arteriosclerosis no es completamente conocida.
Una de las moléculas inflamatorias que se ha relacionado con el desarrollo de arteriosclerosis es la interleucina 18 (IL-18). En modelos animales se ha observado que los niveles plasmáticos de IL-18 desempeñan un importante papel tanto en la formación como en el desarrollo de la placa de ateroma, así como en la estabilidad y la severidad de la misma8. Resultados similares se han observado también en humanos. Diferentes estudios han demostrado la asociación entre los niveles de IL-18 y el desarrollo de enfermedad cardiovascular9–11. Además, algunos estudios han identificado la influencia de algunas variaciones genéticas en los genes implicados en el sistema IL-18 sobre la enfermedad cardiovascular y la severidad de la misma7,12, si bien hay menos datos sobre los Single Nucleotide Polymorphisms (SNPs) localizados en receptor 1 de IL-18 (IL18R1) y proteína accesoria del receptor de IL-18 (IL18RAP), aunque existen resultados contradictorios y no se ha evaluado su efecto sobre la placa de ateroma13,14.
En este sentido, nuestra hipótesis fue que los niveles plasmáticos de IL-18 se asocian con la presencia de arteriosclerosis, pudiendo existir variaciones genéticas que podrían influir el desarrollo de la placa de ateroma. Por ello, el objetivo de nuestro estudio fue evaluar la posible relación entre los niveles plasmáticos de IL-18 y la presencia de arteriosclerosis evaluada a nivel carotídeo, así como analizar la posible influencia de diferentes polimorfismos en los genes IL18R1 e IL18RAP en una población mediterránea.
Material y métodosSujetosSe incluyeron 746 pacientes procedentes del estudio VALencian CArdiovascular Risk (VALCAR). Se trata de un estudio transversal diseñado para evaluar la prevalencia de factores de riesgo cardiovascular en una población urbana, y su asociación con la presencia de arteriosclerosis evaluada mediante ecografía carotídea. Los individuos participantes se incluyeron durante dos años por muestreo consecutivo oportunístico de entre aquellos que acudían a diferentes consultas de nuestro departamento de salud en un área metropolitana de Valencia.
Los criterios de exclusión para nuestro estudio fueron: pacientes con enfermedades inflamatorias crónicas (tanto de tipo digestivo como reumático), la presencia de niveles plasmáticos de proteína C reactiva de alta sensibilidad (PCRas)>10mg/l y haber presentado algún episodio infeccioso o inflamatorio en las 2 semanas previas.
El estudio fue aprobado por el Comité Ético de nuestro centro. Todos los participantes otorgaron su consentimiento por escrito para participar en el estudio.
Parámetros clínicosSe realizó una anamnesis a todos los participantes en la que se prestó especial interés al uso de fármacos de consumo habitual u ocasional durante el periodo del estudio, al hábito tabáquico (número de cigarrillos/día) y al consumo de alcohol (gramos de alcohol/día). Se recogieron también los antecedentes de enfermedad cardiovascular previa a la fecha de inclusión en el estudio. La presión arterial se determinó tras 10 minutos de decúbito supino, utilizando el valor medio de 3 determinaciones separadas entre sí 5min.
Parámetros antropométricosLos parámetros evaluados fueron: peso en kilogramos (kg), talla en metros (m), índice de masa corporal (IMC) en kg/m2 y perímetro de cintura en centímetros (cm), medido en el punto medio entre la espina ilíaca anterosuperior y el reborde costal inferior, con el sujeto en bipedestación y los brazos en posición anatómica. La medida se obtuvo con una cinta métrica graduada en cm.
Parámetros bioquímicosSe extrajo una muestra de sangre tras ayuno nocturno de 12h. La metodología fue similar a la previamente descrita15. En concreto, los niveles plasmáticos de colesterol total (CT), triglicéridos (TG) y glucosa se determinaron por métodos enzimáticos. El colesterol HDL (cHDL) tras precipitación con ácido fosfotúngstico cloruro de magnesio. El colesterol LDL (cLDL) se calculó por la fórmula de Friedewald.
Los niveles plasmáticos de IL-18 se determinaron mediante la técnica ELISA con «Human IL-18 ELISA Kit» (Medical ɛt BIologicalLaboratories Co. Ltd.) y se cuantificaron por medición de absorbancia con el aparato GloMax®-Multi+DetectionSystem (Promega).
Ecografía carotídeaLa ecografía se realizó mediante un equipo Siemens Sonoline G40, con transductor lineal de alta resolución de 8MHz de frecuencia. La exploración se realizó con los sujetos en decúbito supino con la cabeza a 45˚ girada hacia el lado contrario del lado explorado. Se evaluaron 3 segmentos predeterminados de ambos lados: carótida común (1cm proximal al bulbo carotídeo), bulbo carotídeo (1-2cm) y carótida interna (1cm distal a la bifurcación)16. Se realizaron 6 medidas a intervalos regulares de forma bilateral en 3 proyecciones diferentes (ACCD: 90-120 y 150˚; ACCI: 210, 240 y 270˚). Para el análisis estadístico se utilizaron todas las mediciones. El grosor íntima media (GIM), definido como la distancia entre la interfaz luz carotídea-íntima y la interfaz media-adventicia de la pared distal, se determinó en secciones longitudinales la región previa a la bifurcación de la arteria carótida común (1cm). Se consideró placa carotidea al engrosamiento focal mayor del 50% de la pared del vaso que lo rodea, o a un GIM mayor a 1,5mm que protruye en la luz adyacente17.
Todas las exploraciones fueron realizadas por un único investigador (SM-H) entrenado en la realización de ecografías carotídeas y siguiendo siempre el mismo protocolo previamente descrito. El coeficiente de variabilidad se estudió en 20 sujetos, y fue del 5,2% para el GIM medio de ambas carótidas comunes.
Selección de SNP y genotipadoSe obtuvo ADN genómico a partir de células sanguíneas de sangre venosa, utilizando el sistema Chemagic® (Chemagen, Baesweiler, Alemania). El ADN fue cuantificado y diluido hasta una concentración final de 100ng/μl.
Los SNP del receptor de IL-18 para el genotipado fueron seleccionados en base a una conjunción de diferentes parámetros: heterocigosidad (>10% para el alelo de menor frecuencia) en población caucásica, posición y espaciado a lo largo del gen y posible efecto funcional (http://www. ensembl.org/index.html). Cuatro de ellos fueron seleccionados finalmente: rs2270297 y rs2287037 localizados en IL18R1; rs2293224 y rs7559479 localizados en IL18RAP. Los SNP fueron genotipados usando un ensayo de SNPlex® (Applied Biosystems, Foster City, CA, EE. UU.) siguiendo las recomendaciones del fabricante.
Métodos estadísticosLas variables cuantitativas han sido expresadas como media±desviación estándar y las cualitativas como porcentajes y/o número total. Para la comparación de las variables cuantitativas entre grupos se ha utilizado el test de la t de Student y la prueba de ANOVA (2 o más variables, respectivamente) para las variables de distribución normal. Para las variables de distribución no normal se utilizaron el test de Mann-Whitney y el test de Kruskal-Wallis (2 o más variables, respectivamente). Para corregir factores de confusión en algunos estudios de comparación se ha utilizado el análisis por ANCOVA. Para la comparación de las variables cualitativas entre grupos se ha utilizado el test de Chi-cuadrado, o el test de Fisher cuando el número era inferior a 5. Las correlaciones bivariadas entre variables se estudiaron con la prueba de Pearson para variables con distribución normal y prueba de Spearman para variables sin distribución normal. Para evaluar los factores asociados al GIM carotídeo y a la presencia de placa de ateroma se realizaron análisis de regresión lineal y logística respectivamente. Se consideró que las diferencias eran estadísticamente significativas si el valor de p era inferior a 0,05. Se utilizó el paquete estadístico SPSS® para Windows versión 15.0 (SPSS®, Chicago, IL, EE. UU.). Las frecuencias de los alelos y los genotipos fueron calculadas para cada SNP utilizando SPSS® y SNPstats (http://bioinfo.iconcologia.net/index.php)18. El equilibrio de Hardy-Weinberg (HWE) fue calculado mediante el test de Chi-cuadrado con un grado de libertad utilizando el software SNPstat. Los desequilibrios de ligamiento fueron calculados usando la estadística de R2. La asociación entre los polimorfismos y los niveles de IL-18 fue analizada usando un modelo de herencia codominante mediante SPSS® y SNPstat. Para la comparación de las variables cuantitativas entre genotipos se ha utilizado la prueba de ANOVA. La edad y el sexo, como 2 potenciales factores de confusión, se utilizaron como covariables. Se consideró que las diferencias eran estadísticamente significativas si el valor de p era inferior a 0,05.
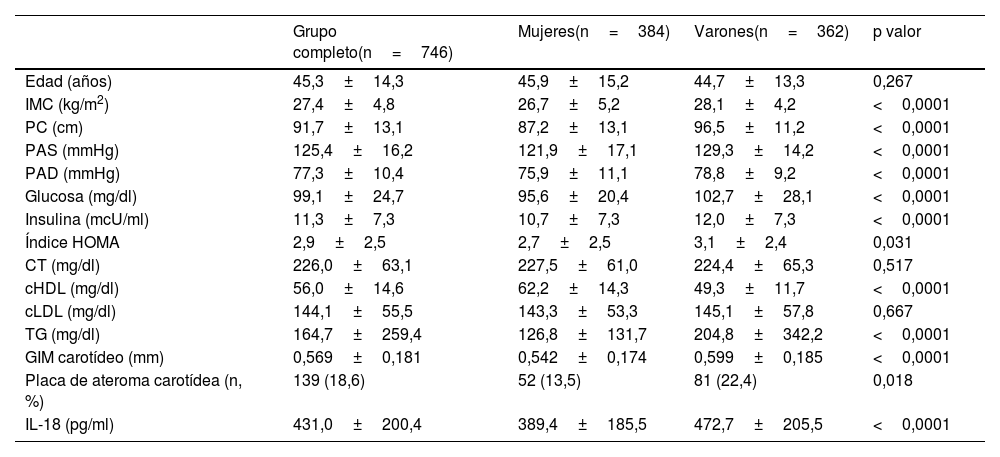
ResultadosLas características generales de la población estudiada se incluyen en la tabla 1. Se encontraron diferencias estadísticamente significativas entre ambos géneros en el IMC, perímetro abdominal, presión arterial sistólica y diastólica, parámetros del metabolismo hidrocarbonado, así como en el cHDL y triglicéridos plasmáticos. Así mismo, los niveles de IL-18 (472,7±205,5 vs. 389,4±185,5pg/ml) y el GIM carotídeo (0,599±0,185 vs. 0,542±0,174mm) fueron significativamente superiores en los hombres. También hubo una mayor frecuencia de placas de ateroma en los varones con respecto a las mujeres.
Características de la población en función del género
| Grupo completo(n=746) | Mujeres(n=384) | Varones(n=362) | p valor | |
|---|---|---|---|---|
| Edad (años) | 45,3±14,3 | 45,9±15,2 | 44,7±13,3 | 0,267 |
| IMC (kg/m2) | 27,4±4,8 | 26,7±5,2 | 28,1±4,2 | <0,0001 |
| PC (cm) | 91,7±13,1 | 87,2±13,1 | 96,5±11,2 | <0,0001 |
| PAS (mmHg) | 125,4±16,2 | 121,9±17,1 | 129,3±14,2 | <0,0001 |
| PAD (mmHg) | 77,3±10,4 | 75,9±11,1 | 78,8±9,2 | <0,0001 |
| Glucosa (mg/dl) | 99,1±24,7 | 95,6±20,4 | 102,7±28,1 | <0,0001 |
| Insulina (mcU/ml) | 11,3±7,3 | 10,7±7,3 | 12,0±7,3 | <0,0001 |
| Índice HOMA | 2,9±2,5 | 2,7±2,5 | 3,1±2,4 | 0,031 |
| CT (mg/dl) | 226,0±63,1 | 227,5±61,0 | 224,4±65,3 | 0,517 |
| cHDL (mg/dl) | 56,0±14,6 | 62,2±14,3 | 49,3±11,7 | <0,0001 |
| cLDL (mg/dl) | 144,1±55,5 | 143,3±53,3 | 145,1±57,8 | 0,667 |
| TG (mg/dl) | 164,7±259,4 | 126,8±131,7 | 204,8±342,2 | <0,0001 |
| GIM carotídeo (mm) | 0,569±0,181 | 0,542±0,174 | 0,599±0,185 | <0,0001 |
| Placa de ateroma carotídea (n, %) | 139 (18,6) | 52 (13,5) | 81 (22,4) | 0,018 |
| IL-18 (pg/ml) | 431,0±200,4 | 389,4±185,5 | 472,7±205,5 | <0,0001 |
Los datos se presentan como media±desviación estándar; p valor entre mujeres y varones.
cHDL: colesterol HDL; cLDL: colesterol LDL; CT: colesterol total; GIM: grosor íntima-media; IL-18: interleucina 18; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PC: perímetro de cintura; TG: triglicéridos.
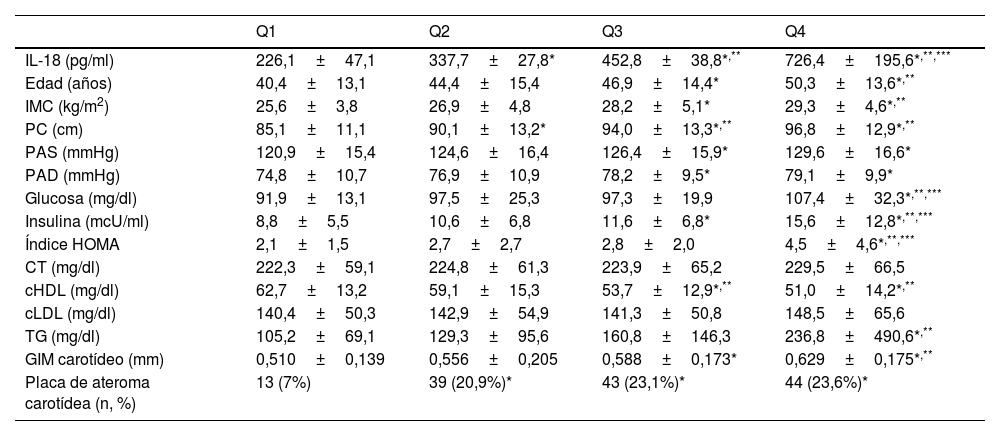
En la tabla 2 se muestran las características de la población dividida en función de los cuartiles de los niveles plasmáticos de IL-18. Se observa que a medida que aumentan los niveles de IL-18 aumentan de forma significativa los niveles de los parámetros asociados con la presencia de resistencia a la insulina, así como el GIM carotídeo. La prevalencia de placas de ateroma fue significativamente inferior en los sujetos incluidos en el cuartil con niveles más bajos de IL-18, comparado con los otros 3, no habiendo diferencias significativas entre los otros 3 grupos.
Características de la población en función de los cuartiles de niveles plasmáticos de IL-18
| Q1 | Q2 | Q3 | Q4 | |
|---|---|---|---|---|
| IL-18 (pg/ml) | 226,1±47,1 | 337,7±27,8* | 452,8±38,8*,** | 726,4±195,6*,**,*** |
| Edad (años) | 40,4±13,1 | 44,4±15,4 | 46,9±14,4* | 50,3±13,6*,** |
| IMC (kg/m2) | 25,6±3,8 | 26,9±4,8 | 28,2±5,1* | 29,3±4,6*,** |
| PC (cm) | 85,1±11,1 | 90,1±13,2* | 94,0±13,3*,** | 96,8±12,9*,** |
| PAS (mmHg) | 120,9±15,4 | 124,6±16,4 | 126,4±15,9* | 129,6±16,6* |
| PAD (mmHg) | 74,8±10,7 | 76,9±10,9 | 78,2±9,5* | 79,1±9,9* |
| Glucosa (mg/dl) | 91,9±13,1 | 97,5±25,3 | 97,3±19,9 | 107,4±32,3*,**,*** |
| Insulina (mcU/ml) | 8,8±5,5 | 10,6±6,8 | 11,6±6,8* | 15,6±12,8*,**,*** |
| Índice HOMA | 2,1±1,5 | 2,7±2,7 | 2,8±2,0 | 4,5±4,6*,**,*** |
| CT (mg/dl) | 222,3±59,1 | 224,8±61,3 | 223,9±65,2 | 229,5±66,5 |
| cHDL (mg/dl) | 62,7±13,2 | 59,1±15,3 | 53,7±12,9*,** | 51,0±14,2*,** |
| cLDL (mg/dl) | 140,4±50,3 | 142,9±54,9 | 141,3±50,8 | 148,5±65,6 |
| TG (mg/dl) | 105,2±69,1 | 129,3±95,6 | 160,8±146,3 | 236,8±490,6*,** |
| GIM carotídeo (mm) | 0,510±0,139 | 0,556±0,205 | 0,588±0,173* | 0,629±0,175*,** |
| Placa de ateroma carotídea (n, %) | 13 (7%) | 39 (20,9%)* | 43 (23,1%)* | 44 (23,6%)* |
Los datos se presentan como media±desviación estándar.
cHDL: colesterol HDL; cLDL: colesterol LDL; CT: colesterol total; GIM: grosor íntima-media; IL-18: interleucina 18; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PC: perímetro de cintura; TG: triglicéridos.
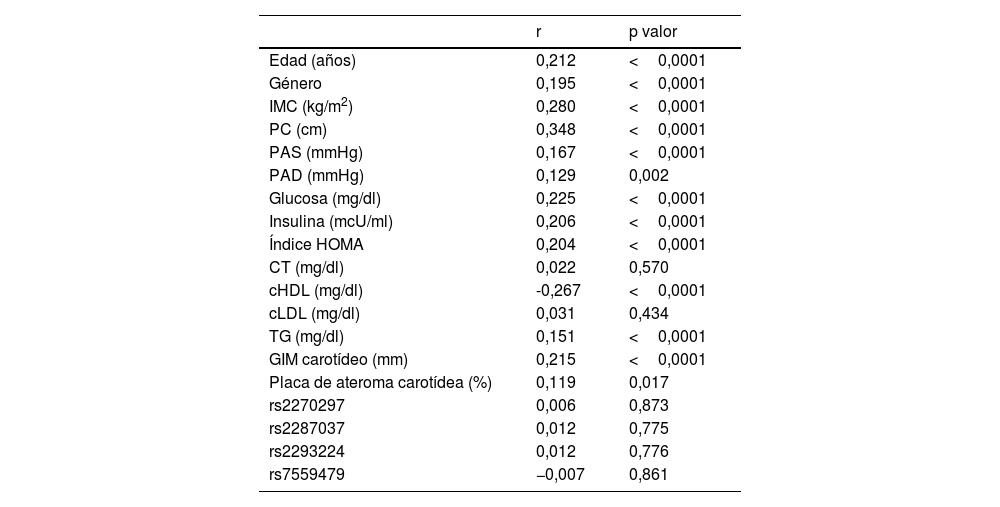
Al analizar la asociación de IL-18 con otros parámetros (tabla 3) se observaron correlaciones significativas con los parámetros asociados a la presencia de resistencia a la insulina, así como a los componentes incluidos en la definición de síndrome metabólico y, además, con el GIM carotídeo y con la presencia de placa de ateroma. No hubo correlación significativa entre los SNPs estudiados y los niveles de IL-18.
Correlaciones entre los niveles plasmáticos de IL-18 y diferentes variables
| r | p valor | |
|---|---|---|
| Edad (años) | 0,212 | <0,0001 |
| Género | 0,195 | <0,0001 |
| IMC (kg/m2) | 0,280 | <0,0001 |
| PC (cm) | 0,348 | <0,0001 |
| PAS (mmHg) | 0,167 | <0,0001 |
| PAD (mmHg) | 0,129 | 0,002 |
| Glucosa (mg/dl) | 0,225 | <0,0001 |
| Insulina (mcU/ml) | 0,206 | <0,0001 |
| Índice HOMA | 0,204 | <0,0001 |
| CT (mg/dl) | 0,022 | 0,570 |
| cHDL (mg/dl) | -0,267 | <0,0001 |
| cLDL (mg/dl) | 0,031 | 0,434 |
| TG (mg/dl) | 0,151 | <0,0001 |
| GIM carotídeo (mm) | 0,215 | <0,0001 |
| Placa de ateroma carotídea (%) | 0,119 | 0,017 |
| rs2270297 | 0,006 | 0,873 |
| rs2287037 | 0,012 | 0,775 |
| rs2293224 | 0,012 | 0,776 |
| rs7559479 | −0,007 | 0,861 |
cHDL: colesterol HDL; cLDL: colesterol LDL; CT: colesterol total; GIM: grosor íntima-media; IL-18: interleucina 18; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PC: perímetro de cintura; TG: triglicéridos
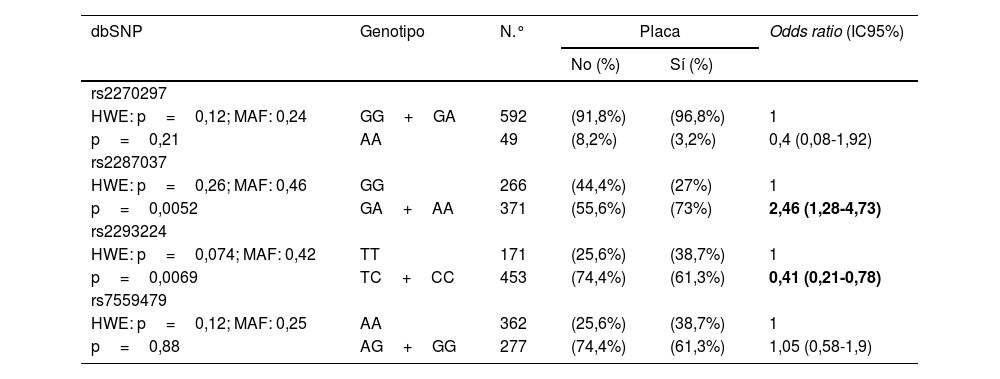
Además, se analizó la posible asociación entre la presencia de alteraciones a nivel carotídeo y los polimorfismos analizados (tabla 4). El equilibrio de Hardy-Weinberg se mantuvo para todos los polimorfismos analizados. Los portadores del alelo menor de rs2287037 presentaron un incremento del riesgo de presentar placa de ateroma, mientras que los portadores del alelo menor de rs2293224 presentaron una reducción significativa de dicho riesgo.
Asociación entre la presencia de placa de ateroma carotídea y los SNPs de IL-18 ajustado por edad y género
| dbSNP | Genotipo | N.° | Placa | Odds ratio (IC95%) | |
|---|---|---|---|---|---|
| No (%) | Sí (%) | ||||
| rs2270297 | |||||
| HWE: p=0,12; MAF: 0,24 | GG+GA | 592 | (91,8%) | (96,8%) | 1 |
| p=0,21 | AA | 49 | (8,2%) | (3,2%) | 0,4 (0,08-1,92) |
| rs2287037 | |||||
| HWE: p=0,26; MAF: 0,46 | GG | 266 | (44,4%) | (27%) | 1 |
| p=0,0052 | GA+AA | 371 | (55,6%) | (73%) | 2,46 (1,28-4,73) |
| rs2293224 | |||||
| HWE: p=0,074; MAF: 0,42 | TT | 171 | (25,6%) | (38,7%) | 1 |
| p=0,0069 | TC+CC | 453 | (74,4%) | (61,3%) | 0,41 (0,21-0,78) |
| rs7559479 | |||||
| HWE: p=0,12; MAF: 0,25 | AA | 362 | (25,6%) | (38,7%) | 1 |
| p=0,88 | AG+GG | 277 | (74,4%) | (61,3%) | 1,05 (0,58-1,9) |
HWE: Hardy-Weinberg equilibrium; MAF: minor allele frequency; SNP: single-nucleotide polymorphism.
En negrita se muestran los datos estadísticamente significativos.
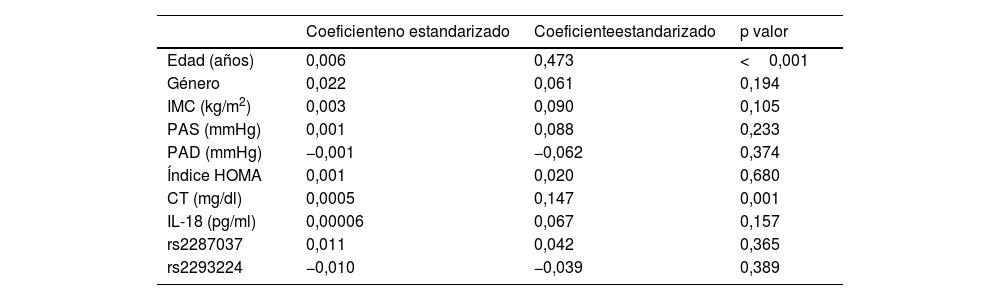
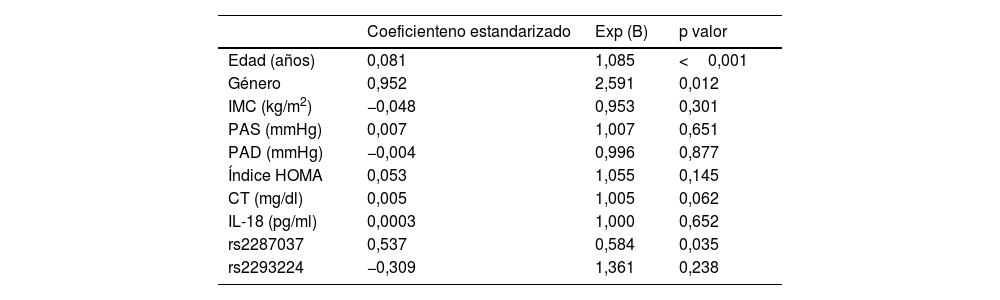
Finalmente, se realizaron análisis de regresión. Mediante regresión lineal se evaluaron cuáles eran los factores asociados con el incremento del GIM carotídeo, observando correlación significativa únicamente con la edad y con los niveles de colesterol (tabla 5). Mediante regresión logística se evaluaron los factores asociados a la presencia de placa de ateroma, observando una asociación significativa con la edad, el género y uno de los SNPs evaluados, rs2287037 (tabla 6).
Modelo de regresión que evalúa los determinantes independientes de GIM carotídeo (variable dependiente)
| Coeficienteno estandarizado | Coeficienteestandarizado | p valor | |
|---|---|---|---|
| Edad (años) | 0,006 | 0,473 | <0,001 |
| Género | 0,022 | 0,061 | 0,194 |
| IMC (kg/m2) | 0,003 | 0,090 | 0,105 |
| PAS (mmHg) | 0,001 | 0,088 | 0,233 |
| PAD (mmHg) | −0,001 | −0,062 | 0,374 |
| Índice HOMA | 0,001 | 0,020 | 0,680 |
| CT (mg/dl) | 0,0005 | 0,147 | 0,001 |
| IL-18 (pg/ml) | 0,00006 | 0,067 | 0,157 |
| rs2287037 | 0,011 | 0,042 | 0,365 |
| rs2293224 | −0,010 | −0,039 | 0,389 |
CT: colesterol total; GIM: grosor íntima-media; IL-18: interleucina 18; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Modelo de regresión que evalúa los determinantes independientes de la placa de ateroma (variable dependiente)
| Coeficienteno estandarizado | Exp (B) | p valor | |
|---|---|---|---|
| Edad (años) | 0,081 | 1,085 | <0,001 |
| Género | 0,952 | 2,591 | 0,012 |
| IMC (kg/m2) | −0,048 | 0,953 | 0,301 |
| PAS (mmHg) | 0,007 | 1,007 | 0,651 |
| PAD (mmHg) | −0,004 | 0,996 | 0,877 |
| Índice HOMA | 0,053 | 1,055 | 0,145 |
| CT (mg/dl) | 0,005 | 1,005 | 0,062 |
| IL-18 (pg/ml) | 0,0003 | 1,000 | 0,652 |
| rs2287037 | 0,537 | 0,584 | 0,035 |
| rs2293224 | −0,309 | 1,361 | 0,238 |
CT: colesterol total; GIM: grosor íntima-media; IL-18: interleucina 18; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
En este estudio se demuestra que los pacientes con niveles plasmáticos más elevados de IL-18 presentan factores de riesgo cardiovascular asociados. Además, los niveles elevados de IL-18 se asociaron de forma significativa con un mayor GIM carotídeo y con la presencia de placas de ateroma. Esta asociación parece estar influenciada por factores genéticos, como lo demuestran las asociaciones encontradas entre los SNPs en el gen del receptor de IL-18 y la presencia de placa de ateroma.
La arteriosclerosis es una enfermedad crónica en cuya patogénesis intervienen diferentes moléculas inflamatorias. Dentro de estas, la IL-18 es una citocina que juega un importante papel en el desarrollo del proceso inflamatorio19. De hecho, se considera que, junto con la IL-1β, es una de las 2 citocinas inflamatorias más destacadas del inflamasoma que promueven el desarrollo de la aterosclerosis20. Sin embargo, en relación a este hallazgo parecen existir datos contradictorios. Fan et al.21 en un metaanálisis, aplicando metodología de aleatorización mendeliana, no encontraron relación entre los niveles de IL-18 y el riesgo de enfermedad cardiovascular. Por tanto, el conocimiento del papel de IL-18, así como de los posibles mecanismos implicados en la modulación del proceso arteriosclerótico tienen gran interés, sobre todo porque podría ser una posible vía sobre la que incidir para reducir el riesgo de desarrollar arteriosclerosis y enfermedad cardiovascular22.
En el presente estudio, los pacientes con niveles más elevados de IL-18 presentaron mayor GIM carotídeo, así como una mayor asociación con otros factores de riesgo cardiovascular. Además, aquéllos con menores niveles de IL-18 presentan una menor proporción de placas de ateroma (tabla 2). Estos hallazgos van en la misma línea que estudios previos en los que se observó que la IL-18 tenía un papel proaterogénico. Así, los niveles plasmáticos de IL-18 demostraron ser un buen predictor tanto del desarrollo de enfermedad cardiovascular como de mortalidad por dicha causa11,23. Por el contrario, modelos animales deficientes en IL-18 tienen menor presencia de arteriosclerosis24. Además, datos experimentales indican que la vía de señalización de IL-18 está involucrada en la inestabilidad de la placa25,26.
Sin embargo, existe gran variabilidad en el desarrollo de arteriosclerosis y enfermedad cardiovascular entre los pacientes con niveles elevados de IL-18. La presencia de diferentes variaciones genéticas podría explicar esto, al menos, en parte27. Estudios previos han mostrado que polimorfismos en el gen de la IL-18 se asocian con el desarrollo de enfermedad coronaria y la severidad de la misma7,12, aunque existen datos contradictorios14,28.
La señalización de IL-18 se induce mediante la unión de esta citoquina a un receptor heterodimérico llamado IL-18R. Este, está formado por 2 cadenas, IL-18R1 (con función de unión) e IL18RAP (proteína accesoria del receptor, con función de transducción de señales). La interacción de ambas cadenas de IL-18R es necesaria para inducir la señalización de IL-1829,30. En nuestro estudio hemos analizado 2 SNPs de IL-18R1 (rs2270297 y rs2287037) y 2 SNPs de IL-18RAP (rs2293224 y rs7559479). Observamos que el genotipo con el alelo A del SNP rs2287037 de IL-18R1 se asocia con mayor prevalencia de placa de ateroma carotídea. Por la localización, este SNP podría ser funcional. Además, en el análisis de regresión este SNPs se asoció de forma significativa con la presencia de placa de ateroma. Por el contrario, el genotipo con el alelo C del SNP rs2293224 de IL-18RAP se asocia con una menor prevalencia de placa de ateroma. Sin embargo, no existen estudios previos relacionando variaciones de estos SNPs con la presencia de arteriosclerosis.
Este estudio presenta algunas limitaciones. Por un lado, es un estudio transversal. Por tanto, no es posible establecer relaciones de causalidad. Además, no se han replicado los resultados en otra población. Por último, no existen datos en este estudio de la presencia de placas de ateroma a nivel femoral. Tampoco se ha evaluado si existe asociación entre las características de la placa de ateroma o el número de territorios vasculares afectados y los niveles de IL-18 y las variaciones genéticas estudiadas. No obstante, los hallazgos encontrados apoyan la participación de la IL-18 en el desarrollo de la arteriosclerosis, así como su posible regulación.
En conclusión, este estudio realizado en población mediterránea sugiere que los niveles plasmáticos de IL-18 están relacionados con otros factores de riesgo cardiovascular, especialmente con los relacionados con la presencia de resistencia a la insulina. Además, niveles más elevados de IL-18 se relacionan con la presencia de placas de ateroma, existiendo variaciones genéticas en el gen del receptor de IL-18 que podrían estar asociadas con el desarrollo de dichas placas de ateroma.
FinanciaciónConsorcio Centro de Investigación Biomédica en Red (CIBER) CB07/08/0018, Instituto de Salud Carlos III, Ministerio de Ciencia e Innovación y Unión Europea (Fondos Europeos de desarrollo Regional).
AP es receptora de un contrato postdoctoral Sara Borrell del Instituto de Salud Carlos III (CD22/00012).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Consorcio Centro de Investigación Biomédica en Red (CIBER) CB07/08/0018, Instituto de Salud Carlos III, Ministerio de Ciencia e Innovación y Unión Europea (Fondos Europeos de desarrollo Regional).