Las infecciones producidas por enterobacterias productoras de carbapenemasas (EPC) están aumentando drásticamente a nivel mundial, con especial relevancia en pacientes quirúrgicos. El objetivo de este estudio fue analizar el perfil clínico, las complicaciones, el tratamiento, la mortalidad y los costes en pacientes con infección de sitio quirúrgico (ISQ) asociada a EPC tras cirugía abdominal.
MétodosPacientes con ISQ asociada a EPC tras cirugía abdominal entre enero de 2013 y diciembre de 2018. Se incluyeron aquellos factores y procedimientos previos a la identificación de ISQ, y se realizó un análisis de mortalidad para identificar factores de riesgo en aquellos pacientes con ISQ órgano-cavitaria por EPC tras cirugía abdominal.
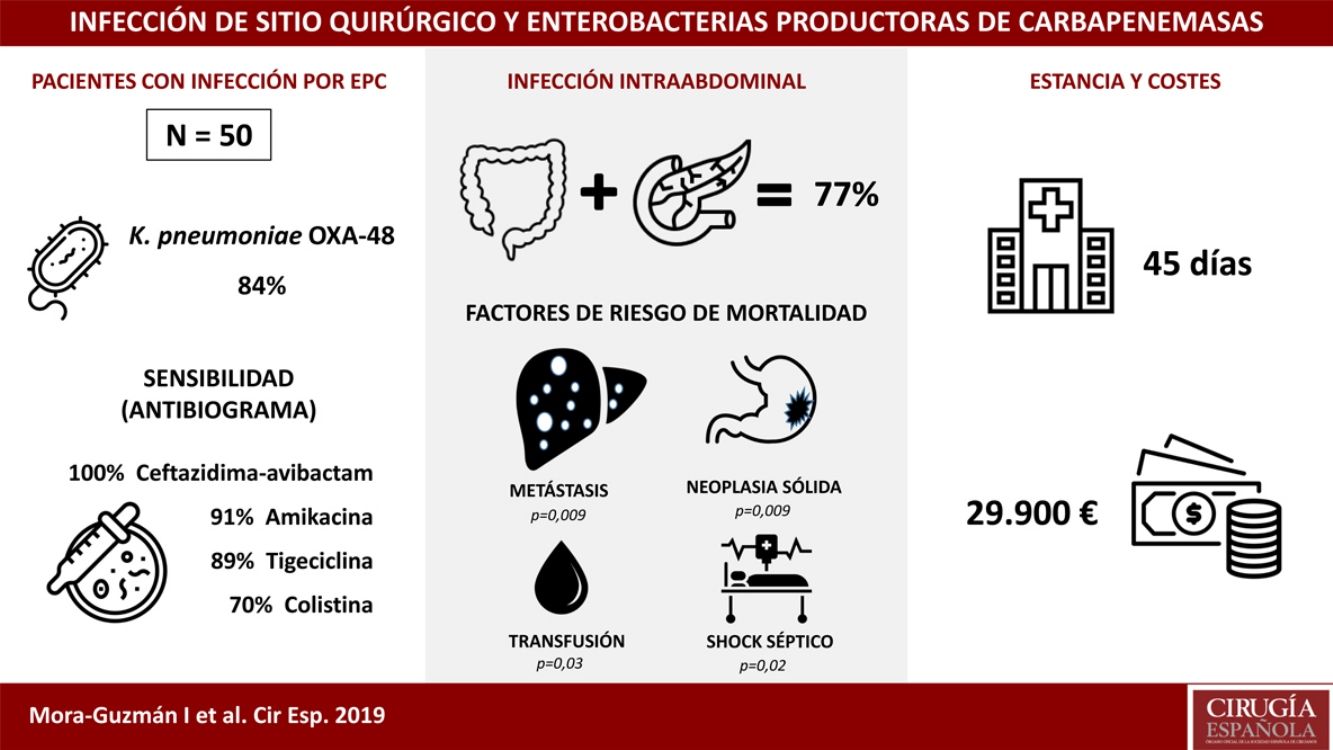
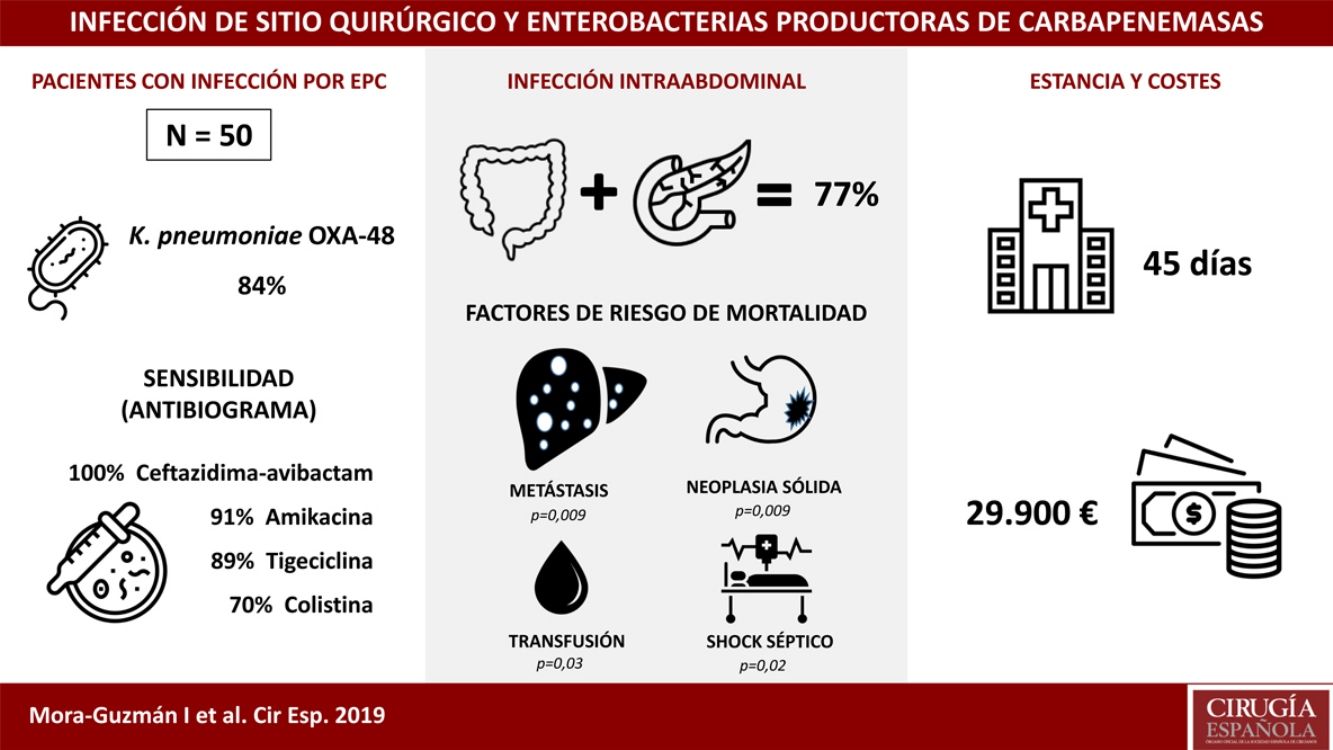
ResultadosCincuenta pacientes fueron incluidos: ISQ incisional superficial 50%, ISQ incisional profunda 28%, ISQ órgano-cavitaria (o infección intraabdominal) 70%. Se identificó Klebsiella pneumoniae OXA-48 en el 84%, siendo más frecuentes la cirugía colorrectal (40%) y la pancreática (20%). La sensibilidad antimicrobiana fue: ceftazidima-avibactam 100%, amikacina 91,7%, tigeciclina 89,1%, colistina 70,8%, meropenem 62,8%, imipenem 52,1%. Se utilizó antibioterapia dirigida adecuada en el 86%, incluyendo terapia combinada en el 76%. La mortalidad global a 30 días de la infección intraabdominal fue de un 20%, siendo factores predictores: neoplasia sólida (p=0,009), metástasis sólida (p=0,009), shock séptico (p=0,02), transfusión de hemoderivados (p=0,03). La mediana global de estancia fue de 45 días (RIC 26-67). La mediana del coste global del ingreso fue 29.946€ (RIC 15.405-47.749).
ConclusionesEl perfil del paciente con ISQ causada por EPC incluye múltiples comorbilidades, procedimientos, larga estancia y altos costes asociados. Son predictores de mortalidad en infección intraabdominal la presencia de neoplasia, metástasis, shock séptico o transfusión.
Infections caused by carbapenemase-producing Enterobacteriaceae (CPE) are dramatically increasing worldwide, with an important impact on surgical patients. Our aim was to assess the clinical profile, outcomes, treatment, mortality and costs of CPE-related surgical site infection (SSI) in patients with abdominal surgery.
MethodsReview of CPE-related SSI in patients with abdominal surgery from January 2013 to December 2018. Patient factors and interventions present previously to the SSI identification were recorded, and a mortality analysis was also performed in patients with abdominal surgery and CPE-related organ/space SSI.
ResultsFifty patients were included: superficial incisional SSI 50%, deep incisional SSI 28%, organ/space SSI (or intra-abdominal infection) 70%. Klebsiella pneumoniae OXA-48 was present in 84%, and the most frequent were colorectal surgery (40%) and pancreatic surgery (20%). The antimicrobial susceptibility was: ceftazidime-avibactam 100%, amikacin 91.7%, tigecycline 89.1%, colistin 70.8%, meropenem 62.8%, imipenem 52.1%. An appropriate definitive antimicrobial treatment was administered in 86%, using a combined scheme in 76%. Global 30-day mortality rate for intra-abdominal infection was 20%, and mortality-related factors were: solid tumour (P=.009), solid metastasis (P=.009), septic shock (P=.02), blood transfusions (P=.03). Median global stay was 45 (IQR 26-67) days. Median global cost of hospitalization was €29,946 (IQR 15,405-47,749).
ConclusionsThe clinical profile of patients with CPE-related SSI associates several comorbidities, interventions, prolonged stay and elevated costs. Mortality-related factors in intra-abdominal infection are solid tumour, metastasis, septic shock or blood transfusions.
El progresivo incremento de la resistencia bacteriana a antibióticos (ATB) y la ausencia del desarrollo de nuevos agentes antimicrobianos han conducido irremediablemente a una reducción en las opciones de tratamiento de las infecciones asociadas a bacterias multirresistentes (BMR)1,2. Durante los últimos años, se ha producido un aumento drástico a nivel mundial de las infecciones por enterobacterias productoras de carbapenemasas (EPC), habiéndose declarado numerosos países endémicos de algunas cepas1–4. Tal es la alarma con respecto a esta situación, que la Organización Mundial de la Salud ha situado recientemente a las EPC entre las BMR con prioridad de primer orden para la investigación y el desarrollo de nuevos ATB5. Las infecciones nosocomiales causadas por EPC asocian altos porcentajes de morbimortalidad y unas cifras elevadas de estancia y costes sanitarios1,6. Existen unas opciones terapéuticas recomendadas, habiéndose obtenido buenos resultados en algunos estudios con la utilización de una terapia ATB combinada, en diferentes escenarios clínicos6,7.
Numerosas publicaciones han detallado la epidemiología, los patrones de resistencia y los factores de riesgo de adquisición y mortalidad de las infecciones asociadas a EPC2,5,8–12. Actualmente, la mayoría de los estudios publicados incluyen pacientes con bacteriemia, infección intraabdominal (IIA) o pacientes ingresados en una Unidad de Cuidados Intensivos (UCI), incluyéndose en ocasiones individuos con cierta heterogeneidad respecto al tipo de infección asociada a EPC. A día de hoy, son escasos los trabajos de investigación que estudian el perfil clínico y los factores de riesgo de infecciones asociadas a BMR en pacientes quirúrgicos13. Se han publicado algunos estudios sobre EPC que analizan pacientes quirúrgicos en UCI12,14, o pacientes inmunodeprimidos tras un trasplante15, siendo la prescripción prolongada previa de ATB un factor crucial. La realización de una intervención quirúrgica asocia un aumento en la morbilidad de los pacientes hospitalizados, existiendo un riesgo mayor de adquirir una infección causada por BMR, con el incremento asociado en estancia y costes16. La identificación precoz de los factores de riesgo y el perfil clínico de aquellos pacientes con una cirugía abdominal podría ser esencial para optimizar el uso racional de ATB y mejorar las estrategias de tratamiento de las infecciones de sitio quirúrgico (ISQ)17. Con el incremento progresivo de infecciones nosocomiales asociadas a EPC, siendo la intervención quirúrgica y la IIA posibles factores de riesgo asociados2,10,12, existen motivos suficientes para justificar el desarrollo de la investigación en estos pacientes con ISQ.
El objetivo de este estudio fue identificar el perfil clínico de los pacientes con ISQ asociada a EPC tras cirugía abdominal, los patrones de resistencia, los factores de riesgo de mortalidad y los costes asociados.
MétodosLa población a estudio estuvo formada por los pacientes consecutivos intervenidos de cirugía abdominal con ISQ por EPC adquirida durante el ingreso en Cirugía General y Digestivo (CGD) entre enero de 2013 y diciembre de 2018. Los criterios de inclusión fueron: adultos mayores de 18 años de edad, presencia de al menos un cultivo positivo a partir de 48h tras el ingreso, asociado a datos clínicos de ISQ. Para realizar un seguimiento completo de la evolución de cada paciente tras la detección de ISQ, se excluyeron aquellos que tenían aislamientos de EPC no ingresados en CGD o trasladados a otros servicios, pacientes con información incompleta de datos microbiológicos y pacientes colonizados por EPC sin expresión clínica.
Los datos quedaron recogidos en una base de datos prospectiva, incluyendo el seguimiento de los pacientes hasta el alta hospitalaria o el fallecimiento. Se incluyeron los pacientes exclusivamente una vez, registrando los aislamientos de EPC en múltiples localizaciones en un mismo individuo.
Las variables objetivo principales del estudio fueron la mortalidad a 30 días y los factores predictores de mortalidad de IIA asociada a EPC tras cirugía abdominal. Las variables objetivo secundarias incluyeron: factores del paciente y comorbilidades, localización de ISQ, tipo de carbapenemasa, perfil de resistencia, tratamiento ATB empleado, estancia y coste total del ingreso.
Se registraron las variables clínicas, los datos microbiológicos, el tratamiento recibido y las complicaciones tras la revisión del historial médico de los pacientes. Se incluyeron datos demográficos y comorbilidades, incluyendo el índice de Charlson18. Los factores de riesgo de infección por EPC presentes previamente a ISQ fueron: hospitalización durante los 12 meses previos, ATB>48h (30 días previos), cirugía abdominal (30 días previos), diálisis (30 días previos) y procedimientos endoscópicos (30 días previos). Se recogieron aquellos procedimientos e intervenciones realizados durante el ingreso previamente a la identificación de ISQ: diálisis, transfusión de hemoderivados, intubación/ventilación mecánica, traqueotomía, catéter venoso central, sonda nasogástrica, sonda vesical, drenaje abdominal, nutrición parenteral, ingreso>48h en UCI. La información relativa a la intervención quirúrgica recogida fue: clasificación de riesgo anestésico de la American Society of Anesthesiologists, origen específico de la enfermedad (hígado, vías biliares, páncreas, estómago, colon, recto, etc.), intervención urgente/programada, abordaje (abierto/mínimamente invasivo), grado de contaminación de la cirugía según los Centers for Disease Control (CDC), reintervención quirúrgica, complicaciones (según la clasificación Clavien-Dindo)19. Las variables microbiológicas y relacionadas con la infección fueron: fecha y localización de toma de muestra, foco infeccioso principal, shock séptico, especie de EPC aislada y clasificación20, patrones de resistencia de EPC, aislamiento de BMR concomitantes (betalactamasas de espectro extendido [BLEE]). También se registraron el tratamiento ATB empírico y la terapia dirigida para EPC según antibiograma (incluyendo la utilización de tratamiento combinado).
Se recogieron la estancia hospitalaria y la tasa de mortalidad a 30 días, incluyendo el coste total del ingreso (en euros) en cada paciente. Se realizó un análisis de mortalidad con el objetivo de identificar posibles factores de riesgo en aquellos pacientes con infección órgano-cavitaria por EPC tras cirugía abdominal.
El protocolo para la realización de este trabajo fue presentado al Comité Ético de Investigación Clínica del centro, obteniendo la aprobación correspondiente.
Se especificaron las siguientes definiciones previamente al análisis de la base de datos:
La infección nosocomial se definió como una infección que tiene lugar al menos 48h tras el ingreso hospitalario actual, o una infección que ya existía dentro de las 2 semanas anteriores en relación con un ingreso previo21. Shock séptico fue catalogado como sepsis con hipotensión persistente a pesar de la reposición adecuada de volumen, asociada a fallo orgánico22. El foco infeccioso más probable según datos microbiológicos en cada paciente se definió con base en la evaluación clínica por 2 facultativos, según las definiciones CDC21. La antibioterapia empírica apropiada se definió como la administración de ATB con actividad in vitro frente a las EPC identificadas, dentro de las primeras 24h desde el inicio/diagnóstico de ISQ. Se definió antibioterapia dirigida a EPC apropiada si mostró actividad in vitro, con administración de una duración mínima de 48h23. El tratamiento en régimen de monoterapia o terapia combinada se definió según el número de antimicrobianos activos incluidos.
En cuanto al estudio microbiológico, se recogieron e incubaron las muestras teniendo en cuenta la localización del aislamiento: exudado de herida quirúrgica, absceso intraabdominal, hemocultivo, catéter, urocultivo, exudado respiratorio.
El procesamiento microbiológico de las muestras se realizó según la metodología estándar de nuestro laboratorio. La identificación de EPC y la determinación del antibiograma se realizó mediante el sistema MicroScan WalkAway® (Beckman Coulter, Pasadena, CA, EE. UU.), siguiendo las recomendaciones del fabricante. Se incluyeron en el estudio todas las cepas identificadas con concentración mínima inhibitoria>0,125mg/L para ertapenem y meropenem, y concentración mínima inhibitoria>1mg/L para imipenem, siguiendo las recomendaciones del European Committee on Antimicrobial Susceptibility Testing24. Respecto a las cepas de EPC aisladas en 2013 y 2014, la identificación fenotípica se realizó según métodos colorimétricos CARBA NP25, con el estudio de genotipos en el Centro Nacional de Microbiología (Instituto de Salud Carlos III). En aquellas EPC identificadas a partir de 2015, el estudio de fenotipo se realizó con el test inmunocromatográfico OXA-48 Card Letitest (Coris BioConcept, Gembloux, Bélgica)26. Cuando el examen inmunocromatográfico fue negativo, se emplearon técnicas de biología molecular mediante la reacción en cadena de la polimerasa en tiempo real Xpert® Carba-R (Cepheid, Sunnyvale, CA, EE. UU.)27.
Análisis estadísticoLos resultados se expresaron como porcentajes para las variables categóricas y como media y desviación estándar para las variables continuas, utilizando la mediana y el rango intercuartílico (RIC) para las variables con distribución asimétrica. Para el estudio de la normalidad de las variables se utilizó el test de Kolmogorov-Smirnov. Se utilizó el test de χ2 o el test exacto de Fisher para la comparación de las variables categóricas. Para el estudio de las variables continuas se utilizaron los test de la t de Student y la U de Mann-Whitney, según la normalidad o no de las variables, respectivamente. Se consideraron diferencias estadísticamente significativas de forma bilateral con valores de p<0,05. El análisis estadístico se realizó mediante el programa SPSS® v. 25.0 para Windows (SPSS Inc., Chicago, IL, EE. UU.).
ResultadosDurante un periodo de 6 años (2013-2018) se incluyeron 50 pacientes consecutivos con ISQ asociada a EPC tras cirugía abdominal. El 50% de los pacientes presentaron ISQ incisional superficial, el 28% ISQ incisional profunda y el 70% ISQ órgano-cavitaria (o IIA). La edad media fue de 66,5±12,9 años y la mediana del índice de comorbilidad de Charlson, de 4 (RIC 1-6), con un 54% de pacientes de sexo masculino. Las comorbilidades más comunes fueron: neoplasia previa (48%), inmunodepresión (38%), diabetes mellitus (28%) o cardiopatía (22%). El 60% de los pacientes tuvieron al menos una hospitalización durante los 12 meses anteriores, habiendo sido tratados con ATB durante los 30 días previos a ISQ el 100% (con administración de carbapenémicos en el 68% de los pacientes). Otros factores con alta prevalencia durante el ingreso fueron: catéter venoso central (64%), nutrición parenteral (56%), transfusión (48%), endoscopia (42%) e ingreso prolongado en UCI (42%). La mediana de tiempo de ingreso hasta el aislamiento de EPC fue de 16 días (RIC 10-30).
Teniendo en cuenta la localización y la patología subyacente, la cirugía más frecuente en pacientes con ISQ asociada a EPC fue la cirugía colorrectal (40%), seguida de la cirugía pancreática (20%). En cuanto al grado de contaminación de la cirugía, la más común fue la cirugía limpia-contaminada (52%), seguida de la cirugía contaminada (30%). En el global de la serie, la tasa de complicaciones mayores (Clavien-Dindo≥3) fue del 66%, con una tasa de mortalidad a 30 días del 14% (7 pacientes). Todos los pacientes fallecidos incluyeron ISQ órgano-cavitaria, siendo por tanto la tasa de mortalidad a 30 días en el subgrupo de ISQ órgano-cavitaria (o IIA) del 20%. Los porcentajes de reintervención y reingreso en nuestra serie fueron del 34 y 24%, respectivamente.
Las cepas de Klebsiella pneumoniae fueron las EPC más frecuentemente identificadas, con 42 casos (84%). Se aisló Enterobacter cloacae en 4 pacientes (8%), Escherichia coli en 3 (6%) y Morganella morganii en uno (2%). La clase OXA-48 estuvo presente en 49 casos (98%), y VIM en un paciente con E. cloacae. Se identificaron 2 EPC simultáneamente en un paciente: K. pneumoniae OXA-48 y E. coli OXA-48. Existió infección previa asociada a BLEE en 9 casos (18%).
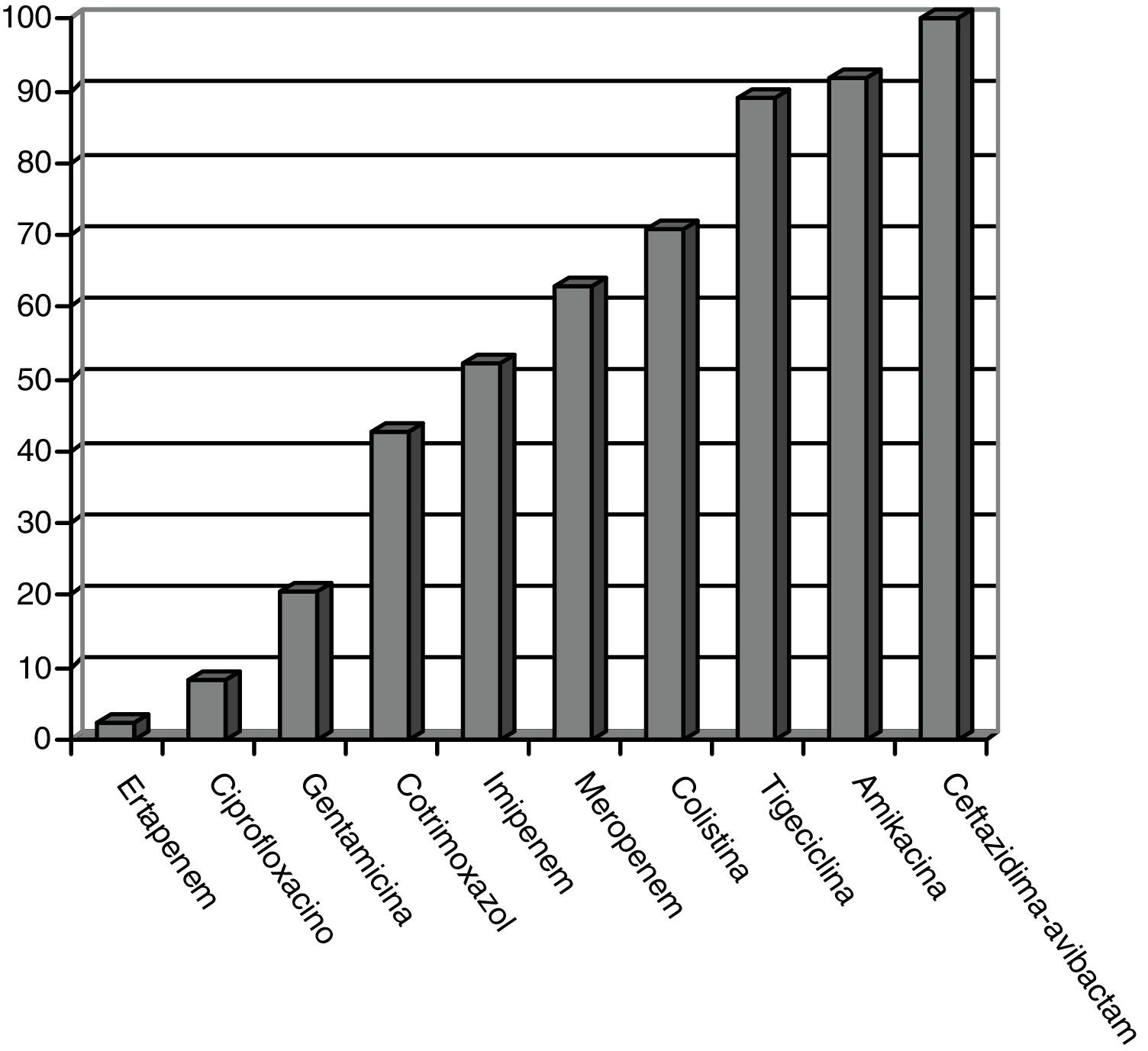
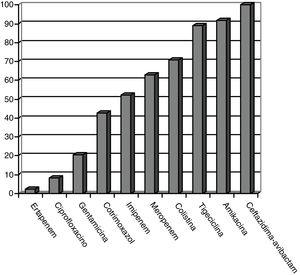
Los patrones de sensibilidad de EPC según el antibiograma se muestran en la figura 1. Las EPC fueron muy susceptibles a ceftazidima-avibactam (100%), amikacina (91,7%), tigeciclina (89,1%) y colistina (70,8%), existiendo concentraciones mínimas inhibitorias mayores, pero con aceptable susceptibilidad a meropenem (62,8%) e imipenem (52,1%). Existió pobre susceptibilidad a ciprofloxacino (8,3%) y ertapenem (2,3%).
Se utilizó antibioterapia empírica adecuada (según actividad in vitro frente a EPC) en 7 pacientes (14%), prescribiéndose antibioterapia dirigida a EPC de forma apropiada en 43 (86%). Teniendo en cuenta la prescripción de antibioterapia dirigida a EPC, no se objetivaron diferencias significativas en cuanto a mortalidad: sobre los pacientes con tratamiento adecuado (43), fallecieron 6 pacientes (14%), y sobre los pacientes con tratamiento inadecuado (7), falleció un paciente (14,3%).
Se prescribió antibioterapia dirigida combinada en 38 pacientes (76%), con una combinación de 2 ATB activos en 35 pacientes (70%). Los porcentajes de mortalidad fueron similares independientemente de la utilización de terapia combinada: combinación ATB 6 pacientes (15,8%), no combinación ATB un paciente (8,3%). En 23 casos (46%) la terapia combinada incluyó un carbapenémico. La mediana de duración de ATB dirigida fue de 14 días (RIC 9-20).
De los 35 pacientes con ISQ órgano-cavitaria (IIA), la mayoría fueron intervenidos de enfermedad colorrectal o biliopancreática (77,1%), precisando una reintervención el 34,3%.
En los casos con IIA, K. pneumoniae productora de carbapenemasa OXA-48 fue igualmente la EPC más prevalente, con 29 casos (82,8%). Se identificaron E. cloacae en 3 pacientes (8,6%), 2 OXA-48 (5,7%) y un VIM, E. coli OXA-48 en 2 (5,7%) y M. morganii OXA-48 en 1 (2,8%). Se identificó infección previa por BLEE en 8 casos (22,8%). Los ATB con mejores porcentajes de sensibilidad como tratamiento de IIA asociada a EPC fueron: ceftazidima-avibactam (100%), amikacina (90,9%), tigeciclina (89,6%), colistina (78,9%) y meropenem (56,7%). Analizando el tratamiento ATB prescrito, existió un 88,6% de pacientes con terapia ATB dirigida apropiada, utilizando terapia combinada en el 77,1%. Teniendo en cuenta la antibioterapia dirigida a EPC, fallecieron 6 sobre 31 pacientes (19,4%) con antibioterapia apropiada, y uno sobre 4 pacientes (25%) con antibioterapia inapropiada, sin diferencias estadísticamente significativas (p=1). No se objetivaron tampoco diferencias significativas analizando la mortalidad según el empleo de antibioterapia dirigida en monoterapia o combinada.
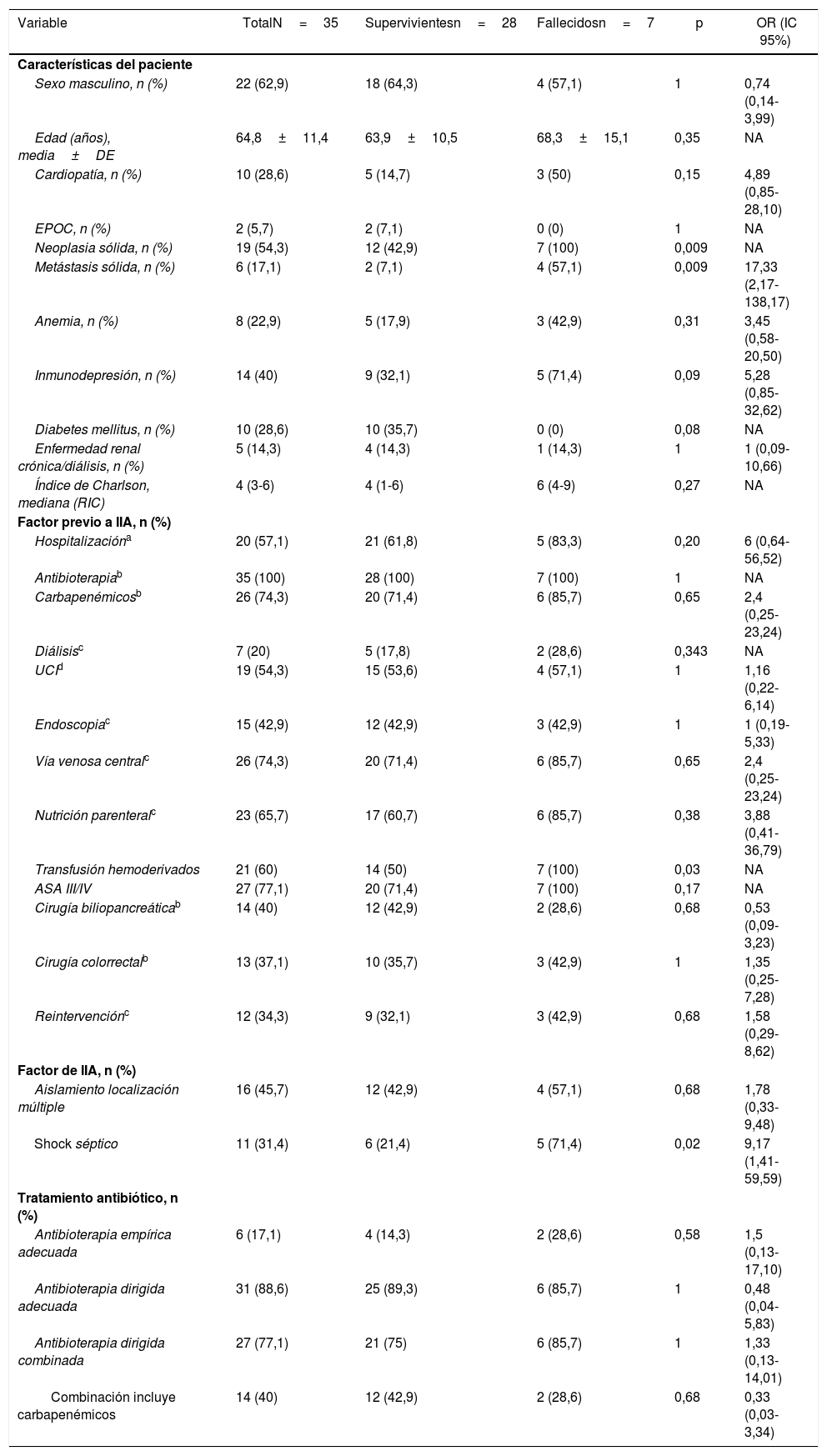
En el análisis de mortalidad de IIA (Tabla 1), se identificaron diferencias significativas en las siguientes variables como factores de riesgo: neoplasia sólida (p=0,009), metástasis sólida (p=0,009), shock séptico (p=0,02) y transfusión de hemoderivados (p=0,03).
Análisis de factores asociados con mortalidad en pacientes con infección intraabdominal por enterobacterias productoras de carbapenemasas tras cirugía abdominal
| Variable | TotalN=35 | Supervivientesn=28 | Fallecidosn=7 | p | OR (IC 95%) |
|---|---|---|---|---|---|
| Características del paciente | |||||
| Sexo masculino, n (%) | 22 (62,9) | 18 (64,3) | 4 (57,1) | 1 | 0,74 (0,14-3,99) |
| Edad (años), media±DE | 64,8±11,4 | 63,9±10,5 | 68,3±15,1 | 0,35 | NA |
| Cardiopatía, n (%) | 10 (28,6) | 5 (14,7) | 3 (50) | 0,15 | 4,89 (0,85-28,10) |
| EPOC, n (%) | 2 (5,7) | 2 (7,1) | 0 (0) | 1 | NA |
| Neoplasia sólida, n (%) | 19 (54,3) | 12 (42,9) | 7 (100) | 0,009 | NA |
| Metástasis sólida, n (%) | 6 (17,1) | 2 (7,1) | 4 (57,1) | 0,009 | 17,33 (2,17-138,17) |
| Anemia, n (%) | 8 (22,9) | 5 (17,9) | 3 (42,9) | 0,31 | 3,45 (0,58-20,50) |
| Inmunodepresión, n (%) | 14 (40) | 9 (32,1) | 5 (71,4) | 0,09 | 5,28 (0,85-32,62) |
| Diabetes mellitus, n (%) | 10 (28,6) | 10 (35,7) | 0 (0) | 0,08 | NA |
| Enfermedad renal crónica/diálisis, n (%) | 5 (14,3) | 4 (14,3) | 1 (14,3) | 1 | 1 (0,09-10,66) |
| Índice de Charlson, mediana (RIC) | 4 (3-6) | 4 (1-6) | 6 (4-9) | 0,27 | NA |
| Factor previo a IIA, n (%) | |||||
| Hospitalizacióna | 20 (57,1) | 21 (61,8) | 5 (83,3) | 0,20 | 6 (0,64-56,52) |
| Antibioterapiab | 35 (100) | 28 (100) | 7 (100) | 1 | NA |
| Carbapenémicosb | 26 (74,3) | 20 (71,4) | 6 (85,7) | 0,65 | 2,4 (0,25-23,24) |
| Diálisisc | 7 (20) | 5 (17,8) | 2 (28,6) | 0,343 | NA |
| UCId | 19 (54,3) | 15 (53,6) | 4 (57,1) | 1 | 1,16 (0,22-6,14) |
| Endoscopiac | 15 (42,9) | 12 (42,9) | 3 (42,9) | 1 | 1 (0,19-5,33) |
| Vía venosa centralc | 26 (74,3) | 20 (71,4) | 6 (85,7) | 0,65 | 2,4 (0,25-23,24) |
| Nutrición parenteralc | 23 (65,7) | 17 (60,7) | 6 (85,7) | 0,38 | 3,88 (0,41-36,79) |
| Transfusión hemoderivados | 21 (60) | 14 (50) | 7 (100) | 0,03 | NA |
| ASA III/IV | 27 (77,1) | 20 (71,4) | 7 (100) | 0,17 | NA |
| Cirugía biliopancreáticab | 14 (40) | 12 (42,9) | 2 (28,6) | 0,68 | 0,53 (0,09-3,23) |
| Cirugía colorrectalb | 13 (37,1) | 10 (35,7) | 3 (42,9) | 1 | 1,35 (0,25-7,28) |
| Reintervenciónc | 12 (34,3) | 9 (32,1) | 3 (42,9) | 0,68 | 1,58 (0,29-8,62) |
| Factor de IIA, n (%) | |||||
| Aislamiento localización múltiple | 16 (45,7) | 12 (42,9) | 4 (57,1) | 0,68 | 1,78 (0,33-9,48) |
| Shock séptico | 11 (31,4) | 6 (21,4) | 5 (71,4) | 0,02 | 9,17 (1,41-59,59) |
| Tratamiento antibiótico, n (%) | |||||
| Antibioterapia empírica adecuada | 6 (17,1) | 4 (14,3) | 2 (28,6) | 0,58 | 1,5 (0,13-17,10) |
| Antibioterapia dirigida adecuada | 31 (88,6) | 25 (89,3) | 6 (85,7) | 1 | 0,48 (0,04-5,83) |
| Antibioterapia dirigida combinada | 27 (77,1) | 21 (75) | 6 (85,7) | 1 | 1,33 (0,13-14,01) |
| Combinación incluye carbapenémicos | 14 (40) | 12 (42,9) | 2 (28,6) | 0,68 | 0,33 (0,03-3,34) |
ASA: American Society of Anesthesiologists; DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; IC 95%: intervalo de confianza al 95%; IIA: infección intraabdominal; NA: no aplicable; OR: odds ratio; RIC: rango intercuartílico.
La mediana de la estancia hospitalaria fue de 45 días (RIC 26-67), siendo la mediana de estancia tras el aislamiento de EPC de 25 días (RIC 12-51). La mediana de estancia específica en los casos con IIA asociada a EPC fue de 48 días (RIC 30-66).
La mediana del coste global del ingreso por paciente fue de 29.946€ (RIC 15.405-47.749), siendo la mediana del coste del ingreso en los casos con IIA asociada a EPC de 30.813€ (RIC 16.072-51.853). Estas cifras superan el doble del coste medio global del ingreso de un paciente con IIA no asociada a EPC intervenido de cirugía colorrectal o pancreática, que es de 14.710€ (RIC 8.808-19.651), siendo esta diferencia de costes significativa (p<0,001).
DiscusiónEl presente trabajo incluye una descripción detallada del perfil clínico, las complicaciones y la mortalidad de los pacientes con ISQ asociada a EPC tras cirugía abdominal, con especial hincapié en la IIA. Existe una alta incidencia de infecciones nosocomiales en pacientes quirúrgicos, habiéndose descrito la asociación entre las infecciones por BMR y pacientes con características concretas, lo cual debería ser tenido en cuenta13,28. Actualmente, numerosos países se han declarado endémicos para algunas cepas de EPC, incluyendo varios países europeos. En España, las cepas de K. pneumoniae OXA-48 son las aisladas con mayor frecuencia1,12, ocupando un porcentaje superior al 80% según nuestra experiencia. El perfil clínico de los pacientes descritos en nuestra serie incluye numerosos factores de riesgo, todos descritos previamente1,2,11,29; destacan los altos porcentajes de pacientes con hospitalización previa, ingreso prolongado en UCI, transfusiones o realización de endoscopia. Estos hallazgos están en relación con aquellos descritos en un trabajo reciente acerca de enfermos ingresados en una UCI de pacientes quirúrgicos en un hospital de tercer nivel12, encontrándose una fuerte asociación entre la producción de BLEE y los portadores de EPC, siendo factores independientes para ser portador la antibioterapia previa, la cirugía abdominal y la realización previa de endoscopia digestiva o biliar.
En nuestra serie, el 70% de los pacientes con ISQ presentaron IIA, identificándose 7 individuos que fallecieron posteriormente a la detección de EPC, todos en el subgrupo de pacientes con IIA (tasa de 20% de mortalidad). La IIA es una causa importante de morbimortalidad en pacientes quirúrgicos, habiéndose descrito tasas de mortalidad superiores al 9% en estudios multicéntricos acerca de IIA complicada, con atención especial a la cirugía urgente30. Este hecho está unido frecuentemente a ingresos prolongados, con alto porcentaje de estancia en UCI y, consecuentemente, al uso de ATB de amplio espectro y larga duración (incluyendo comúnmente carbapenémicos). La mayoría de los trabajos describen altas tasas de mortalidad de las infecciones asociadas a EPC, con otras variables a tener en cuenta, como el escenario clínico, el hospital o el área de referencia. Una revisión reciente con metaanálisis detalla una mortalidad global del 41% en pacientes con infección causada por K. pneumoniae productora de carbapenemasa (incluyendo pacientes con bacteriemia, infección del tracto urinario y, en ocasiones, IIA)31. Los factores de riesgo de mortalidad en IIA encontrados en nuestra serie fueron la presencia de neoplasia y metástasis sólidas, shock séptico y transfusión; variables ya descritas previamente2,6,9,10,23. En relación con el riesgo de mortalidad, se han desarrollado modelos predictores validados en pacientes con bacteriemia por EPC según la presencia de factores de riesgo (modelo INCREMENT)32. En nuestro estudio no se objetivaron diferencias significativas de mortalidad en IIA respecto a la utilización o no de terapia dirigida combinada frente a EPC, si bien varios trabajos previos han descrito unos resultados más favorables con la combinación de ATB activos8–10,23. Aunque algún estudio reciente ha descrito la posibilidad del tratamiento dirigido con monoterapia en pacientes con bajo riesgo según los modelos de mortalidad33, la terapia combinada es la recomendación actual según las guías vigentes acerca del manejo de la IIA7,34. En los últimos años se ha utilizado ceftazidima-avibactam como tratamiento ATB en monoterapia, habiéndose incluido ya en guías de manejo de IIA7. Publicaciones recientes han detallado la seguridad y los resultados esperanzadores con el uso de este fármaco en monoterapia35,36. A pesar de ello, se ha declarado la necesidad urgente del desarrollo de nuevos ATB activos frente a EPC5, estando actualmente en fase de investigación diferentes antimicrobianos37.
Los días de estancia hospitalaria y los costes asociados a infecciones por EPC suponen un problema adicional, como queda expuesto en nuestros resultados. La resistencia a ATB es responsable actualmente de un elevado número de muertes y de costes sanitarios, siendo la causa principal la prescripción inadecuada de ATB16,38. Para atajar esta situación se han propuesto diferentes medidas, como los programas de optimización de ATB o las alianzas colaborativas a nivel internacional para el control óptimo de la prescripción39, incluyendo también la IIA17. De tal forma, el cirujano actual debería estar familiarizado no únicamente con la prescripción de ATB, también con el cumplimiento de las medidas óptimas descritas con mayor efectividad para la prevención de ISQ40, teniendo en mente la posibilidad de aparición de resistencias, con todo lo que ello conlleva41. Según la evidencia científica disponible, los programas de vigilancia ATB o de optimización de ATB (programas PROA), conocidos también como antimicrobial stewardship programs, se basan en protocolos de manejo multidisciplinar que de forma efectiva reducen la incidencia de ISQ y de resistencias tras su implantación y seguimiento38,39.
Finalmente, hay que recordar que el mejor tratamiento también incluye la mejor prevención posible, debiendo poner en marcha aquellas medidas necesarias para identificar aquellos pacientes potencialmente portadores de EPC. Diversos organismos internacionales, como la Organización Mundial de la Salud o los CDC de Europa, han publicado protocolos de actuación con unas medidas concretas ante cualquier paciente hospitalizado con riesgo potencial de ser portador asintomático de EPC. En un algoritmo de actuación los CDC de Europa42 actualmente recomiendan el empleo de unas medidas específicas en cualquier paciente hospitalizado, utilizando el aislamiento preventivo (con medidas de aislamiento de contacto) y el cribado de EPC en pacientes con cualquier factor de alto riesgo de ser portador. Los factores de alto riesgo establecidos por los CDC son: historia previa conocida como portador de EPC, conexión epidemiológica con un paciente identificado portador de EPC, ingreso durante 24h en el año previo en una institución relacionada con los cuidados sanitarios, dependiente de diálisis en el año previo y tratamiento con quimioterapia por cáncer en el año previo.
El presente estudio incluye algunas limitaciones a considerar. En primer lugar, incluye una serie con un bajo número de pacientes, hecho que podría afectar a la identificación de diferencias estadísticamente significativas. Como estudio en un único centro con un número limitado de pacientes de CGD, los resultados se extraen, por tanto, de una población con características muy específicas y podrían no ser extrapolables a otras poblaciones o centros con diferente perfil clínico o microbiológico. Finalmente, este trabajo representa un estudio observacional, estando basados los datos incluidos en las características de los pacientes y en el criterio de cada cirujano respecto a la toma de decisiones, de tal forma que los resultados y las conclusiones detallados deberían considerarse con la debida cautela.
En resumen, las ISQ asociadas a EPC, y especialmente la IIA tras cirugía abdominal, constituyen una cuestión actual de relevancia a tener en cuenta por el cirujano moderno. Estas infecciones asocian unos altos porcentajes de complicaciones, procedimientos, tratamientos necesarios, estancia y costes sanitarios en nuestros pacientes que deben hacernos reflexionar para intentar poner en marcha aquellas medidas de prevención y optimización de ATB que sean necesarias.
Conflicto de interesesLos autores declaran la no existencia de conflicto de intereses en el presente estudio.