Evaluar la bacteriobilia de los pacientes intervenidos de duodenopancreatectomía cefálica (DPC) con y sin prótesis biliar preoperatoria y, analizar si un tratamiento antibiótico perioperatorio dirigido en función de la microbiología esperada permite no mostrar diferencias en la infección de localización quirúrgica (ILQ) entre grupos.
MétodosEstudio retrospectivo observacional unicéntrico de pacientes intervenidos de DPC con prótesis biliar preoperatoria (grupo P) y sin prótesis (grupo NP). Se analizaron las complicaciones postoperatorias incluyendo la ILQ y sus subtipos tras aplicar un protocolo de tratamiento antibiótico perioperatorio dirigido con cefotaxima y metronidazol (grupo NP) y piperacilina-tazobactam (grupo P).
ResultadosEntre enero de 2014 y diciembre de 2021, se trataron 127 pacientes (84 en el grupo NP y 43 en el grupo P). El cultivo intraoperatorio fue positivo en un 16,7% (grupo NP) vs. un 76,7% (grupo P; p<0,01). Los microorganismos aislados en el grupo NP fueron Enterobacterales (10,7%) y Enterococcus spp. (7,1%) sin encontrar Candida. En el grupo P: Enterococcus spp. (48,8%), Enterobacterales (51,2%) y Candida (16,3%) fueron más altos (p<0,01%). No se detectaron diferencias en la morbimortalidad entre los grupos. La ILQ fue del 17,8% en el grupo NP y del 23,2% en el grupo P (NS).
ConclusiónLa bacterobilia es diferente en aquellos pacientes con drenaje biliar con una mayor presencia de Enterobacterales, Enterococcus spp. y Candida. No hubo diferencias en la incidencia de ILQ después de aplicar el tratamiento antibiótico perioperatorio dirigido a los microorganismos esperados en cada grupo. Se plantea la necesidad de cambiar la profilaxis quirúrgica convencional en los pacientes portadores de prótesis biliar.
To evaluate the bacterobilia in patients undergoing pancreaticoduodenectomy (PD) based on whether they carry a preoperative biliary drainage or not and to analyse if a targeted perioperative antibiotic treatment based on the expected microbiology leads in no differences in Surgical Site Infections (SSI) between the groups.
MethodsRetrospective observational single-center study of patients undergoing pancreaticoduodenectomy with preoperative biliary stent (group P, Prosthesis) and without stent (group NP, No Prosthesis). Postoperative complications including SSI and its subtypes were analyzed after applying a targeted perioperative antibiotic treatment protocol with cefotaxime and metronidazole (group NP) and piperacillin-tazobactam (group P).
ResultsBetween January 2014 and December 2021, 127 patients were treated (84 in group NP and 43 in group P). Intraoperative cultures were positive in 16.7% (group NP) vs 76.7% (group P, P<.01). Microorganisms isolated in group NP included Enterobacterales (10.7%) and Enterococcus spp. (7.1%) with no Candida detected. In group P: Enterobacterales (51.2%), Enterococcus spp. (48.8%), and Candida (16.3%) were higher (P<.01%). No differences in morbidity and mortality were observed between the groups. SSI rate was 17.8% in group NP and 23.2% in group P (ns).
ConclusionBacterobilia differs in patients with biliary drainage, showing a higher presence of Enterobacterales, Enterococcus spp. and Candida. There were no differences in SSI incidence after applying perioperative antibiotic treatment tailored to the expected microorganisms in each group. This raises the need to reconsider conventional surgical prophylaxis in patients with biliary stent.
La duodenopancreatectomía cefálica (DPC) se asocia todavía a una elevada morbilidad1,2. Frecuentemente es necesario drenar la vía biliar antes de la intervención quirúrgica3 y la manipulación de la vía biliar se relaciona con el aumento de la bacteriobilia4,5. Este hecho puede influir en la infección de localización quirúrgica (ILQ)6 y consecuentemente en la morbimortalidad7,8.
La profilaxis antibiótica es clave en el control de la ILQ. Algunos autores sugieren ampliar la cobertura antibiótica en la DPC9 o la duración del tratamiento10.
El objetivo de este estudio es evaluar la bacteriobilia de pacientes intervenidos de DPC con y sin prótesis biliar preoperatoria y, analizar si un tratamiento antibiótico perioperatorio dirigido en función de la microbiología esperada permite no mostrar diferencias en la ILQ entre grupos.
MétodosEstudio retrospectivo observacional en los pacientes intervenidos de DPC de causa maligna (neoplasias cabeza de páncreas, colangiocarcinomas distal o tumor periampular) o benigna (pancreatitis crónica). Se dividieron en 2 grupos: los que precisaron prótesis biliar preoperatoria mediante colangiopancreatografía retrógrada endoscópica (CPRE) (grupo P, prótesis) y los que no (grupo NP, no prótesis). Las indicaciones de CPRE fueron: 1) Neoplasia con ictericia obstructiva (bilirrubina total >15mg/dl) con o sin colangitis asociada; 2) Neoplasias de cabeza de páncreas borderline resecables tributarias de tratamiento neoadyuvante con algún grado de colestasis, y 3) Pancreatitis crónica con estenosis de la vía biliar. Estas indicaciones se basan en las guías europeas de endoscopia11.
Se recogieron las variables demográficas, quirúrgicas y de complicaciones postoperatorias incluyendo la ILQ.
El cálculo muestral (45 pacientes por grupo) se realizó en base al estudio de Donald et al.9, para detectar diferencias del 10% del grupo NP y del 35% del grupo P (riesgo alfa del 0,05 y beta inferior 0,2), incluyendo el doble de pacientes del grupo NP (90), por tener menor riesgo de bacterobilia.
Tratamiento antibiótico perioperatorioEl antibiótico fue administrado durante la inducción anestésica, con redosificación a las 3h del inicio de la cirugía y mantenido durante 5 días/cada 8h hasta la obtención de los cultivos intraoperatorios.
El grupo NP recibió cefotaxima 2g/IV y metronidazol 500mg/IV (según las recomendaciones de nuestro centro basadas en las guías autonómicas12 y nacionales13) y el grupo P piperacilina-tazobactam 4,5/ IV (basado en el estudio de Donald et al.9).
En los casos de alergia a la penicilina recibieron gentamicina 240mg/IV y metronidazol 500mg/IV (grupo NP) y tigeciclina 100mg/IV (grupo P).
Tras seccionar el conducto hepático común, se obtuvieron 5cm3 de bilis para cultivo microbiológico aerobio y anaerobio.
El tratamiento se interrumpió al quinto día cuando los cultivos fueron negativos y en los casos de cultivos positivos sin signos de infección ni reactantes de fase aguda (PCR<100mg/l, lactato <1,7mmol/l, procalcitonina <2μg/l). En caso de infección, con cultivos postoperatorios (CP) positivos de la herida quirúrgica o de una colección intraabdominal, el tratamiento se ajustó según antibiograma hasta mejoría clínica (ausencia de fiebre) y analítica (descenso de leucocitosis y de reactantes de fase aguda).
Complicaciones postoperatorias e ILQLas complicaciones médico-quirúrgicas re recogieron según la clasificación de Clavien-Dindo14 y el Comprehensive Complication Index (CCI)15.
Se clasificó la ILQ en superficial, profunda y órgano/espacio16. Se definió la fístula pancreática17, fístula biliar18, retraso del vaciamiento gástrico19 y la hemorragia pospancreatectomía20, según las diferentes definiciones del International Study Group on Pancreatic Surgery (ISGPS). Se registró la mortalidad postoperatoria a los 30 y 90 días. Se compararon los CP de las ILQ con los cultivos biliares intraoperatorios.
Se obtuvo el consentimiento firmado de los pacientes y el estudio fue aprobado por el Comité de Ética de nuestro centro (0/21-043).
Análisis estadísticoLas variables cuantitativas se expresan en valores de mediana y rango intercuartil y las categóricas en números absolutos y porcentajes. El análisis de las variables cuantitativas se realizó mediante test de la t de Student o la U de Mann-Whitney si no seguían la normalidad tras aplicar la prueba de Kolmogorov-Smirnov y para las variables categóricas el test Chi-cuadrado de Pearson o test exacto de Fisher. Para el estudio multivariante para la variable ILQ se utilizó el modelo de regresión logística para variables categóricas. La significación estadística se estableció para un valor de p<0,05 junto al intervalo de confianza del 95%, cuando estuvo indicado. El análisis estadístico se utilizó el programa SPSS® v.25.
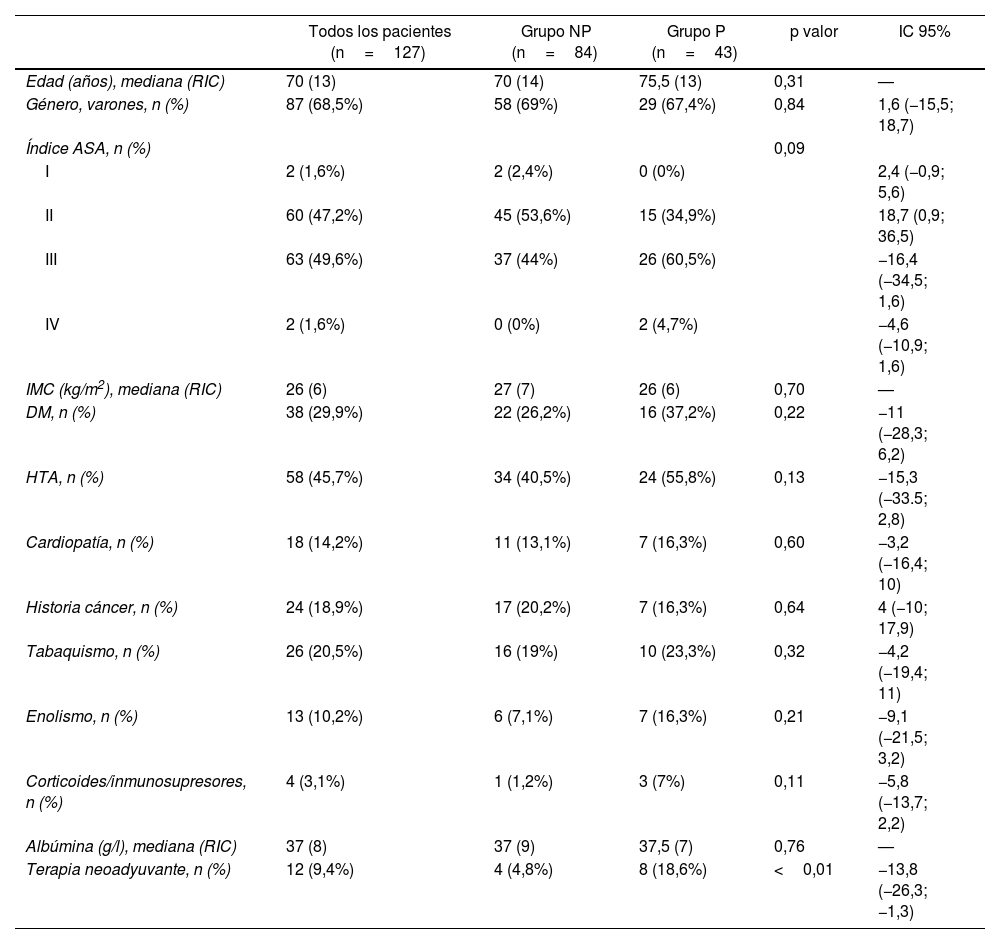
ResultadosCaracterísticas basales y clínicas de los pacientesEntre enero de 2014 y diciembre de 2021 se intervinieron 135 pacientes de DPC. Tras perder 8 por muestras incompletas, quedaron 127 pacientes con cultivo biliar intraoperatorio (CBI), incluyendo 84 (66,1%) en el grupo NP y 43 (33,8%) en el grupo P. Los datos demográficos y características clínicas se muestran en la tabla 1. Los grupos fueron homogéneos en todas las variables excepto en el tratamiento neoadyuvante (p<0,01) dada la mayor necesidad de drenaje preoperatorio en estos pacientes para realizar el tratamiento.
Datos demográficos y clínicos de la serie
| Todos los pacientes (n=127) | Grupo NP (n=84) | Grupo P (n=43) | p valor | IC 95% | |
|---|---|---|---|---|---|
| Edad (años), mediana (RIC) | 70 (13) | 70 (14) | 75,5 (13) | 0,31 | — |
| Género, varones, n (%) | 87 (68,5%) | 58 (69%) | 29 (67,4%) | 0,84 | 1,6 (−15,5; 18,7) |
| Índice ASA, n (%) | 0,09 | ||||
| I | 2 (1,6%) | 2 (2,4%) | 0 (0%) | 2,4 (−0,9; 5,6) | |
| II | 60 (47,2%) | 45 (53,6%) | 15 (34,9%) | 18,7 (0,9; 36,5) | |
| III | 63 (49,6%) | 37 (44%) | 26 (60,5%) | −16,4 (−34,5; 1,6) | |
| IV | 2 (1,6%) | 0 (0%) | 2 (4,7%) | −4,6 (−10,9; 1,6) | |
| IMC (kg/m2), mediana (RIC) | 26 (6) | 27 (7) | 26 (6) | 0,70 | — |
| DM, n (%) | 38 (29,9%) | 22 (26,2%) | 16 (37,2%) | 0,22 | −11 (−28,3; 6,2) |
| HTA, n (%) | 58 (45,7%) | 34 (40,5%) | 24 (55,8%) | 0,13 | −15,3 (−33.5; 2,8) |
| Cardiopatía, n (%) | 18 (14,2%) | 11 (13,1%) | 7 (16,3%) | 0,60 | −3,2 (−16,4; 10) |
| Historia cáncer, n (%) | 24 (18,9%) | 17 (20,2%) | 7 (16,3%) | 0,64 | 4 (−10; 17,9) |
| Tabaquismo, n (%) | 26 (20,5%) | 16 (19%) | 10 (23,3%) | 0,32 | −4,2 (−19,4; 11) |
| Enolismo, n (%) | 13 (10,2%) | 6 (7,1%) | 7 (16,3%) | 0,21 | −9,1 (−21,5; 3,2) |
| Corticoides/inmunosupresores, n (%) | 4 (3,1%) | 1 (1,2%) | 3 (7%) | 0,11 | −5,8 (−13,7; 2,2) |
| Albúmina (g/l), mediana (RIC) | 37 (8) | 37 (9) | 37,5 (7) | 0,76 | — |
| Terapia neoadyuvante, n (%) | 12 (9,4%) | 4 (4,8%) | 8 (18,6%) | <0,01 | −13,8 (−26,3; −1,3) |
ASA: American Society of Anesthesiologists; DM: diabetes mellitus; IC 95%: intervalo de confianza del 95%; HTA: hipertensión arterial; NP: no prótesis; P: prótesis; p valor: comparación entre grupo NP y P; RIC: rango intercuartílico.
Test de Chi-cuadrado para variables cualitativas, t de Student para cuantitativas y U de Mann-Whitney para cuantitativas que no siguen la normalidad.
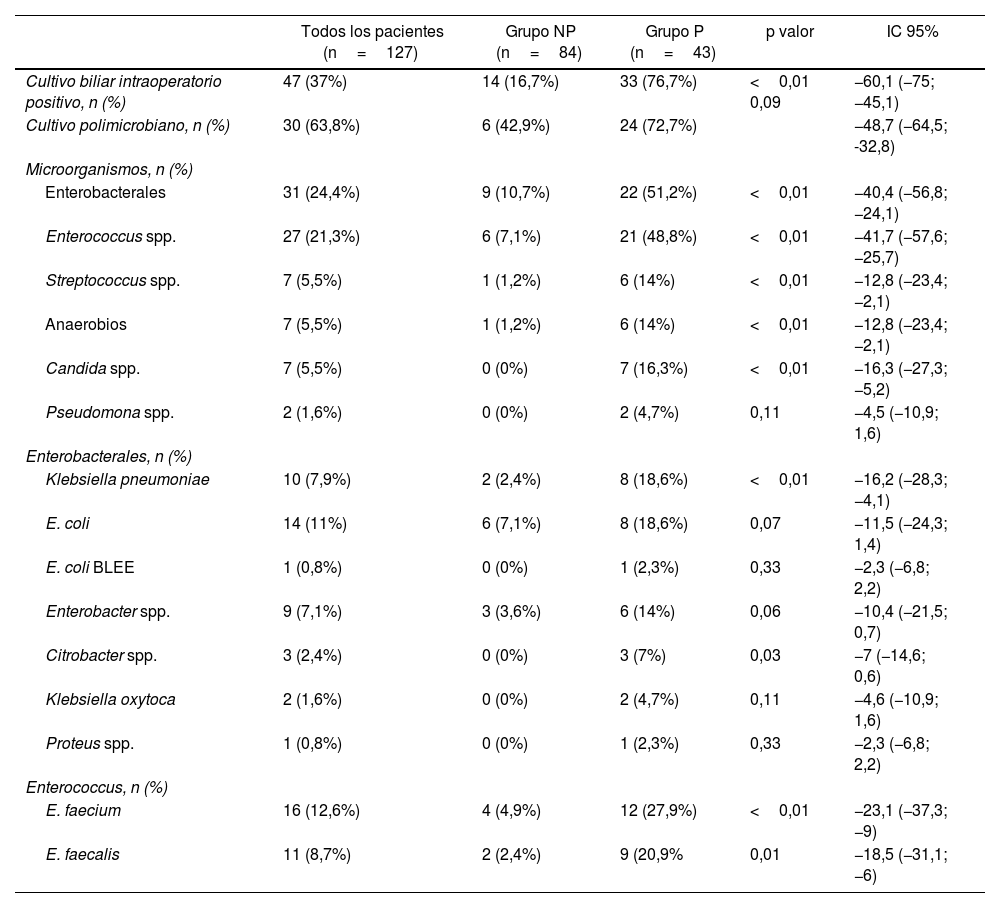
El grupo NP tuvo CBI positivos en el 16,7% y el grupo P en el 76,7% de pacientes (p<0,01) siendo la mayoría de ellos polimicrobianos (72,7%) (tabla 2).
Resultados microbiológicos intraoperatorios
| Todos los pacientes (n=127) | Grupo NP (n=84) | Grupo P (n=43) | p valor | IC 95% | |
|---|---|---|---|---|---|
| Cultivo biliar intraoperatorio positivo, n (%) | 47 (37%) | 14 (16,7%) | 33 (76,7%) | <0,01 0,09 | −60,1 (−75; −45,1) |
| Cultivo polimicrobiano, n (%) | 30 (63,8%) | 6 (42,9%) | 24 (72,7%) | −48,7 (−64,5; -32,8) | |
| Microorganismos, n (%) | |||||
| Enterobacterales | 31 (24,4%) | 9 (10,7%) | 22 (51,2%) | <0,01 | −40,4 (−56,8; −24,1) |
| Enterococcus spp. | 27 (21,3%) | 6 (7,1%) | 21 (48,8%) | <0,01 | −41,7 (−57,6; −25,7) |
| Streptococcus spp. | 7 (5,5%) | 1 (1,2%) | 6 (14%) | <0,01 | −12,8 (−23,4; −2,1) |
| Anaerobios | 7 (5,5%) | 1 (1,2%) | 6 (14%) | <0,01 | −12,8 (−23,4; −2,1) |
| Candida spp. | 7 (5,5%) | 0 (0%) | 7 (16,3%) | <0,01 | −16,3 (−27,3; −5,2) |
| Pseudomona spp. | 2 (1,6%) | 0 (0%) | 2 (4,7%) | 0,11 | −4,5 (−10,9; 1,6) |
| Enterobacterales, n (%) | |||||
| Klebsiella pneumoniae | 10 (7,9%) | 2 (2,4%) | 8 (18,6%) | <0,01 | −16,2 (−28,3; −4,1) |
| E. coli | 14 (11%) | 6 (7,1%) | 8 (18,6%) | 0,07 | −11,5 (−24,3; 1,4) |
| E. coli BLEE | 1 (0,8%) | 0 (0%) | 1 (2,3%) | 0,33 | −2,3 (−6,8; 2,2) |
| Enterobacter spp. | 9 (7,1%) | 3 (3,6%) | 6 (14%) | 0,06 | −10,4 (−21,5; 0,7) |
| Citrobacter spp. | 3 (2,4%) | 0 (0%) | 3 (7%) | 0,03 | −7 (−14,6; 0,6) |
| Klebsiella oxytoca | 2 (1,6%) | 0 (0%) | 2 (4,7%) | 0,11 | −4,6 (−10,9; 1,6) |
| Proteus spp. | 1 (0,8%) | 0 (0%) | 1 (2,3%) | 0,33 | −2,3 (−6,8; 2,2) |
| Enterococcus, n (%) | |||||
| E. faecium | 16 (12,6%) | 4 (4,9%) | 12 (27,9%) | <0,01 | −23,1 (−37,3; −9) |
| E. faecalis | 11 (8,7%) | 2 (2,4%) | 9 (20,9% | 0,01 | −18,5 (−31,1; −6) |
IC 95%: intervalo de confianza del 95%; NP: no prótesis; P: prótesis; p valor: comparación entre grupo NP y P; spp.: especie.
Test de Chi-cuadrado para variables cualitativas, t de Student para cuantitativas y U de Mann-Whitney para cuantitativas que no siguen la normalidad.
Los microorganismos más frecuentes en el CBI del grupo NP fueron Enterobacterales y Enterococcus spp. En el grupo P hubo un incremento significativo de estas familias de bacterias (p<0,01), así como una presencia de Candida spp. del 16,3% de los pacientes (p<0,01) (tabla 2).
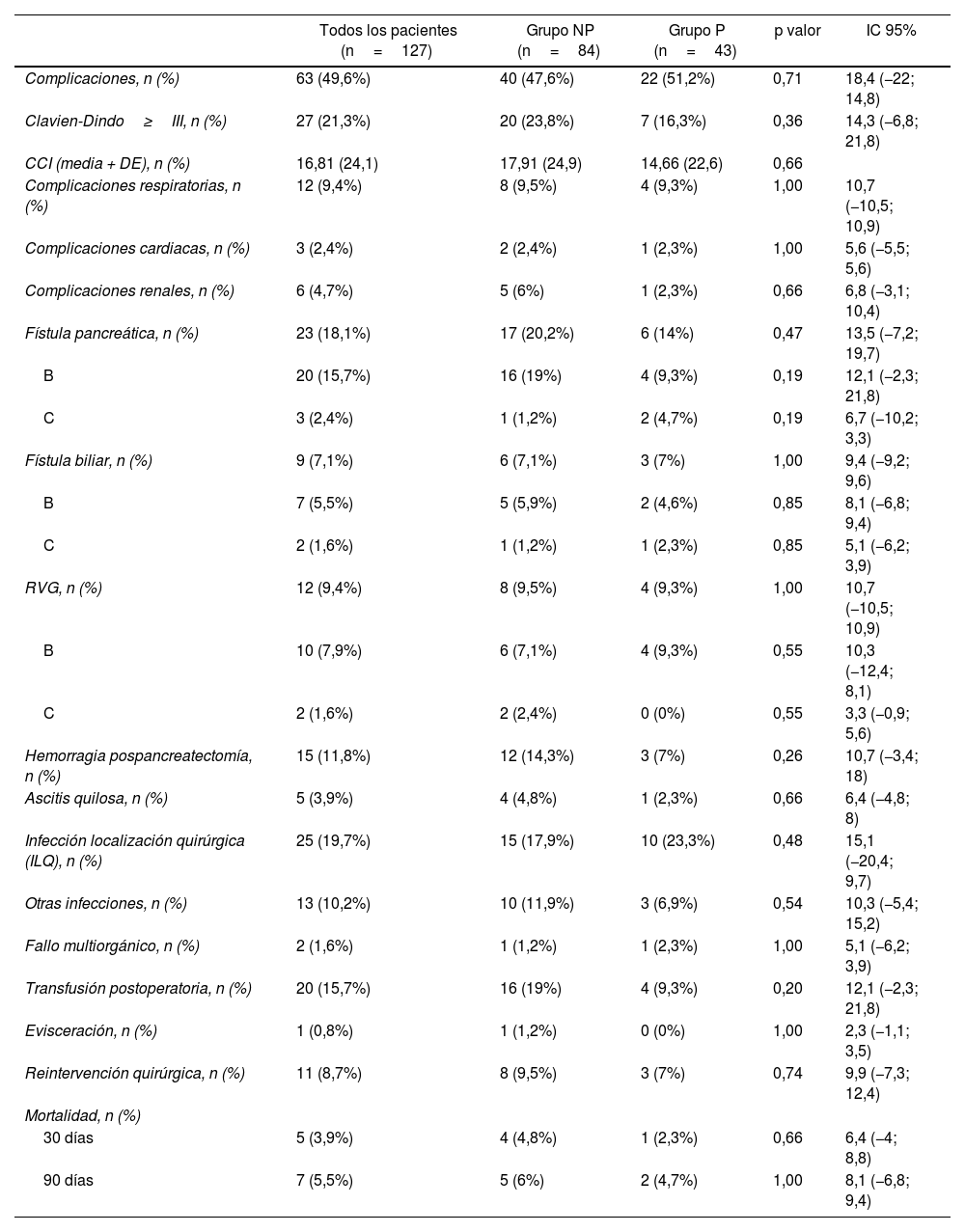
No se han detectado diferencias significativas entre grupos respecto a las complicaciones médicas, las específicas de cirugía pancreática ni la mortalidad a los 30 o 90 días (tabla 3).
Complicaciones postoperatorias
| Todos los pacientes (n=127) | Grupo NP (n=84) | Grupo P (n=43) | p valor | IC 95% | |
|---|---|---|---|---|---|
| Complicaciones, n (%) | 63 (49,6%) | 40 (47,6%) | 22 (51,2%) | 0,71 | 18,4 (−22; 14,8) |
| Clavien-Dindo≥III, n (%) | 27 (21,3%) | 20 (23,8%) | 7 (16,3%) | 0,36 | 14,3 (−6,8; 21,8) |
| CCI (media + DE), n (%) | 16,81 (24,1) | 17,91 (24,9) | 14,66 (22,6) | 0,66 | |
| Complicaciones respiratorias, n (%) | 12 (9,4%) | 8 (9,5%) | 4 (9,3%) | 1,00 | 10,7 (−10,5; 10,9) |
| Complicaciones cardiacas, n (%) | 3 (2,4%) | 2 (2,4%) | 1 (2,3%) | 1,00 | 5,6 (−5,5; 5,6) |
| Complicaciones renales, n (%) | 6 (4,7%) | 5 (6%) | 1 (2,3%) | 0,66 | 6,8 (−3,1; 10,4) |
| Fístula pancreática, n (%) | 23 (18,1%) | 17 (20,2%) | 6 (14%) | 0,47 | 13,5 (−7,2; 19,7) |
| B | 20 (15,7%) | 16 (19%) | 4 (9,3%) | 0,19 | 12,1 (−2,3; 21,8) |
| C | 3 (2,4%) | 1 (1,2%) | 2 (4,7%) | 0,19 | 6,7 (−10,2; 3,3) |
| Fístula biliar, n (%) | 9 (7,1%) | 6 (7,1%) | 3 (7%) | 1,00 | 9,4 (−9,2; 9,6) |
| B | 7 (5,5%) | 5 (5,9%) | 2 (4,6%) | 0,85 | 8,1 (−6,8; 9,4) |
| C | 2 (1,6%) | 1 (1,2%) | 1 (2,3%) | 0,85 | 5,1 (−6,2; 3,9) |
| RVG, n (%) | 12 (9,4%) | 8 (9,5%) | 4 (9,3%) | 1,00 | 10,7 (−10,5; 10,9) |
| B | 10 (7,9%) | 6 (7,1%) | 4 (9,3%) | 0,55 | 10,3 (−12,4; 8,1) |
| C | 2 (1,6%) | 2 (2,4%) | 0 (0%) | 0,55 | 3,3 (−0,9; 5,6) |
| Hemorragia pospancreatectomía, n (%) | 15 (11,8%) | 12 (14,3%) | 3 (7%) | 0,26 | 10,7 (−3,4; 18) |
| Ascitis quilosa, n (%) | 5 (3,9%) | 4 (4,8%) | 1 (2,3%) | 0,66 | 6,4 (−4,8; 8) |
| Infección localización quirúrgica (ILQ), n (%) | 25 (19,7%) | 15 (17,9%) | 10 (23,3%) | 0,48 | 15,1 (−20,4; 9,7) |
| Otras infecciones, n (%) | 13 (10,2%) | 10 (11,9%) | 3 (6,9%) | 0,54 | 10,3 (−5,4; 15,2) |
| Fallo multiorgánico, n (%) | 2 (1,6%) | 1 (1,2%) | 1 (2,3%) | 1,00 | 5,1 (−6,2; 3,9) |
| Transfusión postoperatoria, n (%) | 20 (15,7%) | 16 (19%) | 4 (9,3%) | 0,20 | 12,1 (−2,3; 21,8) |
| Evisceración, n (%) | 1 (0,8%) | 1 (1,2%) | 0 (0%) | 1,00 | 2,3 (−1,1; 3,5) |
| Reintervención quirúrgica, n (%) | 11 (8,7%) | 8 (9,5%) | 3 (7%) | 0,74 | 9,9 (−7,3; 12,4) |
| Mortalidad, n (%) | |||||
| 30 días | 5 (3,9%) | 4 (4,8%) | 1 (2,3%) | 0,66 | 6,4 (−4; 8,8) |
| 90 días | 7 (5,5%) | 5 (6%) | 2 (4,7%) | 1,00 | 8,1 (−6,8; 9,4) |
CCI: Comprehensive Complication Index; DE: desviación estándar; IC 95%: intervalo de confianza del 95%; NP: no prótesis; P: prótesis; p valor: comparación entre los grupos NP y P; RVG: retraso del vaciamiento gástrico.
Test de Chi-cuadrado para variables cualitativas, t de Student para cuantitativas y U de Mann-Whitney para cuantitativas que no siguen la normalidad.
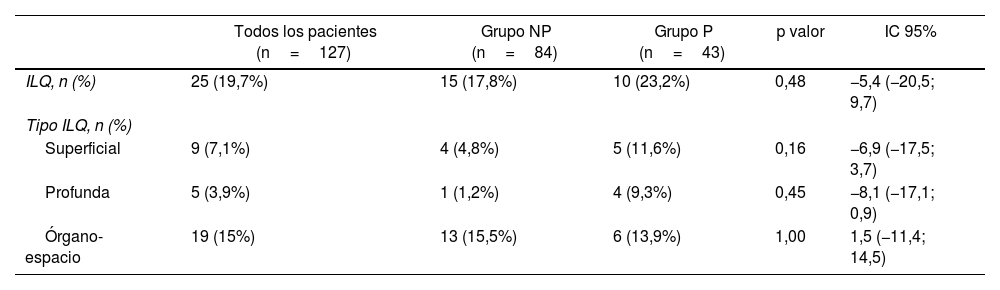
Tampoco se detectaron diferencias entre grupos en la tasa de ILQ global (19,7%) ni en sus subtipos (tabla 4).
Infección de localización quirúrgica (ILQ) respecto a los grupos NP y P
| Todos los pacientes (n=127) | Grupo NP (n=84) | Grupo P (n=43) | p valor | IC 95% | |
|---|---|---|---|---|---|
| ILQ, n (%) | 25 (19,7%) | 15 (17,8%) | 10 (23,2%) | 0,48 | −5,4 (−20,5; 9,7) |
| Tipo ILQ, n (%) | |||||
| Superficial | 9 (7,1%) | 4 (4,8%) | 5 (11,6%) | 0,16 | −6,9 (−17,5; 3,7) |
| Profunda | 5 (3,9%) | 1 (1,2%) | 4 (9,3%) | 0,45 | −8,1 (−17,1; 0,9) |
| Órgano-espacio | 19 (15%) | 13 (15,5%) | 6 (13,9%) | 1,00 | 1,5 (−11,4; 14,5) |
IC 95%: intervalo de confianza del 95%; ILQ: infección de localización quirúrgica; NP: no prótesis; P: prótesis; p valor: comparación entre los grupos NP y P.
Test de Chi-cuadrado para variables cualitativas, t de Student para cuantitativas y U de Mann-Whitney para cuantitativas que no siguen la normalidad.
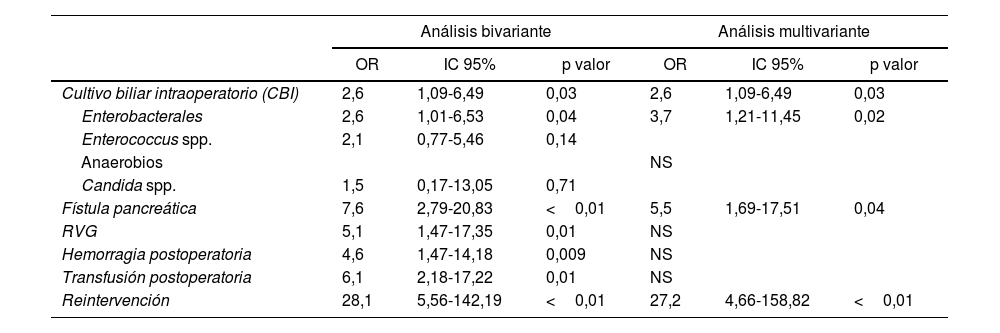
No hubo diferencias significativas en la ILQ respecto a variables demográficas, clínicas, tratamiento neoadyuvante ni variables quirúrgicas. El análisis bivariante de la ILQ reveló diferencias significativas en los CBI para Enterobacterales, presencia de fístula pancreática, retraso del vaciamiento gástrico, hemorragia postoperatoria, transfusión postoperatoria y reintervención quirúrgica (tabla 5).
Infección de localización quirúrgica (ILQ). Análisis bivariante y multivariante
| Análisis bivariante | Análisis multivariante | |||||
|---|---|---|---|---|---|---|
| OR | IC 95% | p valor | OR | IC 95% | p valor | |
| Cultivo biliar intraoperatorio (CBI) | 2,6 | 1,09-6,49 | 0,03 | 2,6 | 1,09-6,49 | 0,03 |
| Enterobacterales | 2,6 | 1,01-6,53 | 0,04 | 3,7 | 1,21-11,45 | 0,02 |
| Enterococcus spp. | 2,1 | 0,77-5,46 | 0,14 | |||
| Anaerobios | NS | |||||
| Candida spp. | 1,5 | 0,17-13,05 | 0,71 | |||
| Fístula pancreática | 7,6 | 2,79-20,83 | <0,01 | 5,5 | 1,69-17,51 | 0,04 |
| RVG | 5,1 | 1,47-17,35 | 0,01 | NS | ||
| Hemorragia postoperatoria | 4,6 | 1,47-14,18 | 0,009 | NS | ||
| Transfusión postoperatoria | 6,1 | 2,18-17,22 | 0,01 | NS | ||
| Reintervención | 28,1 | 5,56-142,19 | <0,01 | 27,2 | 4,66-158,82 | <0,01 |
IC 95%: intervalo de confianza del 95%; NS: no significativo; OR: odds ratio; RVG: retraso vaciamiento gástrico; spp: especie.
Modelo de regresión logística.
Mientras que el análisis multivariante reveló que los factores de riesgo significativos para desarrollar ILQ fueron el CBI positivo para Enterobacterales, presencia de fístula pancreática y la reintervención quirúrgica (tabla 5).
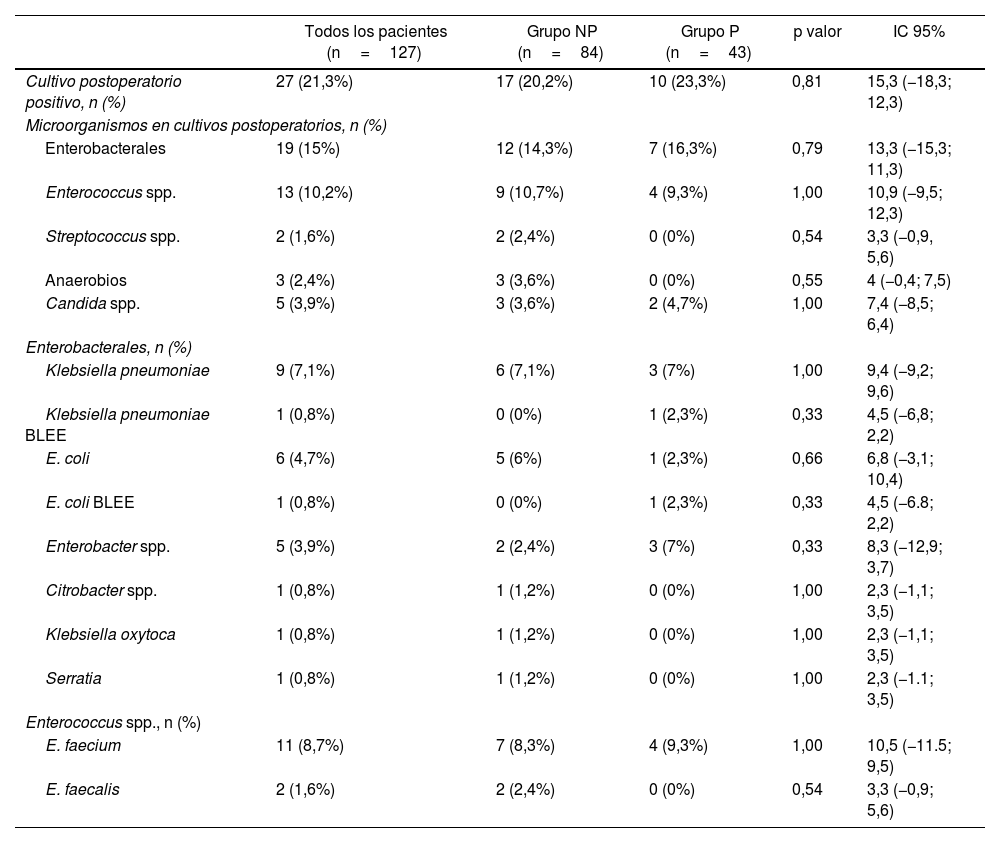
Los CP de ILQ se detallan en la tabla 6.
Resultados cultivos postoperatorios
| Todos los pacientes (n=127) | Grupo NP (n=84) | Grupo P (n=43) | p valor | IC 95% | |
|---|---|---|---|---|---|
| Cultivo postoperatorio positivo, n (%) | 27 (21,3%) | 17 (20,2%) | 10 (23,3%) | 0,81 | 15,3 (−18,3; 12,3) |
| Microorganismos en cultivos postoperatorios, n (%) | |||||
| Enterobacterales | 19 (15%) | 12 (14,3%) | 7 (16,3%) | 0,79 | 13,3 (−15,3; 11,3) |
| Enterococcus spp. | 13 (10,2%) | 9 (10,7%) | 4 (9,3%) | 1,00 | 10,9 (−9,5; 12,3) |
| Streptococcus spp. | 2 (1,6%) | 2 (2,4%) | 0 (0%) | 0,54 | 3,3 (−0,9, 5,6) |
| Anaerobios | 3 (2,4%) | 3 (3,6%) | 0 (0%) | 0,55 | 4 (−0,4; 7,5) |
| Candida spp. | 5 (3,9%) | 3 (3,6%) | 2 (4,7%) | 1,00 | 7,4 (−8,5; 6,4) |
| Enterobacterales, n (%) | |||||
| Klebsiella pneumoniae | 9 (7,1%) | 6 (7,1%) | 3 (7%) | 1,00 | 9,4 (−9,2; 9,6) |
| Klebsiella pneumoniae BLEE | 1 (0,8%) | 0 (0%) | 1 (2,3%) | 0,33 | 4,5 (−6,8; 2,2) |
| E. coli | 6 (4,7%) | 5 (6%) | 1 (2,3%) | 0,66 | 6,8 (−3,1; 10,4) |
| E. coli BLEE | 1 (0,8%) | 0 (0%) | 1 (2,3%) | 0,33 | 4,5 (−6.8; 2,2) |
| Enterobacter spp. | 5 (3,9%) | 2 (2,4%) | 3 (7%) | 0,33 | 8,3 (−12,9; 3,7) |
| Citrobacter spp. | 1 (0,8%) | 1 (1,2%) | 0 (0%) | 1,00 | 2,3 (−1,1; 3,5) |
| Klebsiella oxytoca | 1 (0,8%) | 1 (1,2%) | 0 (0%) | 1,00 | 2,3 (−1,1; 3,5) |
| Serratia | 1 (0,8%) | 1 (1,2%) | 0 (0%) | 1,00 | 2,3 (−1.1; 3,5) |
| Enterococcus spp., n (%) | |||||
| E. faecium | 11 (8,7%) | 7 (8,3%) | 4 (9,3%) | 1,00 | 10,5 (−11.5; 9,5) |
| E. faecalis | 2 (1,6%) | 2 (2,4%) | 0 (0%) | 0,54 | 3,3 (−0,9; 5,6) |
IC 95%: intervalo de confianza del 95%; NP: no prótesis; P: prótesis; p valor: comparación entre los grupos NP y P.
Test de Chi-cuadrado para variables cualitativas.
Cuando analizamos los microorganismos que causaron la ILQ en el grupo P, comparando los cultivos intraoperatorios y postoperatorios, podemos ver que muchos microorganismos presentes en el cultivo intraoperatorio desaparecieron.
Los microorganismos que persistieron y causaron la infección lo hicieron por resistencia intrínseca a piperacilina-tazobactam o bien por desarrollar resistencia BLEE: betalactamasa de espectro extendido.
El tratamiento antibiótico se modificó en el 17,3% de los pacientes según los CP obtenidos de ILQ sin detectar diferencias entre grupos: 15 (17,8%) vs. 7 (16,3%).
DiscusiónLa DPC sigue siendo una cirugía compleja con una elevada morbilidad, y hasta el 30% de las complicaciones son infecciosas21. La necesidad de drenaje biliar preoperatorio se considera un factor de riesgo para la aparición de la ILQ22. Donald et al.9 detectaron la presencia de Enterococcus spp. y Enterobacter en las infecciones de heridas y redujeron la ILQ en un 80% aplicando una profilaxis de amplio espectro con piperacilina-tazobactam. Basándonos en este hecho, aplicamos en nuestro hospital el mismo tratamiento solo a los pacientes portadores de prótesis biliar, considerados de riesgo, dado que presentaban el doble de ILQ órgano/espacio respecto a los no portadores (28 vs. 14%, datos no publicados).
Aunque en nuestra serie hay un incremento significativo de Enterobacterales,Enterococcus spp. y Candida spp. en bilis de pacientes del grupo P, ello no comporta un aumento de la tasa de ILQ respecto al grupo NP ni en los distintos tipos (superficial, profunda ni órgano/espacio) al aplicar un tratamiento perioperatorio dirigido a la flora esperada en este grupo con piperacilina-tazobactam.
Estudios recientes23,24, demuestran la reducción de ILQ y de fístula pancreática usando profilaxis con piperacilina-tazobactam en postoperados de DPC, aunque los pacientes portadores o no de prótesis biliar están mezclados en ambos grupos.
Se conoce que la obstrucción biliar puede llevar al sobrecrecimiento bacteriano25. La manipulación biliar incrementa la colonización hasta el 70-100%26 y es en la mayoría de las ocasiones polimicriobiana27. Acorde con el metaanálisis de Müssle et al.28, el grupo P muestra una mayor bacteriobilia respecto al grupo NP en los cultivos intraoperatorios, siendo la mayoría polimicrobianos (72,7 vs. 42,9%; p=0,09).
Dado que la contaminación biliar favorece la ILQ tras DPC, es esencial realizar cultivos intraoperatorios para identificar la bacterobilia29 y tasa de resistencias de cada área sanitaria. En consonancia con otros autores30–32, nuestro estudio reveló que los microorganismos más frecuentes fueron Enterobacterales y Enterococcus spp.
Existe un incremento progresivo de Enterococcus en la flora de los pacientes33 y, aunque hay autores que defienden que forman parte de la flora biliar normal, se debe considerar la patogenicidad de E. faecalis34.
Detectamos Candida spp. en el 16,3% de los casos solo del grupo P (p<0,01), coincidiendo con lo publicado por Scheufele et al.7, aunque su patogenicidad no está bien definida en este contexto y por lo tanto el manejo sigue siendo controvertido. Según los resultados obtenidos, el cultivo intraoperatorio positivo para Candida spp. no representa un factor de riesgo independiente para el desarrollo de la ILQ. De esta manera, no se considera necesaria la profilaxis antifúngica sistemática.
El uso de la tinción de Gram intraoperatoria35 es una buena estrategia empleada por algunos grupos para controlar la ILQ tras conocer la flora el mismo día de la intervención, aunque nosotros no la utilizamos dado que puede requerir una elevada variabilidad de combinación de antibióticos.
Entre las limitaciones destacamos el hecho de tratarse de un estudio retrospectivo y la duración del tratamiento, que tras ver los resultados obtenidos, se podría plantear el mismo esquema con una duración del tratamiento inferior. Como fortalezas resaltamos la homogeneidad en el tratamiento quirúrgico y en el análisis de resultados microbiológicos por desarrollarse en un único centro.
El esquema de tratamiento perioperatorio con piperacilina-tazobactam solo en el grupo P, a diferencia de otros estudios, puede evitar el desarrollo de resistencias en el grupo NP, aunque destaca la baja presencia de bacterias resistentes en el grupo P (2,3% de E. coli BLEE) probablemente por la baja presión antibiótica preoperatoria.
Así concluimos que: la bacterobilia es diferente en los pacientes con drenaje biliar preoperatorio respecto a los pacientes no drenados encontrando en el grupo P un incremento significativo de Enterobacterales, Enterococcus spp. y Candida spp.
No se observaron diferencias en la tasa de la ILQ tras DPC aplicando el tratamiento antibiótico perioperatorio dirigido a la flora biliar de cada grupo. El CBI positivo para Enterobacterales resultó ser factor de riesgo independiente para desarrollar la ILQ.
Así pues, proponemos la necesidad de cambiar la profilaxis quirúrgica convencional a tratamiento antibiótico perioperatorio dirigido según la bacterobilia esperada y el perfil de resistencias de cada área sanitaria en los pacientes con prótesis biliar preoperatoria.
Aprobación éticaEste estudio se realizó de acuerdo con los principios de la Declaración de Helsinki. La aprobación fue otorgada por el Comité de Ética de nuestro centro (fecha: 24/03/2021, No O/21-043).
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a la Dra. Esther Calbo, jefa de servicio de enfermedades infecciosas, así como a la Dra. Eva Cuchí, adjunta del servicio de microbiología, la participación en el estudio.