La evaluación patológica de las muestras de duodenopancreatectomía cefálica (DPC) y el impacto de las resecciones R1 sobre la supervivencia ha sido recientemente cuestionado. Este estudio evalúa la introducción de un protocolo de estudio anatomopatológico estandarizado (PE) y el pronóstico de las resecciones R1 después de un seguimiento a largo plazo.
MétodosSe revisaron 109 tumores periampulares sometidos a DPC desde 2005 hasta 2013 a partir de una base de datos mantenida prospectivamente. Se analizaron los resultados de la introducción de un PE y se evaluaron la tasa de recurrencia (TR), la supervivencia libre de enfermedad (SLE) y la supervivencia global (SG) de la resección R1 para cada margen positivo.
ResultadosLas piezas de DPC de tumores periampulares analizadas mediante un PE mostraron una mayor tasa de ganglios linfáticos aislados (17 vs. 8; p=0,003), N+ (60% vs. 31%; p<0,001), invasión microvascular (67% vs. 34%; p=0,001) y resecciones R1 (42% vs. 18%; p=0,010).
Se compararon los adenocarcinomas pancreáticos con resección R1 en el grupo PE con los R0, presentando mayores porcentajes de resecciones vasculares (p=0,033), N+ (p=0,029), invasión linfática y perineural (p=0,047; p=0,029), una mayor TR (p=0,026), menor SLE (p=0,016) y menor SG (p=0,025). La infiltración del margen medial se relacionó con un peor pronóstico.
ConclusionesNuestra serie muestra un aumento en la resección R1 después de la introducción de un PE. La infiltración del margen medial parece asociarse con una mayor TR y una disminución de la SLE y SG.
The pathological evaluation of pancreaticoduodenectomy (PD) samples and the impact of R1 resections on survival has recently been questioned. This study evaluates the introduction of a standardized pathology study protocol (PSP) and the prognosis of R1 resections after long-term follow-up.
MethodsWe reviewed data from a prospectively maintained database regarding 109 periampullary tumors treated by PD from 2005 to 2013. The results of the introduction of a PSP were analysed, and the recurrence rate (RR), disease-free survival (DFS) and overall survival (OS) of the R1 resections were evaluated for each positive margin.
ResultsThe PD specimens of periampullary tumors analyzed by PSP showed a higher rate of isolated lymph nodes (17 vs. 8; P=.003), N+ (60% vs. 31%; P<.001), microvascular invasion (67% vs. 34%; P=.001) and R1 resections (42% vs. 18%; P=.010).
Pancreatic adenocarcinomas with R1 resection in the PSP group were compared with R0, presenting higher percentages of vascular resections (P=.033), N+ (P=.029), lymphatic and perineural invasion (P=.047; P=.029), higher RR (P=.026), lower DFS (P=.016) and lower OS (P=.025). Invasion of the medial margin correlated with a worse prognosis.
ConclusionsOur series shows an increase in R1 resection after the introduction of a PSP. Infiltration of the medial margin seems to be associated with a higher RR and a decrease in DFS and OS.
El adenocarcinoma ductal de páncreas (ACDP) es la cuarta causa de muerte por cáncer en Europa1, y la resección quirúrgica sigue siendo el único tratamiento potencialmente curativo. Llama la atención la discrepancia descrita en la tasa de resecciones R1 después de la duodenopancreatectomía cefálica (DPC), oscilando entre el 16 y 85%2,3, que, además, no siempre se ha relacionado con una supervivencia peor que la de las resecciones R03,4.
Estos hallazgos plantean dudas sobre la fiabilidad y la estandarización de la evaluación patológica de las muestras de DPC. Dicha evaluación no se ha investigado hasta hace poco y existe una considerable controversia sobre la técnica de tallado del espécimen, las definiciones del margen de resección (MR) y su nomenclatura, con 28 términos utilizados para definir los diferentes MR5. El Protocolo de estudio de Leeds (LEEPP)2 supuso una estandarización en el análisis de las muestras de DPC, que luego fue adoptado por numerosas instituciones europeas, definiendo una técnica de corte precisa y con MR específicos.
El objetivo de este estudio es comparar la infiltración del MR en muestras de DPC antes y después de la introducción de un protocolo estandarizado (PE) basado en el LEEPP, analizando el pronóstico oncológico después de un seguimiento a largo plazo según la afectación de los distintos MR. En primer lugar, los pacientes cuyas muestras se estudiaron siguiendo un PE se compararon con el grupo de protocolo no estandarizado (PNE), con el fin de evaluar las diferencias en la tasa de resección R1. En segundo lugar, las resecciones R1 de ACDP analizados con un PE se compararon con los R0, evaluando la tasa de recurrencia (TR), la supervivencia libre de enfermedad (SLE) y la supervivencia global (SG), en función de los distintos MR.
MétodosPacientes y característicasSe realizó un análisis retrospectivo de una base de datos mantenida de forma prospectiva que incluía todos los tumores periampulares sometidos a DPC en un hospital universitario de tercer nivel desde 2005 hasta 2013. Durante este período, 186 pacientes fueron intervenidos mediante DPC y después de excluir lesiones benignas, neoplasias mucinosas papilares intraductales, quistes mucinosos o serosos, tumores neuroendocrinos y tumores del estroma gastrointestinal, se identificaron 109 tumores periampulares, 63 de ellos ACDP.
El equipo quirúrgico estuvo compuesto por cirujanos con experiencia en cirugía pancreática que no cambiaron durante el período de estudio. La resección clásica según Whipple con reconstrucción en un asa de Child fue el procedimiento quirúrgico estándar. Los tumores que infiltraban la vena mesentérica superior (VMS) o la vena porta (VP) se trataron mediante resección venosa.
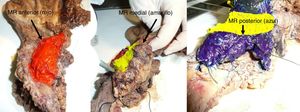
El PE se introdujo en febrero de 2009 siguiendo las directrices del LEEPP2. Incluía una técnica de corte en un plano perpendicular al eje duodenal, con un marcaje multicolor del MR circunferencial constituido por los márgenes anterior, medial, posterior y de transección (fig. 1). Se registró el tamaño tridimensional del tumor, su relación con los MR más cercanos y todas las estructuras anatómicas principales. Se tomaron muestras de los MR circunferenciales así como de los márgenes del conducto biliar distal y del estómago. La definición de R1 no cambió a lo largo del estudio: se definió R1 como la presencia de tumor a menos de 1mm del MR y R0 cuando la distancia entre el tumor y el MR era mayor de 1mm.
La selección de pacientes candidatos para quimioterapia o quimiorradioterapia y los regímenes de las mismas se basó en las recomendaciones vigentes en cada período: la quimiorradioterapia neoadyuvante se utilizó en ACDP borderline o localmente avanzados6, mientras que la quimioterapia adyuvante se administró de forma rutinaria, salvo contraindicaciones para la misma, en todos los ACDP.
Para el cálculo de la SG y la SLE se excluyó a los pacientes que fallecieron durante los primeros 90 días postoperatorios. Los pacientes fueron revisados cada 3 meses durante los primeros 2 años postoperatorios y, posteriormente, cada 6 meses hasta el quinto año. Planeamos hacer un seguimiento de los pacientes durante un período mínimo de 5 años antes de analizar los resultados oncológicos.
En cada paciente se recogieron variables demográficas, existencia de drenaje biliar preoperatorio, variables perioperatorias, variables relacionadas con el estudio anatomopatológico, incluyendo la cantidad de ganglios linfáticos extirpados, así como la relación entre ganglios linfáticos positivos y el número total de ganglios resecados, también conocida como cociente ganglionar, con un valor de corte del 15% (CG15)7,8, y la infiltración de los diferentes MR. Las complicaciones postoperatorias se clasificaron según la escala de Clavien-Dindo9. Las fístulas pancreáticas se clasificaron según la definición más reciente del International Study Group of Pancreatic Fistula10, a partir de la medición de la amilasa en el drenaje en el tercer día postoperatorio.
Análisis estadísticoEl análisis estadístico se realizó con el programa SPSS® v.21 (SPSS®, Chicago, Illinois, EE.UU.). Las variables cualitativas se expresaron como número y porcentaje y las variables cuantitativas como media y desviación estándar (DE) en caso de seguir una distribución normal y mediana con rango intercuartílico cuando no seguían una distribución normal. Las variables categóricas se analizaron con la prueba exacta de Fisher. Las variables continuas se evaluaron previamente con los test de Shapiro-Wilk, Kolmogorov-Smirnoff y Levene (p>0,05) para evaluar si seguían o no una distribución normal y se analizaron con la t de Student cuando seguían una distribución normal y la U de Mann-Whitney en los demás casos. Los datos de supervivencia se analizaron mediante el método de Kaplan-Meier y se compararon con la prueba log-rank. Las diferencias se consideraron significativas para valores de p<0,05.
ResultadosEl estudio incluyó 109 pacientes con tumores periampulares (tabla 1): 63 ACDP, 27 adenocarcinomas de la ampolla de Vater, 15 colangiocarcinomas y 4 tumores duodenales.
Variables demográficas, perioperatorias y supervivencia
| Total | ACDP | |||
|---|---|---|---|---|
| n=109 | n=63 | |||
| Edad (M±DE) (años) | 65 | ±10,9 | 67 | ±10,4 |
| Sexo femenino [n (%)] | 40 | (36,7) | 27 | (44) |
| IMC (M±DE) (kg/m2) | 27,1 | ±5,2 | 26,6 | ±4,86 |
| Infiltración venosa preoperatoria [n (%)] | 24 | (22,0) | 24 | (38) |
| Drenaje biliar preoperatorio [n (%)] | 79 | (72,4) | 43 | (68) |
| Resección venosa [n (%)] | 22 | (20,1) | 22 | (30) |
| Resección arterial [n (%)] | 1 | (0,9) | 1 | (2) |
| Tamaño tumoral [mediana (RIQ)] (mm) | 25 | (18-35) | 30 | (25-40) |
| pN+ [n (%)] | 48 | (44,0) | 30 | (48) |
| Invasión microvascular [n (%)] | 53 | (48,6) | 41 | (67) |
| Invasión linfática [n (%)] | 55 | (50,4) | 43 | (68) |
| Invasión perineural [n (%)] | 72 | (66,1) | 53 | (84) |
| Diferenciación tumoral [n (%)] | ||||
| Bien | 25 | (22,9) | 11 | (17) |
| Moderadamente | 55 | (50,5) | 34 | (54) |
| Pobremente | 25 | (22,9) | 15 | (24) |
| Indiferenciado | 4 | (3,7) | 3 | (5) |
| R1 [n (%)] | 31 | (28,4) | 26 | (41) |
| Complicaciones post-operatorias ≥Dindo-Clavien 3a [n (%)] | 43 | (39,4) | 15 | (24) |
| Fístula pancreática [n (%)] | 38 | (34,8) | 16 | (25) |
| Tipo B | 15 | (13,7) | 8 | (14) |
| Tipo C | 6 | (5,5) | 1 | (2) |
| Mortalidad [n (%)] | 6 | (5,5) | 3 | (5) |
| Estancia [mediana (RIQ)] (días) | 17,5 | (12-29) | 15,0 | (11-18) |
| Tratamiento neoadyuvante [n (%)] | 2 | (1,8) | 2 | (3) |
| Tratamiento adyuvante [n (%)] | 62 | (56,8) | 38 | (60) |
| TR [n (%)] | 57 | (52,2) | 43 | (68) |
| Tasa de recurrencia locorregional [n (%)] | 26 | (23,8) | 20 | (32) |
| SLE [mediana (RIQ)] (meses) | 25 | (7-57) | 16 | (5-25) |
| SG [mediana (RIQ)] (meses) | 38 | (14-72) | 24 | (11-39) |
ACDP: adenocarcinoma ductal pancreático; CG15: cociente ganglionar>15%; IMC: índice de masa corporal; M±DE: media más o menos desviación estándar; RIQ: rango intercuartílico; SG: supervivencia global; SLE: supervivencia libre de enfermedad; TR: tasa de recurrencia.
A la hora de analizar toda la serie, la edad media fue de 65±11 años; 40 pacientes eran mujeres (36,7%). Se realizó resección venosa en 22 pacientes (20,1%), en los que se encontró infiltración de forma intraoperatoria y solo uno (0,9%) tuvo una resección arterial (un paciente con una arteria hepática derecha accesoria, reconstruida mediante un injerto protésico de politetrafluoroetileno). Treinta y una resecciones (28,4%) resultaron R1. Se observaron complicaciones postoperatorias ≥grado 3a según la clasificación de Clavien-Dindo en 43 casos (39,4%). La mortalidad postoperatoria fue del 5,5% (6 pacientes) y la estancia mediana fue de 17,5 días (12,5-29,5 días). Se administró terapia adyuvante a 62 pacientes (56,8%). Después de la exclusión de las muertes postoperatorias se observó una SLE mediana de 25 meses (7-57 meses), con una SG de 38 meses (14-72 meses). Los datos relativos al subgrupo de ACDP se ilustran en la tabla 1.
Comparación de los hallazgos de PE vs. PNE en los pacientes con tumores periampulares y en el subgrupo de ACDPDebido a las diferencias en el pronóstico de los diferentes tipos histológicos de tumores periampulares (ACDP, colangiocarcinomas, carcinomas de la ampolla de Vater y carcinomas duodenales), después de analizar los resultados de toda la serie en su conjunto analizamos los resultados y el pronóstico oncológico a largo plazo del ACDP como un subgrupo separado. En el grupo de tumores periampulares, cuando el PE se comparó con el PNE, se evidenció un mayor número de ganglios linfáticos aislados (17 [13-20] vs. 8 [5-17]) en el grupo PE (p=0,003), así como una mayor tasa de pN+: 29 (60%) vs. 19 (31%) (p<0,001); invasión microvascular: 32 (67%) vs. 21 (34%) (p=0,001); y R1: 20 pacientes (42%) vs. 11 (18%) (p=0,010). Los hallazgos del subgrupo ACDP fueron superponibles con el grupo general de tumores periampulares y se muestran en la tabla 2.
Evaluación del estudio estandarizado
| Tumores periampulares | ACDP | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| PNE | PE | p | PNE | PE | p | |||||
| n=61 | n=48 | n=30 | n=33 | |||||||
| Edad (M±DE) (años) | 64 | ±10 | 66 | ±11 | 0,394 | 67 | ±11 | 68 | ±10 | 0,661 |
| Sexo (femenino) [n (%)] | 39 | (64) | 30 | (62) | 1 | 18 | (60) | 18 | (54) | 0,800 |
| IMC (M±DE) (kg/m2) | 27,4 | ±4,4 | 26,5 | ±4,7 | 0,576 | 27,8 | ±5,0 | 26,1 | ±4,9 | 0,419 |
| Drenaje biliar preoperatorio [n (%)] | 45 | (74) | 34 | (71) | 0,830 | 22 | (73) | 21 | (64) | 0,432 |
| Resección vascular [n (%)] | 10 | (16) | 12 | (25) | 0,338 | 10 | (33) | 12 | (36) | 1 |
| Complicaciones postoperatorias ≥Dindo-Clavien 3a [n (%)] | 29 | (47) | 14 | (29) | 0,075 | 12 | (40) | 8 | (24) | 0,278 |
| Fístula pancreática [n (%)] | 20 | (33) | 8 | (16) | 0,108 | 6 | (20) | 3 | (9) | 0,289 |
| pT [n (%)] | 0,665 | 0,788 | ||||||||
| T1 | 10 | (16) | 2 | (4) | 1 | (3) | 2 | (6) | ||
| T2 | 16 | (26) | 13 | (27) | 6 | (20) | 9 | (27) | ||
| T3 | 35 | (57) | 33 | (68) | 23 | (77) | 22 | (67) | ||
| pN+ [n (%)] | 19 | (31) | 29 | (60) | 0,003 | 11 | (33) | 19 | (60) | 0,044 |
| N ganglios aislados [mediana (RIQ)] | 6 | (3-11) | 16 | (12-20) | <0,001 | 8 | (5-12) | 17 | (13-20) | <0,001 |
| N ganglios positivos [mediana (RIQ)] | 0 | (0-1) | 1 | (0-3) | 0,132 | 0 | (0-1 | 1 | (0-4) | 0,132 |
| CG15 [n (%)] | 13 | (21) | 13 | (27) | 0,505 | 7 | (23) | 13 | (39) | 0,189 |
| Diferenciación tumoral [n (%)] | 0,097 | 0,546 | ||||||||
| Bien | 16 | (26) | 9 | (18) | 7 | (23) | 4 | (12) | ||
| Moderadamente | 28 | (46) | 27 | (56) | 15 | (50) | 19 | (58) | ||
| Pobremente | 14 | (23) | 11 | (23) | 6 | (20) | 9 | (28) | ||
| Indiferenciado | 3 | (5) | 1 | (2) | 2 | (7) | 1 | (3) | ||
| Invasión microvascular [n (%)] | 21 | (34) | 32 | (67) | 0,001 | 15 | (50) | 26 | (79) | 0,020 |
| Invasión linfática [n (%)] | 25 | (49) | 30 | (62) | 0,226 | 18 | (60) | 25 | (76) | 0,278 |
| Invasión perineural [n (%)] | 36 | (59) | 36 | (75) | 0,104 | 24 | (80) | 29 | (88) | 0,498 |
| R1 [n (%)] | 11 | (18) | 20 | (42) | 0,010 | 7 | (23) | 19 | (57) | 0,005 |
| Tratamiento neoadyuvante [n (%)] | 0 | (0) | 2 | (4) | 0,107 | 0 | (0) | 2 | (6) | 0,170 |
| Tratamiento adyuvante [n (%)] | 29 | (47) | 33 | (69) | 0,033 | 13 | (43) | 25 | (76) | 0,011 |
ACDP: adenocarcinoma ductal pancreático; CG15: cociente ganglionar>15%; IMC: índice de masa corporal; M±DE: media más o menos desviación estándar; RIQ: rango intercuartílico; PE: protocolo estandarizado; PNE: protocolo no estandarizado. En negrita se evidencian los resultados con diferencias estadísticamente significativa.
En cuanto a la tasa de afectación de los MR, la gran mayoría de las resecciones R1 estaban constituidas por ACDP, presentando 17 de ellas (51%) una infiltración del MR posterior, 13 (39%) del MR medial y 4 (12%) del MR anterior (tabla 3). Un paciente presentó afectación del margen de transección pancreático en el estudio tras inclusión en parafina, que sin embargo se había considerado libre de infiltración tumoral en el estudio intraoperatorio. Nueve pacientes (27%) presentaron afectación de más de un MR.
R1 en relación con los distintos márgenes tras la evaluación con PE
| Tumores periampulares | ACDP | |||
|---|---|---|---|---|
| n=48 | n=33 | |||
| Margen afecto [n (%)] | 20 | (42) | 19 | (57) |
| Posterior [n (%)] | 18 | (37) | 17 | (51) |
| Medial [n (%)] | 13 | (28) | 13 | (39) |
| Anterior [n (%)] | 4 | (8) | 4 | (12) |
| Transección [n (%)] | 1 | (2) | 1 | (3) |
| Biliar [n (%)] | 2 | (4) | 2 | (6) |
| Duodenal [n (%)] | - | - | - | - |
| Afectación múltiple [n (%)] | 9 | (19) | 9 | (27) |
ACDP: adenocarcinoma ductal pancreático; PE: protocolo estandarizado.
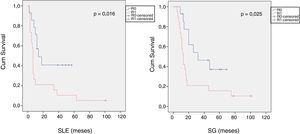
Al comparar los datos de los ACDP con resección R1 analizados según un PE con los R0, los primeros presentaron un mayor porcentaje de resecciones vasculares (p=0,033), un estadio T más avanzado (p=0,022), mayores tasas de N+ (p=0,029), ganglios linfáticos positivos aislados (p=0,001), CG15 (p=0,015), invasión linfática (p=0,047) e invasión perineural (p=0,029) (tabla 4). Además, la resección R1 presentó una mayor TR (p=0,026) y una menor SLE (p=0,016) y SG (p=0,025) (tabla 4 y fig. 2).
Comparación de R0 y R1 tras la evaluación con PE
| ACDP | |||||
|---|---|---|---|---|---|
| R0 | R1 | p | |||
| n=14 | n=19 | ||||
| Edad [mediana (RIQ)] (años) | 65 | (58-74) | 75 | (64-79) | 0,133 |
| Sexo (femenino) [n (%)] | 6 | (43) | 9 | (47) | 1 |
| IMC [mediana (RIQ)] (kg/m2) | 24 | (20-29) | 27 | (24-30) | 0,296 |
| Drenaje biliar preoperatorio [n (%)] | 9 | (64) | 12 | (63) | 1 |
| Resección vascular[n (%)] | 2 | (14) | 10 | (53) | 0,033 |
| Complicaciones post-operatorias ≥ Dindo-Clavien 3a [n (%)] | 4 | (29) | 4 | (21) | 0,695 |
| Fístula pancreática [n (%)] | 0 | (0) | 3 | (16) | 0,244 |
| pT [n (%)] | 0,022 | ||||
| T1 | 2 | (14) | 0 | (0) | |
| T2 | 6 | (43) | 3 | (16) | |
| T3 | 7 | (50) | 16 | (84) | |
| pN+ [n (%)] | 5 | (36) | 15 | (79) | 0,029 |
| N ganglios aislados [mediana (RIQ)] | 15 | (11-22) | 18 | (16-21) | 0,132 |
| N ganglios positivos [mediana (RIQ)] | 0 | (0-1) | 3 | (1-7) | 0,001 |
| CG15 [n (%)] | 2 | (14) | 11 | (58) | 0,015 |
| Diferenciación tumoral [n (%)] | 0,844 | ||||
| Bien | 2 | (14) | 2 | (10) | |
| Moderadamente | 9 | (64) | 10 | (53) | |
| Pobremente | 4 | (27) | 5 | (26) | |
| Indiferenciado | 0 | (0) | 1 | (5) | |
| Invasión microvascular [n (%)] | 9 | (64) | 17 | (89) | 0,106 |
| Invasión linfática [n (%)] | 8 | (57) | 17 | (89) | 0,047 |
| Invasión perineural [n (%)] | 10 | (71) | 19 | (100) | 0,029 |
| Tratamiento neoadyuvante [n (%)] | 1 | (7) | 1 | (6) | 0,692 |
| Tratamiento adyuvante [n (%)] | 10 | (71) | 15 | (79) | 0,695 |
| TR [n (%)] | 8 | (57) | 18 | (95) | 0,026 |
| SLE [mediana (RIQ)] (meses) | 16 | (4-23) | 7 | (6-8) | 0,016 |
| SG [mediana (RIQ)] (meses) | 32 | (2-61) | 13 | (10-16) | 0,025 |
ACDP: adenocarcinoma ductal pancreático; CG15: cociente ganglionar>15%; IMC: índice de masa corporal; M±DE: media más o menos desviación estándar; PE: protocolo estandarizado; RIQ: rango intercuartílico; SG: supervivencia global; SLE: supervivencia libre de enfermedad; TR: tasa de recurrencia. En negrita se evidencian los resultados con diferencias estadísticamente significativa.
En la tabla 5 se ilustran las variables demográficas y perioperatorias en relación con la afectación de los distintos MR afectos. Cuando analizamos el impacto de la infiltración de cada MR sobre el pronóstico oncológico a largo plazo, encontramos que solo la positividad del MR medial estaba relacionada con una mayor TR (p=0,028) y una menor SLE (p=0,028) y SG (p=0,022), mientras que la positividad de los MR anterior, posterior y de transección no mostró diferencias significativas en el pronóstico oncológico a largo plazo (tabla 6).
Variables demográficas y perioperatorias en relación con la afectación de los distintos márgenes de resección afectos
| ACDP | ||||||
|---|---|---|---|---|---|---|
| MM afecto | MP afecto | MA afecto | ||||
| n=13 | n=17 | n=4 | ||||
| Edad [mediana (RIQ)] (años) | 66 | (61-74) | 68 | (63-75) | 62 | (58-70) |
| Sexo (femenino) [n (%)] | 5 | (38) | 8 | (47) | 2 | (50) |
| Resección vascular[n (%)] | 7 | (54) | 8 | (47) | 1 | (25) |
| Complicaciones postoperatorias ≥Dindo-Clavien 3a [n (%)] | 3 | (23) | 2 | (12) | 0 | (0) |
| pT [n (%)] | ||||||
| T1 | 0 | (0) | 0 | (0) | 0 | (0) |
| T2 | 1 | (8) | 4 | (23) | 0 | (0) |
| T3 | 12 | (92) | 13 | (76) | 4 | (100) |
| pN+ [n (%)] | 11 | (85) | 13 | (76) | 4 | (100) |
| Diferenciación tumoral [n (%)] | ||||||
| Bien | 2 | (15) | 1 | (6) | 0 | (0) |
| Moderadamente | 7 | (54) | 11 | (65) | 2 | (50) |
| Pobremente | 3 | (23) | 5 | (29) | 2 | (50) |
| Indiferenciado | 1 | (8) | 0 | (0) | 0 | (0) |
| Invasión microvascular [n (%)] | 11 | (85) | 14 | (87) | 2 | (50) |
| Invasión linfática [n (%)] | 10 | (77) | 13 | (81) | 2 | (50) |
| Invasión perineural [n (%)] | 13 | (100) | 17 | (100) | 4 | (100) |
ACDP: adenocarcinoma ductal pancreático; M±DE: media más o menos desviación estándar; MA: margen anterior; MM: margen medial; MP: margen posterior; margen de transección; RIQ: rango intercuartílico.
Comparación de TR, SLE, SG en relación con los distintos márgenes de resección
| ACDP | |||||||
|---|---|---|---|---|---|---|---|
| Margen | TR [n (%)] | SLE [mediana (RIQ)] (meses) | SG [mediana (RIQ)] (meses) | ||||
| Cualquier margen de resección positivo | R0 (n=14) | 8 (57) | p=0,026 | 16 (4-23) | p=0,016 | 34 (2-61) | p=0,025 |
| R1 (n=19) | 18 (95) | 7 (6-8) | 13 (10-16) | ||||
| MM | R0 (n=20) | 13 (65) | p=0,028 | 14 (6-18) | p=0,028 | 28 (7-45) | p=0,022 |
| R1 (n=13) | 13 (100) | 7 (6-8) | 13 (9-16) | ||||
| MP | R0 (n=16) | 11 (69) | p=0,225 | 14 (7-20) | p=0,161 | 28 (9-43) | p=0,233 |
| R1 (n=17) | 15 (88) | 7 (5-9) | 13 (9-17) | ||||
| MA | R0 (n=29) | 22 (76) | p=0,555 | 12 (6-14) | p=0,125 | 20 (10-26) | p=0,117 |
| R1 (n=4) | 4 (100) | 6 (2-10) | 11 (1-21) | ||||
| MT | R0 (n=32) | 24 (75) | p=1,000 | 8 (5-10) | 17 (12-22) | ||
| R1 (n=1) | 1 (100) | 10 | 12 | ||||
ACDP: adenocarcinoma ductal pancreático; MA: margen anterior; MM: margen medial; MP: margen posterior; MT: margen de transección; SG: supervivencia global; SLE: supervivencia libre de enfermedad; TR: tasa de recurrencia; RIQ: rango intercuartílico.
La resección completa de un tumor, con un margen R0, clásicamente ha representado la piedra angular de la cirugía oncológica. Sin embargo, la amplia variabilidad en la tasa de resecciones R1 después de DPC3,11–14 y su inconstante relación con el pronóstico oncológico a largo plazo abrieron el debate sobre la falta de estandarización en el análisis histopatológico.
En 2006, Verbeke et al.2 resaltaron las dificultades relacionadas con el corte del espécimen pancreático así como la identificación y clasificación de los diferentes MR. Este grupo propuso un nuevo protocolo de estudio patológico estandarizado conocido como LEEPP, que posteriormente fue adoptado por el Royal College of Pathologists. En sus trabajos15,16, demostraron que después de la introducción de un PE, la tasa de resecciones R1 aumentó drásticamente del 53% hasta el 85% (p=0,009). Resultados similares fueron confirmados por Esposito et al.17, quienes describieron un aumento del porcentaje de resecciones R1 del 14 al 76% (p<0,001), en el estudio francés multicéntrico dirigido por Delpero et al.18, que confirmó el aumento en el porcentaje de resección de R1 hasta el 61% tras la introducción de un PE, y por otros autores19–25. Nuestros hallazgos respaldan estos datos, mostrando un aumento de las resecciones R1 con el uso de un PE para el estudio de las piezas de DPC tanto en el caso de ACDP como en el conjunto de tumores periampulares. El impacto de estos resultados no debe subestimarse: la estandarización del análisis de las piezas tras resecciones de ACDP es imprescindible para su comparación entre distintos grupos de estudio con el fin de evaluar rigurosamente el pronóstico oncológico de estos pacientes así como los regímenes de quimiorradioterapia perioperatoria más favorables.
Un metaanálisis reciente26 revisó 19 series que analizaron muestras de DPC con un PE, confirmando que los MR medial y posterior se veían afectados en aproximadamente el 50% de las muestras. Nuestra serie corrobora estos resultados destacando un 51% de afección de los márgenes posteriores y un 39,4% de afección de los márgenes mediales en los pacientes intervenidos por ACDP.
Además, la introducción de un PE ha demostrado conseguir un análisis más detallado de los especímenes quirúrgicos. Slidell et al.27 demostraron que los pacientes con pN0, pero con menos de 12 ganglios linfáticos estudiados, presentaban un peor pronóstico que los tumores pN0 con un número superior de ganglios linfáticos resecados. Esto probablemente se debe a una infraestadificación de la enfermedad28,29. Nuestros datos mostraron una diferencia significativa en el número de ganglios linfáticos aislados cuando se aplicó un PE. Como ni la técnica quirúrgica ni los cirujanos cambiaron después de la introducción del PE, estos resultados pueden interpretarse como consecuencia de un análisis más meticuloso del espécimen quirúrgico. De la misma forma, en nuestro trabajo hemos observado una mayor prevalencia de pacientes pN+ y con invasión microvascular tras la introducción del PE.
Otro aspecto importante a considerar es la misma definición de márgenes R0/R1, ya que la mayoría de grupos europeos considera resección R1 aquella en la que el tumor se sitúa a menos de 1mm del MR, mientras que los patólogos estadounidenses consideran una resección R1 como un tumor directamente en contacto con el MR. El impacto de la distancia entre el tumor y el MR fue analizado por John et al.23, quienes encontraron diferencias en la SG solo cuando la resección R1 se definió como tumores localizado a menos de 1mm del MR. Chang et al.30, Jamieson et al.14 y Gebauer et al.25 analizaron la misma relación y encontraron diferencias en la SG cuando el tumor se localizó a menos de 1,5 o 2mm. Estos datos sugieren que la definición de R1 debe incluir tumores localizados a, al menos, 1mm del MR; estudios multicéntricos deberían evaluar si este límite debe de aumentarse hasta 1,5 o 2mm.
El impacto de la afectación de los MR en relación con la SLE fue investigado por Sugiura et al.31 y John et al.23, quienes no encontraron diferencias significativas en cuanto a la SLE. Sin embargo, otras series3,19,21,24,32–35, incluyendo un trabajo multicéntrico más reciente35, demostraron una disminución significativa tanto de la SLE como de la SG en relación con la afectación del MR. Estos hallazgos están respaldados por nuestra serie, que demuestra un aumento de la TR y una disminución de la SLE y SG en pacientes con MR afectos tras una evaluación con un PE. En cuanto a la influencia de la infiltración de cada margen sobre el pronóstico oncológico, Delpero et al.18 y Ghaneh et al.35 demostraron un empeoramiento de la SG en caso de afectación del MR medial. Nuestros datos corroboran los hallazgos relativos al empeoramiento del pronóstico oncológico en caso de afectación del MR medial, y evidencian una disminución de la SLE y SG en caso de afectación del MR posterior, que en nuestra serie no llega a alcanzar la significación estadística. Estos hallazgos tienen una relevancia clínica importante, ya que el aumento de las tasa de resección R0 del MR medial podría mejorarse mediante tratamientos neoadyuvantes o estrategias quirúrgicas más agresivas con resecciones vasculares en pacientes con infiltración dudosa de la VMS. Esta situación es compleja, ya que no existe una clara evidencia respecto a si tumores resecables con un contacto menor de 180̊ de la VMS en pruebas de imagen preoperatorias deberían someterse a tratamiento neoadyuvante o a resección quirúrgica como tratamiento inicial; además, la evaluación intraoperatoria de la infiltración de la VMS puede ser muy compleja debido a la difícil diferenciación entre la fibrosis peritumoral y la infiltración tumoral propiamente dicha. Nuestros datos sugieren un empeoramiento del pronóstico en caso de afectación del MR medial, sin embargo, se necesitan ensayos clínicos para encontrar la mejor forma de disminuir dicha tasa de R1.
Existen limitaciones en nuestro estudio, como el amplio intervalo de tiempo durante el cual se han reclutado los pacientes y los cambios en las estrategias de tratamiento y los regímenes de quimioterapia utilizados a lo largo del estudio. Otra limitación está representada por el reducido número de pacientes incluidos en nuestro trabajo, que no ha permitido realizar análisis de las variables de estudios en grupos apareados por los posibles factores de confusión. Por lo tanto, nuestra opinión es que una vez que la definición de los diferentes márgenes pancreáticos y la resección R1 estén estandarizados, estudios multicéntricos prospectivos deberían evaluar la influencia del tratamiento adyuvante y neoadyuvante así como la agresividad de las estrategias quirúrgicas para mejorar el porcentaje de R0 y mejorar la SLE y la SG.
En conclusión, nuestro trabajo muestra un aumento del porcentaje de resección R1 tras la introducción de un PE para el estudio del ACDP, así como un mayor número de ganglios linfáticos aislados, N+ e invasión microvascular, en relación con un informe patológico estandarizado. Las resecciones R1 en el grupo PE parecen mostrar una mayor TR y una disminución tanto en la SLE como en la SG, que únicamente se mantenía en la positividad del MR medial al analizar cada uno de los MR por separado.
AutoríaMDM: concepción y diseño, recopilación y análisis de datos, redacción, revisión; JLMN: recopilación de datos y revisión del manuscrito; MGR: recopilación de datos, edición de imágenes; EAM: revisión del manuscrito; EMP: concepción, revisión, aprobación final.
Conflicto de interesesLos autores certifican que no existe ningún conflicto de intereses con ninguna organización financiera/de investigación/académica, con respecto al contenido que se analiza en el manuscrito.