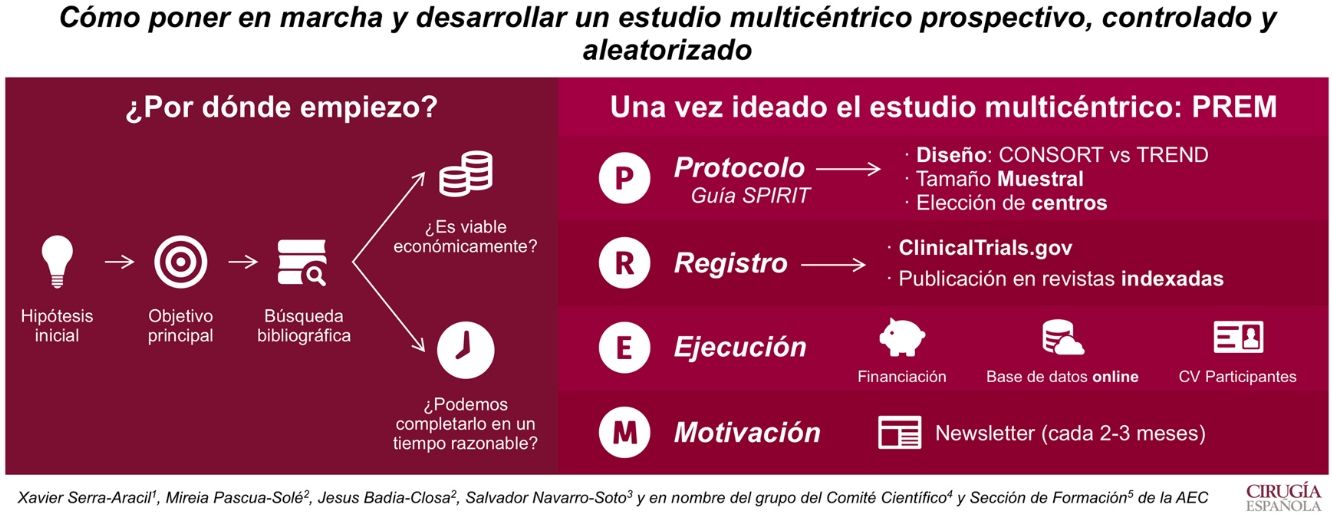
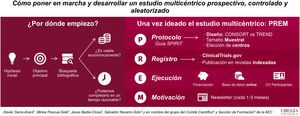
El objetivo de este artículo es ilustrar cómo poner en marcha y desarrollar un estudio multicéntrico prospectivo, controlado y aleatorizado.
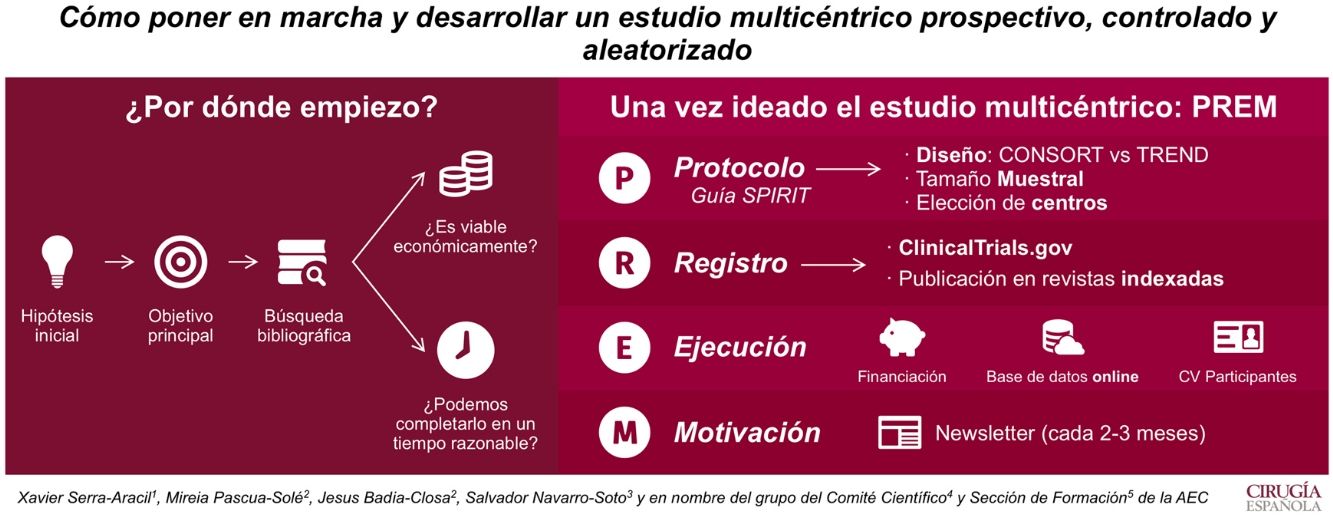
Por ello, lo primero que se necesita es crear una idea que genere una hipótesis y un objetivo principal. La búsqueda bibliográfica nos permite ver su relevancia clínica y las evidencias publicadas. Además, hay que plantearse si el estudio es viable económicamente y si puede ser completado en un período menor a 4 años.
Una vez ideado el estudio multicéntrico, para ejecutarlo se debe redactar un protocolo (según la guía Standard Protocol items: Recommendations for Interventional Trials [SPIRIT 2013]). En él se recogerán el tipo de diseño, el tamaño muestral y los centros que participarán. La aleatorización es clave en el diseño. Si puede ser aleatorizado, se recomienda utilizar la guía Consolidated Standards of Reporting Trials (CONSORT), si no, la Transparent Reporting of Evaluations with Non-Randomized Designs (TREND).
Cuando el protocolo es aprobado por el Comité Ético de Investigación Clínica del hospital, hay que darle visibilidad. Es por eso que se recomienda su registro en ClincalTrials.gov y su publicación en revistas indexadas.
Para el inicio del estudio, se requiere buscar fuentes de financiación. Estas permiten tener una base de datos on line, que permiten aleatorizar al momento y mantener el registro al día desde cualquier centro.
Por último, hay que destacar que es imprescindible la motivación. La multicentricidad solo se entiende si todos los centros participan. Así que informar de resultados y dar ánimos cada 1-3 meses (en forma de newsletter) es una manera de conseguir un buen funcionamiento del estudio.
Our main goal is to describe how to start and develop a multicenter, prospective, randomized, controlled trial.
The first step is to have an idea that will become the hypothesis and a main objective. A bibliographic search should be done to check for clinical interest and originality. Moreover, the study must be feasible and should be finished within 4 years.
In order to start the multicenter study, a protocol should be written (in accordance with the SPIRIT guidelines Standard Protocol items: Recommendations for Interventional Trials), including the design type, sample size and participating hospitals. Randomization is key to the design and, therefore, the CONSORT (Consolidated Standards of Reporting Trials) guidelines must be followed. However, if the study cannot be randomized, the TREND (Transparent Reporting of Evaluations with Non-Randomized Designs) guidelines are recommended.
When the protocol is approved by the Ethics Committee for Clinical Investigation of the hospital, we ought to create visibility. It is suggested to register the trial on ClincalTrials.gov and submit its publication to indexed magazines.
Financial resources are necessary to execute the study and maintain an online database. This allows the registry to be updated and accessible to all the participants in the study. What is more, randomization can be done immediately.
And last, but not least, is motivation. Multicentricity equals to participation of all the chosen medical centers. Updating and motivating them by sending a newsletter every 1-3 months keeps participants engaged in the study.
Los estudios prospectivos, controlados y aleatorizados (PCA) son los estudios de mayor evidencia científica y validez interna. Estos estudios son identificados con nivel de evidencia 1a-b según el Centre for Evidence-Based Medicine de Oxford1.
Los estudios multicéntricos tienen el valor añadido de asociar la reproductibilidad en otros centros. Por tal motivo, los estudios multicéntricos PCA (EMPCA) poseen un máximo nivel de validez tanto interna como externa.
Cómo se inicia un estudio multicéntrico prospectivo controlado y aleatorizadoTodo debe empezar con una pregunta: ¿qué problema quirúrgico intento dar respuesta? Esta pregunta genera una idea que se traduce en una hipótesis y el objetivo principal del estudio. El siguiente paso es la búsqueda exhaustiva en la literatura médica. Para ello se traduce la pregunta en distintas palabras clave que se introducen en las bases bibliográficas (tipo PUBMED, SCOPUS, COCHRANE) que realizan la búsqueda utilizando el formulario de búsqueda avanzada mediante la utilización de operadores lógicos o «booleanos» (AND, OR, NOT). Posteriormente, se evalúa el resultado de la búsqueda y seleccionan los artículos de mayor interés.
Tras la actualización bibliográfica debemos hacernos las siguientes preguntas: ¿la literatura médica consultada da suficientemente respuesta a nuestra pregunta? En caso negativo: ¿nuestra idea es clínicamente relevante?
Cómo se plasma una idea que conduce a un estudio multicéntrico prospectivo, controlado y aleatorizado: descripción del protocolo de estudioEl protocolo de un EMPCA es la base para planificar, ejecutar, publicar y evaluar el estudio. Sin embargo, los protocolos y las guías que existen varían enormemente en cuanto a su calidad y contenido. Para dar respuesta a este problema, se publicó la declaración Standard Protocol items: Recommendations for Interventional Trials (SPIRIT 2013)2; representa una guía o manual de instrucciones en la que se establecen los contenidos mínimos que debe tener el protocolo de un ensayo clínico o estudio PCA. En esta declaración se describe una «checklist», que consta de 33 elementos.
Un protocolo bien redactado facilita una evaluación adecuada de los aspectos científicos, éticos, de seguridad, la valoración plena de su ejecución y sus resultados una vez finalizado. Esta homogenización facilita el desarrollo del trabajo y permite que no haya vacíos que al final del estudio son difíciles de resolver.
Diseño de estudio multicéntrico prospectivo, controlado y aleatorizado de superioridadLos estudios PCA con un diseño adecuado representan el método de referencia en la evaluación de nuevos tratamientos (médicos o quirúrgicos). Sin embargo, si carecen de rigor metodológico, pueden dar resultados sesgados.
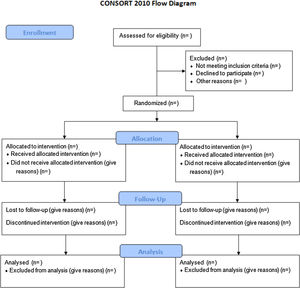
Para evaluar un estudio PCA con precisión, se requiere de una descripción completa y clara sobre su metodología y los hallazgos obtenidos. Esta falta de rigor dio lugar a la publicación, en 1996, de la guía Consolidated Standards of Reporting Trials (CONSORT). Este manifiesto ocasionó un aumento en la calidad de los estudios, aunque muchos de ellos continuaron siendo incorrectos3. Como consecuencia, el Grupo CONSORT realizó una actualización que denominaron CONSORT 2010 Statement4. Este documento incluye una lista de 25 elementos en formato checklist y el diagrama de flujo (fig. 1), para ayudar al desarrollo del estudio.
Este manuscrito proporciona orientación para desarrollar los diseños de los estudios PCA más comunes: ensayos paralelos, aleatorizados, individuales y de 2grupos. Otros diseños de estudios PCA, como los ensayos aleatorios grupales, requieren de otro tipo de variables. Las extensiones CONSORT para estos diseños se pueden encontrar a través del sitio web CONSORT5.
Diseño de estudio multicéntrico prospectivo, controlado y aleatorizado de no inferioridadGeneralmente, los estudios PCA se diseñan con el objetivo de intentar demostrar que un tratamiento médico o quirúrgico es superior que el estándar o convencional. Sin embargo, en ocasiones, la finalidad no es demostrar si un tratamiento es mejor, sino que un tratamiento posee ciertas ventajas (como menores complicaciones postoperatorias, mejor calidad de vida, etc.), que no es inferior al tratamiento estándar.
A diferencia de los estudios PCA de equivalencia, en los de no inferioridad no nos preocupa si el nuevo tratamiento es similar, siempre que «no sea mucho peor»6. Cuánto peor (cuánto menos efectivo), dependerá del equipo investigador, que considerará hasta qué punto es aceptable la importancia del resultado de la efectividad. Este porcentaje aceptable de peor tratamiento es lo que se denomina «margen de no inferioridad», descrito con la letra delta (δ).
De la misma forma que existe el manual o guía de estudios PCA de superioridad a través del CONSORT, Piaggio et al.7 han descrito su adaptación a estudios de no inferioridad y equivalencia con una checklist apropiada a estos estudios.
En los estudios prospectivos controlados y aleatorizados, ¿es siempre posible o ético aleatorizar?Un estudio PCA asegura que todos los pacientes incluidos provienen de una misma población y, por tanto, son comparables. Posteriormente, la aleatorización enmascara posibles variables de confusión, no conocidas. Los resultados de este tipo de diseño son los que mayor evidencia científica aportan y permiten aplicarlos a futuros pacientes. Sin embargo, esto no implica que cualquier decisión terapéutica deba basarse en un diseño PCA8.
Un ejemplo donde es dudosa la aplicación de los resultados de un estudio prospectivo basado en la aleatorización es el estudio de Barendse et al.9. Es un EMPCA entre la microcirugía endoscópica transanal (TEM) vs. resección mucosa endoscópica (RME) en grandes adenomas de recto. Incluyeron centros con gran experiencia en RME pero asociaron otros con escasa experiencia en TEM. Obtuvieron resultados de TEM peores que los habituales descritos en la literatura, por lo que concluyeron que la RME era la técnica de elección debido a una tasa de complicaciones más bajas y una mejor relación costo-efectividad que la TEM. Pese a tener un perfecto diseño de EMPCA, sus conclusiones eran cuestionables10.
Así pues, se aceptan los estudios no aleatorizados cuando:
- 1.
Resulta imposible o no es ético realizar aleatorización (p. ej., aleatorizar el efecto del paracaídas cuando te lanzas de un avión).
- 2.
El objetivo del estudio es analizar la efectividad de 2tratamientos en condiciones de práctica clínica real, teniendo mayor experiencia en uno de ellos.
- 3.
Interesa evaluar el coste-efectividad de una intervención terapéutica8.
Para el desarrollo de estudios prospectivos controlados no aleatorizados se han diseñado los estudios Transparent Reporting of Evaluations with Non-Randomized Designs (TREND)11. Como en el resto de las guías, se publica su «checklist», que permite tener instrucciones de cómo desarrollar este tipo de estudios.
Relacionado con esta circunstancia, nuestro grupo quiso diseñar un EMPCA comparando en hemicolectomías derechas la anastomosis intracorpórea vs. la extracorpórea. Observamos que existían centros que no tenían experiencia con la anastomosis intracorpórea, por lo que tenían que pasar por una curva de aprendizaje. Por otra parte, quien realizaba anastomosis intracorpórea ya tenía experiencia previa en la extracorpórea, creyendo que la primera era mejor. En tal circunstancia, nuestro Comité Ético de Investigación Clínica (CEIC) no nos dejó aleatorizar debido a que no era ético aleatorizar entre 2técnicas cuando se cree que una de ellas es mejor que la otra o se tiene menor experiencia12.
¿Por qué realizar estudios multicéntricos?La respuesta es doble. La principal, para reunir un mayor número de pacientes en menor tiempo. Por otra parte, concede al estudio una mayor validez externa. Significa que diluye el efecto que un centro tenga mejores cirujanos que otro, por lo que los resultados se asemejan más a la realidad.
¿Qué número total de pacientes debo incluir en el estudio multicéntrico prospectivo, controlado y aleatorizado? ¿Cómo calcular tamaño muestral?La importancia del cálculo muestral se debe a que, si no incluimos un suficiente número de pacientes, podemos dar resultados no concluyentes con un diseño impecable. Incluir un excesivo número de pacientes, no obstante, implica un gasto de recursos.
Existen reglas que no se deben infringir, de lo contrario cometemos un sesgo que puede invalidar nuestro estudio:
- –
El cálculo se debe realizar en relación con la variable principal del estudio. En ocasiones, observamos cómo el cálculo se hace sobre variables secundarias, porque con la principal el número que obtenemos es excesivo.
- –
El riesgo del «nivel de significación», «riesgo alfa (α)» o de tipo i, por defecto se da el valor de 0,05-0,025. Indica la probabilidad de rechazar una hipótesis nula que realmente es verdadera. Dicho de otra forma, que tenemos una probabilidad de 0,05-0,025 de cometer un «falso positivo» y decir que los grupos son diferentes cuando en realidad no lo son.
- –
El riesgo denominado «potencia de la prueba», «1 – beta (1 – β)» o tipo ii. Se trata de la probabilidad de rechazar una hipótesis nula que es falsa; dicho de otra forma, representa la probabilidad de aceptar una hipótesis alternativa como verdadera cuando así lo es. Se estima como prudente una potencia del 90-80% o riesgo β de 0,1-0,2.
- –
El método de cálculo variará en función de si la variable principal es cuantitativa o categórica (son los casos más frecuentes).
- –
El porcentaje de pérdidas durante el reclutamiento. Se suele considerar del 10% sobre el total del cálculo.
- –
Finalmente, calcularemos la muestra en función del diseño del estudio.
Es el estudio más típico con una variable principal categórica. En estos casos, como investigadores debemos tener una serie de datos claros:
- –
El porcentaje de éxitos con el tratamiento estándar y cuál es el porcentaje de éxitos que mejorará el tratamiento experimental (o de estudio).
- –
Los riesgos α y β que asumiremos, añadiendo un 10% de pérdidas.
Existen múltiples calculadoras on line que hallan el tamaño muestral. Una de las más conocidas en nuestro entorno es la calculadora de tamaño muestral GRANMO13.
Como ejemplo, el tamaño de la muestra del estudio de las anastomosis intra y extracorpóreas en las hemicolectomías derechas12 se ha calculado tomando la dehiscencia anastomótica (DA) como la variable principal. Se estima la DA del 8% en el grupo extracorpórea y del 2% en el grupo intracorpórea, con un riesgo α de 0,05 y 1 – β de 0,9, y una pérdida del 10%. El número estimado de casos a incluir es de 208 pacientes por grupo, por lo que el tamaño muestral es de 416 pacientes.
Cálculo muestral en estudio multicéntrico prospectivo, controlado y aleatorizado de no inferioridadEn este tipo de estudios, los datos que debemos conocer son:
- –
El porcentaje de éxito con tratamiento estándar.
- –
El porcentaje del «margen de no inferioridad delta-δ».
- –
Los riesgos α y β que asumiremos, añadiendo un 10% de pérdidas.
Como ejemplo, en un estudio de nuestro grupo sobre el tratamiento con y sin antibióticos en la diverticulitis aguda no complicada14. Las condiciones de la estimación del porcentaje de éxito fueron del 90-91%, con un margen de no inferioridad delta-δ del 7%, un riesgo α de 0,025 y 1 – β de 0,8, y una pérdida del 10%. El número estimado de casos a incluir es de 230 pacientes por grupo; el tamaño muestral es de 460 pacientes.
Siguiente etapa, debemos preguntarnos: ¿será viable el estudio multicéntrico prospectivo, controlado y aleatorizado?Ahora que conocemos las dificultades del diseño y el número de pacientes a incluir en el EMPCA, debemos preguntarnos si es viable desde el punto de vista de infraestructuras, económico y de duración. Si se prolonga en exceso el estudio, este puede quedar obsoleto. De la misma manera, puede ocasionar un desgaste de todo el equipo investigador que impida finalizarlo.
Elección de centros y política de autorías en los estudios multicéntricos prospectivos, controlados y aleatorizadosMuchos EMPCA son publicitados y abiertos a todos los centros que deseen participar, pero nuestra experiencia no ha sido favorable en esta situación. Suele haber una avalancha de peticiones de centros para participar que posteriormente no reciben aprobación del estudio por su CEIC o no se recibe contestación o no incluyen a pacientes. Creemos que la elección debe ser con aquellos que conocemos y tengan un compromiso con el estudio, tanto desde el punto de vista de personas como de medios.
Otro punto importante es establecer la política de autorías para los trabajos que surjan del estudio y en la presentación de comunicaciones a congresos. Por ello, desde el inicio se debe resaltar la política del orden y el número de los autores principales (la mayoría de las revistas limitan el número de autores). Se debe generar el nombre del estudio con el grupo de todos los profesionales participantes por hospitales, siendo nombrados en el apartado de los agradecimientos. Escribir al final de las autorías: «on behalf of … group» (permite que todos los participantes tengan su reconocimiento saliendo reflejados en el PubMed).
Comités Éticos de Investigación Clínica del centro promotor y centros colaboradores. Registro internacional de ensayos clínicosLos EMPCA debe ser aprobados por el Comité de Ética e Investigación Clínica (CEIC) del centro promotor.
En este tipo de estudios, en lugar de enviar la solicitud de aprobación al CEIC, es aconsejable realizar reuniones con ellos y tener la capacidad de autocrítica con la intención de mejorar el protocolo. Gracias a estas reuniones en el estudio de las hemicolectomías derechas con anastomosis intra o extracorpóreas, nos indicaron la imposibilidad de aleatorizar, pero dieron la solución del diseño TREND12. Cuanto más elaborado sea el protocolo del estudio del centro promotor, más sencillo será la aprobación en los centros colaboradores.
En caso de utilizar medicamento en el EMPCA, deberá solicitarse el registro en la Agencia Española del Medicamento.
Todas las revistas indexadas y de alto factor de impacto solicitan previo al inicio del estudio su registro en webs internacionales de ensayos clínicos. Una de las más conocida es la clinicaltrials.gov a través de la URL: https://register.clinicaltrials.gov15. Tras su registro se obtendrá un número que servirá de identificación del estudio y todo el mundo tendrá conocimiento del desarrollo de este.
El seguro del estudioNo es necesario si el EMPCA se considera de bajo nivel de intervención y realiza una comparación de tratamientos estándar entre sí. Los procedimientos complementarios de diagnóstico o seguimiento deben entrañar un riesgo o carga adicional muy limitado para la seguridad de los sujetos, siendo mínimo comparado con el de la práctica clínica habitual16. En caso contrario, el propio CEIC solicitará que se contrate un seguro para la aprobación del estudio.
Visibilidad de los estudios multicéntricos prospectivos, controlados y aleatorizadosEs muy importante dar visibilidad a este tipo de estudios. No solo para que la comunidad internacional conozca el estudio que se realiza, sino para que gracias a ello les pueda poner en contacto con distintos grupos que estén interesados en el tema.
La visibilidad no es suficiente con el registro en webs de ensayos clínicos internacionales. Debemos intentar que se publique en revistas de PubMed indexadas. Muchas de ellas son en formato Open Access (exigen el pago de los gastos de publicación), pero existen otras con formato mixto que no ocasionan gastos añadidos.
Un ejemplo de visibilidad ha sido con un clásico estudio de nuestro grupo conocido como TAUTEM. Fue registrado en ClinicalTrial.gov en 2009; hasta su publicación en 2018, no recibimos información de otros grupos con interés por nuestro estudio17.
Creación de cuaderno de datos on linePara una correcta gestión de los datos y aleatorización automática, es fundamental la creación de una base de datos on line. Esta puede crearse a través de empresas especializadas o con una contract research organization, que es una empresa que provee todos los servicios de gestión de ensayos clínicos.
Este cuaderno on line facilita a todos los centros colaboradores que desde cualquier ordenador conectado a Internet se pueda aleatorizar al momento e introducir datos a cualquier hora del día. A los promotores les permite conocer en todo el momento la situación del estado del estudio y los resultados al momento.
Búsqueda de financiaciónTodo este trabajo no es gratuito. Además de requerir de un liderazgo por parte del investigador principal, existe mucho trabajo que se une al nuestro cotidiano. Por ello es recomendable la contratación de un «data manager», que se encargará no solo de la introducción de datos, sino de la coordinación de todas las pruebas de los pacientes y los problemas que surjan con el resto de centros.
A este personal se añaden los gastos generados por la gestión de algunos CEIC que la solicitan, la traducción al inglés y la publicación del protocolo, el contrato con la CRO, la creación, la gestión y el mantenimiento de la base de datos on line, el seguro del estudio (si se requiere), las reuniones con los centros colaboradores, el análisis estadístico de los resultados definitivos, la traducción correcta al inglés de los distintos manuscritos y comunicaciones derivados del EMPCA, la asistencia a congresos nacionales e internacionales para la presentación del estudio, los gastos de la publicación en Open Access (si lo consideramos oportuno), etc.
Para todo ello se debe buscar financiación. Podemos buscarla en sociedades científicas (Asociación Española de Cirujanos, Fundación Asociación Española de Coloproctología, Sociedad Catalana de Cirugía, etc.), Departamentos de Salud de las distintas consejerías de las comunidades autónomas, fundaciones privadas, becas del Instituto de Salud Carlos III (FISSS), becas de fondos europeos, etc.
Es importante, además de tener el protocolo, los curriculum vitae de todos los investigadores principales de cada centro; a ser posible el normalizado (CVN)18. Nos evitará, cuando tengamos que presentar una beca, perder la oportunidad de solicitarla por no disponer de los CVN.
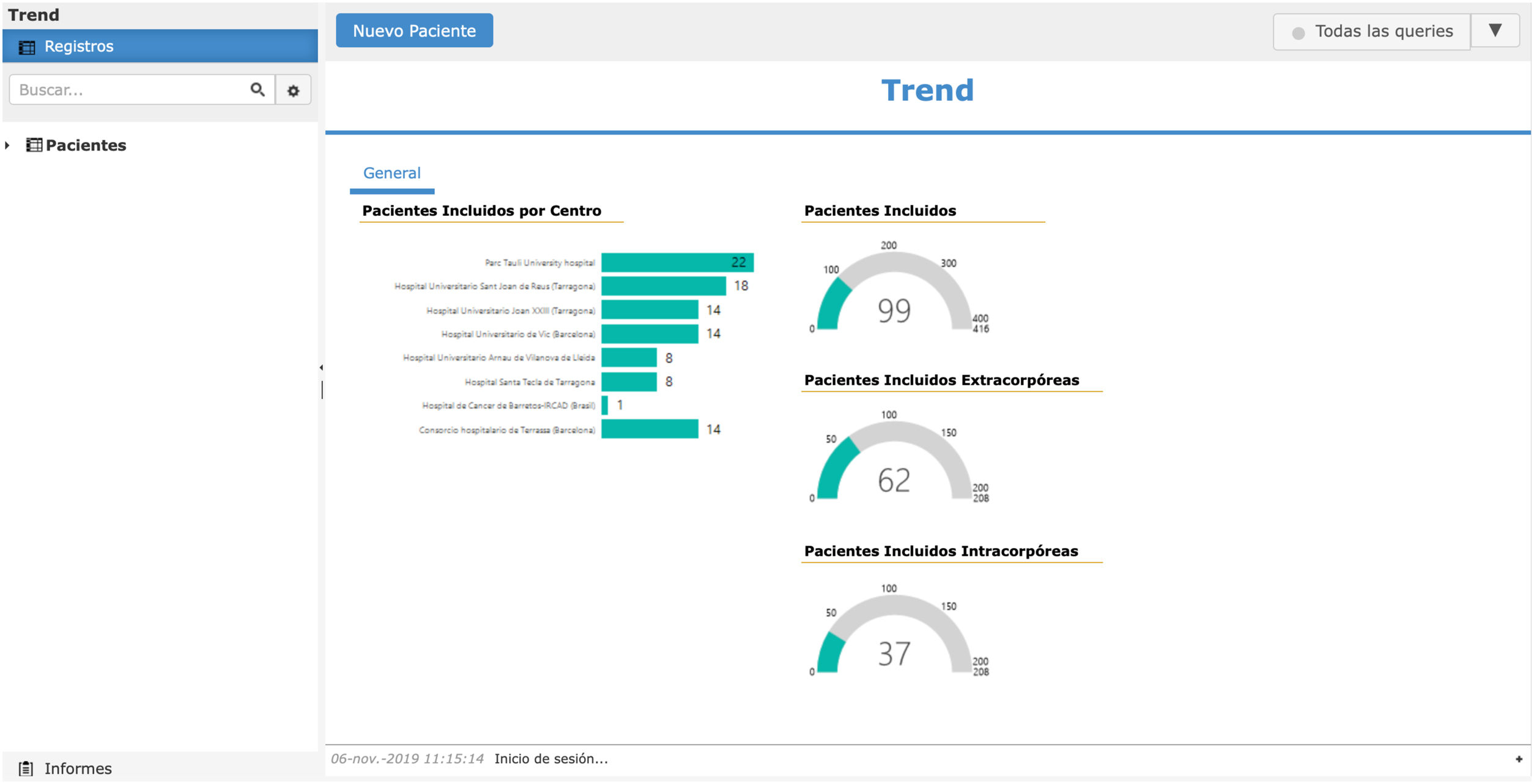
Última etapa: empezar y motivación continuada al grupoEl reto final está en terminar el estudio. Por ello, es obligación del investigador principal y del grupo promotor mantener la motivación del resto de centros colaboradores. Es muy importante tener una base de datos on line motivadora que haga que cada vez que se introduzca un paciente se conozca el estado actual del estudio (fig. 2). Es fundamental la creación de un newsletter cada 1-3 meses, con la formación de gráficos, generar objetivos, idear cumplimientos y dar resultados parciales sin comprometer sesgos de resultados.
Comentario final (fig. 3)
El objetivo de este manuscrito ha sido detallar paso a paso todas las fases del desarrollo de un EMPCA, no como una carrera de obstáculos, sino de cómo etapa a etapa es posible desarrollarlo, siempre que se cuente con un buen equipo (tabla 1).
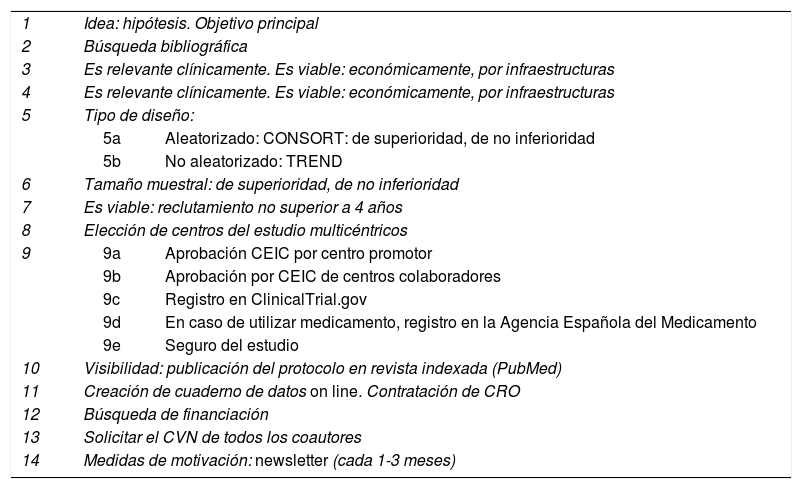
Guía-checklist de las etapas en el desarrollo de un estudio multicéntrico, prospectivo, controlado y aleatorizado
| 1 | Idea: hipótesis. Objetivo principal | |
| 2 | Búsqueda bibliográfica | |
| 3 | Es relevante clínicamente. Es viable: económicamente, por infraestructuras | |
| 4 | Es relevante clínicamente. Es viable: económicamente, por infraestructuras | |
| 5 | Tipo de diseño: | |
| 5a | Aleatorizado: CONSORT: de superioridad, de no inferioridad | |
| 5b | No aleatorizado: TREND | |
| 6 | Tamaño muestral: de superioridad, de no inferioridad | |
| 7 | Es viable: reclutamiento no superior a 4 años | |
| 8 | Elección de centros del estudio multicéntricos | |
| 9 | 9a | Aprobación CEIC por centro promotor |
| 9b | Aprobación por CEIC de centros colaboradores | |
| 9c | Registro en ClinicalTrial.gov | |
| 9d | En caso de utilizar medicamento, registro en la Agencia Española del Medicamento | |
| 9e | Seguro del estudio | |
| 10 | Visibilidad: publicación del protocolo en revista indexada (PubMed) | |
| 11 | Creación de cuaderno de datos on line. Contratación de CRO | |
| 12 | Búsqueda de financiación | |
| 13 | Solicitar el CVN de todos los coautores | |
| 14 | Medidas de motivación: newsletter (cada 1-3 meses) | |
CEIC: comité de ética e investigación clínica; CRO: contract research organization; CVN: curriculum vitae normalizado.
Todo grupo investigador tiene como objetivo poder aportar conocimiento a nuestra práctica clínica diaria y que se refleje en revistas de alto factor de impacto. Una de las formas más importantes es a través de estos EMPCA.
FinanciaciónNo se ha recibido ningún tipo de financiación para realizar este artículo.
Conflicto de interesesNinguno.
A la Junta Directiva de la AEC por la oportunidad de desarrollar este artículo. A todos los miembros del Servicio de Cirugía General y Aparato Digestivo del Hospital Universitario Parc Taulí, la Fundación de Investigación Parc Taulí y a todos los centros colaboradores de los estudios multicéntricos por su colaboración inestimable.
Salvador Navarro Soto, Raquel Sánchez Santos, Luís Sabater Ortí, Manuel Pera Román, Victor Soria Aledo, Eduardo M. Targarona Soler, Xavier Serra Aracil.
José Luis Ramos Rdriguez, María Socas Macías, Sergio Moreno, Ignacio Rey Simó, Sandra García Botella, Helena Vallverdú, Inés Rubio, Laura Armananzas, Ivan Arteaga, J.M. Miguelena, Vicenç Artigas Raventos, Enrique Mercader, Dieter Morales García, Monica Millan, María Dolores Frutos, Gonzalo de Castro, Manuel López Cano, Baltasar Pérez Saborido, Itziar Larrañaga, Xavier Serra Aracil.