Introducción
El cáncer colorrectal es una patología frecuente y ocupa un lugar importante en el quehacer diario del cirujano general, y el cáncer de recto es el que más dificultades técnicas suscita a la hora del tratamiento quirúrgico. Ello se debe a su localización en el anillo pélvico, a sus relaciones anatómicas y a su continuidad con el mecanismo esfinteriano anal. Todo ello hace que la incidencia de complicaciones intra y postoperatorias, conservación esfinteriana, recidiva local y supervivencia varíe considerablemente entre los cirujanos1-5. En los últimos años, se han introducido cambios en el tratamiento que han mejorado los resultados, como la utilización de grapadoras de autosutura, la extirpación total del mesorrecto y la radioquimioterapia adyuvante y posteriormente neoadyuvante. En lo referente a la radioquimioterapia neoadyuvante, por un lado facilita la cirugía del cáncer de recto mediante la disminución del tamaño y el volumen tumoral, y por otro disminuye las recidivas locales, y esto hace que los resultados puedan ser mejores, tanto en manos de cirujanos expertos en cirugía colorrectal como de cirujanos con menor entrenamiento en esta cirugía, y puede existir controversia acerca de si el factor cirujano puede influir en los resultados del tratamiento quirúrgico del cáncer de recto tratado con radioquimioterapia preoperatoria.
El objetivo de este trabajo es valorar el papel del factor cirujano en los resultados del tratamiento quirúrgico del cáncer de recto a corto-medio plazo en pacientes que previamente han sido sometidos a radioquimioterapia preoperatoria.
Pacientes y métodos
Pacientes
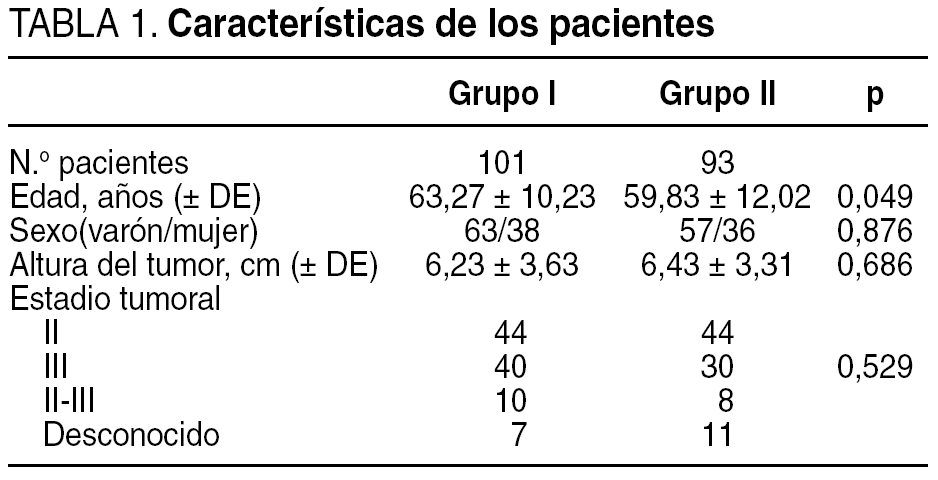
Se incluyeron 194 pacientes intervenidos, de forma consecutiva entre enero de 1998 y julio de 2004, de cáncer de recto y sometidos a radioquimioterapia preoperatoria. Los criterios de inclusión fueron: tumor primario de recto localizado entre 1 y 15 cm desde los márgenes del ano; estadios II y III; menos de 75 años, y sin contraindicación para la radioquimioterapia preoperatoria. En el examen preoperatorio se realizó una exploración clínica, analítica general con CEA, rectocolonoscopia total con biopsia, enema opaco baritado en el caso de que la rectocolonoscopia fuera incompleta, sigmoidoscopia rígida, ecografía endorrectal y tomografía computarizada (TC) toracoabdominal. Los cirujanos se dividieron en 2 grupos según el volumen de intervenciones realizadas: grupo I, compuesto por 3 cirujanos con más de 12 intervenciones realizadas por año, bien como cirujano principal o ayudante, y grupo II, 16 cirujanos con menos de 12 intervenciones realizadas por año, bien como cirujano principal o ayudante. Esta categorización se realizó de acuerdo con el trabajo de Hermanek y Hohenberger6, quienes estimaron que un volumen de 1 o 2 intervenciones por mes de cáncer de recto son necesarias para obtener unos resultados adecuados a corto y largo plazos.
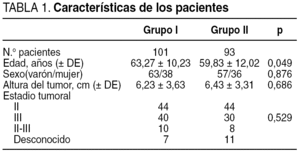
El grupo I estaba compuesto por 101 pacientes, de los que 63 eran varones y 38 mujeres, con una media de edad de 63,27 ± 10,23 años (32-79). La distancia media del tumor fue de 6,23 ± 3,63 cm. En 44 (44%) pacientes el tumor se localizó entre 0 y 5 cm, en 46 (45%) entre 6 y 10 cm, y en 11 (11%) entre 11 y 15 cm. En 44 (43%) pacientes se evidenció preoperatoriamente un estadio II, en 40 (40%) un estadio III y en 17 (17%) no se pudo constatar el estadio tumoral por no realizar la ecografía endorrectal preoperatoria en 7 pacientes o ser incompleta por estenosis tumoral en 10.
El grupo II estaba compuesto por 93 pacientes, de los que 57 eran varones y 36 mujeres, con una media de edad de 60,47 ± 12,02 años (24-80). La distancia media del tumor fue de 6,43 ± 3,31 cm. En 37 (40%) pacientes el tumor se localizó entre 0 y 5 cm, en 48 (51%) entre 6 y 10 cm y en 8 (9%) entre 11 y 15 cm. En 44 (48%) pacientes se evidenció preoperatoriamente un estadio II, en 30 (33%) un estadio III y en 18 (19%) no se pudo constatar el estadio tumoral por no realizar la ecografía endorrectal preoperatoria en 11 pacientes o ser incompleta por estenosis tumoral en 8.
Radioquimioterapia
La pauta de radioterapia fue de ciclo largo con acelerador lineal, y se aplicó una dosis total de 45 Gy a dosis de 1,8 Gy/día, 5 días a la semana durante 5 semanas, en 3 campos. Se asoció quimioterapia con 5-fluor uracilo 25 mg/m2/día más ácido folínico 20 mg/m2/día, durante el tiempo que duraba la radioterapia.
Cirugía
La cirugía se realizó 4-6 semanas después de completar el tratamiento neoadyuvante. La elección de resección abdominoperineal, resección anterior baja o ultrabaja se realizó según el criterio y experiencia del cirujano. En ambos grupos de pacientes la intención inicial fue la de realizar una extirpación total del mesorrecto. La cirugía se consideró curativa si el cirujano realizaba una extirpación completa del tumor, si no existían metástasis a distancia y si el informe anatomopatológico informaba que los márgenes del espécimen estaban libres; y paliativa cuando el cirujano era consciente de dejar tumor local o cuando se hallaban metástasis hepáticas o peritoneales durante la intervención quirúrgica. La ileostomía temporal se realizó según criterio del cirujano.
Seguimiento
Los pacientes fueron controlados en consulta cada 3 meses el primer año y cada 6 meses los siguientes 4 años. En cada control se realizó un examen clínico, analítica general con CEA. Cada 6 meses una ecografía y radiografía de tórax y anualmente colonoscopia y TC abdominopélvica. El seguimiento se realizó en el 100% de los pacientes. La recurrencia local se definió como la recurrencia en la pelvis, se excluyeron las metástasis en los ovarios; la muerte en presencia de recidiva local o con metástasis se definió como el fallecimiento relacionado con tumor, y la muerte sin evidencia de recurrencia tumoral local o a distancia se definió como muerte no relacionada con tumor.
Método estadístico
Los datos se procesaron con el paquete estadístico SPSS 10.0 para Windows. Las comparaciones de 2 medias en muestras independientes con el test de la t de Student. Para el estudio de la relación entre variables cualitativas y la comparación de proporciones en muestras independientes se realizó un análisis de tablas de contingencia mediante el test χ2 de Pearson, y el subsiguiente análisis de residuos, mediante el que se valoró si el porcentaje de un resultado en algún grupo difería de manera significativa respecto al porcentaje global en la muestra. Por último, se realizó un análisis de supervivencia para analizar la mortalidad en el seguimiento de estos pacientes y su relación con diversos factores. En segundo lugar, las muertes por causas distintas de la enfermedad en estudio se trataron como datos censurados en el momento de la muerte. Se calcularon las tasas de supervivencia mediante el método de estimación de Kaplan-Meier en los diferentes grupos y las curvas de supervivencia se compararon con el test de Breslow. Los datos de supervivencia de cada grupo se resumen mediante sus tasas de supervivencia media y sus errores estándar.
De manera similar, se ha realizado el análisis de supervivencia para el intervalo libre de enfermedad (ILE), donde el evento de interés no es la muerte del paciente sino la aparición de recidiva y/o metástasis, recidiva local y metástasis hepáticas.
Resultados
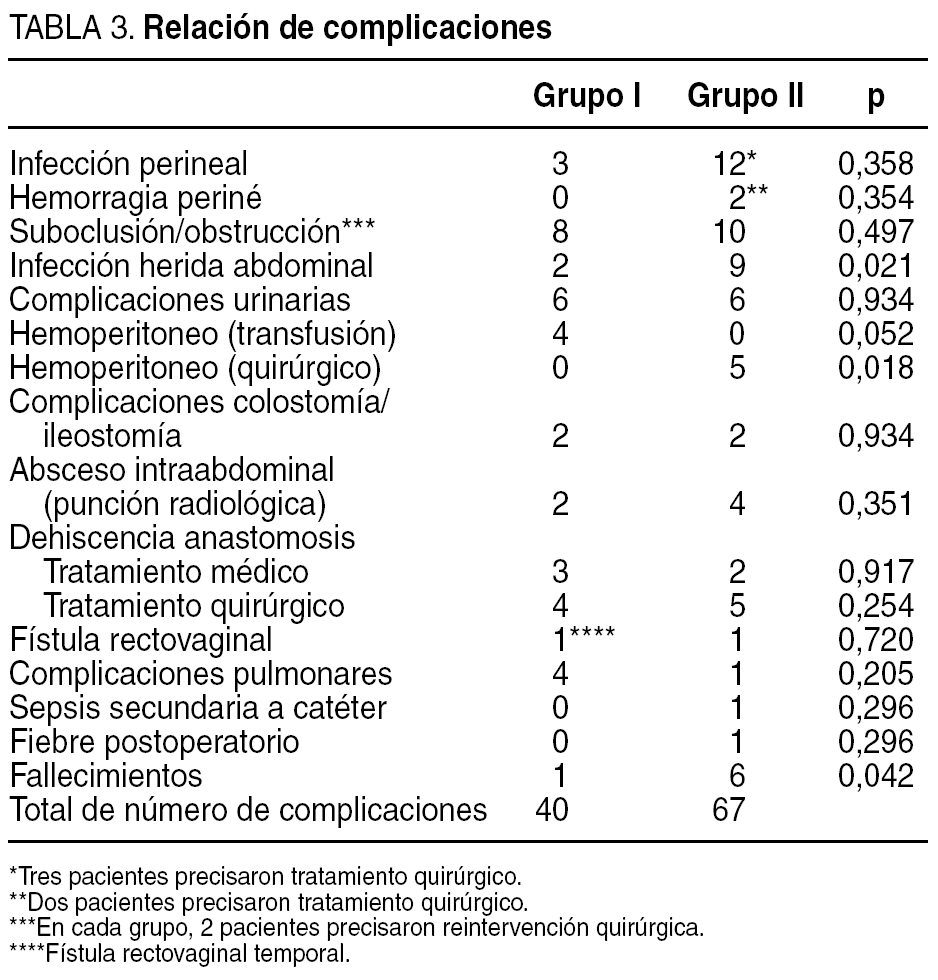
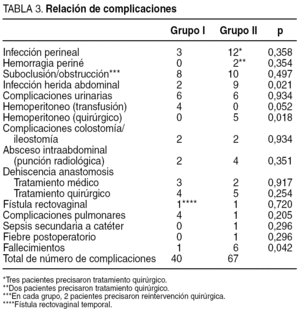
Los 2 grupos de pacientes fueron homogéneos en cuanto a edad, sexo, localización del tumor y estadio tumoral (tabla 1). La cirugía fue curativa en 173 (89%) pacientes (grupo I: 87 [86%] pacientes, y grupo II: 86 [92%]) y paliativa en 21 (11%) (grupo I: 14 [14%] pacientes, y grupo II: 7 [8%]) (p = 0,337). Los cirujanos del grupo I realizaron una cirugía conservadora de esfínteres en 78 (77%) pacientes y los del grupo II en 48 (52%) (p < 0,001) (tabla 2). En los pacientes del grupo I se realizó una resección anterior en el 100, 100 y 58% cuando el tumor se localizaba entre 11 y 15, 6 y 10, y 1 y 5 cm, respectivamente, frente a 100, 69 y 23,5% en el grupo II. Hubo complicaciones en 79 (41%) pacientes: 34 (34%) del grupo I y 45 (48%) del grupo II (p = 0,037) (tabla 3). Las complicaciones se dividieron en 4 grupos según su gravedad7, y únicamente hubo diferencias significativas en las complicaciones grado IV (fallecimiento del paciente: grupo I, 1 dehiscencia anastomótica, y grupo II, 3 dehiscencias anastomóticas, 1 absceso intraabdominal, 1 hematoma pélvico infectado y 1 hemoperitoneo) (p = 0,042) (tabla 4). Se dejó ileostomía temporal en 43 (55%) pacientes del grupo I y en 6 (12%) del grupo II (p < 0,001).
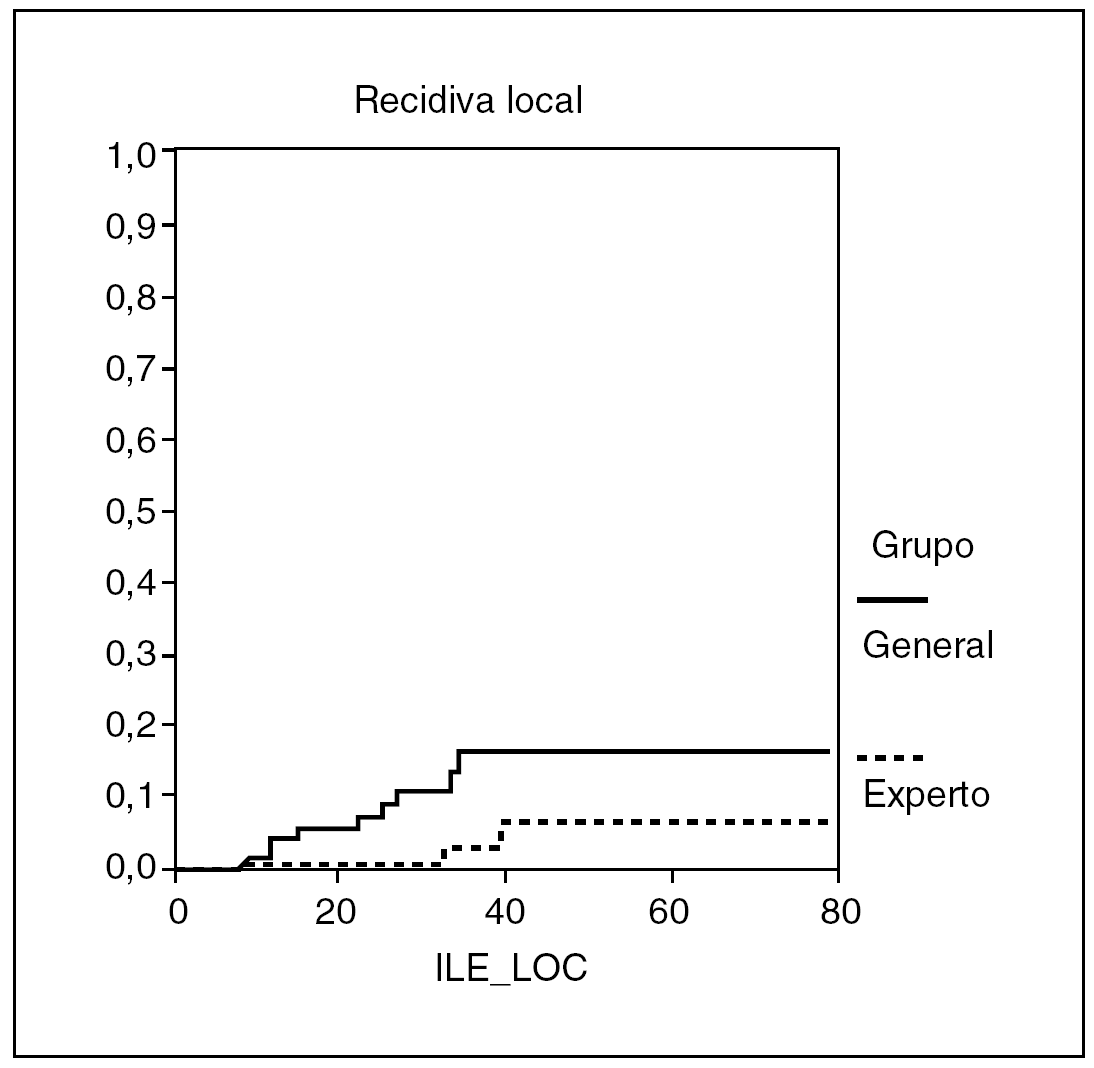
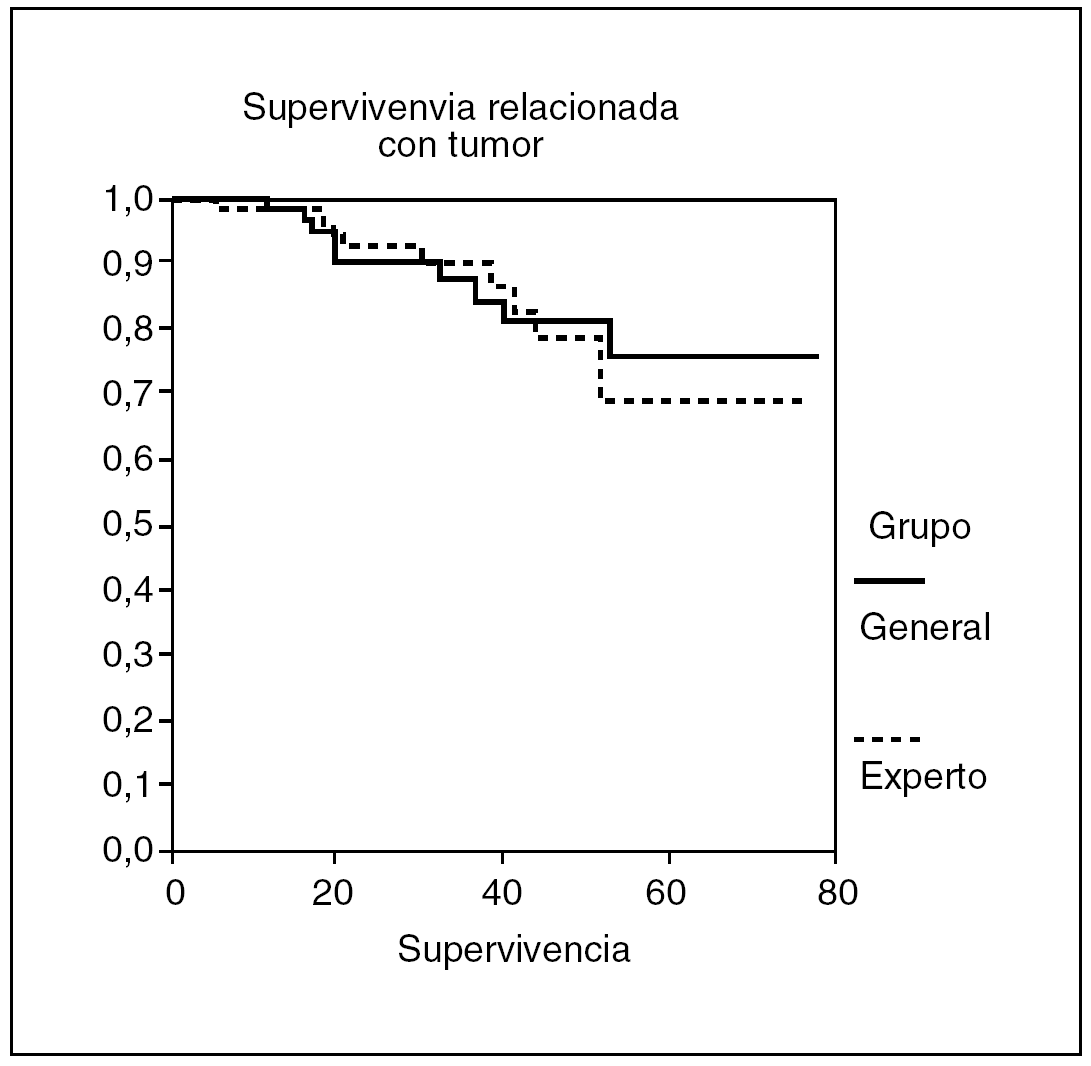
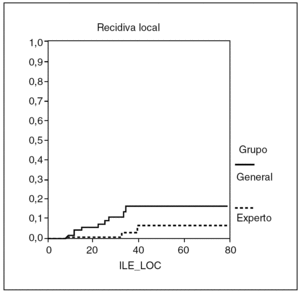
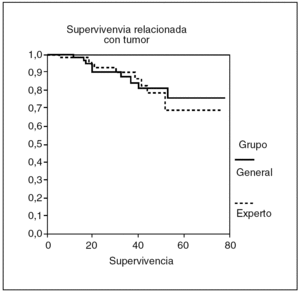
La estancia hospitalaria fue de 9,9 ± 6,8 días (3-36) en el grupo I y de 13,9 ± 8,2 días (5-48) en el grupo II (p < 0,001). Con un seguimiento medio de 37 meses para el grupo I y de 38 meses para el grupo II, presentaron recidiva local 3 (3,5%) pacientes del grupo I y 9 (11,3%) del grupo II, y la estimación de recidiva local según la curva de Kaplan Meyer fue del 1,4 y el 6,4% a los 2 y 5 años para el grupo I, y del 7,5 y el 16,6% para en grupo II (fig. 1), con diferencias próximas a la significación (p = 0,054). La supervivencia fue similar en ambos grupos: 87,7% en el grupo I y 82,2% en el grupo II, y la estimación de supervivencia según la curva de Kaplan Meyer fue del 92,3 y el 68,9% a los 2 y 5 años, respectivamente, para el grupo I, y del 90 y el 75,7% en el grupo II, sin diferencias significativas (fig. 2).
Fig. 1. Recidiva local.
Fig. 2. Supervivencia relacionada con tumor
Discusión
Numerosos estudios han demostrado la relación entre el factor cirujano y los resultados a corto-largo plazo en distintas patologías o técnicas quirúrgicas como cáncer de páncreas, cáncer de esófago, tiroidectomía, resección hepática, mastectomía, cirugía bariátrica y prostatectomía8-14, y han comprobado que la experiencia del cirujano tiene un impacto decisivo en la morbimortalidad y la supervivencia. Del mismo modo, en el tratamiento quirúrgico del cáncer colorrectal y, más específicamente, en el cáncer de recto, diferentes estudios han puesto de manifiesto que el cirujano es un factor pronóstico independiente, que influye en el riesgo de morbimortalidad, recurrencias y supervivencia1-5. Ello se debe a que la gran mayoría de cirujanos no especializados en cirugía colorrectal intervienen un bajo número de pacientes al año, y no adquieren la experiencia suficiente para realizar una cirugía ortodoxa, correcta y pautada, y en muchas ocasiones efectúan una disección roma, sin visión de las diferentes fascias, planos y estructuras nerviosas presacras, sin extirpación total del mesorrecto, y todo ello puede comprometer los resultados del tratamiento quirúrgico del cáncer de recto, al valorar la tasa de cirugía conservadora de esfínteres las complicaciones postoperatorias, la incidencia de recidiva local y la supervivencia.
Uno de los aspectos importantes, principalmente para el paciente, en el tratamiento del cáncer de recto es la realización de una cirugía conservadora de esfínteres que respete los principios oncológicos establecidos. Su incidencia aumentó con al utilización de mecanismos de autosutura mecánica que permitió realizar anastomosis bajas, donde la mano del cirujano no llegaba. La realización de una cirugía conservadora de esfínteres ha mejorado en los últimos años debido, por un lado, a la utilización de la radioquimioterapia preoperatoria, que disminuye el volumen tumoral y hace más accesible el cáncer de recto, al estar éste encerrado en el anillo pélvico y, por otro lado, a la extirpación total del mesorrecto porque la disección bajo visión directa del suelo pélvico facilita las anastomosis bajas con grapadora o manual por vía perineal. Si además se asocia cirujanos con experiencia en cirugía colorrectal, esta incidencia aumenta, como ha ocurrido en nuestro estudio al pasar del 52% de cirugía conservadora de esfínteres en el grupo de cirujanos con poca experiencia en cirugía colorrectal al 78% en los cirujanos con experiencia. Estas diferencias se aprecian en los dos tercios inferiores, donde el porcentaje de cirugía conservadora de esfínteres es mayor en el grupo I, mientras que en el tercio superior todos los pacientes recibieron una RA.
El que la utilización de neoadyuvancia aumente la cirugía conservadora de esfínteres no es un aspecto en el que todos los autores estén de acuerdo. Palman y otros autores no modifican la técnica a pesar del tratamiento15-17, y esto se debe a que utilizan la pauta corta (25 Gy en 5 días) donde la cirugía se realiza inmediatamente, por lo que no da tiempo a que se produzca la disminución del volumen tumoral. Sin embargo, otros autores defienden que la neoadyuvancia aumenta la cirugía conservadora de esfínteres18,19, y en estos casos emplean la pauta larga asociada a quimioterapia, por lo que la reducción del volumen tumoral es más patente y permite un mejor acercamiento a la pelvis.
La incidencia de recurrencia local es, en gran medida, el parámetro más utilizado para valorar la calidad de la cirugía del cáncer de recto. La gran mayoría aparece antes de los 2 años, aunque cuando el paciente es sometido a radioquimioterapia preoperatoria se retrasa su aparición. Cuando ocurre una recidiva local es una auténtica catástrofe para el paciente y un reto para el cirujano, debido a que sólo un porcentaje pequeño de pacientes se pueden someter a cirugía y ésta la deben realizar cirujanos muy especializados. La incidencia de recidiva local varía ampliamente entre las series publicadas y ello está relacionado con varios factores. Uno de ellos es la utilización del tratamiento adyuvante, principalmente la radioquimioterapia preoperatoria, que produce una disminución significativa de recidivas locales al pasar de una incidencia del 21-38% en pacientes sin radioterapia preoperatoria20-22 a tasas del 3-17% en pacientes sometidos a tratamiento neoadyuvante23-25. Otro factor que está relacionado con la recidiva local es la extirpación total del mesorrecto, de la que se han publicado series con tasas de recidiva local < 6%3. Finalmente, otro de los factores que más se ha relacionado con la incidencia de recidiva local es el factor cirujano, que se puede explicar por un mayor hábito y mejora de la habilidad quirúrgica de los cirujanos con experiencia en cirugía colorrectal, al realizar estas intervenciones de forma cotidiana. En este sentido, si la recurrencia local mejora la supervivencia, como algunos estudios han demostrado, la especialización en cirugía colorrectal puede tener impacto en la supervivencia.
Como se ha visto, con la introducción de la extirpación total del mesorrecto se ha conseguido mejorar los resultados, principalmente en lo referente a una disminución de la incidencia de recidiva local, y de igual manera la terapéutica adyuvante, principalmente la radioquimioterapia preoperatoria que ha mejorado la incidencia de recidiva locales y en algunos trabajos la supervivencia. Para mejorar aún más estos resultados, la gran mayoría de autores argumentan que la especialización del cirujano en coloproctología y el volumen de pacientes que se intervienen, son factores decisivos en los resultados del tratamiento quirúrgico del cáncer de recto. El Stockholm Colorectal Cancer Study Group26, que previamente había demostrado que la radioterapia preoperatoria mejoraba los resultados en el tratamiento quirúrgico del cáncer de recto al disminuir el número de recidivas locales y aumentar la supervivencia, comprobó que estos resultados pueden mejorar si a los cirujanos se les somete a un aprendizaje en la extirpación total del mesorrecto. Así, tras este aprendizaje, la incidencia de cirugía conservadora de esfínteres mejoró del mismo modo que la recurrencia local y mortalidad relacionada con el cáncer.
En lo referente a las complicaciones postoperatorias, al igual que ocurre con la recidiva local y cirugía conservadora de esfínteres, éstas pueden mejorar cuando los pacientes son tratados por cirujanos con experiencia en cirugía colorrectal. En otros estudios4, al igual que nosotros, se ha comprobado que la tasa total de complicaciones es menor en el grupo tratado por cirujanos expertos en cirugía colorrectal. De estas complicaciones, señalar que existieron diferencias en el grado IV, que son las complicaciones graves que llevan al paciente al fallecimiento. Con relación a la infección de la herida perineal, se ha visto que es mayor en pacientes que reciben radioquimioterapia preoperatoria al compararlos con los que no reciben ningún tipo de terapia preoperatoria27, aunque en otros trabajos la incidencia de infecciones de la herida perineal es similar28. En nuestro estudio existe una disminución en la incidencia de infecciones de herida perineal debido a una disminución en el porcentaje de resecciones abdominoperineales que se producen en el grupo de cirujanos con experiencia en cirugía colorrectal. Por el contrario, uno de los efectos adversos del aumento de la cirugía conservadora de esfínteres es el aumento de fugas anastomóticas. Para evitar el peligro que supone una sepsis oculta debida a una fuga anastomótica, es recomendable, cuando se realiza una extirpación total del mesorrecto con anastomosis ultrabaja, la realización de una derivación temporal del tránsito a través de la anastomosis, bien con ileostomía o con colostomía29. En nuestro estudio se pone de manifiesto la importancia de la derivación temporal del tránsito, donde el grupo de cirujanos con experiencia en cirugía colorrectal realizan con mucha más frecuencia derivaciones temporales, frente al grupo de cirujanos con poca experiencia en cirugía colorrectal, y esto redunda en un aumento de complicaciones graves debido a la dehiscencia anastomótica, al existir en el primer grupo 1 fallecimiento que se debió a una dehiscencia anastomótica, pese a llevar una ileostomía de protección, y en el segundo grupo 3 fallecimientos por dehiscencia anastomótica sin ileostomía de protección.
De este estudio se desprende que en los resultados del tratamiento quirúrgico del cáncer de recto no sólo influyen las características anatomopatológicas del tumor, la terapia neoadyuvante y la meticulosidad de la cirugía, sino que la experiencia del cirujano colorrectal es un factor decisivo y fundamental en los resultados, con la valoración de las complicaciones, la incidencia de cirugía conservadora de esfínteres y la recidiva local. Es por ello que este tipo de pacientes deberían ser intervenidos por cirujanos expertos pertenecientes a una unidad de cirugía colorrectal, que realizan este tipo de intervenciones de una forma cotidiana y habitual, y no por cirujanos que la realizan de forma aislada y ocasional. En el caso de no existir estas unidades en el hospital, se debería formar a algún miembro del equipo en el tratamiento quirúrgico del cáncer de recto para mejorar los resultados en esta patología.
Correspondencia: Dr. J.A. Luján.
Servicio de Cirugía General.
Hospital Universitario Virgen de la Arrixaca.
30120 El Palmar. Murcia. España.
Correo electrónico: juanlujan@telefonica.net
Manuscrito recibido el 3-2-2005 y aceptado el 30-6-2005.