Introducción. Evaluamos la influencia de diferentes variables clínicas, patológicas y terapéuticas sobre la supervivencia tras gastrectomía con intención curativa en pacientes con adenocarcinoma gástrico.
Pacientes y métodos. Entre 1985 y 1992, 202 pacientes fueron gastrectomizados por adenocarcinoma gástrico, 108 (53,4%) con intención curativa. Los datos clinicoterapéuticos fueron obtenidos retrospectivamente de las historias clínicas, y los patológicos de la revisión de sus preparaciones. El análisis estadístico utilizado fue el test de rangos logarítmicos (análisis univariante) y el modelo de regresión de Cox (análisis multivariante), siendo la variable dependiente el tiempo de supervivencia.
Resultados. La tasa de supervivencia a los 5 años fue del 55%. Los datos de mal pronóstico en el análisis univariante fueron: afectación difusa del estómago o localización proximal, práctica de esplenectomía, transfusión perioperatoria, presencia de microinvasión capilar, grado de T y estadio tumoral avanzado, edad mayor de 65 años, afectación ganglionar y desarrollo de complicaciones postoperatorias. En el análisis multivariante, estas tres últimas variables emergen como factores pronósticos desfavorables independientes para la supervivencia.
Conclusiones. Edad avanzada, afectación ganglionar y morbilidad postoperatoria son factores que influyen desfavorablemente en la supervivencia de pacientes con adenocarcinoma gástrico resecado con intención curativa.
Introduction. We evaluate the influence of several clinical, pathological and therapeutic variables on survival after gastrectomy with curative intent in patients with gastric adenocarcinoma.
Patients and methods. Between 1985 and 1992, 202 patients underwent gastrectomy to treat gastric adenocarcinoma, with curative intent in 108 cases (53.4%). The clinical and therapeutic data were obtained retrospectively from the clinical records and pathological findings were collected by reviewing the tissue preparations. The statistical study consisted of the log-rank test for univariate analysis and Cox's regression model for multivariate analysis, where the dependent variable was the survival time.
Results. The five-year survival rate was 55%. Findings associated with poor prognosis in the univariate analysis were diffuse gastric involvement or proximal location, performance of splenectomy, perioperative transfusion, presence of capillary microinvasion, advanced T stage and tumor stage, age over 65 years, lymph node involvement and the development of postoperative complications. The multivariate analysis showed the latter three variables to be independent unfavorable prognostic factors in terms of survival.
Conclusions. Advanced age, lymph node involvement and postoperative morbidity have an unfavorable influence on survival of patients who undergo curative resection of gastric adenocarcinoma.
Introducción
A pesar de la disminución de incidencia del adenocarcinoma gástrico en muchos países con una alta prevalencia de esta enfermedad, sigue siendo un importante problema oncológico, a juzgar por los 670.000 nuevos casos detectados a escala mundial en 19931.
En las últimas 2 décadas se han realizado esfuerzos tendentes a identificar en pacientes con esta neoplasia parámetros pronósticos que pudieran predecir los resultados a largo plazo del tratamiento quirúrgico y ayudar a definir grupos de enfermos de alto riesgo que pudieran beneficiarse de terapias adyuvantes. Estas variables incluyen características de los pacientes, de su tumor y el tratamiento aplicado, como la edad2, localización tumoral3, afectación de ganglios linfáticos2,4, profundidad de invasión de la pared gástrica2,5, microinvasión linfática y capilar5, caracteres morfométricos y arquitecturales del tumor6, ploidía de las células tumorales7 y tipo de linfadenectomía efectuada2,8.
El presente estudio, realizado en un hospital situado en un área de incidencia media-baja de esta neoplasia, pretende analizar los resultados del tratamiento de esta enfermedad para determinar en el grupo de pacientes sometidos a una resección con intención curativa la influencia de diferentes parámetros clínicos, patológicos y terapéuticos sobre el pronóstico y tiempo de supervivencia de los pacientes.
Pacientes y método
Desde julio de 1985 a junio de 1992, 269 pacientes fueron intervenidos por adenocarcinoma gástrico en una única institución pública, de los cuales 202 (75,1%) fueron sometidos a resección. La ausencia de metástasis a distancia y de tumor residual tras la escisión quirúrgica, denominada resección R0 por la Unión Internacional Contra el Cáncer (UICC), es un factor de importancia crítica sobre la recurrencia locorregional y la supervivencia8. De los 202 enfermos gastrectomizados, en 108 (53,4%) la cirugía practicada puede ser considerada una resección curativa R0.
Se revisaron las historias clínicas de estos 108 pacientes, de los que cuatro (3,7%) se perdieron para el seguimiento. La documentación de los restantes estuvo disponible hasta junio de 1999 o hasta su fallecimiento. Excluyendo las muertes postoperatorias (ocurridas hasta 30 días después de la intervención), el tiempo medio de seguimiento fue de 3,4 años (límites, 2,5 meses y 13,8 años). Se analizaron los siguientes parámetros: edad, sexo, localización tumoral, tipo de gastrectomía y linfadenectomía llevada a cabo, asociación o no de esplenectomía, realización de transfusión perioperatoria y presencia de morbilidad postoperatoria.
Se revisaron las preparaciones histológicas de los 108 pacientes (en su defecto, se obtuvieron nuevas a partir de sus bloques de parafina de archivo). Las variables estudiadas fueron: grado de diferenciación tumoral, tipo histológico según las clasificaciones de Laurèn9, Ming10 y Oota11, presencia de microinvasión capilar, profundidad de invasión de la pared gástrica, presencia de metástasis linfáticas y estadio tumoral según la clasificación TNM12. Todos los datos fueron analizados por dos expertos patólogos, desconocedores del curso clínico posterior de los enfermos.
La supervivencia actuarial a los 5 años fue determinada mediante las curvas de supervivencia de Kaplan-Meier13. El test de rangos logarítmicos14 se usó para determinar diferencias estadísticas en el análisis univariante entre grupos estratificados según las distintas variables clínicas y patológicas. Mediante análisis de regresión logística, para el que se utilizó el modelo de Cox15, se realizó un estudio multivariante con el fin de determinar qué variables se comportaron como factores pronósticos independientes.
Tanto en el análisis univariante como en el multivariante, el nivel de significación se estableció en el 5% (p < 0,05). En ambos casos se incluyeron el tiempo de seguimiento de los casos perdidos y las muertes postoperatorias, siendo el tiempo de supervivencia postoperatoria la variable dependiente. Para el estudio estadístico se utilizó el programa SSPS, versión 6.1 (SPSS Inc., Chicago, EE.UU.).
Resultados
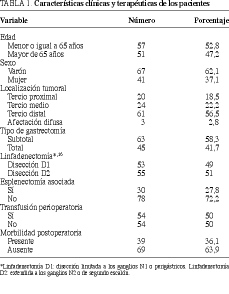
Los datos clínicos y terapéuticos de los 108 pacientes sometidos a una resección R0 se resumen en la tabla 1. La edad media fue de 62,9 años (desviación estándar de 12,4). El tipo de gastrectomía estuvo determinado por la localización tumoral: se realizó gastrectomía subtotal en el 83% de las neoplasias distales, mientras que la gastrectomía total fue la técnica más común (en el 70,1% de los casos) para las otras localizaciones. El número de cirujanos participantes fue de nueve.
En 10 pacientes con tumores de la unión esofagogástrica se asoció esofagectomía distal, y en 7 de los 30 sometidos a esplenectomía se realizó pancreatectomía distal. Tras gastrectomía total, las técnicas reconstructivas más empleadas fueron la de Billroth II (74,6% de los casos) y la gastroyeyunostomía en "Y" de Roux (19%), mientras que tras gastrectomía total se realizó generalmente una esofagoyeyunostomía en "Y" de Roux (75,5% de los casos).
Aparecieron complicaciones postoperatorias en 39 enfermos (36,1%). De los 108 pacientes, un 11% presentaron problemas respiratorios, un 10,1% dehiscencia anastomótica, un 5,6% abscesos intraabdominales, un 3,8% problemas en la herida operatoria, un 2,8% hemorragia digestiva o intraabdominal y un 2,8% trastornos cardiovasculares. Nueve enfermos (8,3%) requirieron reintervenciones en el período postoperatorio. La mortalidad postoperatoria ascendió al 6,5%. En pacientes con tumores en estadio I, la tasa de morbilidad fue del 17,8% y la mortalidad nula. En el estadio II, estas cifras fueron del 38,7 y del 3,2%, respectivamente. En el estadio III aparecieron complicaciones en el 36,6%, y la tasa de mortalidad ascendió al 7,3%. Por último, en el estadio IV, ambas cifras ascienden hasta el 85,5 y el 37,5%, respectivamente.
Por lo que respecta a los datos del estudio histopatológico, éstos se encuentran reflejados en la tabla 2. Debido a la presencia de metástasis hepáticas o peritoneales resecadas en la intervención, 6 pacientes (5,5%) fueron incluidos en la categoría M1 de la clasificación TNM.
Según las curvas de Kaplan-Meier, la tasa de supervivencia a los 5 años fue del 55% (si se incluyen las resecciones paliativas R1 y R2, este porcentaje desciende al 29%). Datos clínicos y terapéuticos de mal pronóstico con significación estadística en el análisis univariante fueron la edad mayor de 65 años (p < 0,001), la afectación difusa del estómago o la localización proximal (p = 0,03), la práctica de esplenectomía (p = 0,03), la realización de transfusión perioperatoria (p = 0,04) y el desarrollo de complicaciones postoperatorias (p = 0,005). Para los parámetros histopatológicos, el mal pronóstico en el análisis univariante va ligado a la microinvasión capilar (p = 0,04), invasión en profundidad de la pared gástrica (p = 0,002), presencia de afectación ganglionar (p < 0,001) y estadio TNM avanzado (p < 0,001).
El análisis de regresión múltiple (tabla 3) reveló tres variables independientes con capacidad para predecir la supervivencia después de la resección curativa de un carcinoma gástrico: edad, desarrollo o no de complicaciones postoperatorias y afectación ganglionar. Los datos que tuvieron mayor significación desfavorable fueron la edad mayor de 65 años y la infiltración de ganglios linfáticos de segundo escalón o N2.
Discusión
La detección de caracteres clínicos, patológicos o relacionados con el tratamiento que puedan predecir la evolución de pacientes con adenocarcinoma gástrico es el objetivo de numerosos estudios publicados en las últimas décadas. La identificación de dichos factores pronósticos permitiría obtener agrupaciones homogéneas de pacientes y definir grupos de alto riesgo donde aplicar disecciones más extensas o terapias adyuvantes.
Para la mayoría de autores actuales, el factor pronóstico individual más importante en esta neoplasia es la ausencia o presencia de tumor residual después de una adecuada exéresis quirúrgica8. Para intentar obtener una serie de enfermos lo más homogénea posible, en el estudio sólo se han incluido pacientes sometidos a una resección con intención curativa, sin evidencia macro o microscópica de tumor residual.
Nuestros datos sugieren que ni el sexo ni el tipo de gastrectomía efectuada (total o subtotal) tienen efecto sobre la supervivencia, resultado similar al obtenido en amplias series recientemente publicadas2,17.
La linfadenectomía practicada no ha presentado influencia pronóstica en este estudio, en el que no se han estratificado los pacientes en función de su estadio y la afectación ganglionar, al igual que en el estudio de Bonenkamp et al16. Es posible que la eficacia de la linfadenectomía ampliada (D2) dependa de estos factores: se ha demostrado8 que ésta no tiene influencia en la supervivencia a largo plazo en estadios I, III o IV, pero la mejora en tumores en estadio II, tanto en el subgrupo T2N1 como en el T3N0. Con respecto a este último, en 2 trabajos recientes2,18, la disección D2 también benefició a pacientes en situación N0, probablemente debido a la enfermedad ganglionar microscópica no detectada en exámenes histológicos rutinarios.
Por otra parte, ni el grado de diferenciación tumoral ni ninguna de las clasificaciones histopatológicas usuales han presentado ninguna capacidad predictiva sobre la supervivencia, lo que indicaría la necesidad de una nueva clasificación histológica con implicaciones pronósticas.
En relación con la localización tumoral, las neoplasias de tercio proximal o que afectan difusamente al órgano presentaron en el estudio univariante un significativo peor pronóstico que las localizadas en otras áreas, aunque en el estudio multivariante esta variable se comportó como dependiente, al igual que en el trabajo de Siewert et al8. Es muy posible que las diferencias se deban a un estadio más avanzado de los tumores proximales o difusos con respecto a los de tercio medio o distal. El efecto desfavorable de la esplenectomía en la supervivencia puede estar también mediado por factores como la estadificación tumoral17, y desaparece como factor independiente en el análisis multivariante.
La influencia de la transfusión perioperatoria sobre el pronóstico de los enfermos oncológicos ha sido estudiada en relación con diferentes neoplasias. Su efecto inmunosupresor, favorecedor de las recidivas, estaría mediado por una alteración en la función de macrófagos y células T19. Aunque Vamvakas20, en 1995, en un metaanálisis sobre series no aleatorizadas de pacientes sometidos a resección de un adenocarcinoma gástrico, encontró un riesgo de recurrencia tumoral o muerte 2,5 veces superior en pacientes transfundidos, no existen evidencias de estas diferencias cuando se analizan ensayos clínicos aleatorizados19. En la presente serie, la transfusión, relacionada en el estudio univariante con un significativo peor pronóstico a largo plazo, no se ha comportado como una variable independiente.
Otros estudios han resaltado la importancia pronóstica de la microinvasión linfática2,5,18 y capilar3,5. En esta serie se estudió esta última, detectándose un peor pronóstico para los pacientes con invasión vascular en sus especímenes de resección. Tampoco este factor se comportó en el análisis multivariante como variable independiente, a diferencia de lo obtenido en los trabajos de Kajiyama3 y Michelassi5.
Las tres variables con capacidad predictiva independiente en nuestro estudio han sido la edad, la afectación ganglionar y la morbilidad postoperatoria. Con respecto a la primera, la edad geriátrica está lastrada por una mayor incidencia de neoplasias avanzadas, enfermedades concomitantes y complicaciones postoperatorias, aunque Bittner et al21 encontraron similar morbilidad, mortalidad y supervivencia a los 5 años entre menores de 70 años y enfermos mayores sin enfermedades concomitantes en el momento de la intervención.
Hoy día existen evidencias de que el pronóstico del cáncer gástrico está íntimamente relacionado con la ausencia o presencia de metástasis en los ganglios linfáticos8,18,22. La proporción de ganglios afectados sobre el total de analizados8 y el número absoluto de ganglios infiltrados22 han sido citados como factores predictivos de supervivencia. Este último es el factor que estratifica a los pacientes en diferentes niveles de la variable N en la última edición de la clasificación TNM23. El diagnóstico y el tratamiento quirúrgico precoz del proceso, con vistas a resecar tumores con una enfermedad ganglionar ausente o incipiente, resulta por tanto de gran importancia para la mejora de nuestros resultados.
La tercera variable independiente ha sido el desarrollo de complicaciones postoperatorias. En esta serie estuvieron presentes en la evolución de 39 (36,1%) de los 108 enfermos, y siete (6,5%) murieron en el postoperatorio. En el estudio mul ticéntrico del Grupo Alemán para el Estudio del Cáncer Gástrico8, la presencia de morbilidad postoperatoria fue el segundo factor pronóstico independiente desfavorable para la supervivencia a largo plazo, tras la afectación ganglionar. A pesar de los avances en técnicas quirúrgicas, anestesia, nutrición y cuidados postoperatorios de los últimos 20 años, la tasa de mortalidad en cirugía gástrica por cáncer en series occidentales permanece entre el 5,1% del estudio multicéntrico de Siewert et al8 y el 7,8%, de acuerdo con la revisión de Macintyre24. Una adecuada selección de los pacientes candidatos a resección gástrica (la morbimortalidad aparece fundamentalmente en pacientes con tumores en estadios avanzados), junto con la corrección de los factores de riesgo preoperatorios y la detección y tratamiento temprano de las complicaciones postoperatorias son, pues, fundamentales también para obtener mejoras a largo plazo.
En conclusión, el pronóstico de los pacientes de esta serie, afectados de un adenocarcinoma gástrico, se ha visto influido por factores relacionados con el enfermo (edad), su tumor (grado de afectación ganglionar) y el tratamiento aplicado (resección curativa o paliativa y desarrollo o no de complicaciones postoperatorias).