El tratamiento actual de la colecistitis aguda litiásica (CAL) es la colecistectomía laparoscópica precoz, asociada a una antibioticoterapia empírica apropiada. La prevalencia de los gérmenes causantes y sus resistencias han sido poco descritas en nuestro medio. El objetivo del estudio fue analizar la etiología bacteriana y sus patrones de resistencia antibiótica en CAL.
MétodosEstudio observacional unicéntrico, retrospectivo, de pacientes consecutivos diagnosticados de CAL en el periodo de enero de 2012 a septiembre de 2019. Se excluyeron aquellos con diagnóstico concomitante de pancreatitis, colangitis, colecistitis posoperatoria, estudio anatomopatológico de colecistitis crónica o carcinoma. Se recogieron las variables demográficas, analíticas, terapéuticas y microbiológicas, incluyendo hemocultivos preoperatorios, cultivos biliares y de exudado peritoneal.
ResultadosDe un total de 1.104 CAL, se tomaron muestras en 830 pacientes: biliares en 89%, de líquido peritoneal y/o hemocultivos en 25%. La mitad de los cultivos biliares y menos de un tercio en sangre y/o peritoneo resultaron positivos. Se aislaron Escherichia coli (36%), Enterococcus spp. (25%), Klebsiella spp. (21%), Streptococcus spp. (17%), Enterobacter spp. (14%) y Citrobacter spp. (7%). Se identificaron anaerobios en el 7% y Candida spp. en 1%. El 37% de los pacientes recibieron una antibioticoterapia empírica inadecuada. Se analizaron detalladamente los patrones de resistencia para cada especie bacteriana. Las bacterias productoras de beta-lactamasas de espectro extendido (34%) y Enterococcus spp. (45%) fueron las principales causantes de la inadecuación, especialmente en pacientes > 80 años.
ConclusionesEl conocimiento actualizado de la microbiología y de los patrones de resistencia en nuestro medio resulta fundamental para reajustar la antibioticoterapia empírica y los protocolos de tratamiento de la CAL.
The current treatment for acute calculous cholecystitis (ACC) is early laparoscopic cholecystectomy, in association with appropriate empiric antibiotic therapy. In our country, the evolution of the prevalence of the germs involved and their resistance patterns have been scarcely described. The aim of the study was to analyze the bacterial etiology and the antibiotic resistance patterns in ACC.
MethodsWe conducted a single-center, retrospective, observational study of consecutive patients diagnosed with ACC between 01/2012 and 09/2019. Patients with a concomitant diagnosis of pancreatitis, cholangitis, postoperative cholecystitis, histology of chronic cholecystitis or carcinoma were excluded. Demographic, clinical, therapeutic and microbiological variables were collected, including preoperative blood cultures, bile and peritoneal fluid cultures.
ResultsA total of 1104 ACC were identified, and samples were taken from 830 patients: bile in 89%, peritoneal fluid and/or blood cultures in 25%. Half of the bile cultures and less than one-third of the blood and/or peritoneum samples were positive. Escherichia coli (36%), Enterococcus spp (25%), Klebsiella spp (21%), Streptococcus spp (17%), Enterobacter spp (14%) and Citrobacter spp (7%) were isolated. Anaerobes were identified in 7% of patients and Candida spp in 1%. Nearly 37% of patients received inadequate empirical antibiotic therapy. Resistance patterns were scrutinized for each bacterial species. The main causes of inappropriateness were extended-spectrum beta-lactamase–producing bacteria (34%) and Enterococcus spp (45%), especially in patients older than 80 years.
ConclusionsUpdated knowledge of microbiology and resistance patterns in our setting is essential to readjust empirical antibiotic therapy and ACC treatment protocols.
La colecistitis aguda (CA) es una enfermedad inflamatoria e infecciosa aguda producida principalmente por una complicación de la colelitiasis. El tratamiento de elección es la colecistectomía laparoscópica precoz, asociada a una terapia antibiótica empírica (TAE) apropiada. Constituye la segunda causa más frecuente de cirugía urgente en nuestro medio.
Entre las múltiples guías clínicas sobre CA, las más extendidas son las Tokyo Guidelines de 2018 (TG18). En ellas se aboga por un tratamiento quirúrgico precoz de las CA leves y moderadas. Para CA graves con fracaso de al menos un órgano, recomiendan un tratamiento menos invasivo con antibioticoterapia de amplio espectro, soporte metabólico y considerar la inserción de un drenaje vesicular percutáneo o endoscópico1. En dichas guías, se resalta la importancia de una correcta selección de la TAE en esta era de crecientes resistencias antibióticas emergentes, y hacen hincapié en la monitorización de los patrones de resistencia locales como medida fundamental para un uso prudente de antimicrobianos, facilitando una pronta desescalada antibiótica y limitando la duración de las pautas antibióticas al tiempo estrictamente necesario2.
En España, las recomendaciones para el tratamiento antibiótico empírico de la infección intraabdominal tienen 15 años de antigüedad3. En las infecciones intraabdominales como la CA, resulta esencial un control precoz del foco infeccioso: total, mediante la extirpación del tejido infectado con una colecistectomía, o parcial, mediante el drenaje de la vesícula biliar en aquellos pacientes que no sean candidatos a tratamiento quirúrgico inicial4. Es precisamente en los sujetos con CA más graves, no candidatos a una colecistectomía de inicio y con una elevada tasa de morbimortalidad, en los que una TAE adecuada es primordial para la curación.
Diversas publicaciones internacionales han descrito que las bacterias más frecuentemente aisladas en la bilis son las enterobacterias, con un discreto predominio de Escherichia coli y Enterococcus spp.5–7. Sin embargo, las series publicadas apenas alcanzan varios cientos de pacientes y, en su mayoría, agrupan aquellos con patología biliar en general: ya sea colangitis o colecistitis, tanto infección aguda como crónica, cirugía electiva o urgente, y colecistitis de variada etiología8,9. Así, las recomendaciones publicadas ofrecen un amplio abanico de posibilidades terapéuticas, tratando de abarcar todos los escenarios posibles, pero resultan inevitablemente ambiguas y poco específicas para la selección de una TAE adecuada en la práctica clínica habitual.
Por tanto, para lograr una optimización de la TAE, resulta fundamental conocer la etiología bacteriana de la colecistitis aguda litiásica (CAL), así como la epidemiología local para indicar la antibioticoterapia empírica óptima en cada caso.
El objetivo principal del estudio fue describir la etiología bacteriana y los patrones de resistencia antibiótica en la CAL «pura» en nuestro medio. Los objetivos secundarios fueron analizar la adecuación de la TAE, así como la identificación de aquellas subpoblaciones que presentan un mayor riesgo de desarrollar infecciones por gérmenes multirresistentes.
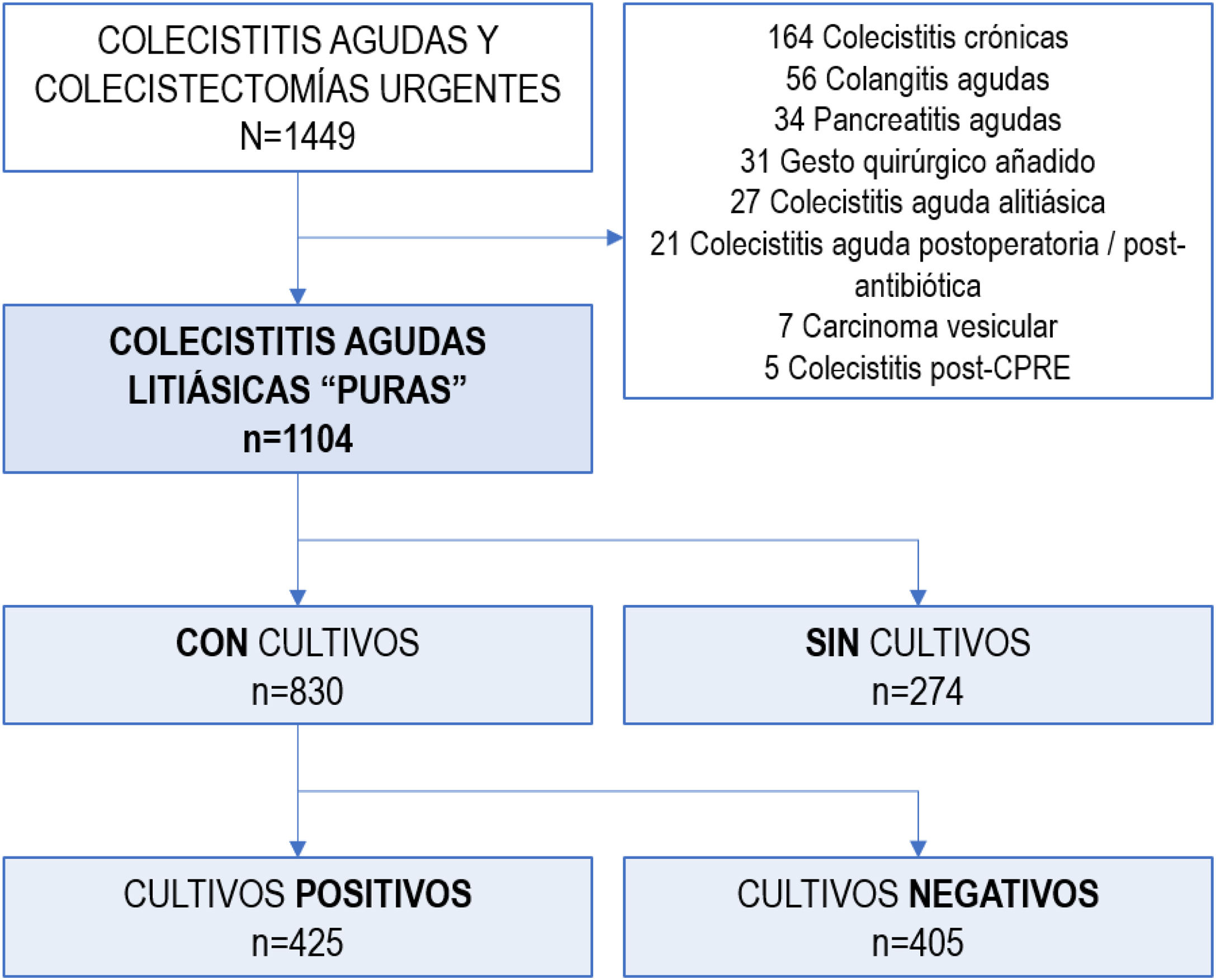
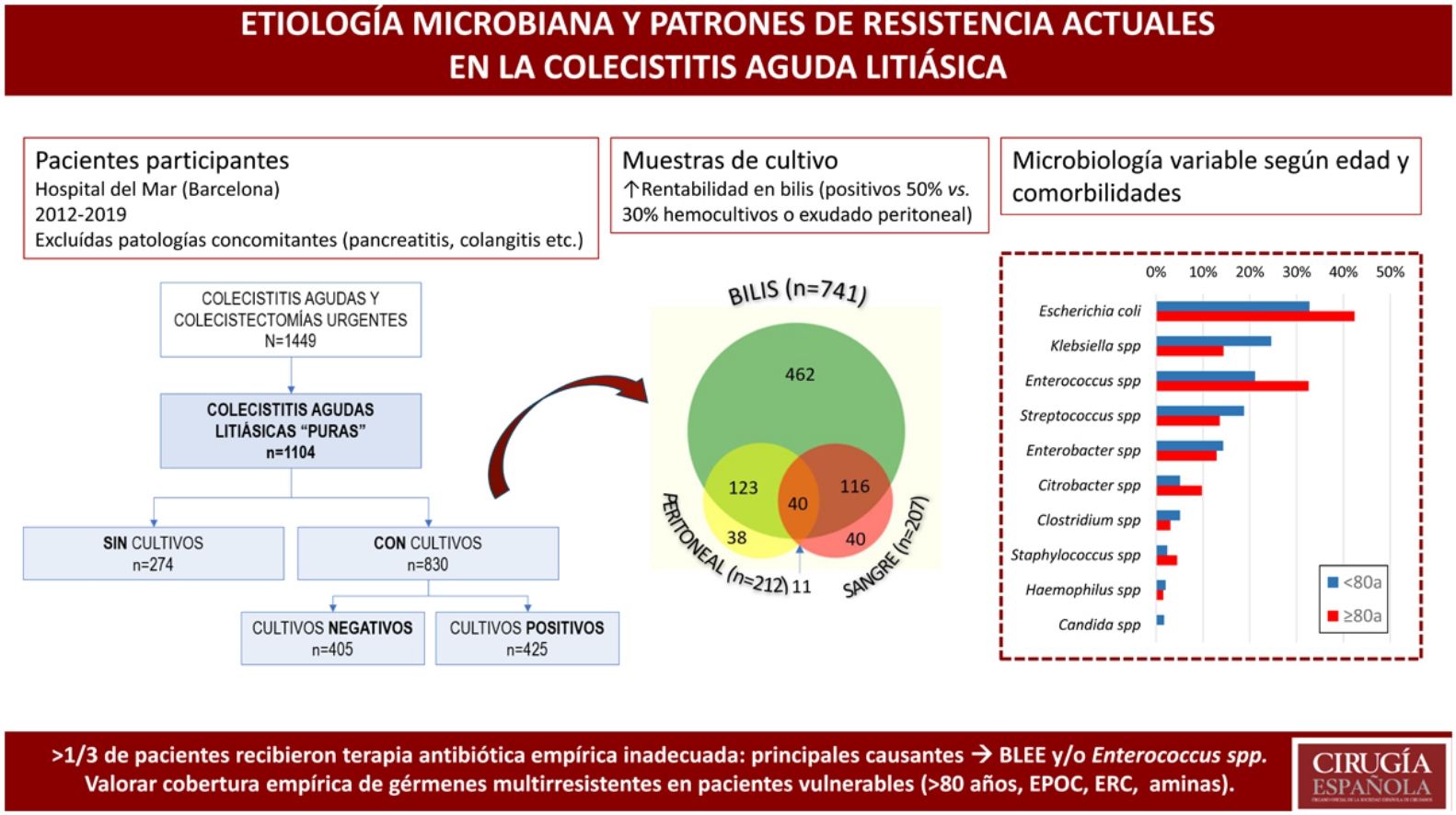
MétodosDiseño. Selección de pacientesEstudio observacional unicéntrico retrospectivo realizado en el Servicio de Urgencias de Cirugía General de un hospital universitario de Barcelona (España), que identificó 1.449 pacientes consecutivos diagnosticados de CAL entre enero de 2012 y septiembre de 2019. Se incluyeron 1.104 pacientes con diagnóstico clínico de CA según las TG1810, así como aquellos con diagnóstico histopatológico de CAL, focalizando el estudio en los pacientes con CAL «pura»11. Se excluyeron aquellos con diagnósticos concurrentes como: colecistitis posoperatoria o posantibiótica, colangitis aguda, pancreatitis aguda, colecistitis alitiásica, cólico biliar persistente, colecistitis tras colangiopancreatografía retrógrada endoscópica (CPRE) o diagnóstico patológico definitivo de carcinoma de vesícula biliar (fig. 1).
VariablesLos datos fueron extraídos y codificados de la historia clínica electrónica. Se recogieron un total de 134 variables demográficas, analíticas, terapéuticas y microbiológicas de los pacientes con CAL «pura» (Anexo. Material suplementario 1). Se analizaron hemocultivos preoperatorios y las muestras de bilis y líquido peritoneal intraoperatorias obtenidos a discreción del cirujano.
En las variables microbiológicas se incluyeron el género y la especie, así como la tinción de Gram, requerimientos de oxígeno (aerobios/anaerobios) y morfología (cocos, bacilos, cocobacilos). Se determinó la sensibilidad antibiótica para cada germen aislado (sensible, resistente, intermedio o desconocido) y se registraron específicamente las bacterias productoras de beta-lactamasas de espectro extendido (BLEE). Las variables se recopilaron en ficheros anonimizados de File Maker v.13TM (Mountainview, CA, EE. UU.).
Estimación de la adecuaciónEl tratamiento antimicrobiano se consideró adecuado cuando fue administrado en dosis e intervalos aceptables, con la vía de administración óptima y siguiendo las guías y recomendaciones locales3.
Se consideró que un germen era sensible al antibiótico cuando la concentración inhibitoria mínima era menor que el umbral de susceptibilidad in vitro aceptado internacionalmente12. En el caso de infecciones polimicrobianas, se determinó la adecuación para cada uno de los microorganismos aislados.
Cuando todos los gérmenes aislados en la muestra de un paciente eran sensibles a los antibióticos empíricos recibidos, la terapia antibiótica se consideró adecuada. Los gérmenes con sensibilidad intermedia al antibiótico administrado se codificaron en conjunto con los resistentes, de tal forma que todo tratamiento de un paciente con uno o más microorganismo(s) resistente(s) o con sensibilidades intermedias a los antibióticos recibidos fue considerado como inadecuado.
IntervencionesTodos los pacientes recibieron inicialmente la TAE por vía endovenosa. Aquellos candidatos a tratamiento con colecistostomía y/o colecistectomía recibieron al menos una dosis antes del procedimiento.
Los cultivos de bilis fueron tomados mediante una punción directa de la vesícula biliar en la colecistostomía, así como punción directa con aguja en aquellos sometidos a cirugía, tanto en el abordaje laparoscópico como en el abierto.
Los cultivos de líquido peritoneal fueron obtenidos intraoperatoriamente mediante una aspiración directa del exudado.
Los hemocultivos se obtuvieron durante el ingreso hospitalario en pacientes con tratamiento exclusivamente médico, y se consideraron únicamente los hemocultivos tomados previos al procedimiento (ya fuera la cirugía y/o colecistostomía) en sujetos sometidos a tratamientos adicionales además de la antibioticoterapia.
Análisis estadísticoSe empleó el programa IBM SPSS Statistics v. 25TM (Rochester, MN, EE. UU.).
Para el análisis univariante de la asociación entre las variables cualitativas, se empleó la prueba de X2 o la F de Fisher, y los resultados fueron presentados en forma de razón de probabilidades con intervalos de confianza del 95% (IC 95%).
La normalidad de la distribución de las variables cuantitativas se estimó mediante la prueba de Kolmogorov-Smirnov y ninguna de las variables mostró una distribución normal, por lo que se consignan como mediana y rango intercuartílico (IQR). La comparación entre medianas no pareadas se realizó mediante la prueba U de Mann-Whitney.
Aspectos éticos y legalesEl estudio cumplió con los estándares establecidos en la Declaración de Helsinki y las Buenas Prácticas Epidemiológicas. El estudio se realizó con la aprobación del Comité de Ética del Hospital del Mar, Barcelona. Número de referencia del Comité: 2020/9312. Código: MMP-ANT-2020–01.
ResultadosSe diagnosticaron como CAL «pura» un total de 1.104 pacientes.
La mayoría recibió un tratamiento inicialmente quirúrgico (n=1.044; 94,6%), y un 5% requirió un tratamiento conservador inicial (colecistostomía n=24; 2,2%; tratamiento médico exclusivo n=36; 3,3%).
En 830 de ellos se tomaron una o varias muestras para cultivos microbiológicos: cultivos de bilis en el 89% (741/830) y muestras de líquido peritoneal o hemocultivos en el 25% de los pacientes (212/830 y 207/830, respectivamente). Los pacientes a los que se tomaron muestras para cultivo fueron con más frecuencia varones (55,7% vs. 42%; odds ratio [OR] 1,736; IC 95% 1,31-2,28), 10 años mayores que aquellos sin cultivo (71 vs. 61 años; p < 0,001), y presentaron CAL más graves (cultivados con gravedad TG-III 35,4% vs. no cultivados con gravedad TG-III 22,6%; OR 1,876; IC 95% 1,36-2,57) (tabla 1).
Características basales de los pacientes con colecistitis aguda litiásica «pura»
| Global (n=1.104) | Cultivados (n=830) | No cultivados (n=274) | p* | ||
|---|---|---|---|---|---|
| Edad mediana (IQR) | 69 (53-80) | 71 (57-80) | 61 (45-77) | < 0,001 | |
| OR** | IC 95% | ||||
| Sexo ♂ | 577 (52,26) | 462 (55,66) | 115 (41,97) | 1,74 | 1,3-2,3 |
| Diabetes mellitus | 239 (21,65) | 189 (22,77) | 50 (18,25) | 1,32 | 0,9-1,9 |
| ACME11 | |||||
| EPOC | 112 (10,14) | 91 (10,96) | 21 (7,66) | 1,48 | 0,9-2,4 |
| ≥ 80 años | 281 (25,45) | 224 (26,99) | 57 (20,80) | 1,41 | 1,0-1,9 |
| Demencia | 44 (3,99) | 38 (4,58) | 6 (2,19) | 2,14 | 0,9-5,1 |
| Aminas vasoactivas | 41 (3,71) | 38 (4,58) | 3 (1,09) | 4,33*** | 1,3-14,2 |
| Tokyo Guidelines Severity Grade 2018 | |||||
| TG-I | 280 (25,36) | 182 (21,93) | 98 (35,77) | ||
| TG-II | 468 (42,39) | 354 (42,65) | 114 (41,61) | TG-III vs. TG I-II 1,88 (1,4-2,6) | |
| TG I-II | 748 (67,75) | 536 (64,58) | 212 (77,37) | ||
| TG-III | 356 (32,25) | 294 (35,42) | 62 (22,63) | ||
| Tratamiento quirúrgico inicial | 1.044 (94,57) | 794 (95,66) | 250 (91,24) | 2,12 | 1,2-3,6 |
ACME: Acute Cholecystitis Mortality Estimation; EPOC: enfermedad pulmonar obstructiva crónica; IC: intervalo de confianza; IQR: rango intercuartílico; OR: odds ratio; TG: Tokyo Guidelines.
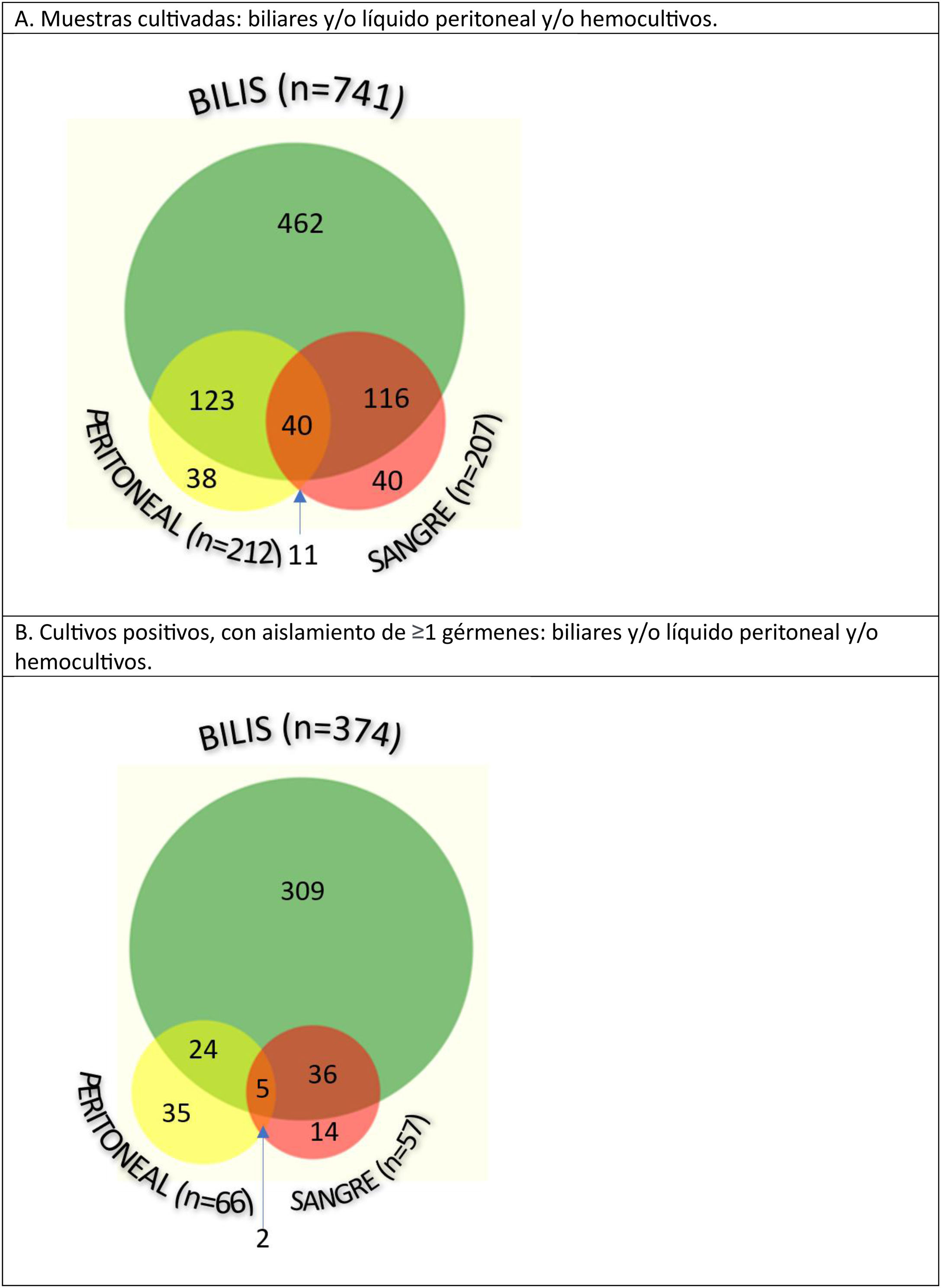
Entre las 1.160 muestras obtenidas, los cultivos más productivos fueron los de bilis, ya que resultaron positivos en el 50,5% de los pacientes (374/741), mientras que, en el resto de las muestras, menos de un tercio de los cultivos fueron positivos (66/212 en líquido peritoneal y 57/207 en hemocultivos) (fig. 2).
Los pacientes con cultivos positivos resultaron ser más ancianos (74 vs. 64 años; p < 0,001), más frecuentemente diabéticos (26,1% vs. 19,3%; OR 1,482; IC 95% 1,06-2,05), con patología pulmonar obstructiva crónica (14,1% vs. 7,7%; OR 1,983; IC 95% 1,25-3,13) y presentaron cuadros clínicos más severos (TG-III en pacientes con cultivos positivos 39,1% vs. TG-III con cultivos negativos 31,6%; OR 1,387; IC 95% 1,04-1,84) en comparación con aquellos en los que no se aisló ningún germen en los cultivos realizados (tabla 2).
Características de los pacientes en los que se tomaron cultivos (bilis, y/o exudado peritoneal, y/o hemocultivos)
| Cultivados (n=830) | Cultivos positivos (n=425) | Cultivos negativos (n=405) | p* | ||
|---|---|---|---|---|---|
| Edad mediana (IQR) | 71 (57-80) | 74 (65-81) | 64 (50-78) | 0,001 | |
| OR** | IC 95% | ||||
| Sexo ♂ | 462 (55,66) | 242 (56,94) | 220 (54,32) | 1,11 | 0,8-1,5 |
| Diabetes mellitus | 189 (22,77) | 111 (26,12) | 78 (19,26) | 1,48 | 1,1-2,1 |
| ACME11 | |||||
| EPOC | 91 (10,96) | 60 (14,12) | 31 (7,65) | 1,98 | 1,3-3,1 |
| ≥ 80 años | 224 (26,99) | 132 (31,06) | 92 (22,72) | 1,53 | 1,1-2,1 |
| Demencia | 38 (4,58) | 24 (5,65) | 14 (3,46) | 1,67 | 0,9-3,3 |
| Aminas vasoactivas | 38 (4,58) | 28 (6,59) | 10 (2,47) | 2,79 | 1,3-5,8 |
| Tokyo Guidelines Severity Grade 2018 | |||||
| TG-I | 182 (21,93) | 82 (19,29) | 100 (24,69) | ||
| TG-II | 354 (42,65) | 177 (41,65) | 177 (43,70) | TG-III vs. TG I-II1,39 (1,0-1,8) | |
| TG I-II | 536 (64,58) | 259 (60,94) | 277 (68,40) | ||
| TG-III | 294 (35,42) | 166 (39,06) | 128 (31,60) | ||
| Tratamiento quirúrgico inicial | 794 (95,66) | 404 (95,06) | 390 (96,30) | 0,65 | 0,3-1,3 |
ACME: Acute Cholecystitis Mortality Estimation; EPOC: enfermedad pulmonar obstructiva crónica; IC: intervalo de confianza; IQR: rango intercuartílico; OR: odds ratio; TG: Tokyo Guidelines.
Se identificaron bacilos gramnegativos en el 75% de los pacientes, cocos grampositivos en el 43% y la combinación de ambos en un 24%. La flora aislada fue polimicrobiana en el 39% de las muestras de líquido peritoneal, frente al 35% de las muestras de bilis, y 28% de hemocultivos.
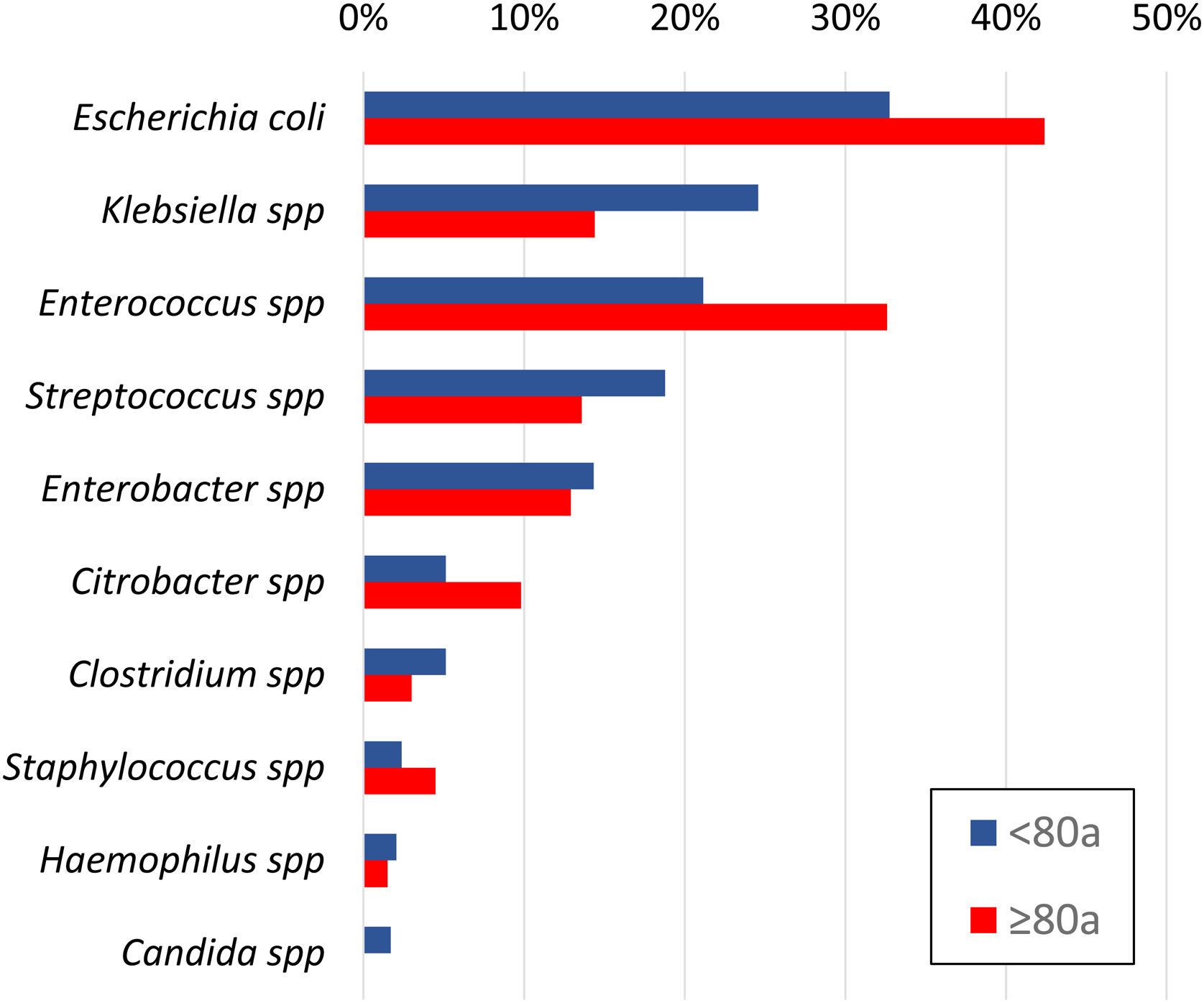
En los 425 cultivos positivos, los microorganismos más frecuentemente identificados fueron E. coli (152; 36%), Enterococcus spp. (105; 25%), Klebsiella spp. (91; 21%), Streptococcus spp. (73; 17%), Enterobacter spp. (59; 14%), Citrobacter spp. (28; 7%) y Clostridium spp. (19; 5%). Se aislaron bacterias anaerobias en el 7,3% y Candida spp. en 1% de los pacientes.
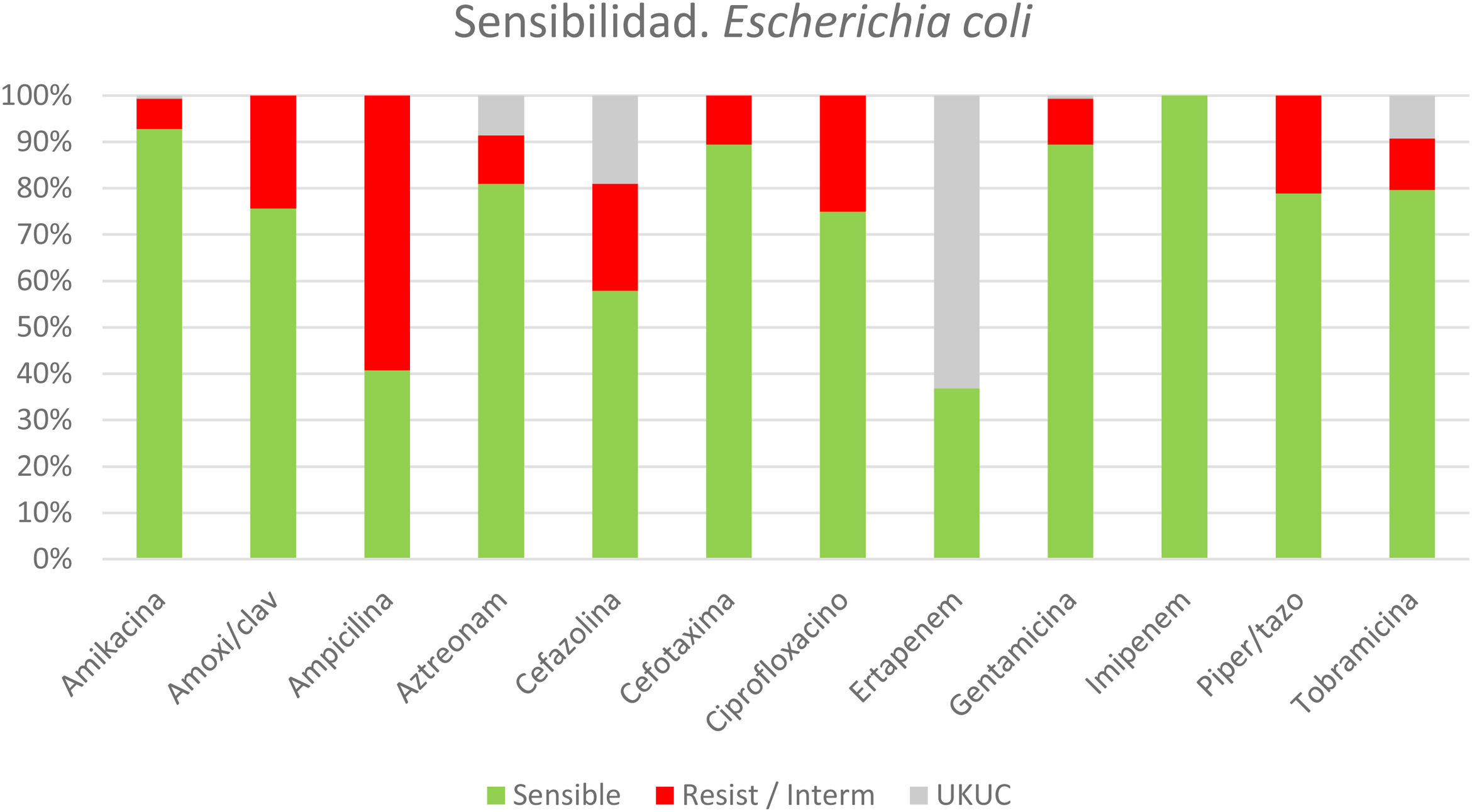
En aquellos pacientes con microorganismos identificados se pudo analizar la TAE indicada (fig. 3), observando que más de un tercio de estos recibieron una TAE inicial inadecuada (158; 37%). Las principales causantes de la inadecuación de la TAE fueron las bacterias productoras de BLEE y/o Enterococcus spp. que supusieron hasta un 69,6% de los casos de inadecuación. El 10,5% (16/152) de E. coli aisladas eran productoras de BLEE, el 5,5% (5/91) de Klebsiella spp., el 35,7% (10/28) de Citrobacter spp. y se alcanzó el 45,8% (27/59) en Enterobacter spp. Los Enterococcus spp. identificados fueron resistentes a la ampicilina en un 18% y a la vancomicina en un 12%.
*Perfil de sensibilidad/resistencia de los colibacilos obtenidos en cultivos de pacientes con colecistitis aguda litiásica.
Resist/Interm: resistente o sensibilidad intermedia; UKUC: unknown unclear, desconocido o dudoso.
*Se ha seleccionado el panel de sensibilidades y resistencias de E. coli como germen más prevalente. En Material Suplementario 2 se adjuntan los paneles correspondientes a las siguientes cinco bacterias aisladas más frecuentemente. n = 152 pacientes (de 425 con cultivos positivos, de un total de 830 cultivados).
Los pacientes de más de 80 años presentaron una mayor proporción de cultivos positivos en comparación con aquellos más jóvenes (58,9% vs. 48,3%; OR 1,533; IC 95% 1,12-2,09) (fig. 4). La prevalencia de BLEE y/o Enterococcus spp. fue mayor en los mayores de 80 años (44,7% vs. 29,7%; OR 1,914; IC 95% 1,25-2,92), los cuales recibieron una TAE inicial inadecuada en casi la mitad de los casos (45% vs. 33% en < 80 años; p=0,032).
Asimismo, en las muestras de los pacientes con comorbilidades, se aislaron gérmenes multirresistentes (BLEE y/o Enterococcus spp.) con mayor frecuencia que en aquellos sin estas patologías de base, que incluyen la enfermedad pulmonar obstructiva crónica (50% vs. 31,8%; OR 2,147; IC 95% 1,24-3,73) y la enfermedad renal crónica moderada o avanzada (54,5% vs. 32,0%; OR 2,548; IC 95% 1,36-4,79). Los pacientes que requirieron aminas vasoactivas perioperatorias presentaron una mayor prevalencia de patógenos multirresistentes (53,6% vs. 33%; OR 2,243; IC 95% 1,08-5,07). No se hallaron diferencias en los aislamientos de gérmenes multirresistentes de pacientes con o sin antecedentes de diabetes mellitus (39,6% vs. 32,5%; OR 1,365; IC 95% 0,87-2,14) o demencia (28% vs. 34,7%; OR 0,730; IC 95% 0,22-2,37).
DiscusiónLa mayoría de los microorganismos aislados en nuestra serie fueron las enterobacterias y cocos grampositivos, principalmente detectados en muestras de bilis.
Diversos grupos internacionales han publicado hasta la fecha los microorganismos aislados con mayor frecuencia en cultivos biliares y en las CA. Kwon et al.5 publicaron en 2013 el mayor estudio de cultivos biliares de los últimos años, incluyendo 2.217 cultivos tomados a 1.430 pacientes. Sin embargo, los autores integraron a todos aquellos con infección aguda por obstrucción de la vía biliar. Por tanto, no solo se analizaron los pacientes con CA y coledocolitiasis asociada, sino que en su mayoría fueron aquellos con colangitis aguda y que no necesariamente requirieron una cirugía de urgencias para la resolución de su infección. En ese estudio, el género más frecuentemente aislado fue Enterococcus spp., resultado que no ha sido reproducido en estudios similares con menor número de participantes6,8,9,13. Nuestro estudio coincide en señalar la tasa creciente de cultivos positivos para Enterococcus spp., sobre todo en la población geriátrica, e incluso con preocupantes resistencias ya identificables a la vancomicina o el linezolid.
Recientemente, Lee et al.7 han publicado un estudio donde describen la microbiología hallada en cultivos exclusivamente realizados en pacientes con CA, excluyendo la colecistitis crónica o la patología maligna. Sin embargo, también incluyeron en el análisis aquellos con coledocolitiasis asociada que requirieron una manipulación previa de la vía biliar mediante CPRE o drenaje biliar. Consideramos que los datos obtenidos de dichos cultivos probablemente se habrán visto alterados por esta manipulación. A pesar de ello, tanto este estudio como el nuestro, coinciden en señalar los principales microorganismos aislados, con tasas de resistencias también similares, aunque con porcentajes menores de los gérmenes más prevalentes.
Un aspecto práctico del estudio actual es la identificación del subgrupo de población susceptible de presentar CAL por gérmenes multirresistentes (BLEE y/o Enterococcus spp.), con características identificables en el estudio perioperatorio.
De entre los factores clásicamente relacionados con la infección por gérmenes multirresistentes, incluyendo las bacterias productoras de BLEE y las infecciones por enterococos3,14,15, nuestra serie recalca el riesgo asociado a la población geriátrica de más de 80 años, con enfermedad pulmonar obstructiva crónica, enfermedad renal crónica o necesidad de soporte vasoactivo. No se hallaron diferencias en las tasas de cultivos positivos para los gérmenes productores de BLEE entre los pacientes afectos o no de enfermedad neurológica avanzada y/o diabetes mellitus. Es probable que este hecho se deba al limitado número de casos y a que los cirujanos responsables ya indicaron terapias con carbapenémicos y/o fármacos dirigidos en estos enfermos.
Tal y como describieron Nakai et al.16, ya no solo debemos considerar las infecciones por BLEE en pacientes institucionalizados. Están descritos otros múltiples factores relacionados con la probabilidad de albergar una infección por BLEE, que indirectamente reflejan la vulnerabilidad del paciente3,14–16. Este subgrupo especialmente vulnerable se beneficiaría de una TAE inicial con antibióticos de muy amplio espectro, incluyendo los carbapenémicos, evitando una TAE única para todos los que padecen CAL.
La TAE inicial inadecuada se ha relacionado con mayores tasas de morbimortalidad17. Considerando que la principal causa de la inadecuación es fundamentalmente la resistencia antibiótica de Enterococcus spp. y/o bacterias productoras de BLEE y, por tanto, deberá priorizarse la cobertura de estos gérmenes multirresistentes en la terapia pautada de inicio.
La limitación principal de nuestro estudio radica en su carácter retrospectivo, con los consiguientes datos omitidos en la historia clínica, la dificultad para determinar el peso de las variables confusoras y para asegurar que la conservación y el transporte de las muestras haya sido idóneo. Asimismo, el registro de la manipulación previa de la vía biliar no es exhaustivo, lo que podría alterar las tasas de prevalencia de algunos gérmenes en un reducido número de pacientes. Además, el estudio adolece del sesgo derivado de que la obtención de cultivos queda a la discreción del cirujano. Se intentó acotar y objetivar la magnitud de este sesgo comparando las características de los pacientes con y sin cultivo, demostrando que precisamente aquellos con cultivo tenían una CAL más grave17.
En conclusión, en nuestra serie, más de un tercio de los pacientes recibieron una TAE inadecuada, debido fundamentalmente a la ausencia de cobertura empírica de bacterias productoras de BLEE y Enterococcus spp., particularmente prevalentes en ancianos mayores de 80 años y aquellos con enfermedad pulmonar obstructiva y enfermedad renal crónicas. Es fundamental el conocimiento detallado de la microbiología local en la CAL, así como sus patrones de resistencia, para un mejor ajuste de la TAE y la actualización de los protocolos de tratamiento.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.