Analizar los factores de riesgo de complicaciones para colecistitis aguda litiásica confrontándolos a las Tokyo Guidelines.
MétodosEstudio retrospectivo de 963 pacientes con colecistitis aguda durante 5 años. Se seleccionaron 725 pacientes con colecistitis aguda litiásica «pura», y analizaron 166 variables mediante regresión logística, incluyendo todos los factores de riesgo de las Tokyo Guidelines. Mediante el Propensity Score Matching, se seleccionaron subpoblaciones comparables de 75 pacientes y se analizaron las complicaciones según el tratamiento realizado (quirúrgico/no quirúrgico) y se utilizó el fallo en el rescate como indicador de calidad del tratamiento en la colecistitis aguda litiásica.
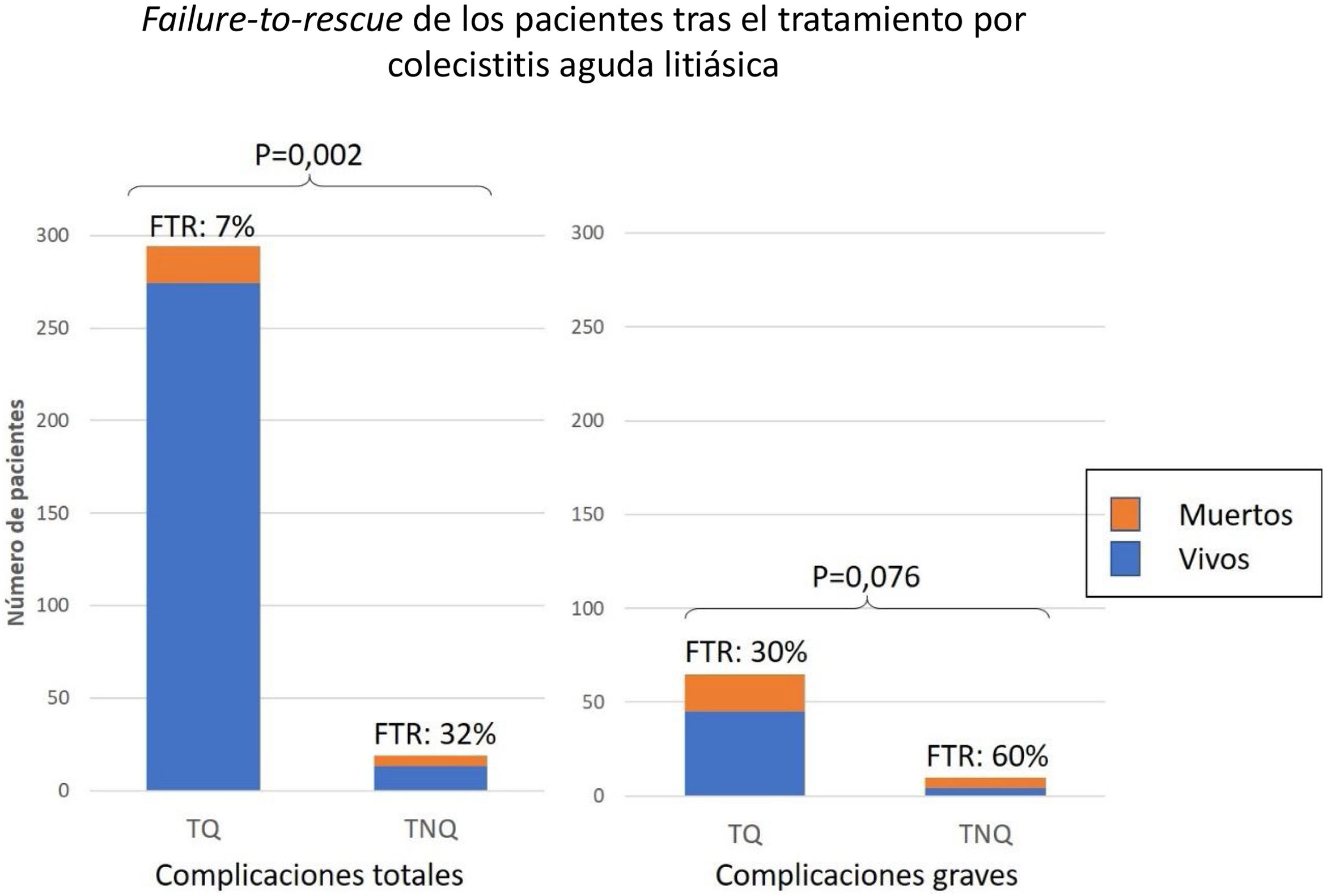
ResultadosLa mediana de edad fue de 69 años (RIQ 53-80). La mayoría de los pacientes fueron ASA II o III (85,1%). El 21% de las colecistitis fueron leves, el 39% moderadas y el 40% graves. Se colecistectomizó al 95% de los pacientes. El 43% de los pacientes se complicaron y la mortalidad fue del 3,6%. Los factores de riesgo independientes para complicaciones graves fueron ASA>II, tumor sólido sin metástasis e insuficiencia renal. El fallo en el rescate (8%) fue mayor en los no operados (32% vs. 7%; P=0,002). Tras realizar el Propensity Score Matching, la tasa de complicaciones graves fueron comparables entre operados y no operados (48,5% vs. 62,5%; P=0,21).
ConclusionesLa colecistectomía precoz es el tratamiento preferente para la colecistitis aguda litiásica. Solo tres de los factores de las Tokyo Guidelines son variables independientes para predecir complicaciones graves. El fallo en el rescate es mayor en los pacientes no intervenidos quirúrgicamente.
To challenge the risk factors described in Tokyo Guidelines in acute calculous cholecystitis.
MethodsRetrospective single center cohort study with 963 patients with acute cholecystitis during a period of 5 years. Some 725 patients with a “pure” Acute calculous cholecystitis were selected. The analysis included 166 variables encompassing all risk factors described in Tokyo Guidelines. The Propensity Score Matching method selected two subgroups of patients with equal comorbidities, to compare the severe complications rate according to the initial treatment (Surgical vs. non-surgical). We analyzed the failure-to-rescue as a quality indicator in the treatment of acute calculous cholecystitis.
ResultsThe median age was 69 years (IQR 53-80). 85.1% of the patients were ASA II or III. The grade of the acute calculous cholecystitis was mild in a 21%, moderate in 39% and severe in 40% of the patients. Cholecystectomy was performed in 95% of the patients. The overall complications rate was 43% and the mortality was 3.6%. The Logistic Regression model isolated 3 risk factor for severe complication: ASA>II, cancer without metastases and moderate to severe renal disease. The failure-to-rescue (8%) was higher in patients with non-surgical treatment (32% vs. 7%; P=.002). After Propensity Score Matching, the number of severe complications was similar between Surgical and Non-Surgical treatment groups (48.5% vs 62.5%; P=.21).
ConclusionsThe recommended treatment for acute calculous cholecystitis is the laparoscopic cholecystectomy. Only three risk factors from the Tokyo Guidelines list appeared as independent predictors of severe complications. The failure-to-rescue is higher in non-surgically treated patients.
El tratamiento de elección de la colecistitis aguda litiásica (CAL) es la colecistectomía laparoscópica precoz. Los pacientes de alto riesgo quirúrgico sufren elevadas tasas de complicaciones (8-20%)1–4 y de mortalidad (0,6-6%)4–7. Esta morbimortalidad, concentrada en los pacientes más graves y/o frágiles, ha promovido varias propuestas para tratamientos no quirúrgicos (TNQ). El quid de la cuestión radica en contestar la pregunta: ¿Quién es el paciente de alto riesgo quirúrgico?
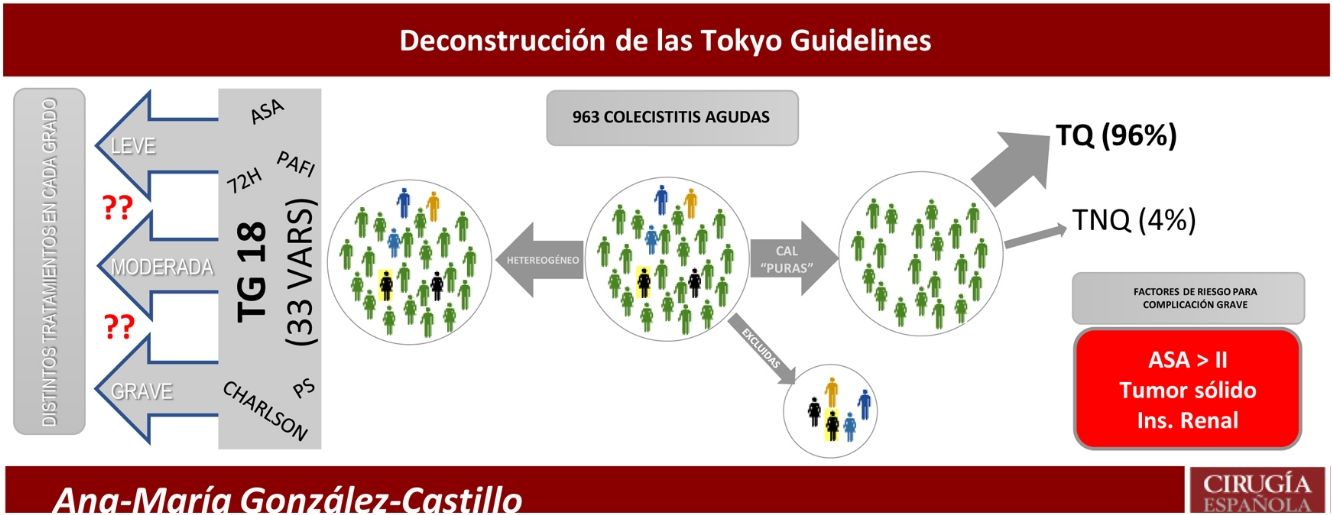
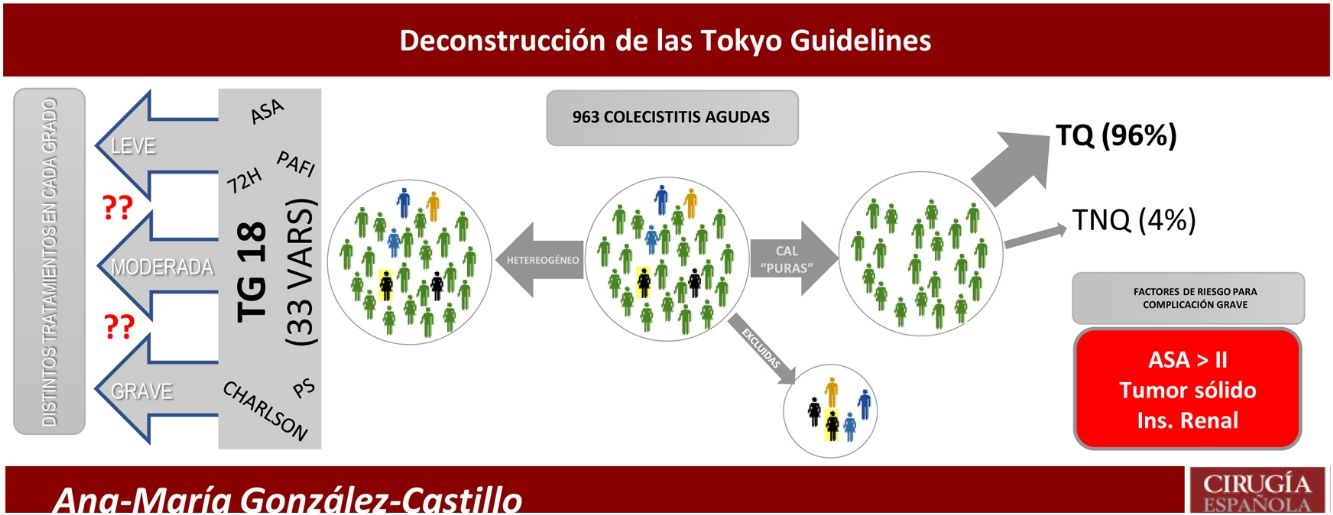
A pesar de la gran cantidad de publicaciones recientes sobre CAL, persiste la controversia sobre la mejor estrategia terapéutica para los pacientes más graves. Esto es debido a poblaciones pequeñas, heterogeneidad de diagnósticos, metodología inapropiada y a las distintas definiciones de alto riesgo quirúrgico. Para identificar al paciente grave, se han extrapolado varias escalas de riesgo generalistas aplicándolas a la CAL, como APACHE8, ASA9,10, P-POSSUM10,11, Charlson Comorbidity Index (CCI)12, AAST13, Clinical Frailty Scale14, o la disfunción multiorgánica15. Las sucesivas versiones de las Tokyo Guidelines7 amalgaman varias de estas escalas para clasificar a los pacientes en tres grupos. Esta estrategia reduce la precisión y confunde en la identificación del paciente que no se debe someter a una colecistectomía precoz.
El objetivo del presente estudio fue analizar detalladamente todos los factores de riesgo descritos en las TG18, para así, identificar un conjunto reducido de factores pronósticos específicos para complicaciones en la CAL.
Pacientes y métodosEstudio clínico retrospectivo, de enero de 2011 a diciembre de 2016, en un hospital universitario con unidad especializada de urgencias quirúrgicas. Los candidatos al estudio fueron 963 pacientes consecutivos diagnosticados de colecistitis aguda.
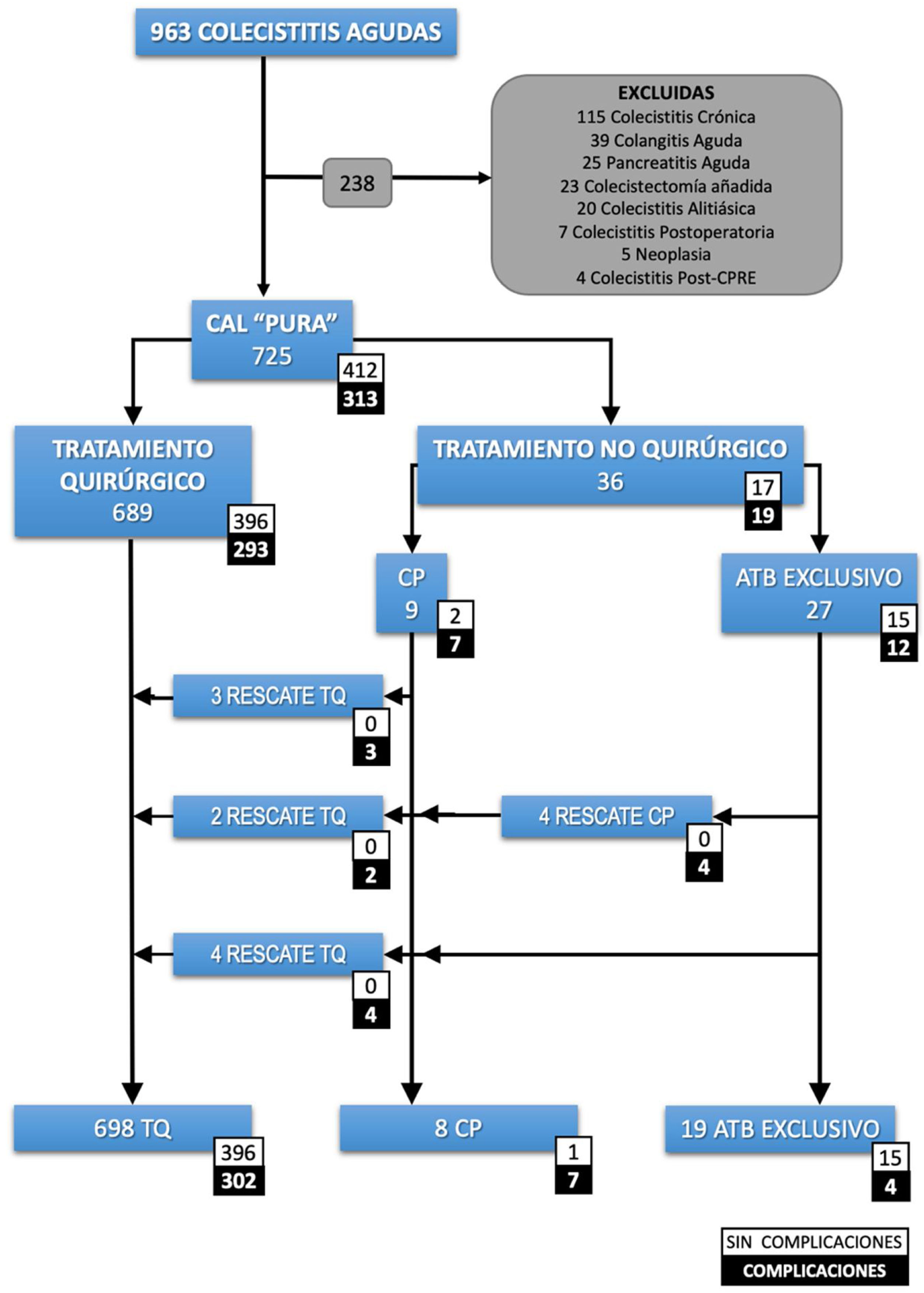
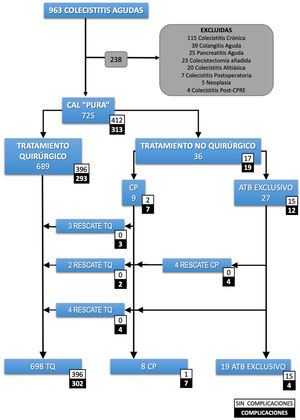
Criterios de inclusión y exclusiónSe incluyeron todos los pacientes con CAL con diagnóstico clínico según las Tokyo Guidelines 2018 (TG18) o con diagnóstico de CAL en el informe histopatológico. La definición de caso fue un paciente con «colecistitis aguda pura». Se excluyeron los pacientes con cualquier otro diagnóstico concomitante influyente en el pronóstico (fig. 1).
Recuento de pacientes.
ATB: antibiótico; CAL: colecistitis aguda litiásica; CP: colecistostomía percutánea; CPRE: colangiopancreatografía retrograda endoscópica; TQ: tratamiento quirúrgico. Colecistectomía añadida: colecistectomía realizada durante un procedimiento quirúrgico urgente diferente. Colecistitis postoperatoria: colecistitis diagnosticada en el postoperatorio de otra intervención quirúrgica.
Se utilizó la base de datos mantenida prospectivamente en FileMaker v.12 (Mountainview, CA, EE. UU.) incluyendo datos demográficos, tipo de intervención, días de ingreso y complicaciones. El registro se completó retrospectivamente con datos de laboratorio, microbiología, antibioticoterapia, gravedad según TG18 (tabla 1), CCI y riesgo quirúrgico según la ASA. El tratamiento inicial fue quirúrgico (TQ: colecistectomía por laparoscopia o laparotomía) o no quirúrgico (TNQ: colecistostomía percutánea, CP, o exclusivamente antibióticos). La variable principal fue la tasa de complicaciones graves (Clavien-Dindo16>IIIa). La mortalidad a los 30 días y la tasa total de complicaciones fueron las variables secundarias del estudio. El seguimiento postevento fue de 30 días en caso de alta hospitalaria antes de ese periodo. En caso contrario, el seguimiento fue hasta el alta hospitalaria independientemente de los días de ingreso.
Diferencias entre pacientes que sufrieron complicaciones graves vs. ninguna complicación en las variables pretratamiento y postratamiento
| Variable | Odds ratiob | 95% IC | P |
|---|---|---|---|
| Sexo (M vs. F) | 1,08 | 0,67-1,75 | 0,411 |
| Clasificación de gravedad según TG18d | |||
| II (Moderada) | 2,75 | 0,92-8,19 | 0,043 |
| III (Grave) | 7,67 | 2,72-21,67 | 0,001 |
| Puntuación ASAc | |||
| II | 1,03 | 1,01-1,04 | 0,150 |
| III | 1,26 | 1,18-1,34 | 0,001 |
| IV | 1,62 | 1,24-2,11 | 0,001 |
| TG18 PAFI <300 | 0,27 | 0,55-1,38 | 0,091 |
| TG18 Oliguria (diuresis <0,5mL/kg/h) | 12,34 | 6,39-23,81 | 0,001 |
| TG18 Inflamación local | 2,25 | 1,2-4,19 | 0,012 |
| TG18 Leucocitosis>18,000/mm3 | 2,13 | 1,2-3,6 | 0,005 |
| TG18 INR> 1,5 | 3,2 | 1,8-5,5 | 0,001 |
| TG18 Insuficiencia renal (creatinina>2 mg) | 8,7 | 5,1-14,99 | 0,001 |
| TG18 Obnubilación | 1,56 | 0,9-2,71 | 0,077 |
| TG18 Disfunción cardiovascular (aminas) | 14,02 | 6,49-30,3 | 0,001 |
| TG18 Signo de Murphy | 0,65 | 0,40-1,05 | 0,052 |
| TG18 Masa palpable hipocondrio derecho | 1,28 | 0,75-2,18 | 0,225 |
| TG18 Taquipnea (> 20 bpm) | 3,78 | 2,06-6,94 | 0,001 |
| TG18 Duración de los síntomas> 72h | 1,24 | 0,76-2,03 | 0,227 |
| Síndrome respuesta inflamatoria sistémica | 2,47 | 1,5-4,06 | 0,001 |
| Complicaciones gravesa | P | ||
|---|---|---|---|
| SíN=75 (10,3%) | NoN=650 (89,7%) | ||
| Índice de Charlson | 2 (3) | 0 (2) | 0,001 |
| Edad (años) | 81 (10) | 67 (28) | 0,001 |
| Bilirubina (mg/dL) | 1,35 (1,69) | 0,8 (1,02) | 0,002 |
| Creatinina (gr/dL) | 1,36 (1,11) | 0,78 (0,38) | 0,001 |
| Fostasa alcalina (UI/L) | 120 (153) | 91 (70) | 0,001 |
| Gamma-glutamyl-transferasa UI/L) | 129 (124) | 117 (298) | 0,317 |
| Glutamil oxaloacetic transaminasa (UI/L) | 39 (132) | 26 (39) | 0,005 |
| INR | 1,4 (0,36) | 1,17 (0,26) | 0,001 |
| Lactato (g/dL) | 2 (2,45) | 1,4 (1) | 0,008 |
| Temperatura (°C) | 36,7 (1,4) | 36,2 (1,1) | 0,289 |
| Leucocitosis> 18000/mm3 | 14,23 (8,6) | 13,7 (6,6) | 0,016 |
| Partial oxygen pressure (mmHg) | 99 (5) | 99 (1) | 0,010 |
| PCR (g/dL) | 23,35 (20,7) | 13,6 (26) | 0,110 |
| Plaquetas (1000/mm3) | 164 (152) | 212 (126) | 0,210 |
| Tratamiento | ||||
|---|---|---|---|---|
| N (%) | OR | 95% IC | P | |
| Colecistectomía | 689 (95) | 0,27 | 0,12-0,58 | 0,002 |
| Colecistectomía rescate | 9 (1,2) | 12 | 3,14-45,8 | 0,001 |
| Laparotomía | 75 (10) | 12,44 | 7,08-21,87 | 0,001 |
| Conversión laparoscopia | 93 (13) | 2,33 | 1,28-4,23 | 0,006 |
| Procedimientos adicionales | 164 (23) | 2,41 | 1,44-4,03 | 0,001 |
| Colecistostomía | 9 (1,2) | 1,4 | 0,28-7,3 | 0,486 |
| Colecistostomía rescate | 4 (0,5) | 3 | 0,3-24,91 | 0,305 |
| Únicamente antibioticoterapia | 27 (3,7) | 0,23 | 0,04-1,31 | 0,087 |
| Postratamiento | |||
|---|---|---|---|
| Complicaciones graves | P | ||
| SíN=75 (10,3%) | NoN=412 (89,7%) | ||
| Estancia hospitalaria (días). | 17 (18) | 3 (3) | 0,001 |
PAFI: Pa02/Fi02; PCR: proteína C reactiva; PT-INR: Prothrombin Time International Normalized Ratio; rpm: respiraciones por minuto.
a N (%) o mediana (RIQ).
Odds-ratio para complicaciones graves.
c ASA score 1ha sido utilizado de grupo control para calcular la odds ratio de los grupos restantes; ASA score V no se ha incluido en el análisis porque únicamente hay 1 paciente en este grupo.
Clasificación de las Guías de Tokyo del año 201843 TG I se utilizó de grupo control para calcular la odds ratio de los grupos restantes.
Todos los pacientes recibieron antibioticoterapia endovenosa según el protocolo local. La CP se realizó guiada por ecografía, insertando un catéter 8 Fr. (SKATER™, Argon Medical Devices, Rochester, NY, EE. UU.) por vía transhepática o transperitoneal, a criterio del radiólogo.
Se propuso a todos los pacientes para tratamiento inicial quirúrgico. Tan solo se aplicó un tratamiento inicial no quirúrgico cuando existían contraindicaciones formales por parte de anestesiología y reanimación, o bien rechazo de la intervención quirúrgica por el paciente o representante legal. La indicación de colecistostomía percutánea fue a criterio del cirujano responsable, frecuentemente avalada por una discusión en profundidad en la sesión clínica diaria.
La colecistectomía laparoscópica se realizó según técnica francesa. La indicación de abordaje abierto, mediante laparotomía subcostal derecha, se restringió a los pacientes con inestabilidad hemodinámica y tratamiento con aminas vasoactivas en el momento de la intervención quirúrgica. Se obtuvo cultivo de bilis vesicular y del exudado peritoneal en el 67% de los casos.
Análisis estadísticoSe siguieron las recomendaciones Strengthening the Reporting of Observational studies in Epidemiology (STROBE)17. Se evaluó la normalidad de la distribución de las variables cuantitativas mediante la prueba de Kolmogorov-Smirnov: ninguna de ellas se distribuyó normalmente y por tanto sus valores se expresan como mediana y rango intercuartil (25-75RIQ). Para evaluar la significación de las diferencias entre las medias de las variables entre grupos, se utilizaron las pruebas no paramétricas U-Man-Whitney para dos grupos, y la prueba de Kruskal-Wallis para tres grupos. La asociación entre las variables cualitativas para comparaciones entre grupos se evaluó con la prueba de Chi cuadrado o test exacto de Fisher, según estuviera indicado. El aumento del riesgo de un evento asociado a una variable se expresó mediante su odds-ratio (OR) e intervalo de confianza del 95%.
Se elaboró un modelo predictivo de complicaciones graves mediante la técnica multivariante de regresión logística binaria, con entrada condicional progresiva paso a paso progresivo con un F-to-enter de 0,5, sin alterar las condiciones basales de la admisión, se rechazaron las variables con diferencias no significativas en el análisis univariante. Se compararon los distintos métodos productivos mediante sus curvas de características funcionales (curvas ROC o Receiver-operating characteristic).
Se evaluó el Failure-to-Rescue (FTR)18,19 como indicador de calidad de la atención global a los pacientes con CAL, tal como fue descrito en 1992 por Silber et al.20 es la proporción de mortalidad en los pacientes que tienen alguna complicación. Para paliar la asimetría entre tasas de tratamiento se utilizó el Propensity Score Matching21 para emparejar dos grupos de gravedad similar según las variables de riesgo identificadas en la regresión logística.
Aspectos éticos y legalesEste estudio ha sido registrado en Clínical Trials (NCT05135299).
El protocolo de estudio ha sido aprobado por la CEIC del Hospital del Mar y clasificado como un estudio no clínico, de conformidad con los preceptos dispuestos en la Ley Orgánica15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal (BOE 14/12/1999, núm 248). Todos los datos recogidos en la base de datos clínicos han sido totalmente anonimizados y todos los archivos se guardan encriptados.
ResultadosSe seleccionaron 725 pacientes con una CAL pura (fig. 1). La mediana de edad fue de 69 años (RIQ: 53-80) y el 26% fueron mayores de 80 años. La mayoría de los pacientes fueron clasificados como ASA II (52,3%) o ASA III (32,8%). De ellos, 689 se intervinieron quirúrgicamente y en 36 (5%) se optó por tratamiento no quirúrgico. La mediana de días de sintomatología antes de su ingreso fue de 3 días (RIQ: 2-5). En el grupo de TNQ, 27 (75%) se trataron exclusivamente con antibióticos y a 9 (25%) se les indicó una CP. La evolución desfavorable de algunos pacientes conllevó a realizar 4 CP más, alcanzando un total de 13 CP y 9 pacientes precisaron TQ. Finalmente, se practicaron 698 (96,2%) colecistectomías.
Según la clasificación de las TG18, el 21% fueron leves, el 39% fueron moderadas y el 40% graves. El abordaje quirúrgico de la CAL fue vía laparoscopia en el 89% (tasa de conversión del 13%).
ComplicacionesEl 43% de los pacientes sufrieron alguna complicación. Las complicaciones de toda la muestra se clasificaron según Clavien-Dindo como leves en 238 pacientes (76%) (grado I a IIIa) y graves en 75 (24%).
Los pacientes con complicaciones tenían 13 años más y el doble de CCI. Los pacientes con mayor puntuación de la ASA sufrieron más complicaciones (tabla 1), mientras que los porcentajes de complicaciones en los grupos de CAL leve y moderada fueron similares (32 vs. 36%). Los pacientes con CAL grave (TG18) sufrieron un porcentaje significativamente mayor de complicaciones, comparadas con las leves y moderadas (55,5 vs. 21%; P=0,001). En el análisis por intención de tratar, los pacientes con TQ o TNQ sufrieron un número similar de complicaciones (53 vs. 42%; P=0,3).
La colecistectomía abierta (11%) presentó un 47% más de complicaciones que la vía laparoscópica (85 vs. 38%; P=0,001), y la colecistectomía laparoscópica convertida tuvo un 33% más de complicaciones que la no convertida (72 vs. 39%; P=0,001).
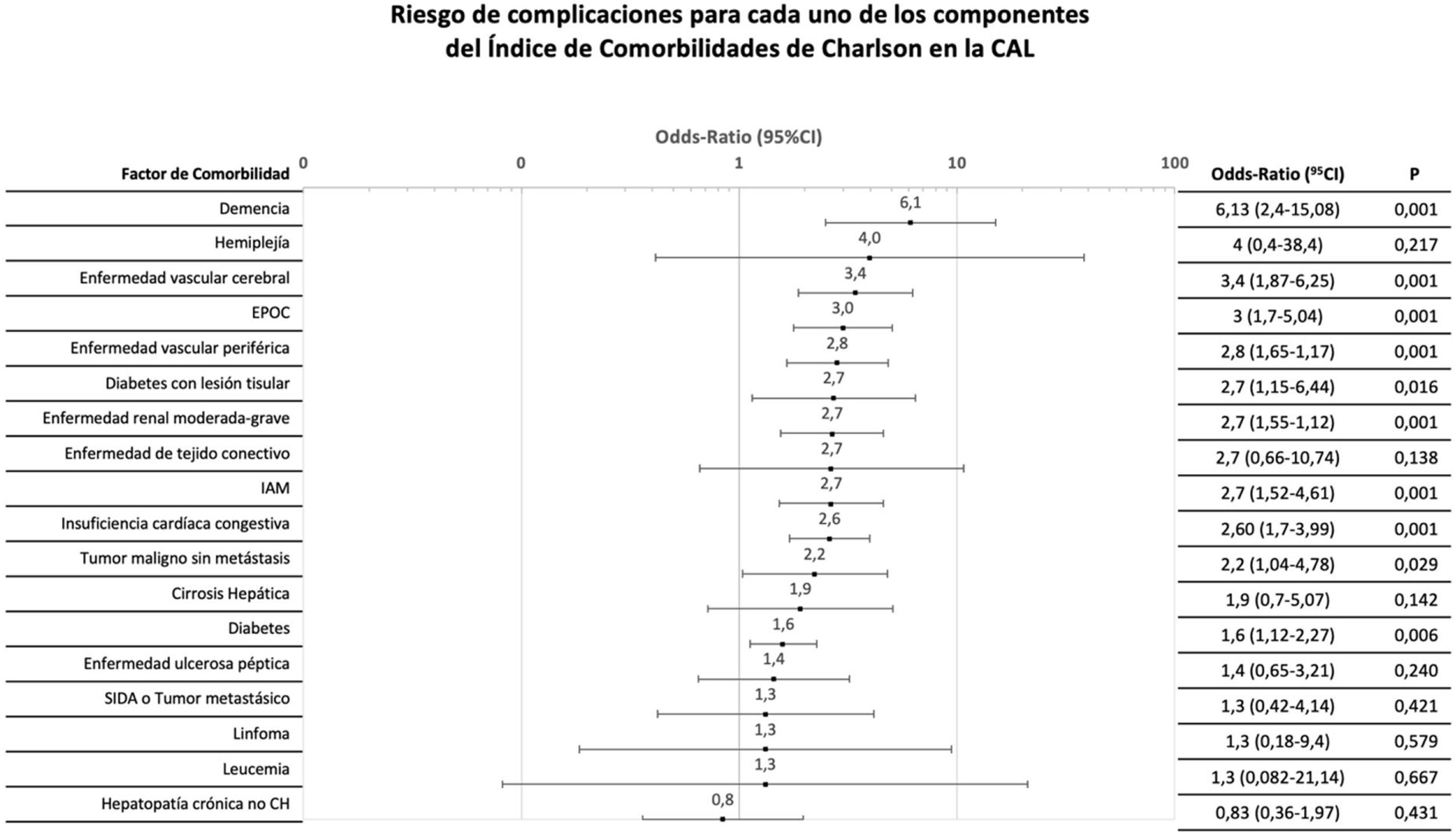
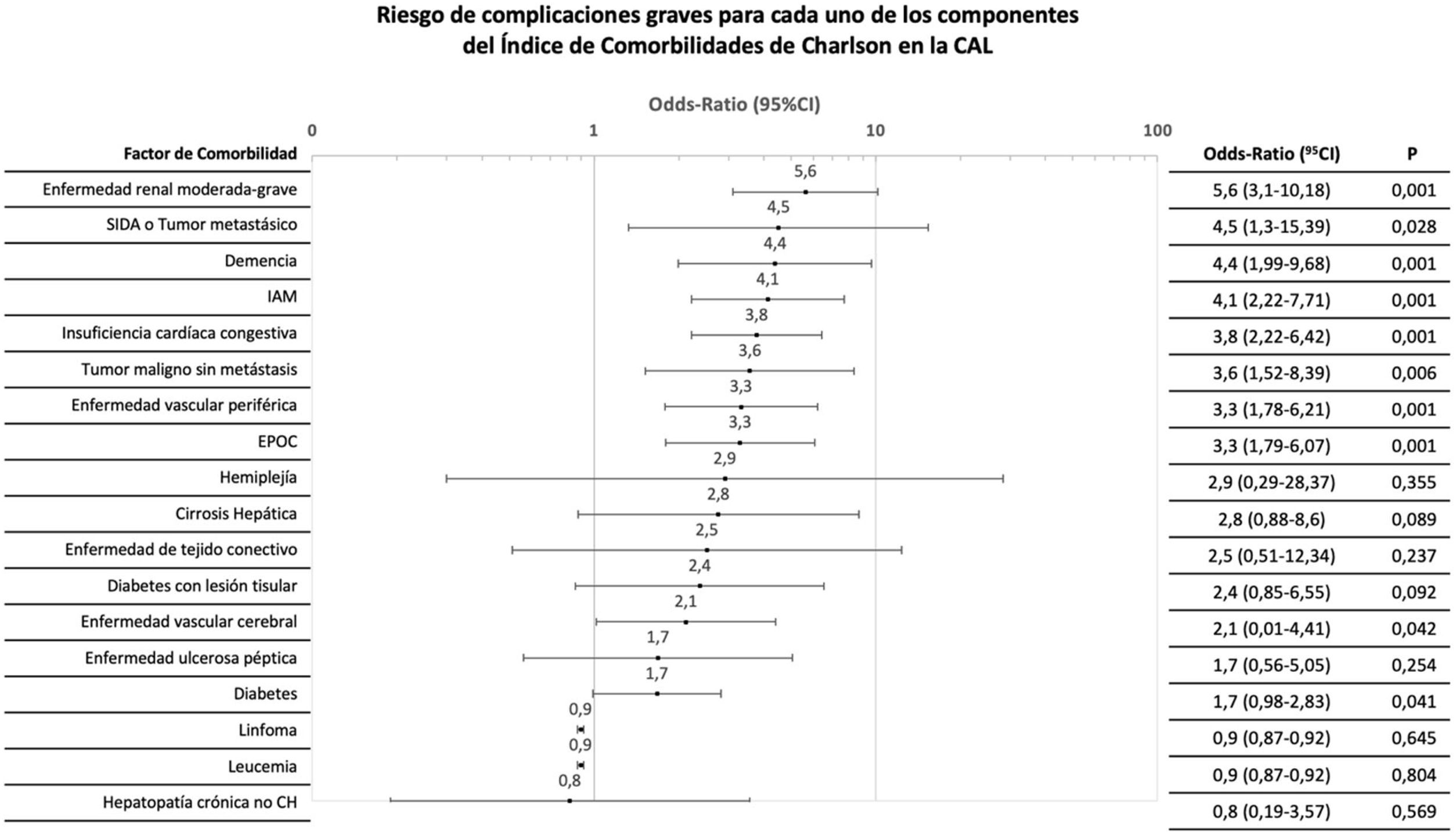
Se analizaron individualmente los factores constitutivos del CCI para cualquier tipo de complicación. La OR para complicaciones varió hasta un orden de magnitud para distintos antecedentes (figs. 2 y 3).
Distribución del riesgo de complicación tras el tratamiento inicial de cada uno de los componentes del índice de comorbilidades de Charlson.
CAL: colecistitis aguda litiásica; CH: cirrosis hepática; CI: intervalo de confianza; EPOC: enfermedad pulmonar obstructiva crónica; IAM: infarto agudo de miocardio.
Distribución del riesgo de complicación grave (Clavien-Dindo > IIIa) tras el tratamiento inicial de cada uno de los componentes del índice de comorbilidades de Charlson.
CAL: colecistitis aguda litiásica; CH: cirrosis hepática; CI: intervalo de confianza; EPOC: enfermedad pulmonar obstructiva crónica; IAM: infarto agudo de miocardio.
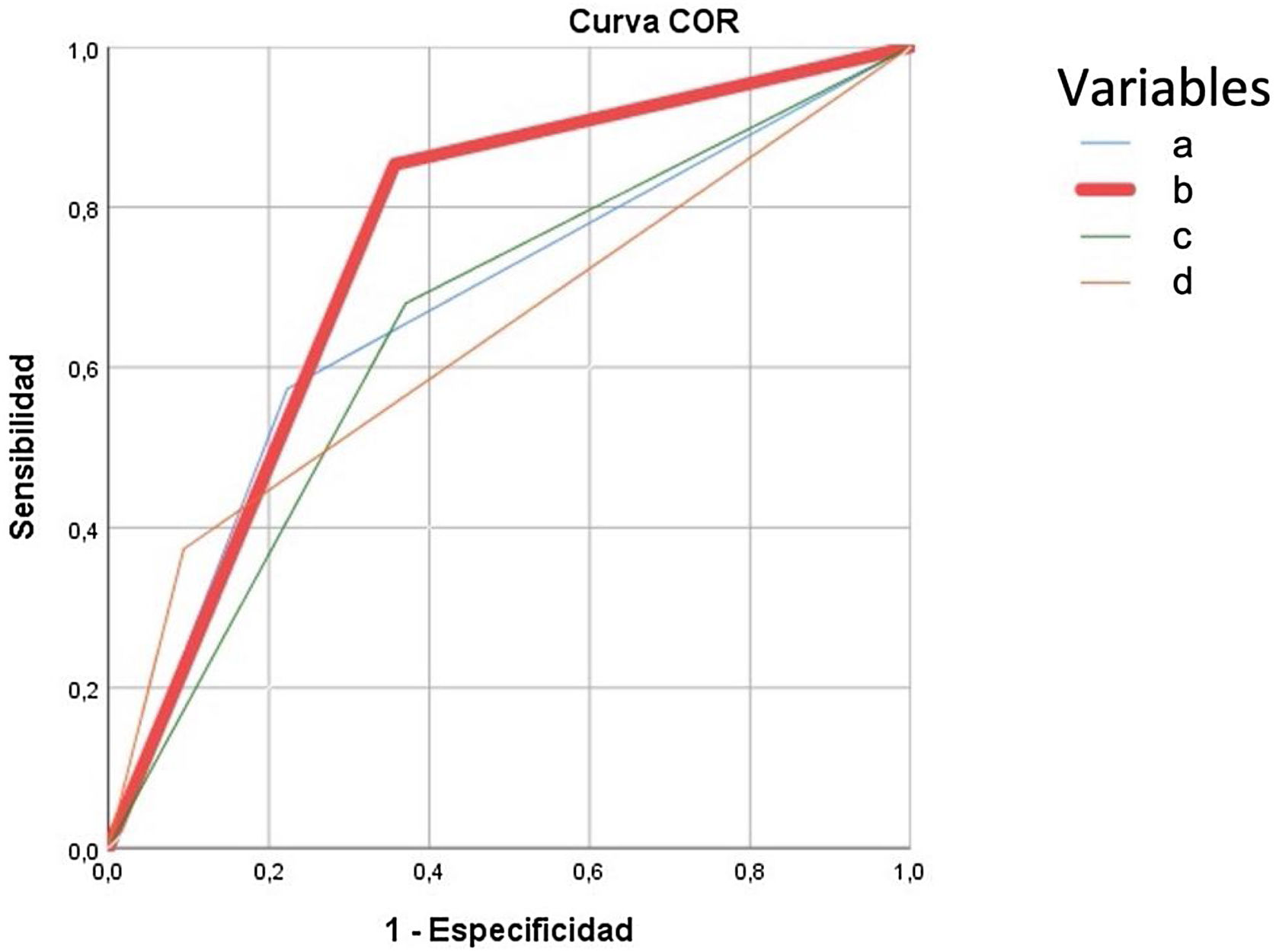
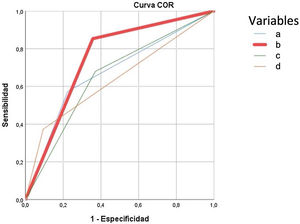
El modelo predictivo de complicaciones graves (Clavien-Dindo≥IIIb) retuvo el ASA III-IV, diagnóstico de tumor sólido sin metástasis e insuficiencia renal, para predecir el 90,1% de las complicaciones. La presencia de cualquiera de las tres variables de complicación grave obtuvo mayor área bajo la curva ROC (75%) que la edad> 80 años (67%), el CCI>5 (66%) o la CAL grave (65%) según TG18 ilustradas en la figura 4.
Curva ROC para predicción de complicaciones graves tras tratamiento de la colecistitis aguda litiásica. Se construye con las variables obtenidas en análisis multivariante, para la variable edad mayor o superior a 80 años, Charlson Comorbidity Index (CCI) mayor a 5 y colecistitis aguda litiásica (CAL) grave. Cada una de las curvas se corresponden a:
Edad mayor o igual a 80 años: AUC 0,675 (95CI: 0,60-0,74).
Curva modelo predictivo: presencia de cualquiera de las variables predictoras de complicaciones graves en la CAL (ASA > 2; cualquier tumor maligno actual; insuficiencia renal moderada grave) AUC: 0,75 (95CI: 0,7-0,8).
Curva CAL grave TG18: pacientes catalogados de CAL grave según las TG18, AUC 0,65 (95CI: 0,56-0,71).
Curva CCI> 5: AUC 0,66 (95CI: 0,56-0,71).
Para cualquier tipo de complicación, el modelo predictivo retuvo el ASA III-IV, demencia, EPOC, insuficiencia renal crónica e INR>1,5 como variables independientes para cualquier tipo de complicación tras indicar un tratamiento inicial, y así pronosticó correctamente el 69,3% de los pacientes con complicaciones.
Utilizando los factores de riesgo identificados en el análisis multivariante (ASA>2, cualquier tumor maligno e insuficiencia renal), según el Propensity Score Matching se seleccionaron dos grupos de 75 pacientes con gravedad similar (75 complicaciones graves y 75 sin complicaciones graves) en los que el TQ (134) presentó una tasa similar de complicaciones graves que el TNQ (16) (48,5 vs. 62,5%; P=0,214). La mortalidad en el TQ fue del 15 vs. el 21% en el TNQ P=0,5.
MortalidadLa mortalidad en la serie fue del 3,6%. Los pacientes que murieron en los 30 días posteriores al tratamiento fueron 20 años mayores y presentaron ASA y CCI más elevados. La mortalidad en las CAL graves fue 9 veces mayor que en las CAL leves. El TNQ ocasionó una mortalidad 6 veces mayor que el TQ. No se hallaron diferencias significativas entre los pacientes que se trataron exclusivamente con antibióticos y a los que se les indicó una CP (15 vs. 22%; P=0,62). La colecistectomía abierta presentó una mortalidad del 20% vs. el 1% de la colecistectomía laparoscópica (P=0,001). En los pacientes que se rescataron quirúrgicamente debido a una evolución tórpida de la CAL con TNQ, la mortalidad fue del 11%.
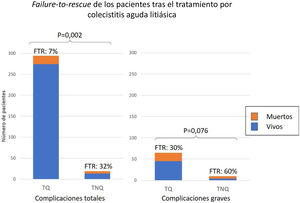
Fallo de rescateEntre los 313 pacientes que sufrieron complicaciones, el FTR fue del 8% y fue significativamente mayor en aquellos con TNQ (32 vs. 7%; P=0,002). Entre los 75 con complicación grave, el FTR tras TNQ fue el doble que tras TQ (60 vs. 30% P=0,076) (fig. 5).
DiscusiónEn esta revisión retrospectiva de colecistitis agudas tratadas mayoritariamente con colecistectomía laparoscópica sin adherencia a las recomendaciones de las TG18, se ha identificado que no todos los factores de riesgo recogidos por las TG18 tienen la misma relevancia para la predicción de complicaciones.
La estricta selección de pacientes es un rasgo distintivo de este estudio. Se excluyeron 238 pacientes, obteniendo una cohorte homogénea con CAL «pura» evitando así la distorsión de otros diagnósticos concomitantes en el pronóstico22,23. Algunos artículos fuente de las TG18, analizan cohortes heterogéneas mezclando distintas etiologías de la colecistitis aguda1,6,22,23 o únicamente excluyen colecistitis crónica24 creando «ruido estadístico» para el análisis. Algunos artículos intentan una selección fina de pacientes25, pero hasta ahora, esta esencial selección tan precisa no se ha publicado.
Este estudio es fruto de un meticuloso registro en una Unidad de Urgencias donde el TNQ, recomendado en TG18, apenas se ha utilizado. Únicamente se aplicó TNQ al 5% de pacientes, aunque el 40% de pacientes presentó CAL grave, actitud adoptada también por otros grupos expertos en CAL3,13,26–28.
La tasa de CAL graves en nuestra cohorte fue mayor (30%) que en otras series (5-19%)1,28–30, probablemente debido a una mayor proporción de disfunción respiratoria, neurológica e INR ≥ 1,5 en nuestros pacientes.
El porcentaje de complicaciones (43%) fue mayor que en estudios multicéntricos1,8,11. Las tasas de complicaciones graves en esta serie fueron el 24% para el TNQ y 7% para el TQ, superior a los reportados en la literatura. Probablemente deban considerarse tres factores para explicar esta alta tasa de complicaciones. En primer lugar, al descartar los pacientes colecistectomizados en el quirófano de urgencias, pero sin una colecistitis aguda «pura», reducimos el denominador de las complicaciones y aumenta su tasa. Asimismo, refleja el alto porcentaje de CAL graves en nuestra población de referencia, tal como atestigua el elevado CCI de los pacientes de este estudio. Finalmente, es plausible que el efecto del registro prospectivo honesto y minucioso de las complicaciones en las auditorías regladas realizadas en nuestro servicio aumente el número de complicaciones, especialmente las no graves, en esta serie. La edad de los pacientes que sufrieron complicaciones fue mayor que en los no complicados. Es probable que la aplicación de escalas de fragilidad, sumado a la optimización preoperatoria de algunos pacientes, disminuya este porcentaje drásticamente. No obstante, se ha descrito recientemente que la recurrencia precoz en los pacientes añosos que no se operaron en el episodio índice es superior y con mayor gravedad que el episodio inicial31.
Las complicaciones en los grupos con CAL leve y moderada (32% y 36%) resultan similares y significativamente menores que en las CAL graves (55%). Probablemente los algoritmos clínicos actuales32 se podrían beneficiar de la simplificación en la clasificación de la CAL en 2 grupos: CAL leves y graves.
El PSM se ha utilizado ocasionalmente para comparar grupos similares en estudios de CAL33,34. En esta serie la diferencia en la tasa de complicaciones entre TNQ y TQ de gravedad similar fue solo de 14%, reflejando probablemente que muchas de las complicaciones no están directamente relacionadas con el tratamiento quirúrgico, tal como ocurre en otros estudios35.
La mortalidad de CAL en las TG18 es <1%7. En este estudio, la mortalidad es sustancialmente mayor (3,6%) que en estudios multicéntricos recientes (0,6-13,5%)1,29,36,37. En nuestra serie, 5/26 éxitus ocurrieron más de 30 días tras el tratamiento; sin ellos, la mortalidad hubiera sido del 2,8%. De incluir los diagnósticos «cólico hepático persistente» y «CAL tras CPRE» como en muchos estudios, reportaríamos una mortalidad engañosamente baja del 1,8% y sin embargo similar a la literatura internacional4,38.
La identificación del paciente de alto riesgo en los algoritmos de CAL es fundamental. Algunos autores coinciden con las TG18 y consideran como alto riesgo a todo paciente con disfunción orgánica6. Los pacientes ASA-III/IV son considerados de alto riesgo39 y presentan elevada morbilidad1,40. No obstante, González-Muñoz et al. en un estudio prospectivo observacional, comprobaron que el grado de colecistitis y el score P-POSSUM eran los dos únicos predictores de mortalidad en la CAL, al contrario que la edad o los scores ASA o CCI11.
Aunque las TG18 no excluyen la colecistectomía como tratamiento inicial en las CAL grupo III (graves), la restringen a «centros avanzados» (sin definir centro avanzado) y además solo para pacientes con «Good Performance Status». La inclusión de esta última condición, extrapolada de los pacientes con cáncer, es sorprendente al no especificar a cuál de las numerosas Performance Status se refieren. En cualquier caso, más de un 40% de las CAL de esta serie estarían clasificados de alto riesgo y probablemente no hubieran recibido una colecistectomía precoz. No obstante, consideramos que un ASA>2 y una CAL grave (TG18) no contraindican siempre un TQ.
En algunos estudios, la edad aparece como factor de riesgo independiente41, pero por sí sola no incrementa el riesgo quirúrgico. La baja capacidad funcional sumada a la comorbilidad constituyen el mayor riesgo de morbilidad tanto en este como en otros estudios42. La aplicación de índices de fragilidad y un abordaje multidisciplinar podrían contribuir a un mejor juicio clínico.
Disponemos de distintas escalas genéricas que predicen el riesgo de complicaciones (APACHE II>158, CCI>61 y P-POSSUM>4010,11), ninguna de ellas específica para la CAL y, por tanto, ninguna resulta particularmente precisa ni superior a otra.
Los pacientes con TNQ presentaron una mortalidad 6 veces mayor que los pacientes tratados con TQ. Los nueve pacientes que presentaron una evolución desfavorable con antibiótico y fueron intervenidos, presentaron una elevada mortalidad (11%) y más de un 50% de complicaciones. Un estudio observacional multicéntrico comparó 4 estrategias (antibiótico intravenoso, colecistostomía como puente a cirugía, como tratamiento definitivo, y colecistectomía precoz). Sus resultados apoyan la colecistectomía precoz como superior a cualquier otra opción40. El tratamiento quirúrgico es la primera opción para el tratamiento de la CAL, incluso en pacientes de alto riesgo, como demuestra el CHOCOLATE trial, que compara colecistectomía precoz vs. CP en pacientes con APACHE entre 7 y 15 en CAL no seleccionadas8.
La complejidad de la evolución del TNQ se plasma en la figura 1: hay pacientes que solo se tratan con antibiótico, otros que inicialmente se indica una CP y otros en los que su evolución transcurre episódicamente por cada una de las opciones terapéuticas hasta ser intervenidos. En cada estudio no aleatorizado hay pacientes inicialmente no quirúrgicos (análisis por intención a tratar) que migran de tratamiento en su evolución (análisis por protocolo). Esta circunstancia, contribuye indudablemente a mantener la incertidumbre sobre el mejor tratamiento para los pacientes de alto riesgo.
El FTR se ha propuesto como indicador de calidad en cirugía18,19. El elevado FTR del grupo de TNQ (32%) está probablemente condicionado por la elevada fragilidad de los pacientes en los que se limitó el esfuerzo terapéutico.
Limitaciones del estudioLa principal limitación del estudio es su naturaleza retrospectiva y unicéntrica. Contrariamente, la baja tasa de TNQ proporciona a esta cohorte más validez para determinar los factores de riesgo de complicación postoperatoria, sobre todo en las CAL graves1,8. No obstante, la baja tasa de TNQ puede contribuir a un sesgo de selección.
Los pacientes de esta serie presentan una patología evolucionada, por lo que sufren un elevado número de complicaciones. No obstante, creemos que esta característica proporciona más robustez al análisis.
El seguimiento de los pacientes fue de 30 días tras el diagnóstico o la cirugía. Sería interesante realizar seguimiento al año, pues seguramente emergerían otras complicaciones11.
La prevalencia de algunos factores de riesgo en nuestro estudio, como taquipnea, PAFI<300, leucemia, linfoma y VIH es baja, y los resultados obtenidos pueden no resultar extrapolables a otras poblaciones.
ConclusionesLa colecistectomía precoz es el tratamiento recomendado para la CAL. La clasificación de la CAL sería más práctica si utilizáramos solo 2 grupos: CAL leve y grave. De todos los factores de riesgo expresados en las TG18, los que conllevan mayor riesgo de complicaciones graves en pacientes con CAL son ASA>II, diagnóstico de tumor sólido sin metástasis e insuficiencia renal. Los pacientes sin intervención quirúrgica que han sufrido alguna complicación presentan una mayor mortalidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.