Existe controversia en la literatura en cuanto a cuál es la mejor técnica de duodenopancreatectomía cefálica (DPC), si la de la preservación pilórica (DPC-PP) o la de Whipple (con antrectomía [DPC-W]), asociándose la primera a una mayor frecuencia del retraso en el vaciamiento gástrico (RVG).
MétodosEstudio retrospectivo y comparativo entre la técnica DPC-PP (n=124 pacientes) y la DPC-W (n=126), utilizadas en pacientes operados, entre 2012 y 2023, por tumores de cabeza de páncreas y periampulares.
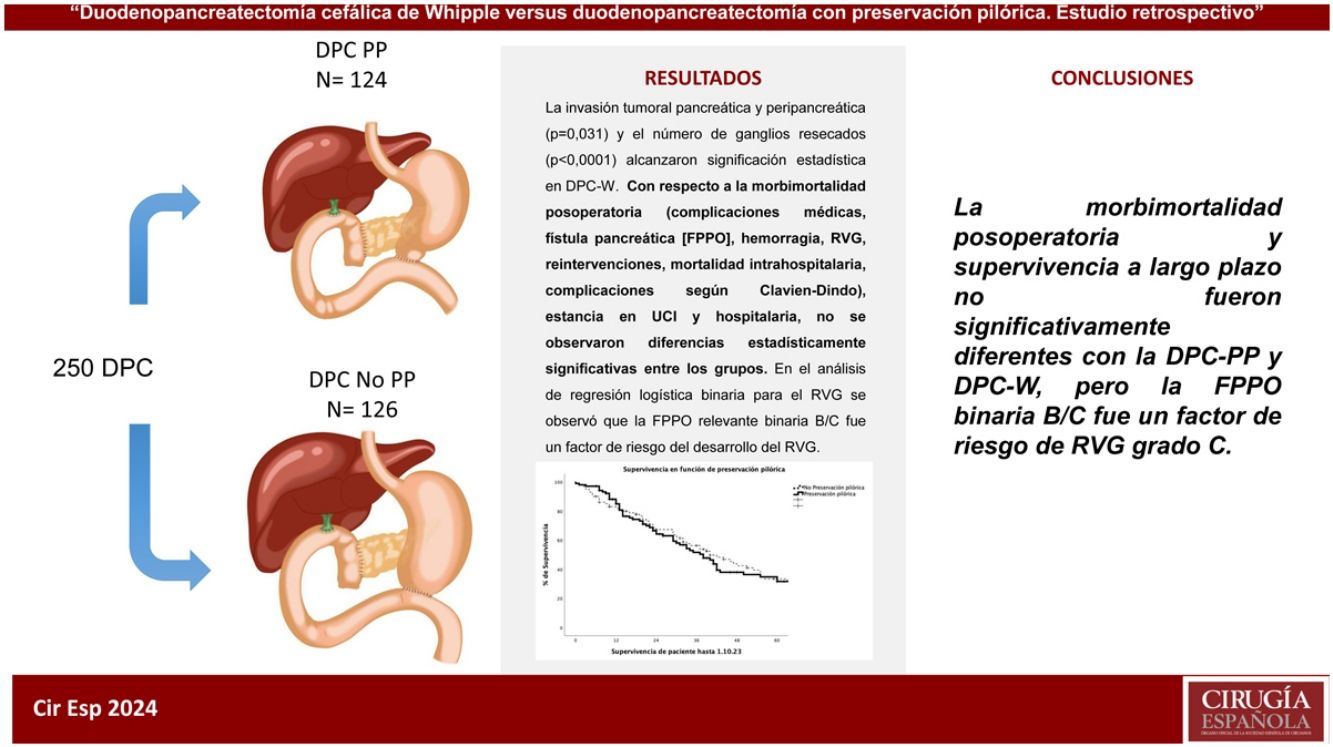
ResultadosEl tiempo de cirugía fue mayor, aunque no significativo, con la técnica de DPC-W. La invasión tumoral pancreática y peripancreática (p=0,031) y el número de ganglios resecados (p<0,0001) alcanzaron significación estadística en DPC-W, aunque no hubo diferencias significativas entre los grupos en cuanto a la invasión tumoral ganglionar.
Con respecto a la morbimortalidad postoperatoria (complicaciones médicas, fístula pancreática [FPPO], hemorragia, RVG, reintervenciones, mortalidad intrahospitalaria, complicaciones según Clavien-Dindo), estancia en UCI y hospitalaria, no se observaron diferencias estadísticamente significativas entre los grupos. Durante el seguimiento tampoco se observaron diferencias significativas entre los grupos con relación a la morbimortalidad a 90 días y supervivencia a 1, 3 y 5 años. En el análisis de regresión logística binaria para el RVG se observó que la FPPO relevante binaria B/C fue un factor de riesgo del desarrollo del RVG.
ConclusionesLa morbimortalidad postoperatoria y supervivencia a largo plazo no fueron significativamente diferentes con la DPC-PP y DPC-W, pero la FPPO binaria B/C fue un factor de riesgo de RVG grado C.
Controversy exists in the literature as to the best technique for pancreaticoduodenectomy (PD), whether pyloric-preserving (PD-PP) or Whipple's technique (with antrectomy [PD-W]), the former being associated with a higher frequency of delayed gastric emptying (DGE).
MethodsRetrospective and comparative study between PD-PP technique (n=124 patients) and PD-W technique (n=126 patients), in patients who were operated for tumors of the pancreatic head and periampullary region between the period 2012 and 2023.
ResultsSurgical time was longer, although not significant, with the PD-W technique. Pancreatic and peripancreatic tumor invasion (p=0.031) and number of lymph nodes resected (p<0.0001) reached statistical significance in PD-W, although there was no significant difference between the groups in terms of lymph node tumor invasion.
Regarding postoperative morbimortality (medical complications, postoperative pancreatic fistula [POPF], hemorrhage, RVG, re-interventions, in-hospital mortality, Clavien-Dindo complications), ICU and hospital stay, no statistically significant differences were observed between the groups. During follow-up, no significant differences were observed between the groups for morbidity and mortality at 90 days and survival at 1, 3 and 5 years. Binary logistic regression analysis for DGE showed that binary relevant POPF grade B/C was a significant risk factor for DGE.
ConclusionsPostoperative morbidity and mortality and long-term survival were not significantly different with PD-PP and PD-W, but POPF grade B/C was a risk factor for DGE grade C.
La duodenopancreatectomía cefálica (DPC) es el tratamiento estándar para los tumores benignos y malignos de la cabeza de páncreas y región periampular1. La DPC de Whipple (DPC-W) consiste en una resección en bloque de la cabeza del páncreas, duodeno, vesícula, vía biliar distal, antrectomía y linfadenectomía de los ganglios adyacentes con reconstrucción gastrointestinal2, mientras que en la técnica de preservación pilórica la única diferencia con la anterior es que se mantiene el antro, píloro y 2-3cm del duodeno proximal (DPC-PP), modificación ideada, en 1944, por Watson3, y reintroducida, en 1978, por Traverso y Longmire4.
La utilización de una u otra técnica ha generado controversia en la literatura en cuanto a cuál es la que se asocia a mejores resultados. Así, en varios estudios se han observado similares resultados con la DPC-PP y la DPC-W con respecto al tiempo quirúrgico, pérdida de sangre y transfusión intraoperatoria5–9, morbimortalidad postoperatoria, supervivencia global5,10–12 y estatus nutricional y calidad de vida8, aunque en un estudio reciente la DPC-PP fue un factor de riesgo de complicaciones a largo plazo (estenosis biliar, colangitis o pancreatitis)12. Por otro lado, en varios estudios se observó que el tiempo operatorio, pérdida sanguínea intraoperatoria y necesidad de transfusión fueron significativamente menores en pacientes con DPC-PP10,11,13.
El retraso en el vaciamiento gástrico (RVG) es una complicación frecuente post-DPC, asociada a estancia hospitalaria prolongada, con una incidencia discordante entre los diferentes estudios comparativos entre la DPC-W y la DPC-PP, refiriéndose una incidencia significativamente más alta de RVG con la DPC-PP10,14–17, mientras que otros autores muestran similares incidencias de RVG con ambas técnicas5,6,8,18–20. De esta manera, los actuales resultados de los diferentes estudios publicados son muy heterogéneos y no arrojan evidencias concluyentes de la superioridad de una de las dos técnicas.
El objetivo de este estudio fue comparar los resultados obtenidos con la utilización de las técnicas referidas en pacientes con tumores de la cabeza de páncreas y región periampular.
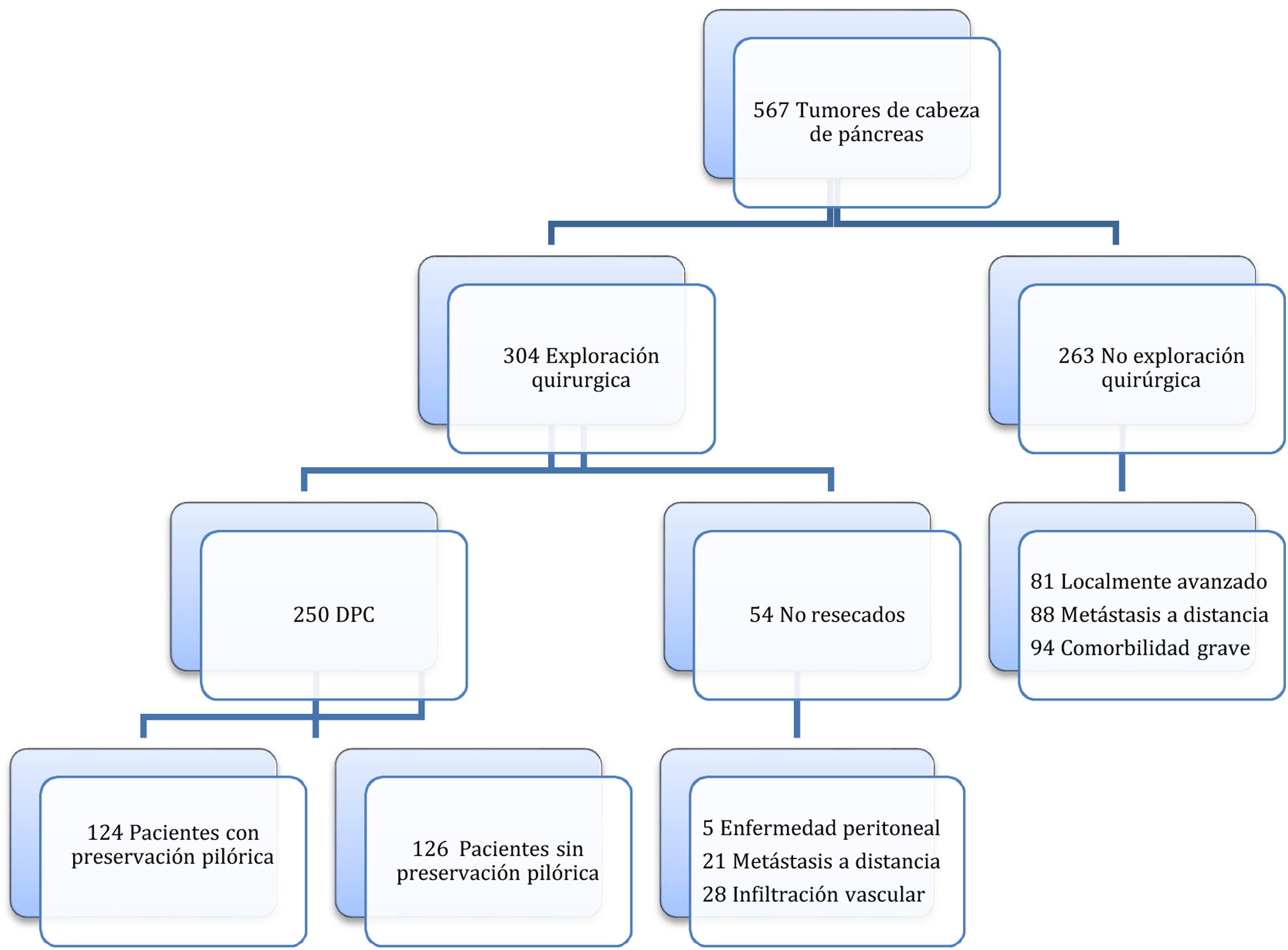
MétodosDesde enero del 2012 hasta febrero del 2023, se diagnosticaron en nuestro centro un total de 567 pacientes con tumores de cabeza de páncreas o de la región periampular, entre los cuales, de entrada, se contraindicó la cirugía en 263 pacientes por enfermedad tumoral avanzada o por comorbilidad grave asociada, indicándose la cirugía en los 303 restantes. Sin embargo, entre este grupo de pacientes la DPC se pudo realizar en 250. Esta muestra de pacientes se dividió en 2 grupos: 1) DPC-PP (n=124; 49,6%); y 2) DPC-W (n=126; 50,4%). (fig. 1). La preservación o resección pilórica (antrectomía) se realizó según la localización del tumor y preferencias de los cirujanos.
El presente estudio es retrospectivo de cohortes y comparativo. Se realizó una comparación entre los grupos analizando las variables preoperatorias, perioperatorias, morbimortalidad a 90 días, supervivencia a 1, 3, y 5 años y un análisis multivariable de los eventuales factores de riesgo de RVG.
El seguimiento de los pacientes de esta serie fue de un mínimo de 6 meses, cerrándose el estudio a finales de agosto de 2023, no objetivándose la pérdida de ninguno de los pacientes de los grupos para la revisión final. El consentimiento informado lo firmaron todos los pacientes antes de la cirugía. El estudio se ha realizado siguiendo las normas de la Declaración de Helsinki de 1964 y posteriores enmiendas. El estudio ha sido aprobado por el Instituto de Investigación, pero no ha sido evaluado por el Comité de Ética al tratarse de un estudio retrospectivo.
Drenaje biliar preoperatorio y técnica quirúrgicaEl drenaje biliar preoperatorio se colocó cuando la bilirrubina total era superior a 15mg/dL. La DPC-PP se realizó cuando el tumor era distal al duodeno pudiendo mantener 2-3cm de duodeno proximal al píloro con márgenes libres de tumor. La DPC-W se efectuó cuando el tumor se hallaba próximo a la primera porción duodenal, y consistió en una gastrectomía distal (20-30% de estómago) sin vagotomía. En presencia de invasión parcial de la vena porta o mesentérica superior se resecó el segmento de la pared venosa afectada con posterior sutura o anastomosis término-terminal. La reconstrucción pancreático-yeyunal término-lateral (ducto-mucosa, biplano) y la bilio-yeyunal siguieron la técnica previamente publicada21. La utilización o no de un tutor anastomótico pancreático-yeyunal se basó en la experiencia y preferencia del cirujano y la presencia de factores de riesgo (diámetro del Wirsung <3mm y consistencia blanda del páncreas). La duodeno-yeyunostomía, en caso de DPC-PP o la gastro-yeyunostomía, en caso de DPC-W, se realizaron en posición antecólica, a 55-60cm de la hepático-yeyunal, en término-lateral (biplano y sutura continua). Según las preferencias de los cirujanos, en determinados casos se realizó una gastro-yeyunostomía término-lateral y yeyuno-yeyunostomía término-lateral a pie de asa (Y de Roux) para evitar el reflujo de la secreción pancreático-yeyunal al estómago. Los bordes analizados por anatomía patológica son el margen posterior de la cabeza del páncreas y AMS, eje de vena porta y VMS y borde de sección pancreático. Se considera resección R1 cuando existe celularidad tumoral a menos de 1mm del margen de resección.
Cuidados perioperatoriosSe colocó sonda nasogástrica (SNG) a todos los pacientes. Se realizó profilaxis antibiótica con 2g de cefazolina i.v. y se administró nutrición parenteral hasta iniciar tolerancia oral. En ausencia de complicaciones (fístula, hemorragia, infección) y con cifras de amilasa por el drenaje <400UI, se retiró la SNG hacia el 3.er-4.o día y los drenajes abdominales hacia el 4.o-5.o día. La tolerancia oral progresiva se inició al día siguiente de retirar la SNG.
Las fístulas pancreáticas postoperatorias (FPPO) se clasificaron según los criterios del ISGPF22, la hemorragia postoperatoria según los criterios del ISGPF23 y el RVG también según los criterios del ISGPS24. Las complicaciones quirúrgicas se definieron según la clasificación de Clavien25, considerándose graves las de grado ≥III. La mortalidad intrahospitalaria se definió como la acaecida durante el ingreso.
Análisis estadísticoLas variables cualitativas se expresaron como el valor absoluto y su frecuencia relativa como porcentaje. La relación entre ellas fue analizada con la prueba de chi-cuadrado o el test exacto de Fisher, según conveniencia. Las variables cualitativas se expresaron como mediana y percentiles absolutos (P0-P100). La relación entre las variables cualitativas se investigó mediante la prueba de la U de Mann-Whitney.
Todas las variables clínicamente relevantes en el análisis univariante, especialmente aquellas con p<0,05, fueron empleadas utilizando la prueba de regresión logística binaria para valorar su influencia sobre la presencia del RVG grado C. Los resultados se expusieron como odds ratios (OR) y el intervalo de confianza del 95% (IC). El análisis de supervivencia se realizó mediante las curvas de Kaplan-Meier y la prueba de log-rank. Un valor de p<0,05 se consideró estadísticamente significativo. Para el análisis estadístico se utilizó el SPSS Statistics, versión 26 (SPSS, Inc., Chicago, IL).
ResultadosCaracterísticas preoperatorias. En la comparación de las variables preoperatorias como la edad, sexo, ASA, IMC, antecedentes personales y clínica, no se observaron diferencias estadísticamente significativas entre ambos grupos (DPC-PP y DPC-W), con la excepción de la obstrucción duodenal, que fue significativamente más frecuente en los pacientes con DPC-W (p=0,049). En cuanto a las pruebas diagnósticas de imagen, la colangiopancreatografía retrógrada endoscópica se realizó con una frecuencia significativamente mayor en el grupo DPC-PP (p=0,013). El tamaño del tumor detectado por pruebas de imagen fue significativamente mayor en el grupo DPC-W (p=0,017). En la comparación del calibre de la vía biliar y el conducto de Wirsung, colocación de prótesis biliar preoperatoria, biopsia o citología preoperatoria no hubo diferencias significativas entre los grupos. En la comparación de los parámetros de laboratorio sólo el valor mediano del CEA fue significativamente mayor en el grupo DPC-W (p=0,042), mientras que no hubo diferencia significativa respecto al valor del CA 19-9 entre los grupos. La quimioterapia, aplicada con mayor frecuencia a los pacientes del grupo DPC-W, no alcanzó diferencia significativa entre los grupos (tabla 1).
Características preoperatorias de los pacientes
| DPC-PP | DPC-W | p | |
|---|---|---|---|
| n=124 | n=126 | ||
| Edad (años) | 68 (16-87) | 66 (27-89) | |
| Sexo (V/M) | 66/58 | 69/57 | 0,808 |
| (53,2%/46,8%) | (54,8%/45,2%) | ||
| ASA | 0,499 | ||
| I | 11 (8,9%) | 9 (7,1%) | |
| II | 54 (43,5%) | 53 (42,1%) | |
| III | 53 (42,7%) | 61 (48,4%) | |
| IV | 6 (4,8%) | 3 (2,4%) | |
| IMC (kg/m2) | 24,7 (16-43,3) | 25,4 (14-42,7) | 0,193 |
| Antecedentes personales | |||
| HTA | 54 (43,5%) | 55 (43,7%) | 0,987 |
| Cardiovascular | 45 (36,3%) | 44 (34,9%) | 0,599 |
| Diabetes mellitus | 30 (24,2%) | 35 (27,8%) | 0,388 |
| Patología respiratoria | 25 (20,2%) | 25 (19,8%) | 0,500 |
| Fumador | 23 (18,5%) | 31 (24,6%) | 0,077 |
| Patología tumoral | 21 (16,9%) | 16 (12,7%) | 0,346 |
| Bebedor | 14 (11,3%) | 19 (15,1%) | 0,635 |
| Clínica | |||
| Ictericia | 80 (64,5%) | 75 (59,5%) | 0,416 |
| Pérdida de peso | 58 (46,6%) | 66 (52,4%) | 0,375 |
| Dolor abdominal | 54 (43,5%) | 52 (41,3%) | 0,715 |
| Colangitis | 24 (19,4%) | 25 (19,8%) | 0,923 |
| Pancreatitis | 15 (12,1%) | 14(11,1%) | 0,808 |
| Hemorragia digestiva alta | 6 (4,8%) | 7 (5,6%) | 0,799 |
| Obstrucción duodenal | 3 (2,4%) | 10 (7,9%) | 0,049 |
| Pruebas diagnósticas. Hallazgos | |||
| TAC | 120 (96,8%) | 124 (98,4%) | 0,397 |
| RM | 88 (71%) | 92 (73%) | 0,718 |
| Ecoendoscopia y biopsia | 75 (60,5%) | 77 (61,1%) | 0,919 |
| CPRE | 74 (59,7%) | 56 (44,4%) | 0,013 |
| CTPH | 15 (12,1%) | 16 (12,7%) | 0,885 |
| Tamaño del tumor (cm) | 2 (0,2-7,1) | 2,4 (0,2-6) | 0,017 |
| Tamaño de la vía biliar (cm) | 1,2 (0,4-3,1) | 1,2 (0,2-2,5) | 0,987 |
| Wirsung radiológico | 0,973 | ||
| Dilatado | 69 (55,6%) | 69 (54,8%) | |
| Normal | 55 (44,3%) | 57 (45,2%) | |
| Prótesis biliar | 0,119 | ||
| No prótesis | 62 (50%) | 77 (61,1%) | |
| Plástica | 39 (31,5%) | 38 (30,2%) | |
| Metálica | 17 (13,7%) | 8(6,3%) | |
| Catéter interno-externo | 6 (4,8%) | 3 (2,4%) | |
| Biopsia preoperatoria | 71 (57,7%) | 77 (61,1%) | 0,586 |
| Citología preoperatoria | 21 (16,9%) | 20 (15,9%) | 0,821 |
| Laboratorio | |||
| Hemoglobina (g/dL) | 12,7 (10,3-16) | 13,1 (9,1-17,2) | 0,415 |
| Plaquetas ×103 | 235 (80-431) | 236 (59-487) | 0,610 |
| INR | 1,02 (0,70-1,44) | 1,03 (0,87-1,47) | 0,967 |
| Creatinina sérica (mg/dL) | 0,77 (0,38-2,48) | 0,78 (0,43-1,9) | 0,343 |
| Glucemia (mg/dL) | 104 (56-290) | 116 (72-304) | 0,482 |
| Na (mEq/L) | 140 (133-145) | 139 (132-145) | 0,972 |
| Albuminemia (g/dL) | 3,9 (2,6-4,8) | 3,9 (2,5-5,5) | 0,613 |
| Bilirrubinemia (mg/dL) | 2,5 (0,2-24,3) | 3,7 (0,2-28,9) | 0,899 |
| GOT (UI/L) | 51 (14-410) | 91 (12-1.140) | 0,946 |
| GPT (UI/L) | 210 (8-2.246) | 357 (10-1.954) | 0,655 |
| GGT (UI/L) | 62 (10-791) | 145 (9-1.682) | 0,143 |
| FA (UI/L) | 275 (31-2.262) | 272 (39-1.909) | 0,444 |
| LDH (U/L) | 234 (116-602) | 269 (15-624) | 0,409 |
| CA 19-9 (U/mL) | 25,4 (3-13.950) | 6,9 (17-6.713) | 0,314 |
| CEA (ng/mL) | 2,3 (0-831) | 2,7 (0-48) | 0,042 |
| Quimioterapia neoadyuvante | 11 (8,9%) | 18 (14,3%) | 0,181 |
CEA: antígeno carcinoembrionario; CPRE: colangiopancreatografía retrógrada endoscópica; CTPH: colangiografía transparietohepática; FA: fosfatasa alcalina; GGT: gamma-glutamiltransferasa; GOT: glutámico-oxalacético-transaminasa; GPT: glutámico-piruvato-transaminasa; HTA: hipertensión arterial; IMC: índice de masa corporal; LDH: lactodeshidrogenasa.
Características intraoperatorias e histológicas. El tiempo y la transfusión fueron mayores, aunque estadísticamente no significativos, con la técnica de DPC-W (380 vs. 402min; p=0,061). La consistencia del páncreas fue con frecuencia significativamente más blanda en el grupo DPC-W y mayor frecuencia de consistencia normal en el grupo DPC-PP, aunque la diferencia no alcanzó la significación estadística (p=0,065). El calibre del Wirsung, medido intraoperatoriamente, fue similar en ambos grupos. La reconstrucción post-DPC con doble asa se realizó con una frecuencia significativamente mayor en el grupo DPC-W (p<0,0001). El drenaje de Penrose se utilizó con una frecuencia significativamente mayor en el grupo DPC-W (p<0,0001). El tipo histológico y el grado de diferenciación tumoral fueron similares en ambos grupos. La invasión tumoral (T) pancreática y peripancreática fue significativamente más agresiva en el grupo DPC-W (p=0,031), y el número de ganglios resecados fue también significativamente mayor en el grupo DPC-W (p<0,0001), aunque sin diferencias significativas entre los grupos en cuanto a la invasión tumoral ganglionar. Con respecto a la invasión tumoral macro- y microvascular y neural, resección R0, resección vascular y estadificación tumoral, no se observaron diferencias significativas entre los grupos (tabla 2).
Características intraoperatorias e histológicas
| DPC-PP | DPC-W | p | |
|---|---|---|---|
| n=124 | (n=126) | ||
| Tiempo de la cirugía (min) | 380 (230-685) | 402 (190-645) | 0,061 |
| Transfusión sanguínea | 18 (14,5%) | 22 (17,6%) | 0,284 |
| Consistencia del páncreas | 0,065 | ||
| Duro | 55 (44,3%) | 59 (46,8%) | |
| Blando | 24 (19,3%) | 37 (29,4%) | |
| Normal | 45 (36,3%) | 30 (23,8%) | |
| Calibre Wirsung (intraoperatorio) | 0,799 | ||
| >3mm | 64 (51,6%) | 66 (52,4%) | |
| <3mm | 60 (48,4%) | 60 (47,6%) | |
| Tipo de reconstrucción | <0,0001 | ||
| Asa única | 118 (95,2%) | 87 (69%) | |
| Doble asa | 6 (4,8%) | 39 (31%) | |
| Drenajes | <0,0001 | ||
| Jackson Pratt | 57 (45,9%) | 29 (23,1%) | |
| Penrose | 67 (54,1%) | 97 (76,9%) | |
| Histología | 0,144 | ||
| Adenocarcinoma | 76 (61,3%) | 96 (76,2%) | |
| Colangiocarcinoma | 13 (10,5%) | 5 (3,9%) | |
| Neuroendocrino | 9 (7,2%) | 5 (3,9%) | |
| Otros | 26 (20,9%) | 20 (15,9%) | |
| Grado de diferenciación | 0,862 | ||
| Bien diferenciado | 30 (24,2%) | 28 (22,2%) | |
| Moderadamente diferenciado | 45 (36,3%) | 54 (42,9%) | |
| Pobremente diferenciado | 18 (14,5%) | 23 (18,3%) | |
| No valorable | 31 (25%) | 21 (16,7%) | |
| Invasión T | 0,031 | ||
| In situ | 4 (3,2%) | 2 (1,6%) | |
| <2cm | 31 (25%) | 13 (10,3%) | |
| >2cm (limitado al páncreas) | 37 (29,8%) | 41 (32,5%) | |
| Invasión peripancreática | 32 (25,8%) | 50 (39,7%) | |
| Invasión TC o peri-AMS | 3 (2,4%) | 4 (3,2%) | |
| Número de ganglios resecados | 13 (8-53) | 17 (8-78) | <0,0001 |
| Invasión ganglionar (N+) | 67 (54%) | 70 (55,6%) | 0,858 |
| Número de ganglios+ | 1 (1-12) | 1 (1-14) | 0,580 |
| Invasión macrovascular | 18 (14,5%) | 23 (18,3%) | 0,458 |
| Invasión microvascular | 52 (41,9%) | 42 (33,3%) | 0,202 |
| Invasión neural | 54 (43,5%) | 61 (48,4%) | 0,647 |
| R0 | 87 (70,2%) | 82 (65%) | 0,637 |
| Resección vascular | 11 (8,9%) | 13 (10,3%) | 0,698 |
| Estadificación tumoral | 0,365 | ||
| IA | 19 (15,3%) | 8 (6,3%) | |
| IB | 10 (8,1%) | 13 (10,3%) | |
| IIA | 12 (9,7%) | 16 (12,7%) | |
| IIB | 34 (27,4%) | 39 (30,9%) | |
| III | 24 (19,3%) | 27 (21,4%) | |
| IV | 5 (4%) | 4 (3,2%) | |
AMS: arteria mesentérica superior; TC: tronco celiaco.
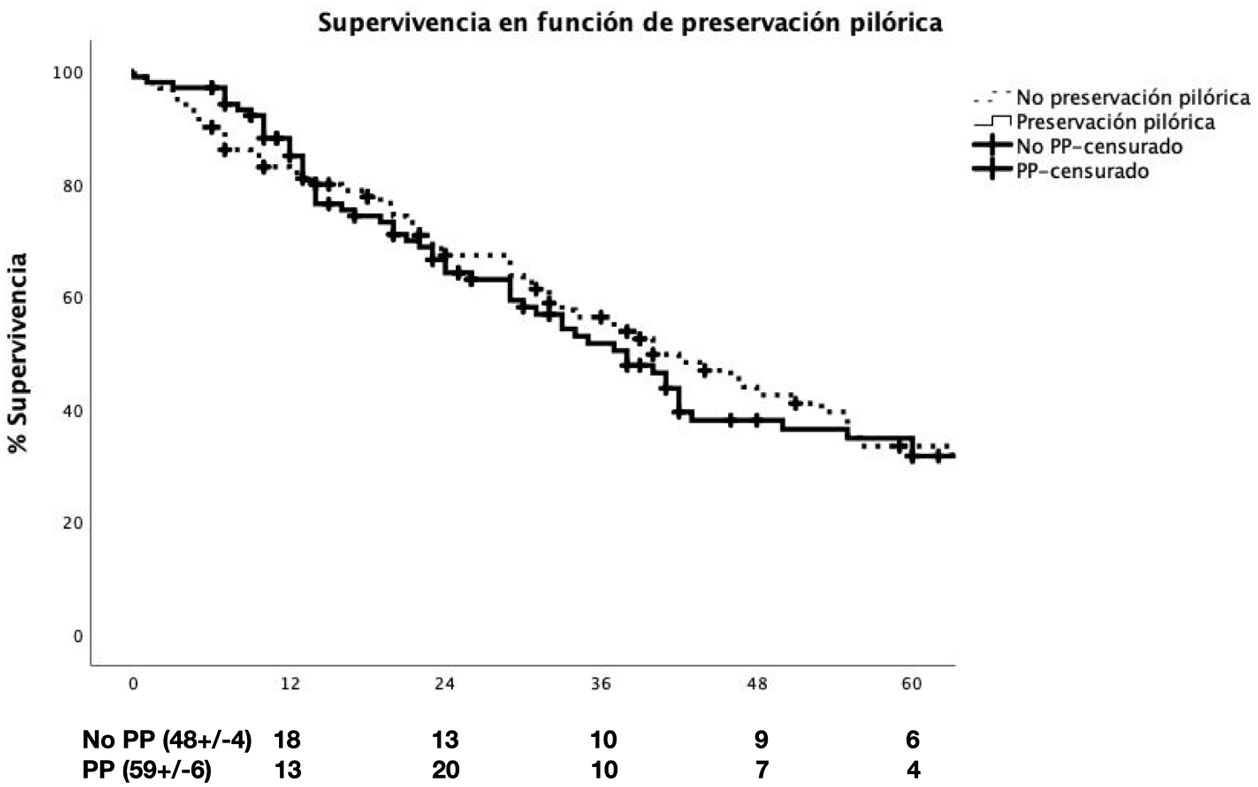
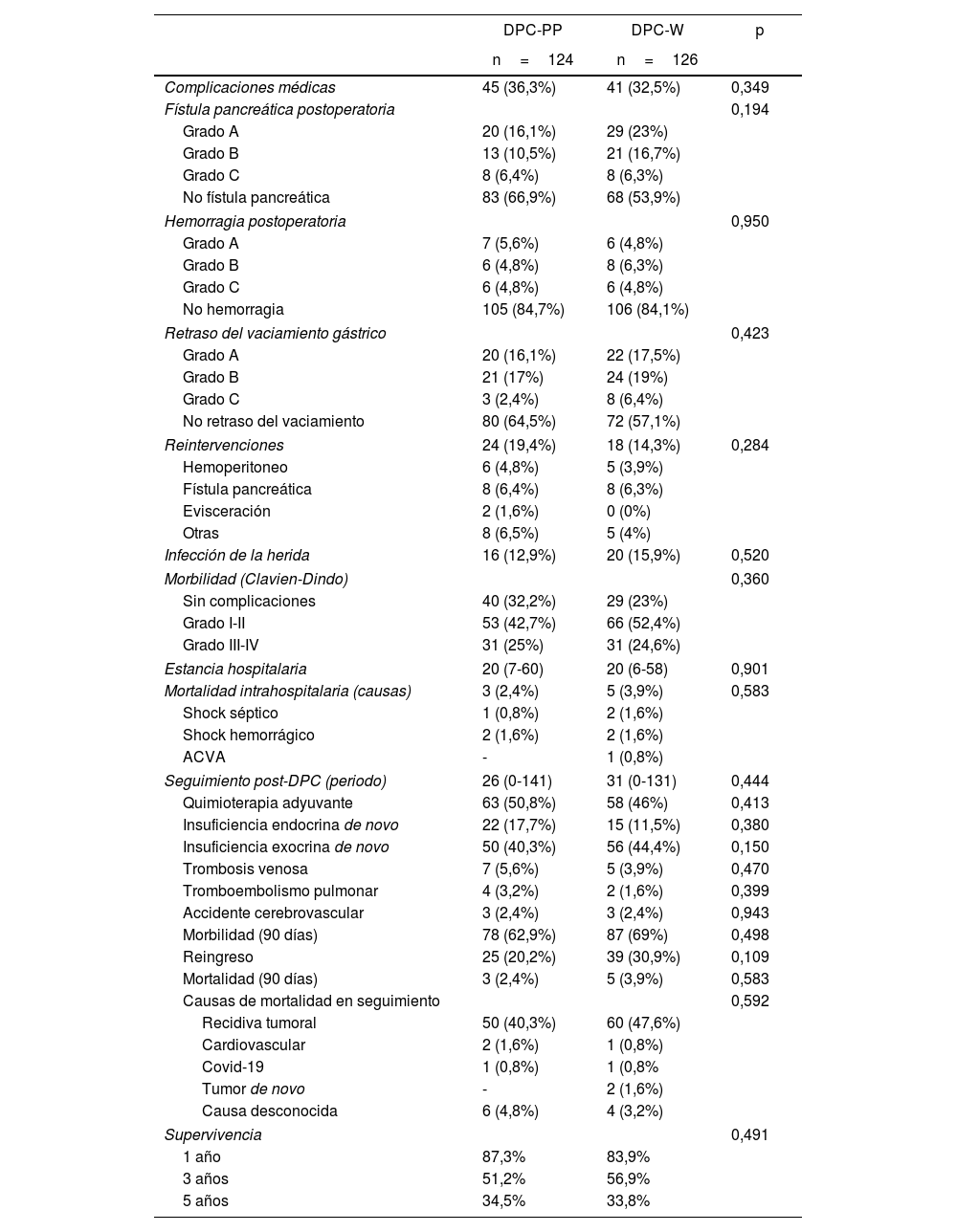
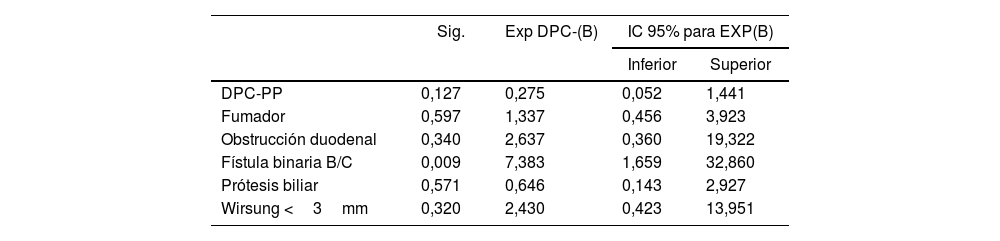
Con relación a la morbimortalidad postoperatoria (complicaciones médicas, FPPO, hemorragia, RVG, reintervenciones, mortalidad intrahospitalaria, complicaciones según Clavien-Dindo), estancia en UCI y hospitalaria, no se observaron diferencias estadísticamente significativas entre los grupos. Durante el seguimiento tampoco se observaron diferencias significativas entre los grupos respecto a la morbimortalidad a 90 días (tabla 3) y supervivencia a 1, 3 y 5 años (fig. 2). En el análisis de regresión logística binaria para el RVG se observó que la FPPO binaria B/C fue un factor de riesgo del desarrollo del RVG C (p=0,009) (tabla 4).
Morbimortalidad postoperatoria y supervivencia
| DPC-PP | DPC-W | p | |
|---|---|---|---|
| n=124 | n=126 | ||
| Complicaciones médicas | 45 (36,3%) | 41 (32,5%) | 0,349 |
| Fístula pancreática postoperatoria | 0,194 | ||
| Grado A | 20 (16,1%) | 29 (23%) | |
| Grado B | 13 (10,5%) | 21 (16,7%) | |
| Grado C | 8 (6,4%) | 8 (6,3%) | |
| No fístula pancreática | 83 (66,9%) | 68 (53,9%) | |
| Hemorragia postoperatoria | 0,950 | ||
| Grado A | 7 (5,6%) | 6 (4,8%) | |
| Grado B | 6 (4,8%) | 8 (6,3%) | |
| Grado C | 6 (4,8%) | 6 (4,8%) | |
| No hemorragia | 105 (84,7%) | 106 (84,1%) | |
| Retraso del vaciamiento gástrico | 0,423 | ||
| Grado A | 20 (16,1%) | 22 (17,5%) | |
| Grado B | 21 (17%) | 24 (19%) | |
| Grado C | 3 (2,4%) | 8 (6,4%) | |
| No retraso del vaciamiento | 80 (64,5%) | 72 (57,1%) | |
| Reintervenciones | 24 (19,4%) | 18 (14,3%) | 0,284 |
| Hemoperitoneo | 6 (4,8%) | 5 (3,9%) | |
| Fístula pancreática | 8 (6,4%) | 8 (6,3%) | |
| Evisceración | 2 (1,6%) | 0 (0%) | |
| Otras | 8 (6,5%) | 5 (4%) | |
| Infección de la herida | 16 (12,9%) | 20 (15,9%) | 0,520 |
| Morbilidad (Clavien-Dindo) | 0,360 | ||
| Sin complicaciones | 40 (32,2%) | 29 (23%) | |
| Grado I-II | 53 (42,7%) | 66 (52,4%) | |
| Grado III-IV | 31 (25%) | 31 (24,6%) | |
| Estancia hospitalaria | 20 (7-60) | 20 (6-58) | 0,901 |
| Mortalidad intrahospitalaria (causas) | 3 (2,4%) | 5 (3,9%) | 0,583 |
| Shock séptico | 1 (0,8%) | 2 (1,6%) | |
| Shock hemorrágico | 2 (1,6%) | 2 (1,6%) | |
| ACVA | - | 1 (0,8%) | |
| Seguimiento post-DPC (periodo) | 26 (0-141) | 31 (0-131) | 0,444 |
| Quimioterapia adyuvante | 63 (50,8%) | 58 (46%) | 0,413 |
| Insuficiencia endocrina de novo | 22 (17,7%) | 15 (11,5%) | 0,380 |
| Insuficiencia exocrina de novo | 50 (40,3%) | 56 (44,4%) | 0,150 |
| Trombosis venosa | 7 (5,6%) | 5 (3,9%) | 0,470 |
| Tromboembolismo pulmonar | 4 (3,2%) | 2 (1,6%) | 0,399 |
| Accidente cerebrovascular | 3 (2,4%) | 3 (2,4%) | 0,943 |
| Morbilidad (90 días) | 78 (62,9%) | 87 (69%) | 0,498 |
| Reingreso | 25 (20,2%) | 39 (30,9%) | 0,109 |
| Mortalidad (90 días) | 3 (2,4%) | 5 (3,9%) | 0,583 |
| Causas de mortalidad en seguimiento | 0,592 | ||
| Recidiva tumoral | 50 (40,3%) | 60 (47,6%) | |
| Cardiovascular | 2 (1,6%) | 1 (0,8%) | |
| Covid-19 | 1 (0,8%) | 1 (0,8% | |
| Tumor de novo | - | 2 (1,6%) | |
| Causa desconocida | 6 (4,8%) | 4 (3,2%) | |
| Supervivencia | 0,491 | ||
| 1 año | 87,3% | 83,9% | |
| 3 años | 51,2% | 56,9% | |
| 5 años | 34,5% | 33,8% | |
ACVA: accidente cerebrovascular agudo.
Regresión logística binaria para retraso del vaciamiento gástrico grado C
| Sig. | Exp DPC-(B) | IC 95% para EXP(B) | ||
|---|---|---|---|---|
| Inferior | Superior | |||
| DPC-PP | 0,127 | 0,275 | 0,052 | 1,441 |
| Fumador | 0,597 | 1,337 | 0,456 | 3,923 |
| Obstrucción duodenal | 0,340 | 2,637 | 0,360 | 19,322 |
| Fístula binaria B/C | 0,009 | 7,383 | 1,659 | 32,860 |
| Prótesis biliar | 0,571 | 0,646 | 0,143 | 2,927 |
| Wirsung <3mm | 0,320 | 2,430 | 0,423 | 13,951 |
Se observa una frecuente homogeneidad respecto a los resultados de la comparación de las variables preoperatorias entre los grupos DPC-PP y DPC-W en diferentes series13,17. Así ha ocurrido en nuestro estudio, si exceptuamos el tamaño significativamente mayor del tumor por imagen radiológica (posteriormente confirmado por el patólogo) asociado al nivel más alto de CEA en el grupo DPC-W, lo cual refleja el estadio tumoral más avanzado, similar a lo recientemente publicado en otra serie con un valor significativamente más alto del CA 19-9 y mayor frecuencia de R1 en el grupo DPC-W26.
La DPC-PP puede ofrecer varias ventajas con respecto a la DPC-W, como son la disminución significativa del tiempo de cirugía, la hemorragia intraoperatoria y la necesidad de transfusión sanguínea10,13,17,18,27. No obstante, según referencia de otros autores5,6,8, nosotros hemos observado un mayor tiempo operatorio, pérdida sanguínea y necesidad de transfusión en el grupo DPC-W, aunque sin diferencias significativas, en comparación con el grupo DPC-PP.
Una de las críticas a la utilización de la DPC-PP es la menor disección y resección oncológica que la realizada con la DPC-W, con el consiguiente riesgo de recurrencia tumoral por afectación del margen de sección duodenal8,28 y menor número de adenopatías tumorales resecadas. Asimismo, otro argumento a favor de la DPC-W es poder realizarla en todos los pacientes sin temor a la isquemia duodenal después de la DPC8. En el presente estudio, hemos comparado dos grupos de técnicas con casi el mismo número de pacientes, realizadas según las preferencias de los cirujanos, condiciones e invasión tumoral. El tamaño del tumor y su grado de invasión pancreática y peripancreática han sido significativamente mayores en el grupo DPC-W. Además, la DPC-W nos ha permitido realizar una exéresis ganglionar de un número significativamente mayor de ganglios, aunque la positividad tumoral de estos fuera similar en ambos grupos. Las tasas más altas, aunque no significativas, de invasión macrovascular y perineural y resección vascular, junto a la estadificación tumoral, nos dan más información sobre el mayor grado de invasión tumoral en el grupo DPC-W en comparación con el grupo DPC-PP.
Tanto en nuestra experiencia como en los datos referidos en la literatura se ha observado que no existen diferencias significativas en la comparación de los pacientes intervenidos mediante DPC-PP y DPC-W con respecto a las tasas de fístulas post-DPC (biliares, FPPO y gastrointestinales)6,8,10,11,17,18, morbilidad postoperatoria según Clavien-Dindo17, reintervenciones6,8,18, infección de la herida operatoria8,10,17,26, estancia hospitalaria6,10,13,18,26 y reingresos26. Además, hemos coincidido con otros estudios en cuanto a la similitud de las tasas de resección R0 y mortalidad hospitalaria con ambas técnicas8,10,11,13,26.
Hemos analizado el RVG en ambos grupos de pacientes por su alta incidencia post-DPC y asociación a la prolongación de la estancia hospitalaria. El RVG se define como la incapacidad para volver a la dieta normal al final de la primera semana post-DPC con necesidad de mantener la sonda nasogástrica24. La patogenia del RVG post-DPC no está clara, atribuyéndose a múltiples causas entre las que se incluyen las relacionadas con la cirugía, como la resección duodenal que ocasiona la ausencia de hormonas gastrointestinales5, isquemia antroduodenal por sección de la arteria pilórica29, congestión duodenal por sección de la vena gástrica izquierda30, espasmo pilórico por sección del nervio vago17,31 y complicaciones quirúrgicas (FPPO, abscesos intraabdominales o hemorragia)32.
La incidencia global del RVG en series comparativas entre DPC-PP y DPC-W se reporta entre el 10,8 y 50%, correspondiendo un 17-61,5% a la DPC-PP y un 21-50% a la DPC-W6,8,10,14–17,19, hallando una incidencia de RVG significativamente superior con la DPC-PP en 5 de estas series10,14–17. En el presente estudio la incidencia global de RVG fue del 39,2%, superior, aunque no significativamente, en el grupo DPC-W frente a DPC-PP (42,8% vs. 35,5%), de forma similar a otras series publicadas6,19. En el análisis de regresión logística binaria para el RVG se observó que la FPPO binaria B/C, pero no la DPC-PP, fue el único factor de riesgo del desarrollo del RVG, como ya han señalado otros autores17,33–38. El hecho de que la FPPO relevante B/C se haya demostrado como factor de riesgo de RVG no se ha correlacionado con una diferencia estadísticamente significativa de RVG entre DPC-PP y DPC-W17.
No observamos diferencias significativas en relación con la incidencia de morbimortalidad a 90 días, siendo las causas de mortalidad fundamentalmente debidas a recidiva tumoral, como publican otros autores26. De la misma manera que en nuestra serie, otros cirujanos muestran similares tasas de supervivencia a largo plazo en los pacientes intervenidos con ambas técnicas5,8,10,11,13.
Con la realización de una DPC-PP se ha observado una mejor calidad de vida y estado nutricional27,39, pudiendo, además, indicar algunas medidas antropométricas una mejor recuperación del paciente8. En varias series se ha demostrado una calidad de vida y estado nutricional similares con ambas técnicas8,13,14,40. Durante el seguimiento a largo plazo no hemos detectado diferencias significativas entre los grupos en relación con la función endocrina y exocrina del páncreas, recidiva tumoral y tasa de reingresos. No obstante, en una reciente publicación se ha demostrado que la DPC-W se asocia a una incidencia significativamente mayor de esteatosis hepática no alcohólica41.
Finalmente, no hay un claro acuerdo respecto a la técnica más idónea a utilizar, ya que los cirujanos se decantan por una u otra técnica en función de la menor incidencia de RVG en la DPC-W8,14,17 o la menor incidencia de hemorragia, transfusión intraoperatoria y tiempo operatorio en la DPC-PP6,18,20, ya que el resto de las complicaciones postoperatorias, mortalidad, estancia postoperatoria y supervivencia a largo plazo son similares con ambas técnicas6,8,14,17,20. Otros cirujanos indican la DPC-PP de forma general en base a que no hay motivos convincentes para sacrificar el píloro, excepto en pacientes con tumor próximo a la primera porción duodenal o isquemia de esta, en cuyo caso debe realizarse una DPC-W26,39.
Como limitación de este estudio señalamos su carácter retrospectivo con el consiguiente sesgo en la recogida de datos, la DPC realizada por varios cirujanos en la DPC, la utilización de 2 asas de intestino en 45 casos, el tiempo largo de inclusión, las diferencias preoperatorias entre los 2 grupos de pacientes y las características de los tumores y su grado de invasión.
Conclusiones. La morbimortalidad postoperatoria y supervivencia a largo plazo no fueron significativamente diferentes con la DPC-PP y DPC-W, pero la FPPO binaria B/C fue un factor de riesgo de RVG. Por tanto, ambas técnicas pueden utilizarse indistintamente, teniendo también en cuenta los márgenes de seguridad del tumor en su proximidad al duodeno.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
AutoríaIago Justo Alonso: diseño del estudio, redacción del artículo, revisión crítica y aprobación de la revisión final.
Alberto Marcacuzco Quinto: diseño del estudio y adquisición y recogida de datos.
Óscar Caso Maestro: adquisición y recogida de datos; análisis e interpretación de resultados.
Laura Alonso Murillo: adquisición y recogida de datos; análisis e interpretación de resultados.
Paula Rioja Conde: adquisición y recogida de datos; aprobación de la revisión final.
Clara Fernández Fernández: adquisición y recogida de datos.
Carlos Jiménez Romero: diseño del estudio, redacción del artículo, revisión crítica y aprobación de la revisión final.
Conflicto de interesesNinguno.