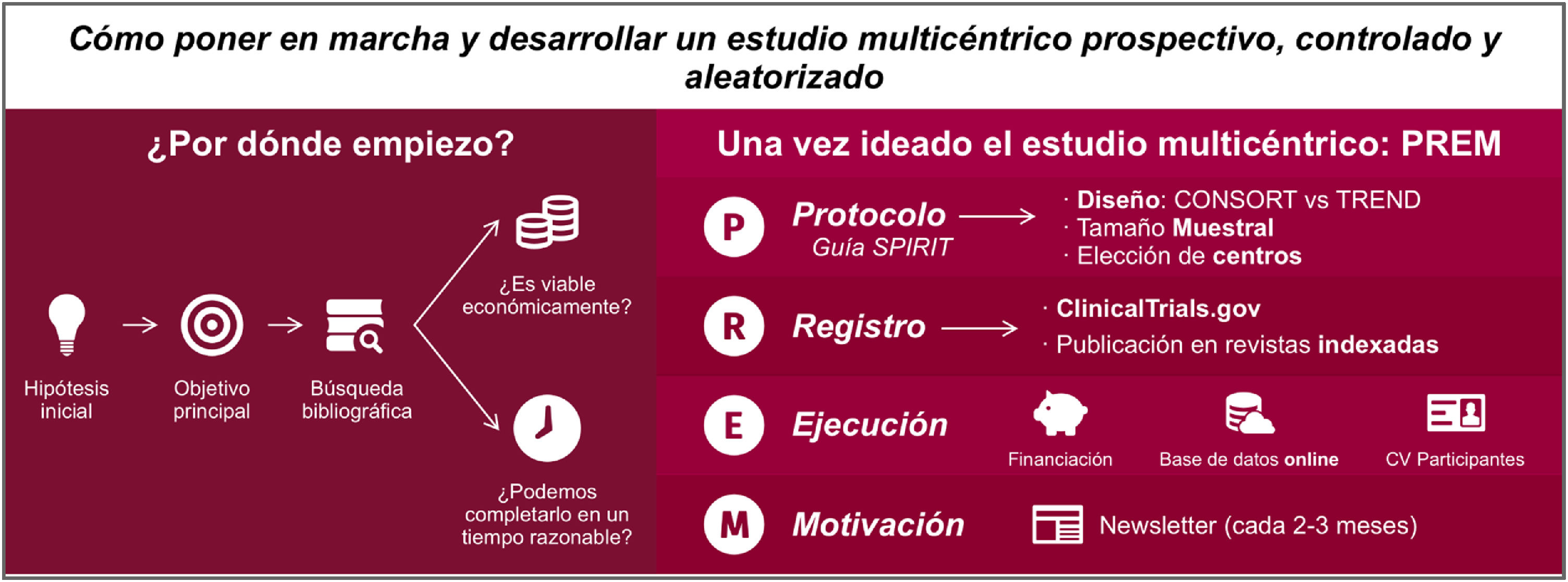
Los estudios prospectivos, controlados y aleatorizados (EPCA) son los estudios de mayor evidencia científica y validez interna, concretamente con un nivel 1a-b según el Centre for Evidence-Based Medicine de Oxford1. Aquí se resumen los pasos a seguir para su elaboración (fig. 1)2.
¿A qué problema intento dar respuesta? Esta es la pregunta por la que debe empezar todo estudio. Ejemplo: ¿Es más beneficiosa para el paciente la anastomosis intracorpórea en la hemicolectomía derecha en la cirugía del cáncer de colon?
A partir de dicha pregunta se genera una hipótesis de trabajo. Para ello, debemos determinar una variable principal que pueda dar respuesta a nuestra pregunta. Ejemplo: La anastomosis intracorpórea en la hemicolectomía derecha en la cirugía del cáncer de colon reduce el riesgo de dehiscencia de sutura.
A continuación, la hipótesis se traduce en el objetivo principal del estudio. Ejemplo: Determinar si la anastomosis intracorpórea en la hemicolectomía derecha en la cirugía del cáncer de colon reduce el riesgo de dehiscencia de sutura.
Búsqueda bibliográficaPasos para realizar una correcta búsqueda bibliográfica en las principales bases bibliográficas (Medline, Cochrane, Scopus…):
- A.
Identificación de las palabras clave de nuestra hipótesis. Recomendamos utilizar el inglés como lengua de búsqueda y, en caso de la base de datos Medline, emplear su vocabulario controlado llamado MeSH.
- B.
Combinar dichas palabras mediante el uso de operadores lógicos o «booleanos»: AND, OR, NOT.
- C.
Evaluar el resultado de la búsqueda y seleccionar los artículos de mayor interés.
El protocolo es la base para planificar, ejecutar, publicar y evaluar el estudio y sus resultados. La declaración SPIRIT 2013 (Standard Protocol items: Recomendations for Interventionals Trials)3 representa una guía común para los diferentes tipos de ensayos clínicos en la que se establecen los contenidos mínimos que debe tener el protocolo.
Según la respuesta que se pretenda buscar, existen distintos diseños de EPCA.
Diseño de EPCA de «superioridad»La finalidad de los estudios de superioridad es demostrar que un tratamiento es mejor que otro o mejor que la ausencia de tratamiento.
La guía CONSORT (Consolidated Standards of Reporting Trials)4,5 se utiliza en la elaboración de los EPCA para otorgar el mayor rigor posible a los resultados dada la posible trascendencia de sus conclusiones.
Diseño de EPCA de «no inferioridad»La finalidad de los estudios de no inferioridad radica en demostrar que un tratamiento es similar a otro, con las particularidades (p.ej., coste, seguridad, tolerancia) que pueden hacerlo más idóneo en determinados escenarios clínicos.
Del mismo modo que en los estudios de superioridad, existe la guía CONSORT adaptada a los estudios de no inferioridad6, con la recomendación para la elaboración del protocolo.
Diseño de EPCA y «no aleatorizados» de superioridad o no inferioridad. ¿Es siempre ético aleatorizar?La aleatorización es una herramienta que contribuye a la homogeneización de los grupos a comparar y evita sesgos de selección.
Sin embargo, existen ciertas excepciones donde se acepta no aleatorizar7:
- A.
Cuando uno de los grupos investigadores piensa que uno de los dos tratamientos es claramente peor.
- B.
Cuando el objetivo es evaluar el coste-efectividad de una intervención terapéutica.
- C.
Cuando el objetivo es analizar la efectividad de los tratamientos en condiciones de práctica clínica habitual, teniendo mayor experiencia en uno de ellos.
The TREND Statement8, publicado en 2004, es la guía actual recomendada para la elaboración de este tipo de estudios.
Cálculo muestralLa importancia del tamaño muestral se debe a que, sin un suficiente número de pacientes, podemos dar resultados no concluyentes con un diseño impecable. Para su cálculo, es necesario determinar una serie de variables en función del diseño del estudio.
Cálculo muestral en estudios PCA de superioridadPara este tipo de estudio, es necesario determinar:
- -
El valor de la variable principal con el tratamiento estándar.
- -
El valor de la variable principal que obtendremos con el tratamiento experimental.
- -
Riesgo α: por defecto se da el valor de 0,05-0,025.
- -
Riesgo β: se estima como prudente una potencia del 90-80% o riesgo β de 0,1-0,2.
- -
Contemplar un 10% de pérdidas.
Existen múltiples calculadoras online para calcular el tamaño muestral a partir de todos los datos comentados anteriormente. Una de las más conocidas en nuestro entorno es la calculadora de tamaño muestral GRANMO9.
Cálculo muestral en estudios PCA de no inferioridadPara este tipo de estudio es necesario determinar:
- -
El valor de la variable principal con el tratamiento estándar.
- -
El margen de no inferioridad aceptado como válido (delta [δ]). Dicho margen es determinado por el equipo investigador y se interpreta como la disminución de la eficacia de un tratamiento en relación a la de otro que es aceptada como válida.
- -
Los riesgos α y β.
- -
Contemplar un 10% de pérdidas.
Una vez determinado el diseño del protocolo y el número de pacientes necesarios a incluir, debe considerarse si el proyecto es viable desde el punto de vista de infraestructuras, económico y de duración.
¿Por qué realizar estudios multicéntricos?La respuesta es doble. Por un lado, permite reunir un mayor número de pacientes en menor tiempo. Por otra parte, concede al estudio una mayor validez externa dado que añade la reproductibilidad en varios hospitales, acercando aún más los resultados a la práctica clínica real y diluyendo el efecto de posibles particularidades de cada centro.
Búsqueda de financiaciónOtro punto determinante para la viabilidad del proyecto es calcular los gastos y buscar posibles fuentes de financiación.
La contratación de un data manager es muy recomendable para el buen funcionamiento del ensayo, porque se encargará no solo de la introducción de datos, sino de la coordinación de todas las pruebas de los pacientes y de los problemas que puedan surgir en cualquiera de los centros.
Finalmente, es también recomendable, de cara a la solicitud de becas, disponer desde un principio los curriculum vitae en formato normalizado (CVN)10 de todos los investigadores. Suele ser un requisito habitual y ahorrará tiempo.
Elección de centrosEs recomendable la elección de centros afines, a ser posible con colaboraciones exitosas previas y que muestran un claro compromiso con el estudio.
RegistroCreación de una base de datos onlinePara una correcta gestión de los datos y la aleatorización es fundamental la creación de una base de datos online. Esta puede realizarse a través de una Contract Research Organization (CRO): empresa proveedora de todos los servicios de gestión de ensayos clínicos.
Comité ético de investigaciones clínicas (CEIC)Los estudios multicéntricos prospectivos y controlados deben ser aprobados por el CEIC del centro promotor.
Registro internacional de ensayos clínicos (ClinicalTrials.gov)Todas las revistas indexadas y de alto factor de impacto solicitan, previamente al inicio del estudio, su registro en webs internacionales de ensayos clínicos. Una de las más conocidas es la ClinicalTrials.gov11.
Seguro del estudioSu función radica en responder ante posibles complicaciones o efectos adversos. Será el propio comité de ética de investigación el que dictamine la necesidad de contratar un seguro para el estudio.
Ejecución y motivaciónEl reto final está en desarrollar y finalizar el estudio. Por ello es obligación del investigador principal y del grupo promotor mantener la motivación del resto de centros colaboradores. Disponer de una base de datos online que muestre el estado actual del estudio y crear un newsletter cada 2-3 meses son dos herramientas muy recomendadas.