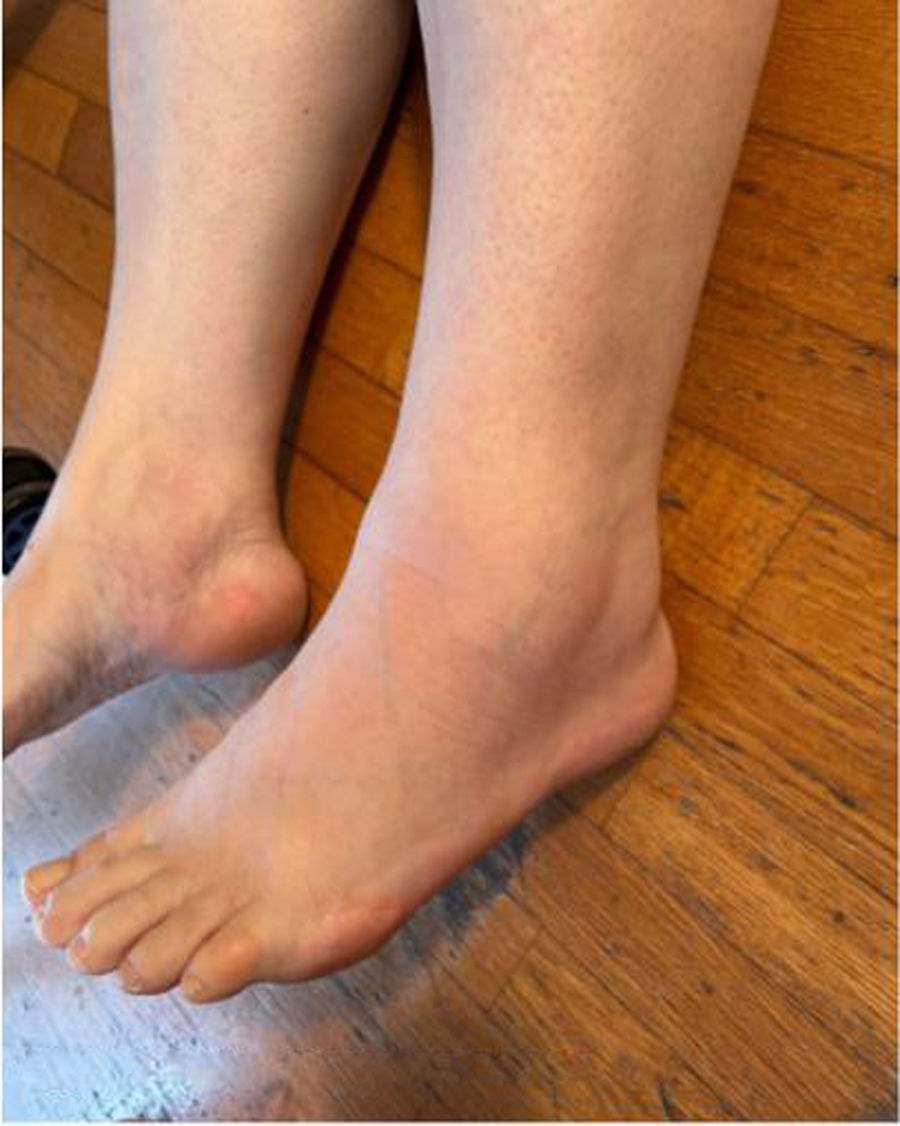
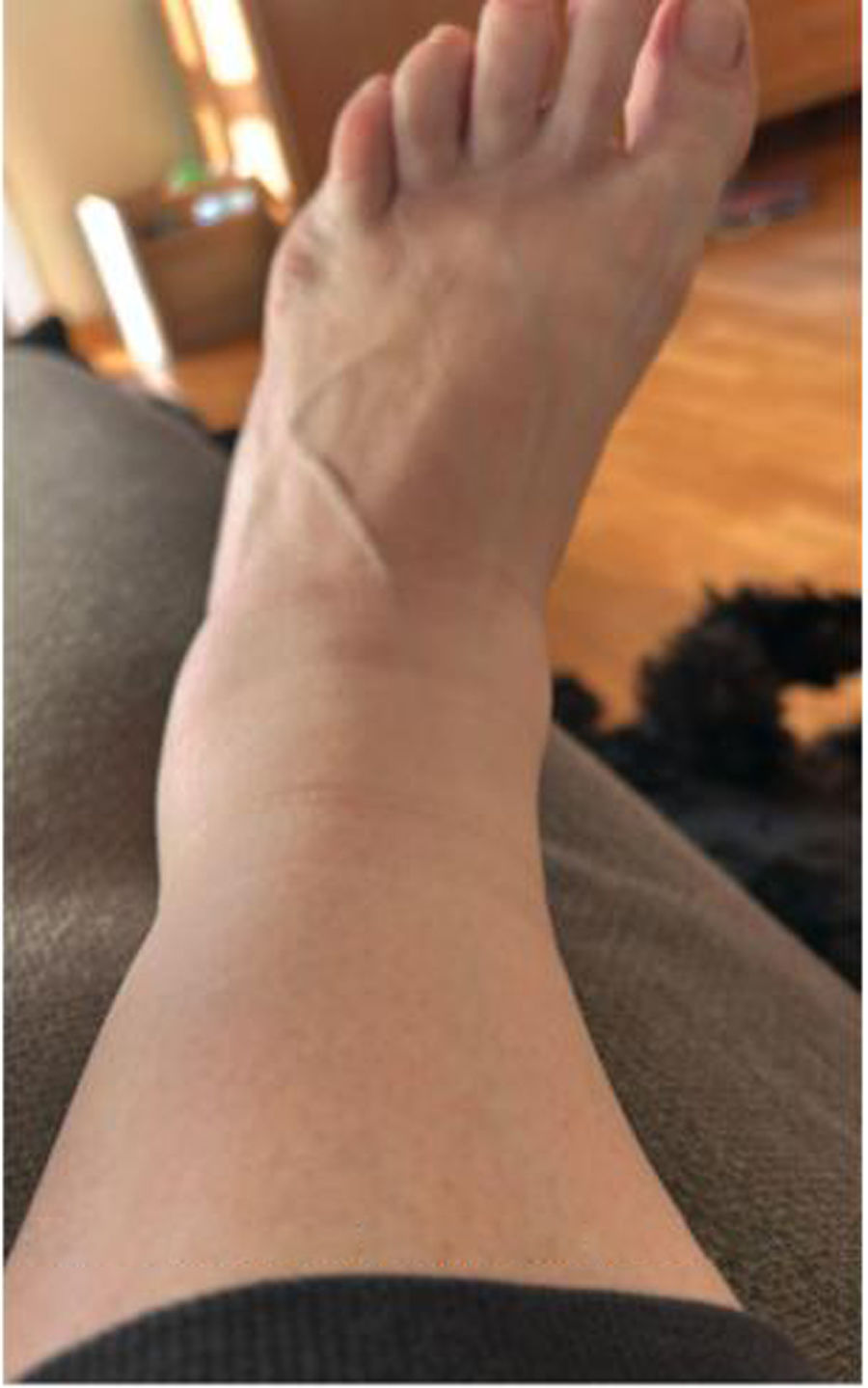
Se presenta el caso de una mujer caucásica de 51 años que consultó en atención primaria por edema bilateral simétrico, doloroso y con fóvea en tobillos y pies, acompañado de eritema y dificultad para caminar (figs. 1 y 2). Los síntomas se desarrollaron en 4 días. Como antecedentes recientes la paciente refirió molestias abdominales, náuseas y diarrea, sin disnea. La exploración física fue normal a nivel cardiopulmonar, sin visceromegalias ni signos inflamatorios articulares generalizados. El test de FABER fue negativo.
Entre sus antecedentes destacaban obesidad, hipertensión tratada con losartán, migraña y alergias ambientales. Un dato relevante fue el inicio reciente de tratamiento con tirzepatida1 15 días antes del cuadro.
Se contemplaron en el diagnóstico diferencial la insuficiencia cardíaca, la trombosis venosa profunda, el síndrome nefrótico y la reacción adversa a fármacos; se propuso retirar la tirzepatida. No obstante, la paciente decidió continuar el tratamiento por la significativa pérdida de peso que estaba experimentando, que consideraba un beneficio importante2.
Se inició tratamiento sintomático con AINE y paracetamol, sin mejoría. Reumatología consideró un posible síndrome de Löfgren asociado a sarcoidosis. Las pruebas revelaron elevación de la VSG, la PCR y el factor reumatoide. La ecografía descartó signos de artritis y la radiografía de tórax fue normal.
Finalmente, ante la sospecha de reacción adversa medicamentosa3, se suspendió la tirzepatida y se inició prednisona a dosis altas, lo que produjo una resolución completa de los síntomas en 15 días. Se realizó consulta con farmacología, que indicó que no había notificaciones previas de artritis asociada específicamente a tirzepatida, aunque sí con otros agonistas del receptor GLP-1. El caso se notificó al sistema de farmacovigilancia a través de la historia clínica electrónica (eCAP).
El análisis del incidente, mediante el Protocolo de Londres4, identificó múltiples factores contribuyentes. En cuanto a la paciente, su decisión de continuar con el tratamiento pese a los síntomas influyó en el manejo inicial, destacando la importancia del consentimiento informado y la educación sanitaria para una adecuada toma de decisiones compartidas.
En el ámbito clínico, se observó que inicialmente no se relacionaron los síntomas con la medicación reciente, y que la retirada del fármaco se retrasó. Esto subraya la necesidad de establecer protocolos que prioricen la suspensión temporal de medicamentos nuevos cuando aparezcan síntomas compatibles con reacciones adversas5.
Desde la perspectiva del profesional, se valoró la correcta evolución del juicio clínico y la colaboración con reumatología, aunque se señaló como área de mejora la necesidad de herramientas que apoyen la evaluación del balance beneficio-riesgo cuando hay resistencia del paciente a modificar el tratamiento.
A nivel de equipo, se destacó la buena coordinación entre atención primaria, reumatología y farmacología clínica. Organizativamente, se cumplió con la notificación del incidente, aunque se propuso mejorar el sistema mediante alertas electrónicas en la prescripción de fármacos nuevos.
En conclusión, este caso ejemplifica un incidente de seguridad del paciente relacionado con una reacción adversa a tirzepatida, que fue identificado y resuelto gracias a una actuación multidisciplinar. El análisis evidencia la importancia de revisar la medicación reciente ante síntomas nuevos, establecer protocolos de suspensión ante sospechas de reacciones adversas y potenciar la participación de farmacia clínica en casos complejos. Asimismo, se subraya la relevancia de fomentar la toma de decisiones compartidas y de incorporar herramientas electrónicas que ayuden a prevenir reacciones adversas durante la prescripción.
AutoríaEl manuscrito ha sido elaborado en su forma de borrador por Esperanza Martín y Eva Martín, siendo suscrito y valorado posteriormente por el resto de los autores.
Consentimiento informadoSe ha obtenido el consentimiento informado por parte de la paciente y se ha accedido a los datos de la historia clínica siguiendo los protocolos establecidos en el Institut Català de la Salut.
Declaración de transparenciaLa autora para la correspondencia, en nombre del resto de las personas firmantes, garantiza la precisión, transparencia y honestidad de los datos y la información contenida en el estudio; que ninguna información relevante ha sido omitida; y que todas las discrepancias entre autores/autoras han sido adecuadamente resueltas y descritas.
FinanciaciónSin financiación.
Conflicto de interesesLos autores declaran el siguiente conflicto de intereses:
Eva Martín es la paciente afectada por el efecto adverso.
No se declaran otros conflictos de intereses.