Investigamos los efectos de una lámina de esponja biodegradable con hidrogel de gelatina (EBHG) o EBHG con un factor de crecimiento de fibroblastos básico incorporado (EBHG ' bFGF), que podría prolongar sus efectos en la progresión de los aneurismas aórticos abdominales (AAA). Los AAA experimentales se indujeron en ratas macho Sprague-Dawley mediante una infusión intraaórtica de elastasa. Las ratas se dividieron en diferentes grupos en función de tratamientos asignados: 1) sin tratamiento, 2) EBHG, 3) EBHG con 100 ng, 1 μg, y 10 μg de bFGF. La EBHG se colocó sobre las aortas infundidas con elastasa. Tras 14 días, el grupo sólo EBHG y los 3 subgrupos con EBHG + bFGF presentaron diámetros aórticos significativamente menores que en el grupo no tratado, y los resultados del análisis anatomopatológico mostraron en estos grupos una atenuación significativa en la reducción de las fibras elásticas y las células musculares lisas. Sin embargo, no se observó ningún efecto terapéutico adicional entre los grupos con EBHG únicamente y EBHG + bFGF. El análisis inmunohistoquímico reveló un aumento de las células positivas para bFGF endógeno en las capas media y adventicia de los grupos sólo EBHG y EBHG + bFGF en comparación con el grupo no tratado. En resumen, la EBHG por sí sola posee efectos terapéuticos significativos en la progresión del AAA al inducir la producción de bFGF endógeno, lo que provoca la preservación de las fibras elásticas y las células musculares lisas.
El aneurisma aórtico abdominal (AAA) es un trastorno habitual y potencialmente mortal que se caracteriza por un desequilibro entre la destrucción y la síntesis de la matriz extracelular de la pared aórtica. La formación del aneurisma está asociada a una inflamación crónica transmural, agotamiento de la población de células musculares lisas (CML), y excesiva producción de una matriz de metaloproteinasa (MMP), lo que provoca la degradación anormal de la elastina y el colágeno1,2. El tratamiento estándar del AAA es la corrección quirúrgica mediante la colocación de implantes vasculares así como la reparación endovascular del aneurisma, todo ello con el objetivo de prevenir la rotura letal del AAA. Sin embargo, sigue sin existir un tratamiento médico eficaz para estabilizar la patología aneurismática y prevenir una mayor expansión o la rotura.
Muchos investigadores han estudiado la fisiopatología de los AAA utilizando modelos experimentales de AAA, y varios estudios han demostrado que los nuevos tratamientos mínimamente invasivos, incluido el tratamiento médico y la terapia génica, han inhibido la expansión de los AAA experimentales3-10. Es sabido que la proliferación de las CML mediales mediante el tratamiento con transferencia génica del factor de crecimiento de fibroblastos básico (bFGF) o la siembra de CML inhibe la expansión de los AAA experimentales7,8,11. En un informe reciente, los fibroblastos gingivales previnieron la degradación de la elastina aórtica de conejo en un modelo de cultivo aórtico ex vivo12. Por tanto, el bFGF o los fibroblastos pueden constituir una nueva terapia en casos de AAA humanos. No obstante, aún no se ha establecido por completo la seguridad y eficacia de la transferencia génica o de la siembra celular en situaciones clínicas. Por otro lado, la semivida del bFGF in vivo es demasiado corta para que pueda ejercer de forma eficaz su actividad biológica cuando se administra en forma libre. Hemos desarrollado un hidrogel de gelatina biodegradable formado por gelatina ácida para facilitar la liberación del bFGF en su lugar de acción durante un período de tiempo más prolongado13-15. El bFGF tiende a formar uniones iónicas con la gelatina ácida y se libera de la matriz al degradarse ésta. El perfil de liberación puede controlarse variando el contenido hídrico de los hidrogeles. Un hidrogel de gelatina biodegradable es seguro in vivo y permite prolongar fácilmente el efecto del bFGF en comparación con la transferencia génica de bFGF. Además, los materiales biodegradables inducen la producción de factores de crecimiento endógenos durante su degradación, bFGF incluido16. Así pues, el hidrogel de gelatina también puede inducirlo, de manera que posiblemente permita la inhibición de la progresión del AAA experimental.
En el estudio aquí descrito, tratamos a ratas con AAA experimentales mediante una lámina de esponja con hidrogel de gelatina (EBHG) o mediante EBHG con bFGF incorporado para investigar los efectos de estos tratamientos en la progresión de los AAA experimentales.
Materiales y MétodosPreparación de la EBHG con o sin bFGFEl bFGF recombinante humano con un punto isoeléctrico de 9,6 fue suministrado por Kaken Pharmaceutical (Tokio, Japón). La EBHG se preparó según se ha descrito con anterioridad13. La EBHG se elaboró mediante entrecruzamiento de gelatina ácida con un punto isoeléctrico de 4,9. Se moldeó en una lámina (15 x 7 x 2 mm) y se liofilizó. Antes de colocar la EBHG sobre la aorta, la EBHG liofilizada se impregnó con una solución acuosa con o sin bFGF durante 1 h para obtener una EBHG con o sin bFGF, respectivamente. Esta lámina de esponja de gelatina se diseñó para que se degradara en 2 semanas.
Animales de experimentaciónSe obtuvieron ratas Sprague-Dawley macho (250-400 g) de CLEA (Tokio, Japón) y se utilizaron para los experimentos. Este estudio fue autorizado por el Animal Care Committee de la Tohoku University Graduate School of Medicine. El cuidado de los animales cumplió con lo establecido en la Guide for the Care and Use of Laboratory Animals (National Research Council, Washington DC, 1996).
Inducción de AAA experimentalesLas ratas fueron anestesiadas con una inyección i.p. de pentobarbital sódico (50-60 mg/kg de peso corporal: Dainippon Pharmaceutical, Osaka, Japón), y se realizó una laparotomía por la línea media en condiciones de esterilidad. Se aisló un segmento de aorta infrarrenal de 1 cm y se ligaron todas las arterias lumbares. Se midió el diámetro externo de la aorta antes de la infusión de la elastasa (DA preinfusión) mediante un calibrador digimático (Mitutoyo, Kanagawa, Japón). Se insertó una sonda de polietileno (Becton Dickinson, Sparks, MD) en la arteria ilíaca externa derecha y se avanzó hasta la aorta aislada. Se colocó un clampaje atraumático en la aorta proximal, y se realizó una ligadura temporal sobre la aorta distal para fijar la sonda. La aorta aislada se infundió con 2,7 unidades de elastasa pancreática porcina de tipo I (E-1250, lote 84K7700; Sigma, St. Louis, MO) durante 60 min utilizando una bomba de inyección (TOP-5200; TOP, Tokio, Japón). Tras infundir la elastasa, se retiró la ligadura y la sonda ligándose la arteria ilíaca externa derecha. Se cerró el retroperitoneo y la pared abdominal. Las ratas se volvieron a explorar el día 14 tras la intervención (14 DPI), y se midió el DA máximo.
Grupos de tratamientoLas ratas de experimentación con la infusión de elastasa se dividieron aleatoriamente en 5 grupos de acuerdo a los tratamientos: un grupo sin tratamiento (grupo no tratado, n = 10), un grupo tratado con EBHG con agua destilada incorporada (grupo EBHG, n = 10), 3 grupos con EBHG con diferentes cantidades incorporadas de bFGF (grupo EBHG + 100 ng, grupo EBHG + 1 μg, y grupo EBHG + 10 μg; n = 10, 6, y 6, respectivamente). Estas EBHG se colocaron sobre las aortas de las ratas infundidas con elastasa, y se cerró el retroperitoneo.
Análisis histológicoSe realizó la evaluación histológica de 3 grupos de ratas, incluido el grupo no tratado, el grupo con sólo EBHG, y el de EBHG ' 100 ng (n = 6, respectivamente). Las ratas fueron sacrificadas el día 14 tras la intervención; se perfundió una solución de paraformaldehído al 4% en solución salina tamponada con fosfato (PBS) durante 5 min a través del ventrículo izquierdo, y las aortas extraídas se fijaron de nuevo con una solución de paraformaldehído al 4% en PBS durante 2 h, seguido de etanol al 100%. Las piezas se incluyeron en parafina y se obtuvieron cortes histológicos de 5 μm, que se tiñeron con tinción de Verhoeff-van Gieson (VVG) para fibras elásticas y se prepararon para su estudio inmunohistoquímico. El cociente fibras elásticas teñidas/área de la media en la tinción VVG se calculó utilizando el software Image-J (NIH, Bethesda, MD).
El estudio inmunohistoquímico se llevó a cabo tras la desparafinización y la rehidratación. Los cortes se trataron durante 10 min con H2O2 para bloquear la actividad de la peroxidasa endógena. Tras el bloqueo con albúmina de suero bovino al 1% en PBS durante 30 min, los cortes histológicos se incubaron con un anticuerpo primario durante la noche a 4°C, incluido un anticuerpo monoclonal murino frente a la α-actina de músculo liso (α-SMA) humana (Sigma) para la tinción de las CML de rata y un anticuerpo de conejo frente al bFGF de rata (Santa Cruz Biotechnology, Santa Cruz, CA). Posteriormente se realizó la incubación con un anticuerpo secundario biotinilado y un complejo avidina-biotina (Dako Cytomation, Glostrup, Dinamarca) según el protocolo del fabricante. Los cortes histológicos se contratiñeron con hematoxilina. Se realizaron experimentos de control negativo sustituyendo el anticuerpo primario por una inmunoglobulina G inespecífica de ratón o conejo. Se determinó la densidad de las CML mediales realizando el promedio de las células positivas a α-SMA en 8 campos de gran aumento escogidos de 2 cortes histológicos.
Análisis estadísticoLos datos se presentan como la media ± error estándar (EE). Los resultados se evaluaron utilizando un análisis de varianza de una vía o de dos vías (ANOVA) asignándose la significancia estadística a p < 0,05. Cuando el resultado del ANOVA fue significativo, se utilizó el test post hoc de Scheffe para comparar los grupos individuales. Se realizó un análisis estadístico utilizando el software StatView J-5.0 (SAS Institute, Cary, NC).
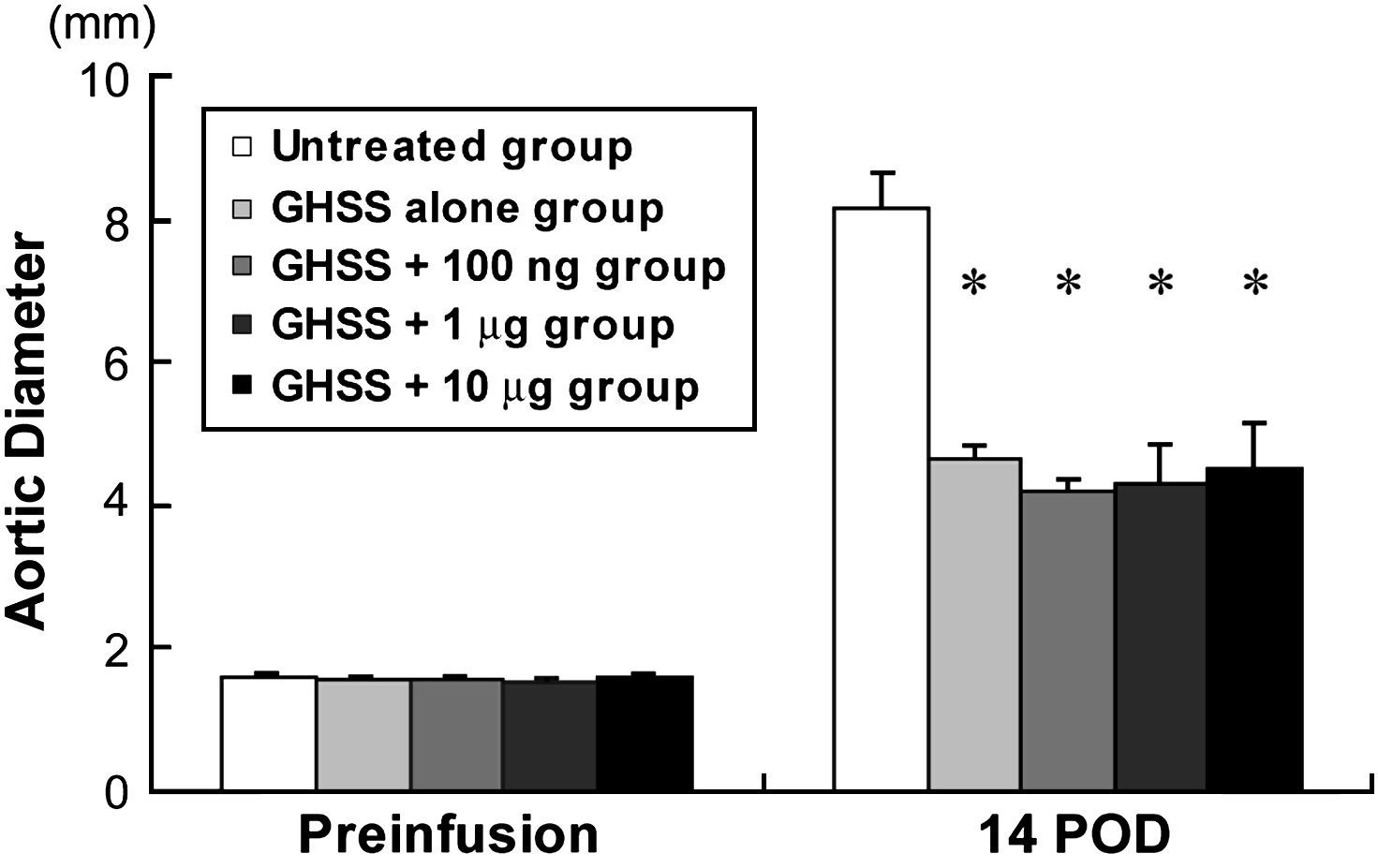
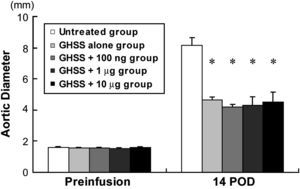
ResultadosAlteraciones del DA en los 5 gruposLas alteraciones del DA en los 5 grupos de ratas con AAA experimentales inducidos mediante la infusión de elastasa se presentan en la figura 1. Los DA preinfusión fueron bastante similares entre los 5 grupos. La infusión de elastasa durante 60 min aumentó de forma notable el DA a los 14 DPI en el grupo no tratado de 1,66 ± 0,02 hasta 8,16 ± 0,50 mm. Bajo las mismas condiciones, todos los grupos de tratamiento (sólo EBHG, EBHG + 100 ng, EBHG + 1 μg, y EBHG + 10 μg) presentaron un DA significativamente menor a los 14 DPI (4,66 ± 0,20, 4,19 ± 0,15, 4,30 ± 0,54, y 4,52 ± 0,64 mm, respectivamente) que el del grupo no tratado. No se observaron diferencias significativas en el DA entre el grupo EBHG sola y los 3 grupos tratados con EBHG más bFGF.
Alteraciones del DA en cada grupo. Preinfusión, antes de la infusión de elastasa. Los datos se presentan como la media ± EE. n = 10 en los grupos no tratado, EBHG, y EBHG + 100 ng; n = 6 en los grupos EBHG + 1 μg y EBHG + 10 μg. *p < 0,0001 frente a DA a los 14 DPI en el grupo no tratado. 14 POD: 14 día tras la intervención (DPI); Aortic Diameter: diámetro aórtico; GHSS + 1 μg group: grupo esponja biodegradable con hidrogel de gelatina (EBHG) + 1 μg; GHSS + 10 μg group: grupo EBHG + 10 μg; GHSS + 100 ng group: grupo EBHG + 100 ng; GHSS alone group: grupo sólo EBHG; Preinfusion: preinfusión; Untreated group: grupo no tratado.
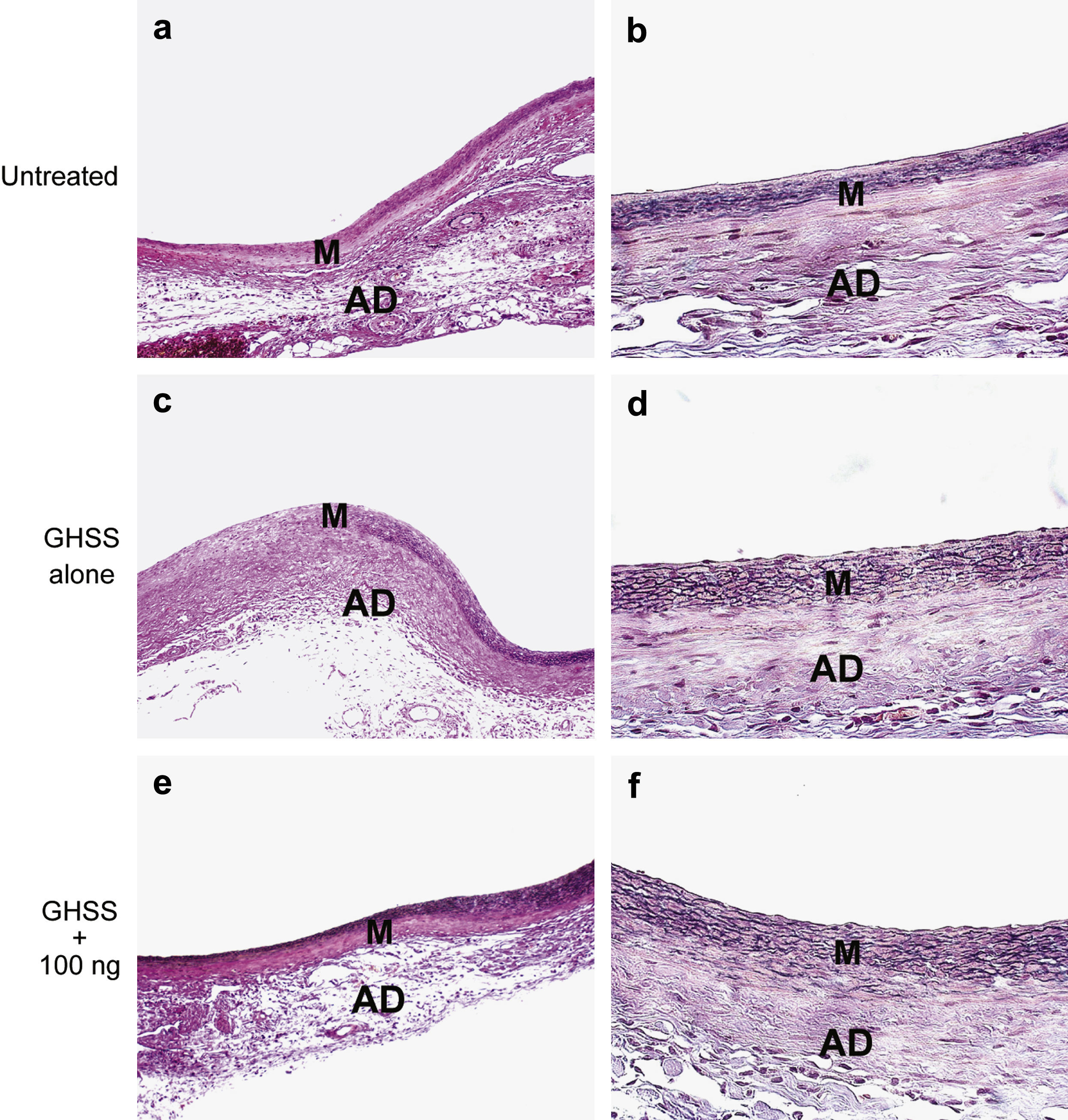
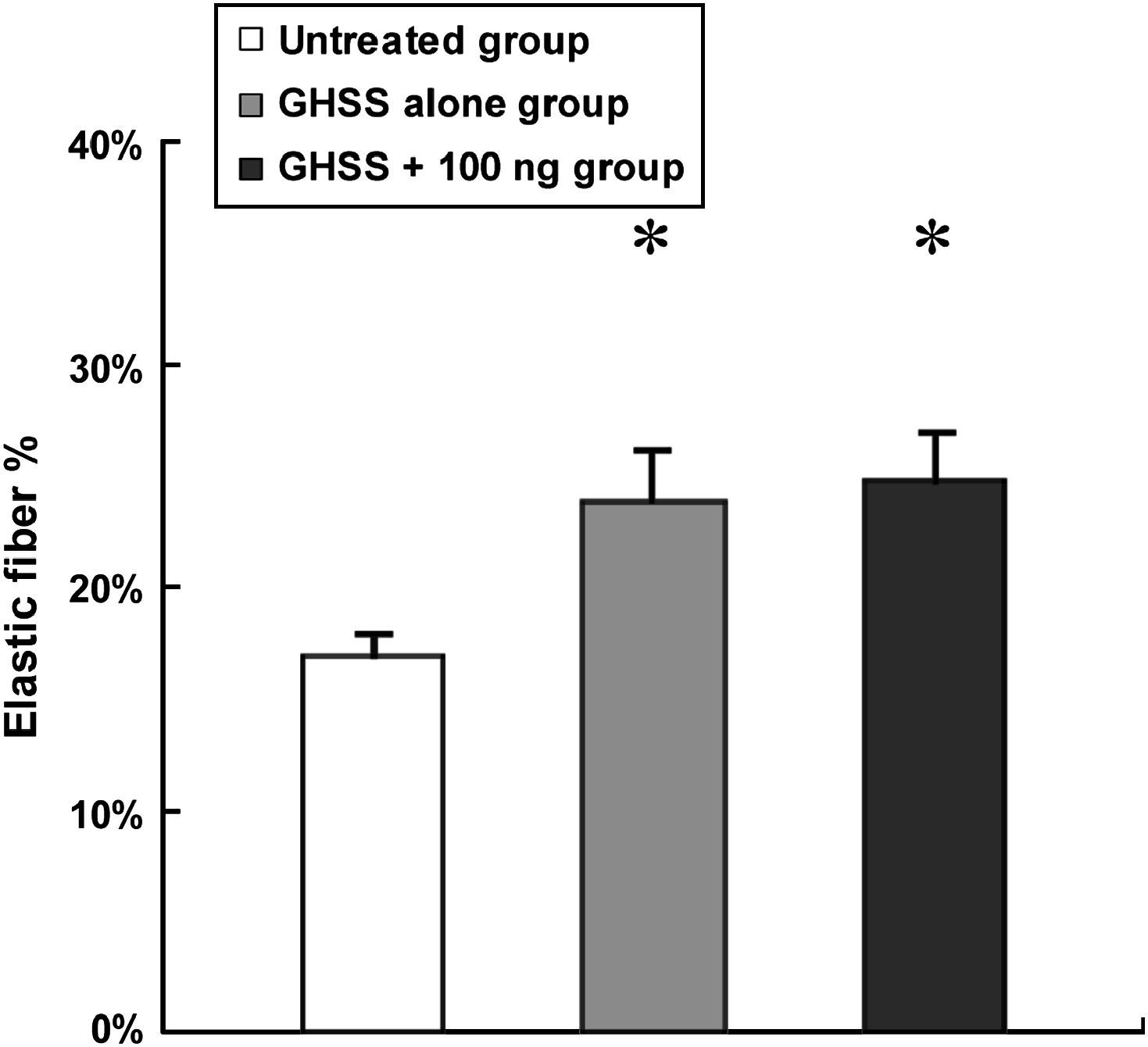
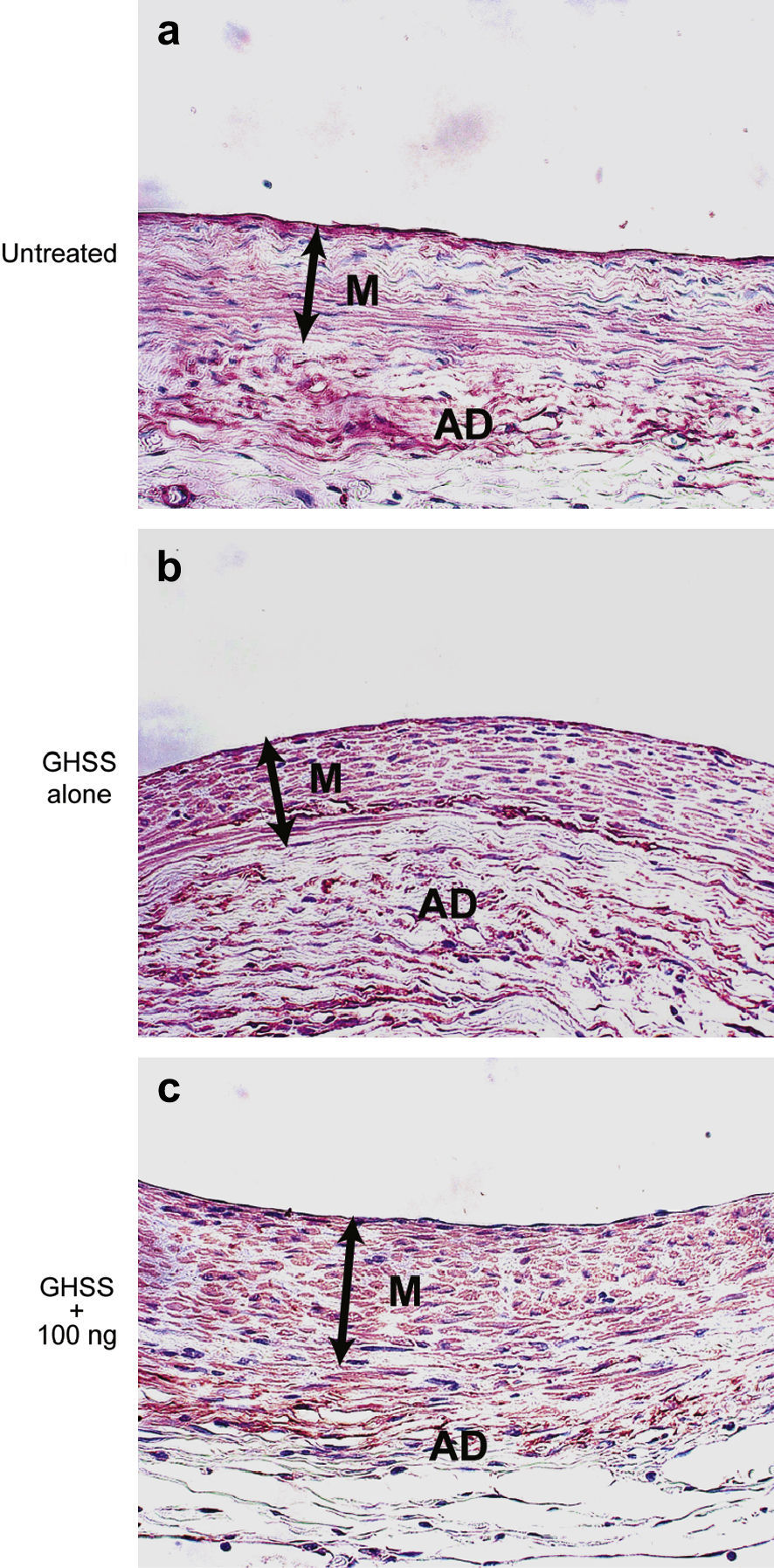
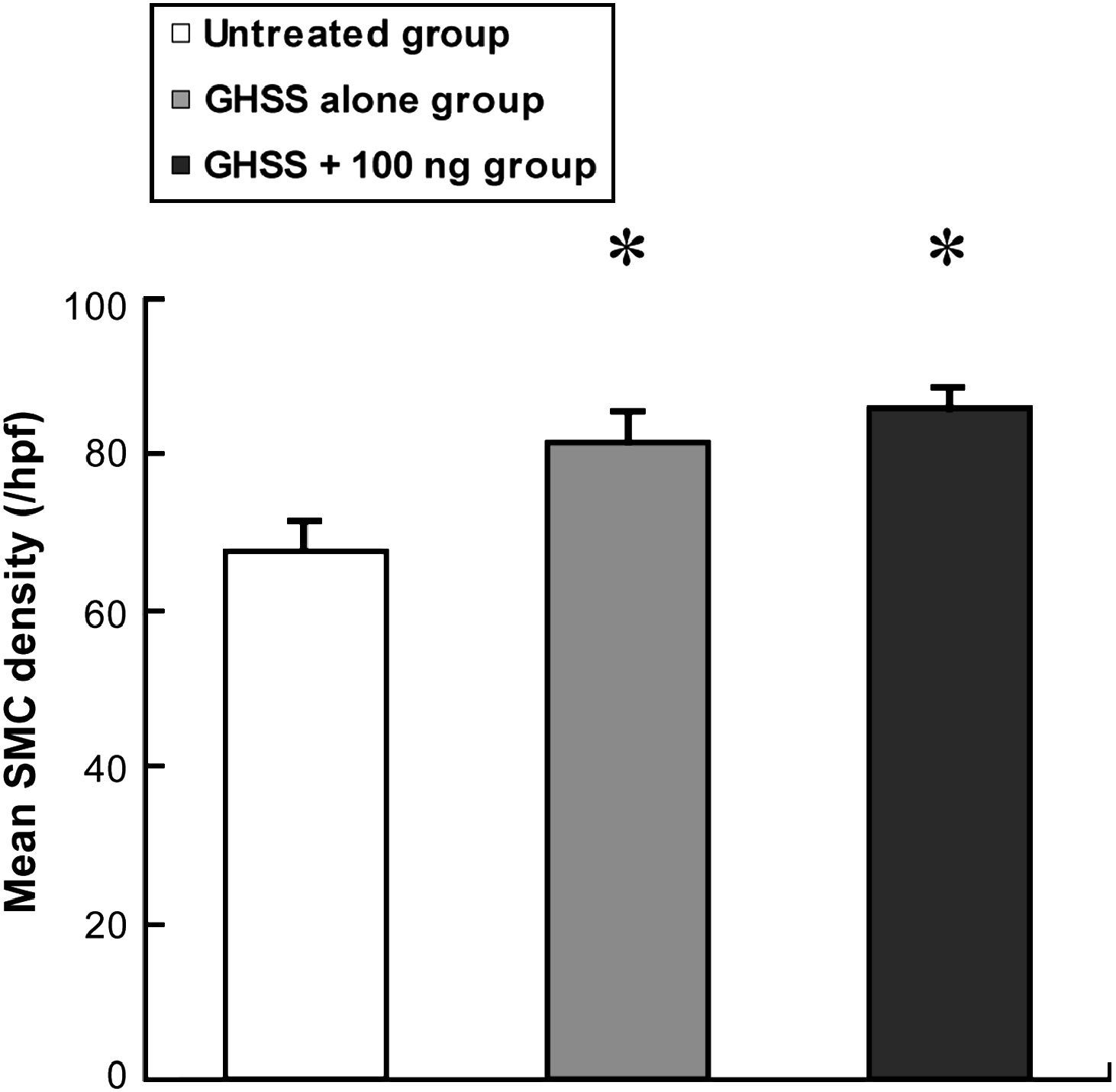
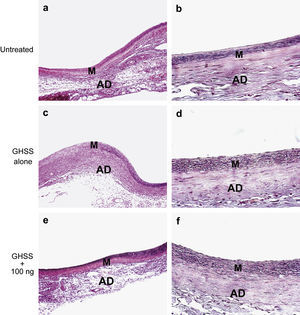
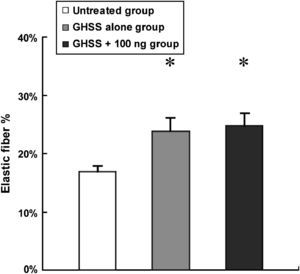
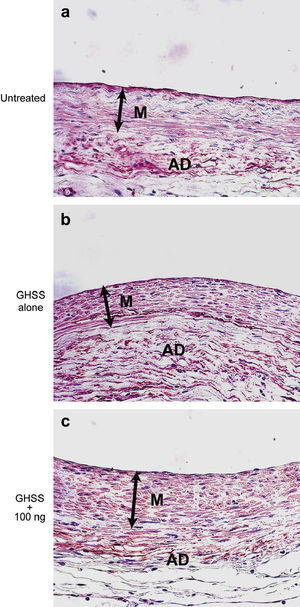
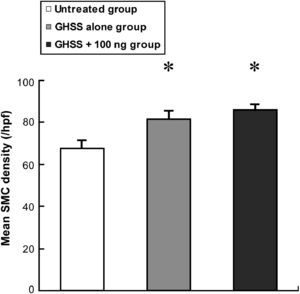
Examinamos la presencia de α-SMA en las fibras elásticas y las CML en la capa media mediante tinción VVG e inmunotinción, respectivamente. La tinción VVG reveló una destacada reducción de las fibras elásticas teñidas en la media del grupo no tratado (figs. 2a y 2b). Por el contrario, la tinción de las fibras elásticas se conservó bien en los grupos de EBHG y EBHG + 100 ng (figs. 2c a 2f). El cociente entre el área de fibras elásticas teñidas y el área de la media, calculado mediante una imagen digital computarizada, fue significativamente más elevado en los grupos EBHG (23,8 ± 2,6%) y EBHG + 100 ng (24,8 ± 2,2%) que en el grupo no tratado (16,8 ± 0,9%), si bien no se observaron diferencias significativas en el cociente entre el grupo EBHG y EBHG + 100 ng (fig. 3). El número de CML teñidas mediante anticuerpo frente a α-SMA en la media fue significativamente mayor en los grupos EBHG (81,8 ± 3,6/hpf) y EBHG + 100 ng (86,1 ± 2,2/hpf) que en el grupo no tratado (67,6 ± 3,2/hpf), si bien no existieron diferencias significativas en el número de CML entre los grupos EBHG y EBHG + 100 ng (figs. 4 y 5).
Microfotografías de la pared aórtica con tinción VVG para las fibras elásticas. Las fibras elásticas están teñidas de negro. Grupos no tratado (a, b), EBHG sola (c, d), y EBHG + 100 ng (e, f). AD: adventicia; GHSS + 100 ng: esponja biodegradable con hidrogel de gelatina (EBHG) + 10 ng; GHSS alone: EBHG sola; M: media; Untreated: no tratado. Aumento original x100 (imágenes de la izquierda) y x400 (imágenes de la derecha).
El cociente fibras elásticas/área de la media en la tinción VVG se calculó utilizando el software NIH Image-J. Los resultados se presentan como la media ± EE en cada grupo. n = 6 en todos los grupos. *p < 0,05 frente al grupo no tratado. Elastic fiber %: % fibras elásticas; GHSS + 100 ng group: grupo esponja biodegradable con hidrogel de gelatina (EBHG) + 100 ng; GHSS alone group: grupo sólo EBHG; Untreated group: grupo no tratado.
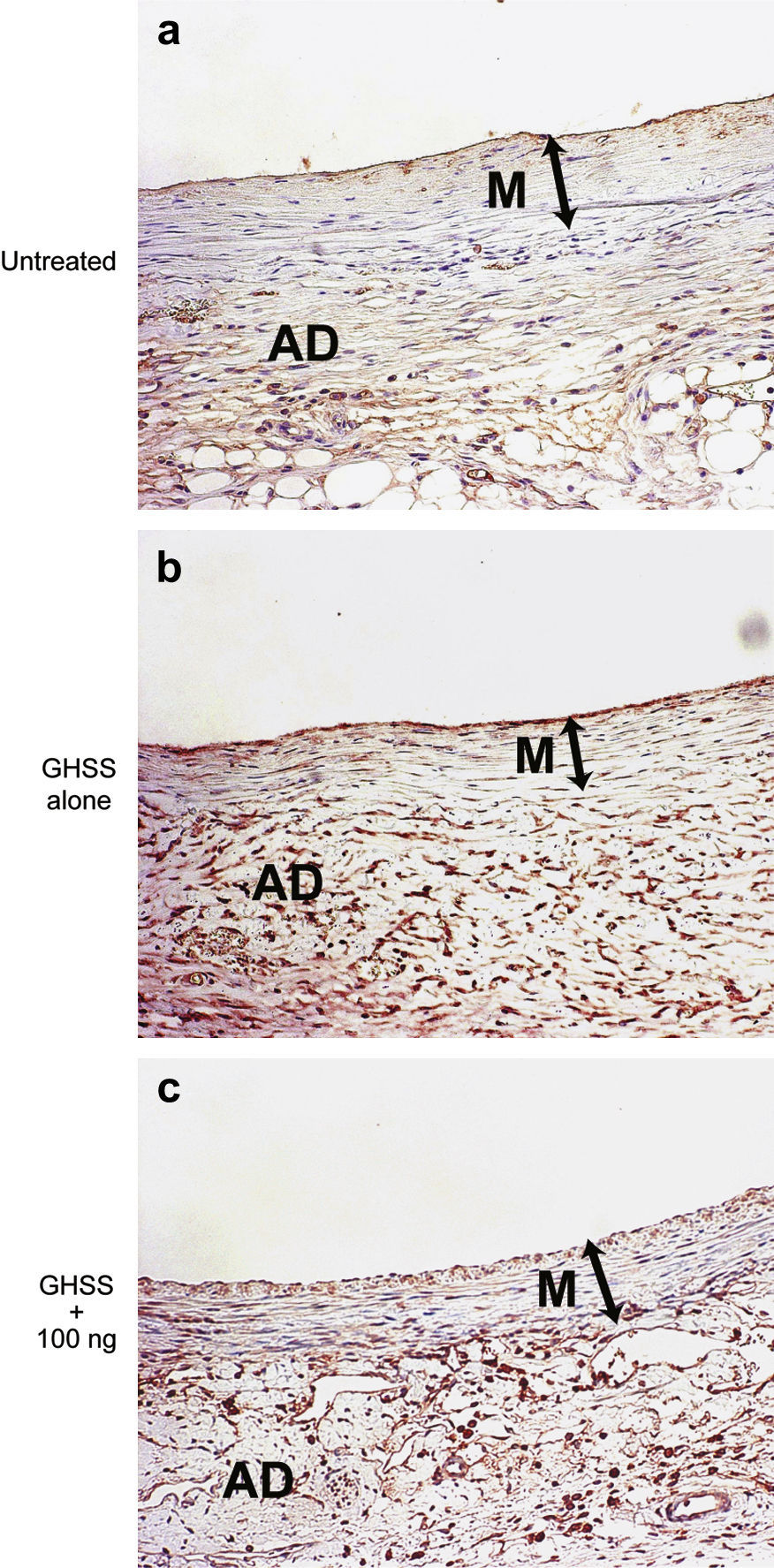
Microfotografías de la pared aórtica con inmunotinción de las CML con anti-α-SMA. El citoplasma de las CML en la media está teñido de color marrón. Grupos no tratado (a), EBHG sola (b), y EBHG + 100 ng (c). AD: adventicia; GHSS + 100 ng: esponja biodegradable con hidrogel de gelatina (EBHG) + 100 ng; GHSS alone: sólo EBHG; M: media; Untreated: no tratado. Aumento original x400.
La densidad de las CML mediales se determinó según el número de células positivas a α-SMA en 8 campos de gran aumento escogidos en dos cortes histológicos. Los resultados se presentan como la media ± EE. n = 6 en cada grupo. *p < 0,01 frente al grupo no tratado. GHSS + 100 ng group: grupo esponja biodegradable con hidrogel de gelatina (EBHG) + 100 ng; GHSS alone group: grupo sólo EBHG; Mean SMC density (/hpf): densidad media de células musculares lisas (CML) (/hpf); Untreated group: grupo no tratado.
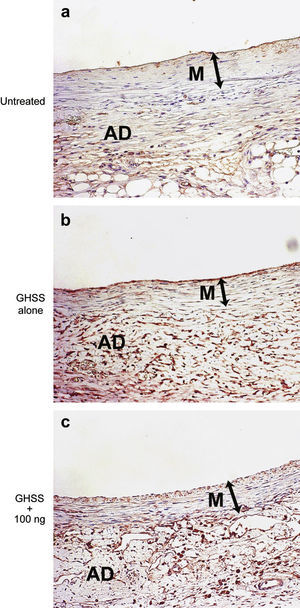
Además, el análisis inmunohistoquímico mostró un aumento de las células positivas (citoplasma y núcleo) al bFGF endógeno en la media y la adventicia de los grupos EBHG y EBHG + 100 ng en comparación con el grupo no tratado (fig. 6).
Microfotografías de la pared aórtica inmunoteñida con anticuerpo anti-bFGF. Grupos no tratado (a), sólo EBHG (b), y EBHG + 100 ng (c). AD: adventicia; GHSS + 100 ng: grupo esponja biodegradable con hidrogel de gelatina (EBHG) + 100 ng; GHSS alone: sólo EBHG; M: media; Untreated: no tratado. Estos resultados revelan un aumento de las células positivas (citoplasma y núcleo) al bFGF en la media y la adventicia de los grupos EBHG sola y EBHG + 100 ng en comparación con el grupo no tratado. Aumento original x200.
Este estudio fue diseñado inicialmente para investigar los efectos terapéuticos de la EBHG con bFGF incorporado en la progresión de los AAA experimentales utilizando el modelo de AAA murino. La EBHG se utilizó para mantener los efectos locales y a largo plazo del bFGF. Preparamos dos grupos de ratas con AAA que actuaron como control, incluido un grupo sin tratamiento alguno y otro tratado con EBHG sin bFGF incorporado, ya que no estaba claro el efecto de la EBHG en los AAA experimentales. Si bien el DA a los 14 DPI de las ratas con EBHG ' bFGF fue significativamente menor que el de las ratas no tratadas, las ratas con sólo EBHG presentaron casi el mismo DA a los 14 DPI en comparación con las ratas con EBHG + bFGF. Nuestros resultados también demostraron un efecto del bFGF independiente de la dosis. Estos resultados sugieren que la colocación de la EBHG sobre la aorta tiene efectos terapéuticos significativos en la progresión de los AAA, mientras que el efecto terapéutico adicional del bFGF fue bastante limitado.
La inducción de AAA experimentales mediante la infusión de elastasa fue realizada inicialmente por Anidjar et al17, quienes informaron que los resultados patológicos de este modelo fueron similares a los del AAA humano. En este estudio, evaluamos las fibras elásticas y las CML de la media, las cuales se reducen de forma espectacular en los AAA humanos y en los AAA experimentales1,17. Nuestros resultados demostraron una destacada reducción de las fibras elásticas y las CML en las ratas no tratadas, como han descrito estudios anteriores, mientras que las ratas tratadas con sólo EBHG atenuaron significativamente esta reducción de fibras elásticas y CML. El tratamiento con EBHG + bFGF también atenuó dicha reducción, pero no se observó una diferencia estadística entre las ratas con EBHG y las ratas con EBHG + bFGF. Estos resultados sugieren que la EBHG por sí misma ejerce una mejoría en la pared aneurismática al preservar las fibras elásticas y las CML, resultando así en un DA menor.
Hipotetizamos que la EBHG por sí misma indujo la producción de bFGF endógeno al degradarse. Cuando realizamos la inmunotinción del bFGF, nuestros resultados mostraron un aumento en el número de células positivas al bFGF endógeno en las capas media y adventicia de las ratas tratadas con EBHG sola en comparación con las ratas no tratadas. Además, al volver a realizar una laparotomía en varias ratas a los 7 DPI se observó una leve fibrosis alrededor de la aorta en las ratas con EBHG + bFGF y en las ratas con sólo EBHG (datos no publicados), lo que sugiere que la EBHG indujo los mismos factores de crecimiento alrededor de la aorta. Estos resultados son compatibles con trabajos previos en los que se describe que la colocación de un polímero de biomaterial in vivo induce la producción de factores de crecimiento endógenos16. Hoshina et al7 demostraron que la transferencia génica del bFGF limitaba el crecimiento del aneurisma debido a la proliferación de CML mediales. Gogly et al12 también presentaron un trabajo en el que los fibroblastos tenían efectos protectores frente a la degradación de las fibras elásticas. Nuestros resultados también demostraron la preservación de las CML y las fibras elásticas en las ratas tratadas con EBHG sola. Por tanto, creemos que la EBHG por sí misma induce la producción de bFGF endógeno, que facilita la proliferación de las CML y los fibroblastos, lo que preserva la degradación de las fibras elásticas, y estas mejorías en la pared aórtica previenen la expansión de los AAA experimentales. Otro posible mecanismo es el efecto del apoyo externo de la aorta por parte de la propia EBHG. La envoltura de un aneurisma intracraneal es un tratamiento eficaz para inhibir la progresión o la rotura de los aneurismas debido al refuerzo de la pared aneurismática18. Haraguchi et al19 también demostraron que la envoltura de los injertos venosos con una lámina de hidrogel de gelatina sin bFGF inhibió de forma significativa la dilatación del injerto debido al mecanismo de apoyo y a la protección de las células endoteliales asociado a algunos factores de crecimiento autocrino. Sin embargo, la EBHG con una solución acuosa es un hidrogel blando, y se degrada en gran parte hacia los 14 días de su administración. Además, en este estudio el hidromel se colocó directamente sobre la aorta, sin envolverla; por tanto, el efecto dinámico de la EBHG para reforzar la pared aneurismática no puede demostrarse de forma concluyente en este estudio. La EBHG puede actuar por otros mecanismos no analizados, por lo que son necesarios estudios adicionales para esclarecer los efectos de la EBHG en la progresión de los AAA experimentales.
La adición de bFGF apenas tuvo efecto terapéutico en este estudio. Además, no se observó un efecto del bFGF dependiente de la dosis en la progresión de los AAA experimentales. Si bien se sabe que el bFGF facilita la proliferación de diferentes células mesenquimales, varios estudios han descrito que una dosis excesiva de bFGF inhibe su proliferación y que su eficacia no depende de la dosis20,21. Por tanto, nuestros resultados sugieren que la EBHG sola induce una cantidad suficiente de bFGF para inhibir la progresión de los AAA experimentales y ésta es, probablemente, la razón de la ausencia de efecto adicional tras la adminitración de bFGF.
El valor terapéutico de un hidrogel de gelatina con bFGF incorporado se ha estudiado ampliamente de forma experimental relacionado con la angiogénesis22 así como con la regeneración del hueso o la piel15,23, iniciándose algunas aplicaciones clínicas24. Para poder utilizar el tratamiento con EBHG en los AAA humanos son necesarias mejoras metodológicas que permitan su administración de forma menos invasiva, como la minilaparotomía o mediante técnicas laparoscópicas. Dado que en la actualidad es difícil aislar toda la aorta abdominal y envolverla con EBHG en seres humanos, en este estudio colocamos la EBHG sobre la aorta abdominal, sin envolverla. De hecho, la colocación de la EBHG sobre la aorta indujo un efecto suficiente. Por tanto, este estudio sugiere que es suficiente aplicar la EBHG en el lado anterolateral de la aorta como tratamiento de los AAA. Además, el hidrogel de gelatina puede presentarse bajo la forma de microesferas24,25, pudiéndose inyectar alrededor del AAA. Si se pudierta utilizar un método mínimamente invasivo, este tratamiento podría aplicarse en AAA de pequeño tamaño o en aquellos pacientes afectos de patología aneurismática que fueran de alto riesgo para la cirugía.
En resumen, nuestro estudio demuestra claramente los efectos terapéuticos de la EBHG en la progresión de los AAA experimentales. El tratamiento con EBHG indujo la producción de bFGF endógeno, que aumentó las CML y los fibroblastos, lo que preservaría la degradación de las fibras elásticas. La mejoría observada en los resultados histológicos dio lugar a la inhibición en la progresión de los AAA experimentales. Nuestros resultados sugieren una aplicación clínica potencial de la EBHG biodegradable para tratar AAA humanos utilizando un método mínimamente invasivo.
Agradecemos al Dr. Shojiro Matsuda, Gunze Limited Research and Development Center, el suministro de la EBHG, y a Kaken Pharmaceutical el suministro del bFGF. Este trabajo fue financiado por una beca a la investigación científica (JSPS-18591402) de la Japanese Society for Promotion of Science.
Parte de este trabajo se presentó inicialmente en el XXII World Congress of the International Union of Angiology, Lisboa, Portugal, 24-28 de junio de 2006.