El análogo de la prostaglandina I2 (PGI2) iloprostes, un potente vasodilatador e inhibidor de la activación plaquetaria, se ha utilizado tradicionalmente en la hipertensión arterial pulmonar y como indicación no aprobada para la revascularización en la isquemia crítica crónica de las extremidades inferiores. Este estudio se diseñó para evaluar el efecto de una infusión de iloprost durante 72h en la isquemia sistémica secundaria al tratamiento convencional de los aneurismas de aorta abdominal realizado de forma electiva (AAAE). Se identificaron 104 pacientes tratados mediante la técnica convencional por AAAE con un diámetro máximo medio de 6,9cm, entre enero de 2000 y de 2007, de los cuales 36 eran aneurismas yuxtarrenales, 15 suprarrenales y 53 infrarrenales. La razón hombres:mujeres fue 2,5:1 y la edad media era 71,9 años. No se identificaron diferencias estadísticamente significativas entre grupos del estudio con respecto a edad, sexo, factores de riesgo, clasificación según la American Society of Anesthesiologists (ASA) o diámetro del aneurisma tratado. Se excluyeron todos los procedimientos de emergencia, urgentes y endovasculares. En el período postoperatorio inmediato, cincuenta y siete pacientes recibieron una infusión de iloprost durante 72 horas en el postoperatorio inmediato, frente a 47 que no la recibieron. Se monitorizó a los pacientes en busca de signos de morbilidad pulmonar, renal, cardíaca, isquemia sistémica y postoperatoria durante su estancia en la unidad de cuidados intensivos (UCI). En los pacientes no tratados con iloprost se observaron tasas significativamente mayores de necesidad de ventilación (p=0,0048), de complicaciones pulmonares (p=0,0019) y de isquemia miocárdica (p=0,0446). En estos pacientes, también se detectaron índices de función renal significativamente más altos, incluidos cambios en la tasa estimada de filtración glomerular (p=0,041) y aumentos postoperatorios de la concentración de urea (p=0,0286). En cinco pacientes (11,6%) del grupo no tratado con iloprost se observó ateroembolización periférica de la extremidad, la cual no se presentó en ningún paciente tratado con iloprost. En pacientes no tratados con iloprost se observó un aumento de las tasas de necesidad de transfusión y de complicaciones intestinales, con una estancia en la UCI fue de más del doble que la de los pacientes tratados con iloprost. La morbilidad de cualquier causa afectó al 67% de los pacientes que no recibieron el fármaco comparado con el 40% de los tratados. Las tasas de supervivencia fueron mayores de forma significativa con iloprost que sin dicho tratamiento, tanto a los 30 días (p=0,009) como la acumulada a los 5 años (p=0,0187). La infusión de iloprost durante 72h después de la corrección abierta de un AAA se asoció con una mejora de la perfusión sistémica y una disminución de la isquemia sistémica. Los pacientes obtuvieron un beneficio significativo en las tasas de supervivencia a los 30 días y a los 5 años, con una mejora significativa de las funciones renal, cardíaca y respiratoria.
Mantener la perfusión sistémica y reducir a un mínimo el riesgo de embolización periférica son un objetivo importante en el manejo del postoperatorio inmediato del tratamiento de los aneurismas de la aorta abdominal (AAA). Debido al riesgo inherente de hemorragia a nivel de la anastomosis con el empleo de heparina intravenosa, se ha buscado un método alternativo para mantener una perfusión óptima durante este período de alto riesgo.
El iloprost es un análogo sintético de la prostaciclina (epoprostenol) con una actividad farmacodinámica similar. Se ha utilizado satisfactoriamente en el tratamiento de la hipertensión arterial pulmonar1,2 y en pacientes con hipertensión arterial pulmonar tromboembólica crónica3. El iloprost se ha utilizado con grados variables de eficacia en el tratamiento de la isquemia aguda de las extremidades4, aterosclerosis obliterante avanzada, fenómeno de Raynaud5,6 e insuficiencia cardíaca congestiva7, como potente vasodilatador e inhibidor eficaz de la agregación plaquetaria.
En el presente estudio se evaluó la actividad del iloprost, un análogo de la prostaglandina I2 (PGI2), como adyuvante potencial para mantener la perfusión sistémica evitando el riesgo hemorrágico postoperatorio asociado a la administración de heparina. Éste es un estudio comparativo de cohortes fundamental para investigar la tolerabilidad y eficacia de la administración de iloprost en el período postoperatorio en pacientes tratados por un AAA de forma electiva (AAAE).
MétodosEl objetivo del presente estudio fue evaluar el efecto de la infusión de iloprost durante 72h sobre el daño isquémico secundario a la corrección abierta de los AAAE practicados en un centro terciario de cirugía vascular de referencia. Se incluyó en el estudio a los pacientes tratados entre el 1 de enero de 2000 y el 1 de enero de 2007. Se excluyeron todas las correcciones de emergencia, urgentes y endovasculares de los AAA. El protocolo de estudio fue aprobado por el comité ético farmacológico del hospital para su utilización en los AAAE.
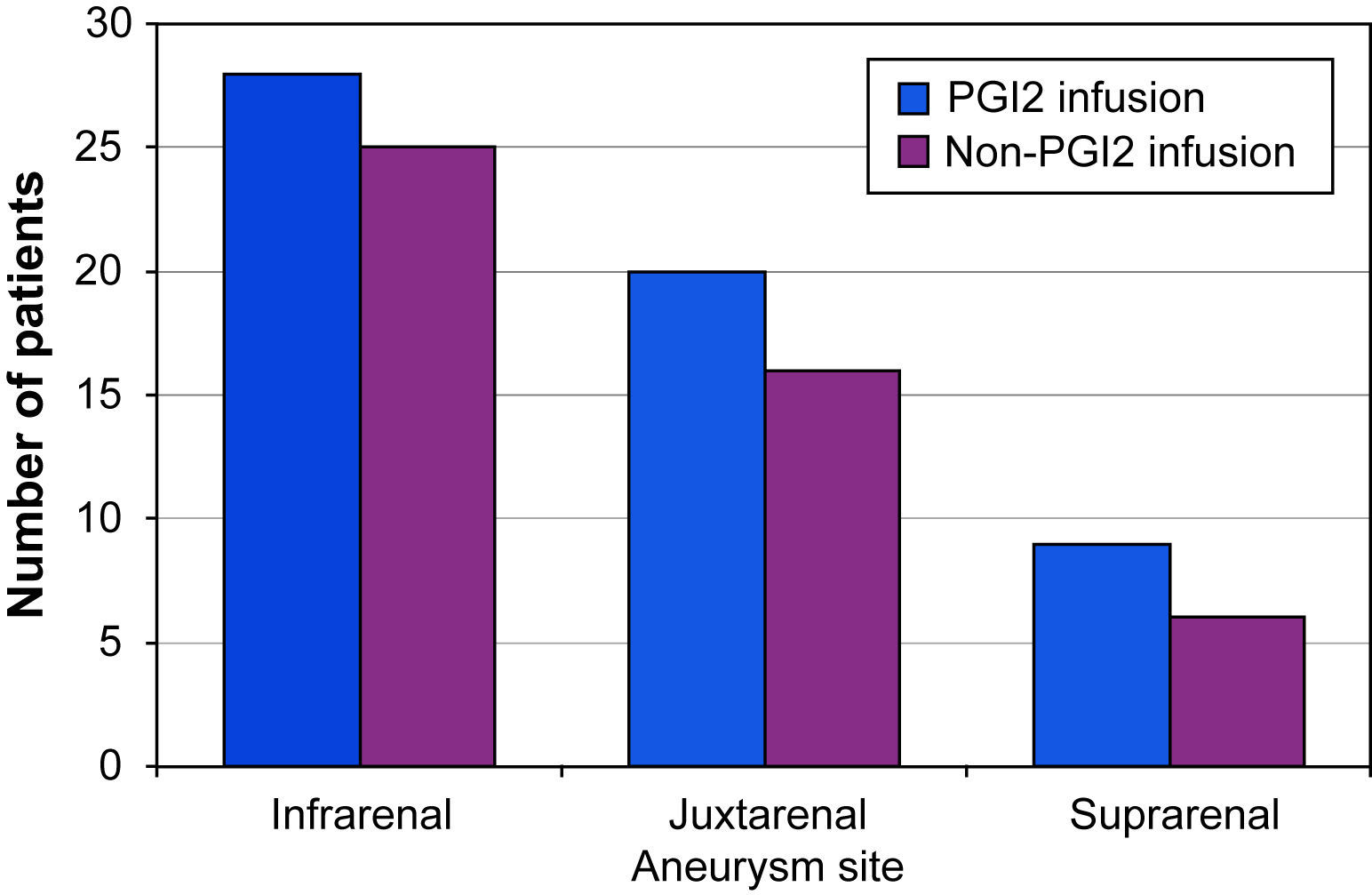
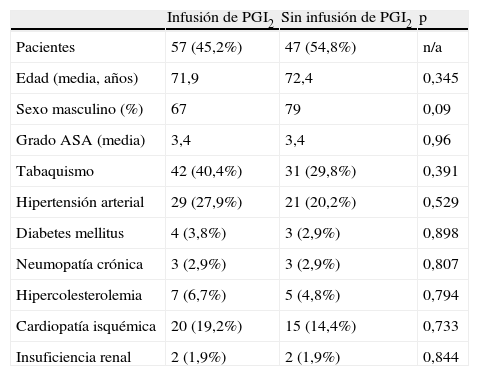
Los datos se obtuvieron a partir de un sistema VascuBase® (Consensus Medical, Vancouver, Canadá) mantenido de forma prospectiva, con las características demográficas y las de la enfermedad, los detalles quirúrgicos y del tratamiento, los registros de los exámenes realizados en el laboratorio vascular y el seguimiento a largo plazo de los pacientes. Se registraron las características demográficas de los pacientes, incluida la edad y el sexo, al igual que las dimensiones aneurismáticas, incluido el diámetro máximo y la localización en relación con las arterias renales (fig. 1). Los datos demográficos, ilustrados en la tabla I, no mostraron diferencias estadísticamente significativas entre los grupos de estudio.
Características demográficas
| Infusión de PGI2 | Sin infusión de PGI2 | p | |
| Pacientes | 57 (45,2%) | 47 (54,8%) | n/a |
| Edad (media, años) | 71,9 | 72,4 | 0,345 |
| Sexo masculino (%) | 67 | 79 | 0,09 |
| Grado ASA (media) | 3,4 | 3,4 | 0,96 |
| Tabaquismo | 42 (40,4%) | 31 (29,8%) | 0,391 |
| Hipertensión arterial | 29 (27,9%) | 21 (20,2%) | 0,529 |
| Diabetes mellitus | 4 (3,8%) | 3 (2,9%) | 0,898 |
| Neumopatía crónica | 3 (2,9%) | 3 (2,9%) | 0,807 |
| Hipercolesterolemia | 7 (6,7%) | 5 (4,8%) | 0,794 |
| Cardiopatía isquémica | 20 (19,2%) | 15 (14,4%) | 0,733 |
| Insuficiencia renal | 2 (1,9%) | 2 (1,9%) | 0,844 |
ASA: American Society of Anesthesiologists; n/a: no aplicable; PGI2: prostaglandina I2.
La función pulmonar se evaluó preoperatoriamente mediante pruebas de función pulmonar normalizadas, realizadas en la Unidad de Neumología del centro. Se registró la tasa de ventilación postoperatoria y su duración, incluida la necesidad de practicar una traqueostomía. Se registraron las tasas de presentación de edema y derrame pulmonar como adyuvante de la evaluación de la función pulmonar. Se registraron como episodios mórbidos neumonía, embolia y atelectasia confirmadas clínica y radiológicamente.
Los índices utilizados para evaluar la función renal incluyeron las determinaciones seriadas de las concentraciones séricas de urea y de creatinina pre y postoperatoria, de las tasas de filtración glomerular estimadas (TFGe) pre y postoperatorias, de la estimación del aclaramiento de creatinina y de la tasa de diálisis postoperatoria.
La función cardíaca, con especial atención en la fracción de eyección, los defectos valvulares, y la presencia de miocardiopatía, se evaluó mediante ecocardiografía transtorácica, junto con registros electrocardiográficos y la determinación de las concentraciones plasmáticas de troponina. Se registró cualquier infarto de miocardio hemodinámico/clínico postoperatorio.
La función intestinal se monitorizó utilizando los valores de pH, de lactato, la confirmación de isquemia mesentérica y la alteración de la función intestinal.
Se registraron las complicaciones de las extremidades inferiores incluyendo la prueba de ateroembolización periférica (trashing) de la extremidad.
Los cambios hematológicos se monitorizaron mediante la determinación seriada de los valores de hemoglobina y el recuento de plaquetas. Tanto los pacientes tratados con la infusión de iloprost como los no tratados tuvieron la misma disponibilidad intraoperatoria de autotransfusión mediante un dispositivo recuperador celular.
El iloprost se administró inmediatamente al llegar a la unidad de cuidados intensivos (UCI) como una infusión de 100 μg diluidos en 500ml de suero salino normal a un ritmo de 20ml/h de manera continua durante 72h. No se realizó el ajuste de la dosis con respecto a las concentraciones de creatinina individuales durante dicho período de 72h. Durante la intervención, ningún paciente recibió la infusión de iloprost, según el protocolo por procedimiento. La selección de pacientes para la administración de la infusión de PGI2 se realizó de acuerdo con el cirujano vascular responsable de las intervenciones. Los pacientes se monitorizaron en la UCI para los efectos adversos respiratorios y/o hemodinámicos.
Sistemáticamente, se prescribieron a los pacientes 300mg de aspirina una vez al día en el séptimo día postoperatorio y 75mg de clopidogrel una vez al día en el décimo día postoperatorio. Los pacientes también recibieron una inyección diaria de heparina de bajo peso molecular (tinzaparina 3.500 UI por vía subcutánea) desde el primer día postoperatorio hasta el alta.
Variables analizadasLos criterios de valoración primarios fueron la mortalidad por cualquier causa, subdividida en la supervivencia a los 30 días y supervivencia acumulada a los 5 años.
Los criterios de valoración secundarios fueron la aparición de acontecimientos adversos mayores, como los cardíacos, renales, respiratorios, intestinales y la isquemia periférica.
Métodos estadísticosSe realizó el análisis de la varianza de una vía para muestras ponderadas independientemente y la prueba t para la comparación de medias. Se consideró estadísticamente significativo un valor de p<0,05. Para evaluar las tasas de supervivencia a los 30 días y de supervivencia acumulada a los 5 años, se utilizó un análisis de supervivencia de Kaplan-Meier.
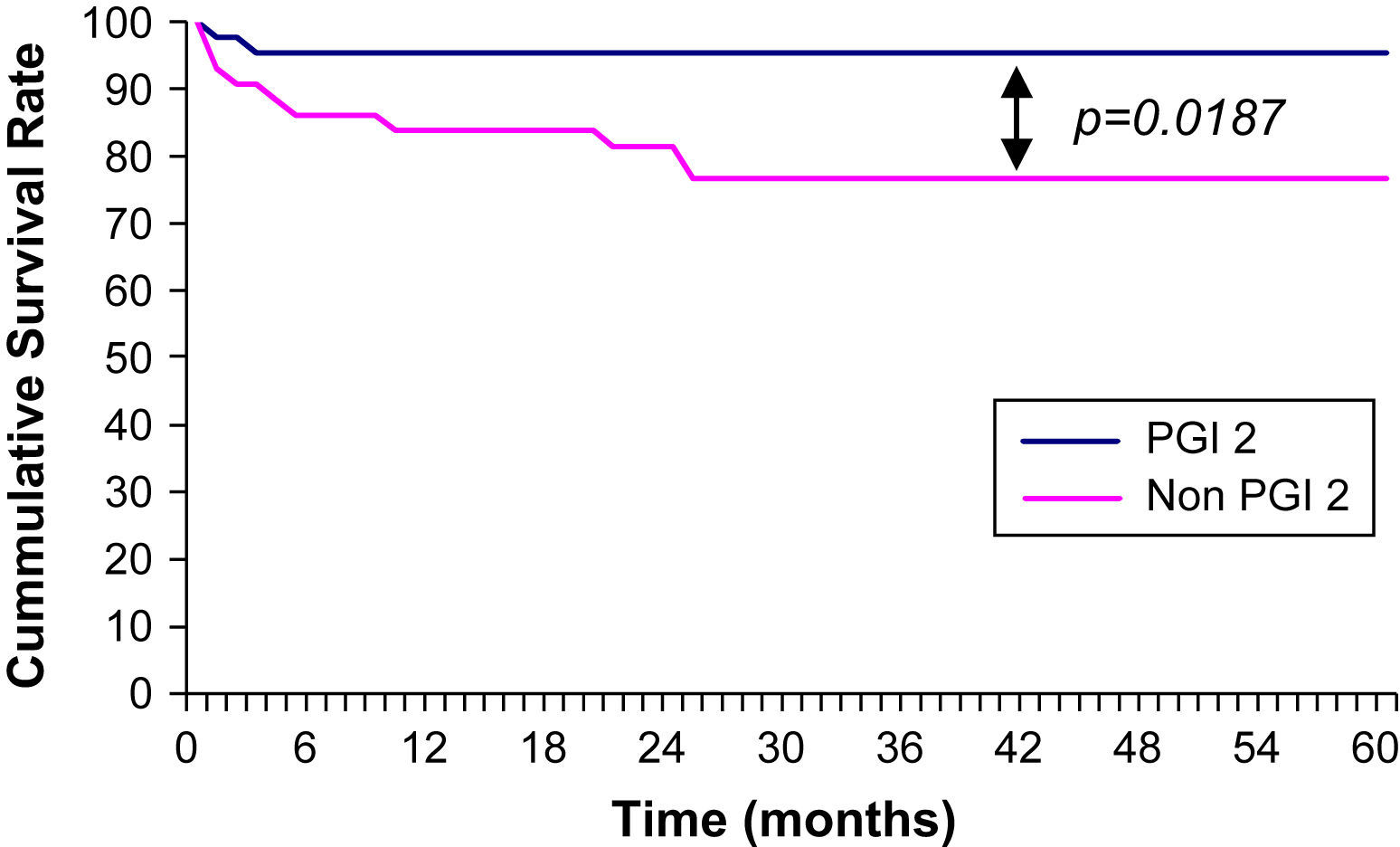
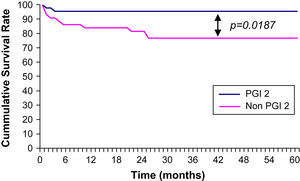
ResultadosSupervivencia acumulada a los 5 añosSe observó una tasa de supervivencia acumulada a los 5 años mayor de forma significativa en pacientes que habían recibido una infusión de iloprost, comparado con los no tratados. En esos pacientes, la tasa de supervivencia fue de 95,4±10% comparado con una tasa de 76,7±7,89% en el grupo no tratado (p=0,0187; razón de riesgo=0,20; intervalo de confianza del 95% 0,05-0,76) (fig. 2).
Mortalidad a los 30 díasLas cifras de mortalidad a los 30 días se calcularon para ambos grupos excluyendo la mortalidad en las 72 primeras horas del período postoperatorio. Durante este período, fallecieron 10 pacientes que no recibieron iloprost (22%) comparado con 2 (4%) que habían recibido la infusión, lo que mostró un beneficio significativo en la mortalidad durante el período postoperatorio precoz (p=0,009).
Morbilidad pulmonarEn pacientes no tratados con iloprost se observaron tasas de ventilación significativamente más altas, con necesidad de ventilación mecánica en 22 pacientes (48%) comparado con 10 (18%) del grupo tratado con la infusión (p=0,002).
De acuerdo con esto, se puso de relieve una mayor tasa de complicaciones pulmonares, incluidas neumonía, edema, derrames, atelectasia, embolia e insuficiencia respiratoria, en el grupo que no recibió la infusión, experimentando morbilidad relacionada con la función pulmonar el 48,8% de los pacientes comparado con el 17,8% de la cohorte tratada con iloprost (p=0,001).
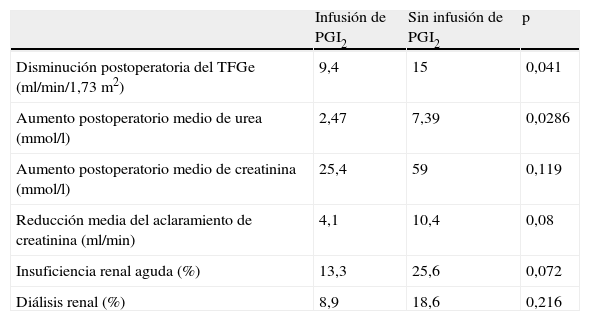
Morbilidad renalLa TFGe se determinó preoperatoriamente junto con el valor postoperatorio mínimo. Se compararon entre ambos grupos los valores medios. Se observó una disminución significativamente mayor de los valores medios en el grupo no tratado con la infusión, de 15ml/min/1,73m2, comparado con el grupo que recibió la infusión, de 9,4ml/min/1,73m2 (p=0,041) (tabla II). Se registraron los valores de urea y creatinina en todos los pacientes preoperatoriamente, en el primer día postoperatorio, y como determinación seriada hasta el alta de la UCI, de los que se recogieron los valores máximos para ambos parámetros. El aclaramiento de creatinina se estimó a partir de la concentración de creatinina preoperatoria y de los valores máximos de creatinina durante la estancia en la UCI. Se observó un aumento significativo de los valores preoperatorios de urea en los pacientes no tratados con iloprost durante el curso postoperatorio en la UCI, que se incrementaron una media de 7,39mmol/l comparado con un incremento de 2,47mmol/l en los tratados con iloprost (p=0,0286).
Morbilidad renal
| Infusión de PGI2 | Sin infusión de PGI2 | p | |
| Disminución postoperatoria del TFGe (ml/min/1,73m2) | 9,4 | 15 | 0,041 |
| Aumento postoperatorio medio de urea (mmol/l) | 2,47 | 7,39 | 0,0286 |
| Aumento postoperatorio medio de creatinina (mmol/l) | 25,4 | 59 | 0,119 |
| Reducción media del aclaramiento de creatinina (ml/min) | 4,1 | 10,4 | 0,08 |
| Insuficiencia renal aguda (%) | 13,3 | 25,6 | 0,072 |
| Diálisis renal (%) | 8,9 | 18,6 | 0,216 |
El aumento de la concentración de creatinina a partir de los valores obtenidos en el preoperatorio fue de más del doble en los pacientes no tratados con iloprost, con un incremento medio de 59μmol/l comparado con un incremento de 25,4μmol/l en los que recibieron la infusión (p=0,119).
Se calculó el aclaramiento de creatinina, y su disminución a partir de los valores preoperatorios fue como promedio de 10,4ml/min en los pacientes no tratados con iloprost y de 4,1ml/min en los tratados (p=0,08).
En 11 pacientes (24%) del grupo no tratado con iloprost se desarrolló necrosis tubular aguda, comparado con seis del grupo tratado (11%) (p=0,07), y fue necesaria la diálisis en seis de esos 11 pacientes comparado con dos de los seis tratados con iloprost.
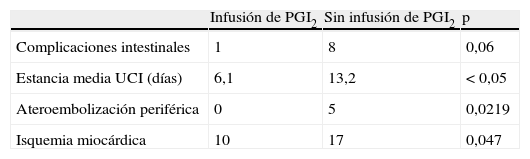
Morbilidad cardíacaSe observó isquemia miocárdica durante el curso postoperatorio con una frecuencia significativamente mayor en los pacientes no tratados con iloprost, con un aumento significativo de la concentración de troponina en 17 de ellos (37%), comparado con 10 (18%) de los que recibieron la infusión durante 72h (p=0,0223) (tabla III).
Se documentaron ocho infartos de miocardio hemodinámica/clínicamente apropiados. En el grupo no tratado con iloprost seis pacientes fallecieron del acontecimiento, mientras que en el tratado sólo fallecieron dos de 10 pacientes.
Morbilidad intestinalNo se registraron diferencias significativas con respecto a la tasa global de complicaciones intestinales, aunque se observó diarrea persistente (> 3 días) en cinco pacientes no tratados con iloprost comparado con sólo uno del grupo tratado. Se observó con mayor frecuencia un aumento de los valores de lactato en los pacientes no tratados con la infusión (n=12, 26%) comparado con aquellos que fueron tratados (n=7, 12,5%) (p=0,07).
Otras morbilidades intestinales observadas en el grupo no tratado fueron la perforación de una úlcera duodenal (n=1), la hemorragia gastrointestinal alta (n=1) y la colitis pseudomembranosa (n=1).
Isquemia periféricaSe observó en cinco pacientes (11%) un ateroembolismo periférico de las extremidades inferiores, todos del grupo de pacientes no tratado del estudio (p=0,018).
Estancia en la UCILa estancia de los pacientes en la UCI fue un 50% más breve si habían recibido la infusión en el postoperatorio, con una media de 6,3 días comparado con 13,1 para los no tratados con iloprost (p=0,05).
Parámetros hematológicosLas necesidades de transfusión de sangre fueron mayores en el grupo que no recibió la infusión con una media de 4,15 unidades de concentrado de hematíes, comparado con 3,6 unidades en el grupo que recibió la infusión (p=0,09).
Se evaluó a los pacientes con respecto a los parámetros hematológicos, incluidos valores seriados de hemoglobina y el recuento de plaquetas. En pacientes tratados con iloprost, se observó una reducción significativa del recuento de plaquetas, con una disminución media de 46x103 plaquetas/dl durante la estancia en la UCI comparado con un aumento medio de 25x103 plaquetas/dl (p=0,006) en el grupo no tratado con iloprost. Entre el período previo a la cirugía y el alta de la UCI, la concentración media de hemoglobina disminuyó en 2,2g/dl en pacientes tratados con la infusión de iloprost comparado con 3g/dl en los no tratados (p=0,006).
Efectos secundarios relacionados con iloprostTres de los 57 pacientes tratados presentaron un efecto secundario asociado a iloprost. Uno desarrolló hipotensión grave que precisó la interrupción de la infusión después de 36h de tratamiento. Los otros dos experimentaron edema pulmonar, uno de ellos durante la última parte de la administración del tratamiento; no fue necesario un cambio del protocolo de infusión.
Pacientes excluidos del estudioSe excluyó cualquier fallecimiento ocurrido en las 72 primeras horas, ya que los pacientes no habían recibido la tanda completa de iloprost durante este período. Se recogieron estos fallecimientos y se realizó un subanálisis. Se produjeron dos muertes durante las primeras 72h del postoperatorio, una en cada grupo; y ambos pacientes se excluyeron del análisis ulterior. Las muertes fueron secundarias a una parada cardiaca en las 24 primeras horas del postoperatorio.
DiscusiónEn los procedimientos quirúrgicos complejos mayores, como el tratamiento convencional de los AAAE, continúa siendo mandatorio mejorar al máximo el estado del paciente, tanto en el período preoperatorio como en el postoperatorio. Dada la naturaleza de este tipo de cirugía, el potencial de complicaciones isquémicas, embólicas e inflamatorias sigue siendo alto y casi un tercio de pacientes sometidos a estos procedimientos experimentarán una morbilidad de grado variable. En un esfuerzo para reducir a un mínimo estas complicaciones potenciales, desarrollamos una nueva pauta de infusión de iloprost.
No ha pasado desapercibido el papel potencial de este fármaco en una amplia variedad de procesos clínicos, con estudios publicados en los que se describen los beneficios en diversas situaciones asociadas con insuficiencia vascular. En ellos, se recogen el tratamiento de la isquemia digital en combinación con dextrano8, la mejoría clínica prolongada de pacientes con vasculopatía periférica oclusiva9, la tolerancia prolongada al ejercicio en pacientes con angina de pecho estable10, el tratamiento eficaz de las enfermedades vasculares periféricas vasospásticas, como el fenómeno de Raynaud6, la inhibición de la agregación plaquetaria asociada a la activación plaquetaria inducida por heparina, y la posibilidad de efectuar procedimientos quirúrgicos cardiovasculares en estos pacientes con una disminución del riesgo de complicaciones trombóticas11-14. Se han publicado también casos clínicos en los que se ha descrito un beneficio en la insuficiencia renal secundaria a vasospasmo15, en la tromboangeítis obliterante, en la isquemia digital y en la insuficiencia renal asociada al síndrome de émbolos de colesterol16.
Muchas de estas publicaciones han mostrado un beneficio en procesos a los que están expuestos los pacientes tratados por AAA mediante la técnica convencional. El desarrollo de una infusión de iloprost en un contexto postoperatorio inmediato que realizamos, consecuentemente, trató de prevenir que los pacientes desarrollaran dicha lesión isquémica.
La farmacocinética de iloprost es multifactorial: (1) la PGI2 estimula la adenilato ciclasa e induce un aumento de los niveles circulantes de adenosín monofosfato cíclico (AMPc), el cual está modulado por la activación de los canales de calcio y potasio de las células musculares lisas endoteliales, lo que da lugar a una hiperpolarización y la inhibición posterior de las miosina cinasas. Este efecto se propaga mediante la acción inhibidora de iloprost sobre los leucotrienos, el tromboxano A2, la endotelina 1 y el factor constrictor derivado del endotelio5. (2) El iloprost es un potente inhibidor de la activación y agregación plaquetarias, y en diversos estudios se ha mostrado que su efecto antiagregante es 10 veces mayor que el de la prostaciclina endógena y más de 100 veces mayor que el del alprostadilo17 (PGI2). (3) Actividades antiinflamatorias y antifibróticas mediadas a través de la inhibición de las citocinas proinflamatorias y profibróticas y la inhibición de la activación y adhesión de los leucocitos. (4) Administrado por vía intravenosa, la semivida de iloprost es de 30min, con una distribución en estado de equilibrio de la sustancia activa en órganos y tejidos a los 3-4min del comienzo de la infusión. El 70% del fármaco se elimina por el riñón, con una eliminación por las heces menor18. Las disfunciones hepática y renal graves influyen en las concentraciones plasmáticas del fármaco pero un deterioro renal de leve a moderado no parece impedir su aclaramiento19.
Los principales inconvenientes de la administración de la infusión de iloprost se relacionan con sus efectos sobre la estabilidad hemodinámica, con una reducción de la resistencia vascular y de la presión arterial dosis-dependiente, con o sin aumento de la frecuencia cardíaca10,14,20,21. Dichos cambios pueden dar lugar a una hipotensión pronunciada; por lo tanto, una presión arterial sistólica menor de 85 mmHg es una contraindicación relativa para su uso. Se han documentado reacciones adversas graves, como el edema pulmonar secundario a la hipertensión arterial venosa pulmonar, y otros efectos adversos, como tos seca persistente, cefaleas y trismus. En el presente estudio no se observó ningún episodio de inestabilidad hemodinámica en los pacientes en los que se practicó una anestesia epidural perioperatoria.
La existencia de insuficiencias renal y hepática se debe tener en consideración cuando se administra iloprost. El aclaramiento del fármaco puede reducirse a la mitad en pacientes con disfunción hepática (clase B de Child Pugh). En un estudio se documentó que en pacientes con cirrosis hepática grave la semivida terminal del fármaco no presentó cambios, pero las concentraciones en estado de equilibrio fueron el doble que las observadas en individuos voluntarios sanos después de una infusión de 1mg/kg/min22.
Se ha demostrado además que la insuficiencia renal grave afecta al aclaramiento de ilioprost tras su administración. Hildebrand et al mostraron una reducción del aclaramiento postinfusión en pacientes con insuficiencia renal terminal del triple respecto al valor del aclaramiento en pacientes cuya función renal era normal22 En pacientes no sometidos a diálisis no es necesario el ajuste de la dosis.
Como criterios de valoración primarios, las tasas de supervivencia a los 30 días y la acumulada a los 5 años aumentaron de forma significativa con la infusión de iloprost, sugiriendo un papel significativo de la infusión de iloprost como adyuvante en el postoperatorio inmediato del tratamiento convencional de los AAAE.
Más tarde, evaluamos una serie de criterios de valoración secundarios relacionados con la isquemia sistémica para evaluar el beneficio global de la infusión. Se ha demostrado el efecto favorable del fármaco en el tratamiento de la isquemia cardíaca, de los procesos embólicos, de la vasculopatía periférica, de la angiopatía diabética y de la enfermedad de Raynaud. Los datos del presente estudio evaluaron su papel protector en relación con la circulación sistémica y con el mantenimiento de la perfusión orgánica. Documentamos los hallazgos clínicos macrocirculatorios de la ateroembolización periférica de la extremidad; no obstante, una evaluación futura de la microcirculación, mediante la determinación transcutánea de oxígeno, podría complementar la evaluación de las acciones de este fármaco. Se mostró un beneficio significativo de grado variable en las funciones cardíaca, pulmonar y renal, relacionado con la infusión. A pesar de no alcanzar significación estadística, algunos resultados mostraron una tendencia hacia unos mejores resultados. Debido a la potencia del estudio, no fue posible identificar significativamente ningún subgrupo de pacientes con comorbilidades preexistentes que se beneficiara de la infusión de iloprost. No obstante, en un estudio prospectivo a mayor escala se podría reconocer a aquellos pacientes de mayor riesgo que se beneficiarían de la infusión de iloprost.
En ningún otro estudio se ha evaluado la infusión de iloprost en una cohorte de pacientes de estas características. Los beneficios sugeridos por los resultados del presente estudio nos hacen creer que, aunque son necesarios estudios adicionales relacionados con este tratamiento, la infusión de iloprost es un nuevo adyuvante, fascinante y potencialmente revolucionario del tratamiento convencional de los AAA durante el postoperatorio inmediato. Como consecuencia de este estudio, todos los pacientes de nuestro hospital que se someten en la actualidad a una corrección electiva abierta reciben esta infusión en el postoperatorio.
Consideramos que las tendencias favorables en la mejora de la perfusión sistémica que demostramos podrían mostrar significación estadística con una cohorte de estudio a mayor escala. Lamentablemente, dada la naturaleza del procedimiento y el advenimiento de las técnicas endovasculares, en particular en el tratamiento de los AAAE, una cohorte lo suficientemente extensa sigue siendo difícil de incluir y está fuera del alcance de este estudio. Se podría evitar cualquier potencial sesgo de selección mediante la asignación aleatoria de los pacientes y, por lo tanto, la prevención de una autoselección. Esperamos que ensayos multicéntricos a mayor escala complementen los hallazgos iniciales del presente estudio y evalúen de forma prospectiva una cohorte a mayor escala en la que se asigne el tratamiento con iloprost de manera aleatoria.
ConclusiónLa infusión de iloprost durante 72h después del tratamiento convencional de los AAA se asocia con una mejora de la perfusión sistémica y una disminución de la isquemia sistémica. Como tratamiento adyuvante de la cirugía, iloprost ofrece un beneficio significativo en la supervivencia a los 30 días y a los 5 años con una disminución significativa de las complicaciones renales, cardíacas y respiratorias.