El objetivo de este estudio fue examinar el efecto del iloprost en las lesiones renales inducidas por isquemia-reperfusión (IR) de la aorta abdominal y su mediación a través de la modulación en la expresión de moléculas de adhesión. Veinticuatro ratas Wistar albinas se distribuyeron de forma aleatoria en 3 grupos (n=8) de la forma siguiente: control (laparotomía simulada), IR aórtica (120min de isquemia y 120min de reperfusión), e IR aórtica + iloprost (0,45μg/kg/h en infusión intravenosa durante 120min de reperfusión). Se obtuvieron muestras de sangre y de tejido renal para su análisis bioquímico. Así mismo se realizó la evaluación histológica mediante tinción con hematoxilina-eosina e inmunohistoquímica. Los análisis bioquímicos demostraron que la IR aórtica aumentó de forma significativa (p<0,05 frente al control) mientras que el iloprost redujo de forma significativa (p<0,05 frente a IR aórtica) las concentraciones plasmáticas de malondialdehído, P-selectina, molécula de adhesión intercelular-1 (ICAM-I), y las concentraciones tisulares de malondialdehído y catalasa. La evaluación histológica mediante tinción inmunohistoquímica demostró que la IR aórtica aumentó de forma significativa (p<0,05 frente al control) mientras que el iloprost redujo de forma significativa (p<0,05 frente a IR aórtica) la inmunorreactividad de la P-selectina, el factor de necrosis tumoral alfa, las CD11b, las CD18, y la ICAM-1. La tinción con hematoxilina-eosina demostró que el iloprost también atenuó los cambios morfológicos asociados a la IR aórtica. Los resultados de este estudio demuestran que el iloprost reduce las lesiones renales inducidas por la IR aórtica en ratas y regula a la baja la expresión de las moléculas de adhesión tanto a nivel local como sistémico tras la IR aórtica durante este efecto protector.
El clampaje y desclampaje aórtico infrarrenal que se usan de forma rutinaria durante la cirugía aórtica abdominal con frecuencia provocan dos lesiones sucesivas: 1) el clampaje aórtico provoca lesiones isquémicas en las extremidades inferiores y en el sistema vascular distal, y 2) el desclampaje aórtico conduce al brusco restablecimiento de la circulación en las extremidades inferiores y a la rápida reoxigenación de los tejidos isquémicos durante la reperfusión1,2. El mecanismo desencadenante de estas lesiones se atribuye a la isquemia-reperfusión (IR) aórtica. La lesión por IR tras un clampaje aórtico provoca lesiones no solamente en las extremidades inferiores sino también en órganos más remotos como los riñones2,3. El daño renal inducido por la IR aórtica predispone a una insuficiencia renal aguda, que sigue siendo una complicación frecuente (15-22%) tras cirugía aórtica infrarrenal4,5. Tras una insuficiencia renal aguda puede presentarse un fallo renal agudo que requiera diálisis, y que sigue asociándose con una elevada mortalidad (66%) a pesar de que su incidencia es relativamente poco frecuente6 (1,8-4%).
La fisiopatología de la lesión renal inducida por la IR aórtica es compleja y solamente se conoce de forma parcial. Implica una cascada de acontecimientos que incluyen la liberación de radicales libres derivados del oxígeno, peroxidación lipídica, síntesis de citocinas, alteración de la adhesión celular, migración leucocitaria, y lesiones tisulares mediadas por leucocitos2,3,7. Para que se inicien las lesiones en órganos remotos, la reperfusión debe activar los leucocitos circulantes y provocar que se adhieran en ellas8. Por tanto, las moléculas de adhesión celular desempeñan un papel crucial en la lesión por IR al mediar en la interacción de los leucocitos con el endotelio9,10. Las moléculas de adhesión celular son selectinas (L-selectina, P-selectina, E-selectina), integrinas (b1 integrinas, b2 integrinas [CD11a/CD18, CD11b/CD18, CD11c/CD18, CD11d/CD18]), y la superfamilia de las inmunoglobulinas9 (molécula de adhesión celular intercelular-1 [ICAM-1], ICAM-2, y molécula de adhesión celular vascular-1 [VCAM-1]).
El iloprost es un análogo estable del epoprostenol11 (prostaciclina) y se utiliza principalmente en el tratamiento de la arteriopatía periférica12 y la hipertensión arterial pulmonar13. El iloprost ha demostrado tener efectos citoprotectores mediados por la vasodilatación, disminuir la agregación plaquetaria, e inhibir la activación de los leucocitos11,12. Si bien se ha documentado el efecto protector del iloprost frente a la lesión por IR en pulmones14, miocardio15 y músculo esquelético16 en estudios realizados en animales, hasta la fecha ninguno ha examinado la modulación de las moléculas de adhesión durante el efecto del iloprost en las lesiones renales. Por tanto, el objeto de este estudio fue examinar: 1) el efecto del iloprost en las lesiones renales inducidas por la IR aórtica y 2) su mediación a través de la modulación de la expresión de moléculas de adhesión durante este efecto.
Materiales y MétodosAnimalesEn el experimento se utilizaron 24 ratas Wistar albinas de ambos sexos y de peso comprendido entre 200 y 250g. Los protocolos experimentales fueron autorizados por el Animal Ethics Committee of Suleyman Demirel University Medical School (29 de septiembre de 2005, n.° 10/05). Las ratas fueron adquiridas en el animalario de la universidad y se alojaron en jaulas individuales en un ambiente controlado en cuanto a temperatura y ciclo lumínico y tuvieron libre acceso a la comida y al agua. Todas las ratas recibieron un trato compasivo, de acuerdo a los ‘‘Principios del Cuidado de los Animales de Laboratorio'’ formulados por la National Society for Medical Research y la Guía para el Cuidado y Uso de Animales de Laboratorio preparada por el Institute of Laboratory Animal Resources y publicada por el National Institutes of Health (NIH publication 85-23, revisión 1985).
Intervenciones quirúrgicasGrupos experimentalesLas ratas se distribuyeron de forma aleatoria en uno de los 3 grupos experimentales (n=8): grupo control, grupo IR aórtica, y grupo IR aórtica + iloprost. El grupo control fue sometido a laparotomía y a la disección de la aorta abdominal infrarrenal (AAI) sin oclusión. El grupo IR aórtica fue sometido a 120min de isquemia aórtica y a 120min de reperfusión. El grupo IR aórtica + iloprost fue sometido a los mismos períodos de isquemia aórtica y reperfusión y recibió iloprost. El iloprost (Ilomedin®; Bayer Schering Pharma AG, Berlín, Alemania) se diluyó en una solución salina y se administró en infusión intravenosa continua17 (0,45μg/kg/h) en una vena de la cola durante 120min de reperfusión.
IR aórticaLas ratas fueron anestesiadas con hidrocloruro de ketamina (Ketalar®, 50mg/kg por vía intramuscular; Eczacibaşi, Estanbul, Turquía), y la anestesia se mantuvo con inyecciones intramusculares suplementarias de hidrocloruro de ketamina. Las ratas se colocaron en decúbito supino bajo una lámpara de calor. La piel se preparó de forma aséptica y se realizó una laparotomía por la línea media. Se instiló una solución salina normal (10ml) en la cavidad peritoneal para mantener el equilibrio hídrico. Se expuso la aorta abdominal desplazando suavemente las asas intestinales hacia la izquierda con gasas húmedas. Se colocó un clampaje microvascular atraumático (Vascu-Statts II, Midi Straight 1001-532; Scanlan, St. Paul, MN) a través del AAI. Posteriormente se cerró el abdomen y la herida se cubrió con un vendaje plástico para reducir al mínimo la pérdida de calor y fluidos. Al cabo de 120min se retiró el clampaje microvascular del AAI y las extremidades posteriores se reperfundieron durante 120min. La oclusión y la reperfusión aórticas fueron confirmadas por la pérdida y reaparición de un pulso satisfactorio en la aorta distal, de forma que se excluyó el fenómeno de no reflujo. Tras obtener muestras de sangre, todas las ratas fueron sacrificadas bajo anestesia, y se extirparon cuidadosamente los dos riñones en bloque. Se extrajeron muestras y se almacenaron a –80°C hasta su evaluación bioquímica.
Análisis bioquímicosMuestras tisulares y sanguíneasLas muestras de sangre se mantuvieron a temperatura ambiente durante 30min y posteriormente se separó el plasma mediante centrifugación a 4.000 x g durante 10min. Todas las muestras se protegieron a –80°C hasta la fecha de su análisis, en que se determinaron las concentraciones plasmáticas de P-selectina, ICAM-1, VCAM-1, malondialdehído (MDA), nitrógeno ureico sanguíneo (BUN), y creatinina.
Las muestras tisulares congeladas de riñón de rata se pesaron y se homogeneizaron (Ultra Turrax T25, 1:10, p/v; Janke & Kunkel, Staufen, Alemania) en 100mmol/l de tampón fosfato (pH 7,4) conteniendo un 0,05% de azida sódica en un baño de hielo. El homogeneizado se expuso a ondas sonoras (Sonoplus UW2070; Bandelin, Berlín, Alemania) durante 30 s y se centrifugó a 5.000 x g durante 10min. El sobrenadante se congeló a –78°C en alícuotas hasta que se utilizaron en el análisis bioquímico. El contenido proteico del sobrenadante se determinó mediante el método de Lowry18. Las concentraciones de MDA, superóxido dismutasa (SOD) y catalasa se determinaron en las muestras tisulares.
Moléculas de adhesiónLas concentraciones plasmáticas de P-selectina, ICAM-1, y VCAM-1 se determinaron con los kits comerciales Mouse sP-Selectin Quantikine®, Mouse sICAM-1 Quantikine®, y Mouse sVCAM-1 Quantikine®, respectivamente (R&D Systems, Mineápolis, MN). La P-selectina, la ICAM-1, y la VCAM-1 se determinaron mediante ELISA (ELx808iu Ultramicroplate Reader®; Biotek Instruments, Winooski, VT). Las concentraciones plasmáticas de P-selectina, ICAM-1, y VCAM-1 se expresaron como nanogramos por mililitro.
MDALas concentraciones tisulares de MDA se determinaron mediante el método de doble calentamiento de Draper y Hadley19. El principio del método es la determinación espectrofotométrica del color producido por la reacción del ácido tiobarbitúrico con el MDA. Para este objetivo se añadieron 2,5ml de una solución de ácido tricloroacético de 100g/l a 0,5ml de sobrenadante en cada tubo de la centrífuga. Los tubos se colocaron en un baño de agua hirviendo durante 15min y posteriormente se enfriaron en agua corriente. Los tubos se centrifugaron a 1.000 x g durante 10min y se añadieron 2ml del sobrenadante a 1ml de la solución de 6,7g/l de ácido tiobarbitúrico en un tubo de ensayo; el tubo se colocó luego en un baño de agua hirviendo durante 15min. Posteriormente la solución se enfrió con agua corriente y se determinó su absorbancia mediante un espectrofotómetro (UV-1601; Shimadzu, Kyoto, Japón) a 532nm. La concentración de MDA se calculó según el coeficiente de absorbancia del complejo MDA-ácido tiobarbitúrico (coeficiente de absorbancia €=1,56 x 105cm−1 • M−1). La concentración tisular de MDA se expresó en nanomoles por miligramo de proteína.
Las concentraciones plasmáticas de MDA se determinaron mediante cromatografía líquida de alta resolución (HPLC) y un kit comercial (Immundiagnostic MDA kit®; Immundiagnostic Systems, Fráncfort, Alemania) utilizando un dispositivo de HPLC (Finnigan MAT TS700™; Thermo Finnigan, San José, CA). La concentración plasmática de MDA se expresó en micromoles por litro.
SODLa actividad de la SOD se determinó mediante el método de Spitz y Oberley20 y Woolliams et al21. La determinación de la actividad de la SOD se basó en la reacción de la xantina con la xantina oxidasa para generar radicales superóxido, que reaccionan con el cloruro de 2-(4-iodofenil)-3-(4-nitrofenol)-5-feniltetrazolio para formar un colorante rojo formazán. La actividad de la SOD se determina, pues, según el grado de inhibición de esta reacción. La concentración tisular de SOD se expresó en unidades por miligramo de proteína. Se utilizó un autoanalizador (Aeroset; Abbott, Abbott Park, IL) para determinar las actividades de la enzima SOD.
CatalasaLa actividad de la catalasa se determinó mediante el método de Aebi22. El análisis se basa en la determinación de la constante de la velocidad (s−1, k) de descomposición del peróxido de hidrógeno. La constante de la velocidad se calculó mediante la fórmula k=(2,3/Δt)(a/b) log(A1/A2), donde A1 y A2 son los valores de la absorbancia del peróxido de hidrógeno en los tiempos t1 (0 s) y t2 (15 s), (a es un factor de dilución y b es el contenido en proteínas del sobrenadante). La actividad de la catalasa en el tejido se expresó como actividad catalítica (k) por miligramo de proteína. Se utilizó un espectrofotómetro Shimadzu UV-1601 para estimar las actividades de la enzima catalasa.
BUN y creatininaLa concentración plasmática de BUN se determinó mediante métodos colorimétricos adaptados a un autoanalizador (Aeroset). La concentración plasmática de BUN se expresó en miligramos por decilitro. La concentración plasmática de creatinina se determinó mediante un método colorimétrico utilizando la reacción de Jaffe23 adaptada a un autoanalizador (Aeroset) y se expresó en miligramos por decilitro.
Evaluación histológicaLos riñones se extirparon de las ratas al final del período experimental y se cortaron sagitalmente en dos mitades. Se obtuvieron 3 muestras tisulares de cada pieza renal para su revisión. Éstas se fijaron mediante inmersión en formaldehído al 10% con una solución salina tamponada con fosfato a temperatura ambiente durante 24h. Tras deshidratarlas en una serie graduada de etanol, se incluyeron en parafina y se cortaron en secciones finas (5mm) utilizando una cuchilla de microtomo.
Hematoxilina-eosinaLos cortes histológicos se montaron en portaobjetos de cristal y se secaron a 70°C, luego se desparafinizaron con xileno durante 20min y se deshidrataron con alcohol al 96% durante 20min. Se realizó una contratinción de los cortes histológicos con hematoxilina (hematoxilina de Mayer, 06002L®; Bio-Optica, Milán, Italia) y eosina y se visualizaron al microscopio óptico. El patólogo que realizó la evaluación histológica desconocía el objetivo del estudio. En las muestras renales se evaluó la presencia de esclerosis glomerular, necrosis glomerular focal, dilatación de la cápsula de Bowman, degeneración del epitelio tubular, necrosis del epitelio tubular, dilatación tubular, infiltración inflamatoria intersticial, congestión de los vasos sanguíneos, engrosamiento de la pared vascular, y fibrosis intersticial. Se puntuaron los cambios histológicos en una escala de 4 puntos: –, ausencia de cambios; +, cambios leves, focales; ++, cambios intermedios, multifocales; y +++, cambios destacados, amplios.
InmunohistoquímicaLos cortes histológicos (5mm) se montaron en portaobjetos de cristal con poli-L-lisina y se incubaron durante toda la noche a 37°C. Luego se desparafinizaron con xileno durante 10min, se deshidrataron en alcohol al 96% durante 5min, y se aclararon con agua destilada. Para obtener los antígenos, las extensiones se trataron mediante calentamiento en microondas a 98°C en un tampón de citrato (pH 6,0) durante 20min y luego se enfriaron durante otros 20min. La actividad de la peroxidasa endógena se bloqueó mediante la incubación durante 20min con hidrógeno peroxidasa al 0,3%, y las extensiones se aclararon con una solución salina tamponada con fosfato. El bloqueo de las proteínas (Large Volume Ultra V Block, TA-125-UB®; Lab Vision, Fremont, CA) se realizó durante 5min. Posteriormente se añadieron anticuerpos cebadores a los cortes histológicos utilizando diferentes períodos de incubación y porcentajes de dilución:
- 1
P-selectina (1:100, policlonal caprino, M-20/SC-6943®; Santa Cruz Biotechnology, Santa Cruz, CA), incubación durante 60min.
- 2
L-selectina (1:100, policlonal caprino, M-18/SC-6946®; Santa Cruz Biotechnology), incubación durante 60min.
- 3
Factor de necrosis tumoral-α (TNF-α) (1:50, monoclonal murino, clon P/T2®; Histopathology, Pécs, Hungría), incubación durante 30min.
- 4
CD11b (1:100, CBL®; Chemicon International, Temecula, CA), incubación durante 60min.
- 5
CD18 (1:100, M 18/2-SC-18862®; Santa Cruz Biotechnology), incubación durante 60min.
- 6
ICAM-1 (1:100, monoclonal murino, 15/2-SC-107®; Santa Cruz Biotechnology), incubación durante 60min.
Posteriormente, los cortes histológicos se aclararon en una solución salina tamponada con fosfato durante 5min y se incubaron con un anticuerpo secundario (Biotinylated Goat Anti Polyvalent, TP-125-BN®; Lab Vision) durante 20min. De nuevo volvieron a aclararse en una solución salina tamponada con fosfato durante 5min y se incubaron con un anticuerpo terciario (Large Volume Streptavidin Peroxidase, TS-125-HR®; Lab Vision) durante 20min. Tras su aclarado en una solución salina tamponada con fosfato durante 5min se añadió diaminobenzidina (TA-125-HR®, Lab Vision) y los cortes histológicos se incubaron durante 15min y se aclararon con agua destilada. Por último se realizó la contratinción de los cortes histológicos con hematoxilina de Mayer 06002L y se montaron con un medio de montaje. El tejido de las amígdalas humanas actuó como control positivo en la inmunotinción de la P-selectina, la L-selectina, y la ICAM-1. Los linfocitos murinos de sangre periférica y el tejido del linfoma humano actuaron como controles positivos en la inmunotinción de las CD18 y CD11b, respectivamente. El tejido del cáncer mamario humano actuó como control positivo en la inmunotinción del TNF-α.
Se revisó la inmunotinción de los cortes histológicos renales tanto en el intersticio renal como en el glomérulo. La expresión de la P-selectina, la L-selectina, el TNF-α, las CD11b, las CD18, y la ICAM-1 se analizó semicuantitativamente y de forma ciega utilizando un sistema de puntuación de 0 a 2: 0, ausencia de tinción; 1, tinción débil; 2, tinción fuerte24.
Análisis estadísticoLos resultados se presentan como medias ± desviación estándar (DE). Se utilizó un programa informático (SPSS versión 13.00; SPSS, Inc., Chicago, IL) para realizar el análisis estadístico. Durante el análisis de los resultados bioquímicos, las diferencias entre grupos se determinaron mediante análisis de varianza de una vía, y posteriormente mediante un test post hoc de Tukey de diferencias honestamente significativas. El nivel de significancia se estableció en p<0,05. Durante el análisis estadístico de los resultados histológicos, las diferencias entre grupos se determinaron mediante el test de Kruskal-Wallis y el test U de Mann-Whitney.
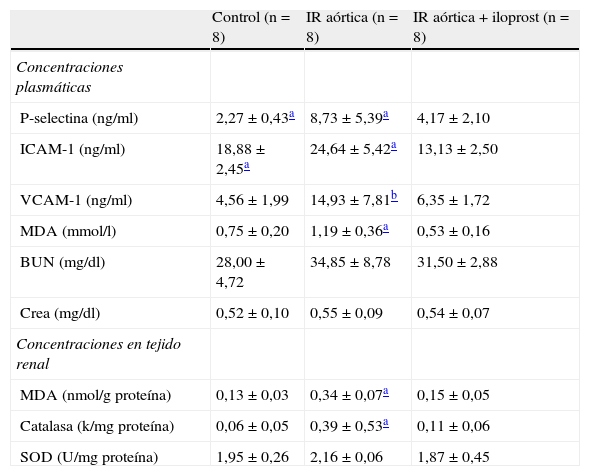
ResultadosAnálisis bioquímicosLa tabla I muestra los resultados de los análisis bioquímicos. La IR aórtica aumentó de forma significativa las concentraciones plasmáticas de P-selectina, ICAM-1, VCAM-1, y MDA (p=0,008, p=0,010, p=0,031, p=0,001 frente al grupo control, respectivamente). El tratamiento con iloprost causó una reducción significativa en las concentraciones plasmáticas de P-selectina, ICAM-1, y MDA (p=0,047, p=0,002, p=0,001 frente a la IR aórtica, respectivamente). El tratamiento con iloprost también redujo la concentración plasmática de la VCAM-1, pero la diferencia no fue estadísticamente significativa (p=0,198 frente a la IR aórtica). En el grupo de la IR aórtica, las concentraciones plasmáticas de BUN y creatinina fueron más elevadas que en el grupo control, pero la diferencia no fue estadísticamente significativa (p=0,105 y p=0,642, respectivamente). En el grupo IR aórtica + iloprost, las concentraciones plasmáticas de BUN y creatinina fueron menores que en el grupo IR aórtica, pero la diferencia no fue estadísticamente significativa (p=0,567 y p=1,000, respectivamente).
Resultados de los análisis bioquímicos.
| Control (n = 8) | IR aórtica (n = 8) | IR aórtica + iloprost (n = 8) | |
| Concentraciones plasmáticas | |||
| P-selectina (ng/ml) | 2,27 ± 0,43a | 8,73 ± 5,39a | 4,17 ± 2,10 |
| ICAM-1 (ng/ml) | 18,88 ± 2,45a | 24,64 ± 5,42a | 13,13 ± 2,50 |
| VCAM-1 (ng/ml) | 4,56 ± 1,99 | 14,93 ± 7,81b | 6,35 ± 1,72 |
| MDA (mmol/l) | 0,75 ± 0,20 | 1,19 ± 0,36a | 0,53 ± 0,16 |
| BUN (mg/dl) | 28,00 ± 4,72 | 34,85 ± 8,78 | 31,50 ± 2,88 |
| Crea (mg/dl) | 0,52 ± 0,10 | 0,55 ± 0,09 | 0,54 ± 0,07 |
| Concentraciones en tejido renal | |||
| MDA (nmol/g proteína) | 0,13 ± 0,03 | 0,34 ± 0,07a | 0,15 ± 0,05 |
| Catalasa (k/mg proteína) | 0,06 ± 0,05 | 0,39 ± 0,53a | 0,11 ± 0,06 |
| SOD (U/mg proteína) | 1,95 ± 0,26 | 2,16 ± 0,06 | 1,87 ± 0,45 |
BUN: nitrógeno ureico sanguíneo; Crea: creatinina; ICAM-1: molécula de adhesión intercelular-1; IR: isquemia-reperfusión; MDA: malondialdehído; SOD: superóxido dismutasa; VCAM-1: molécula de adhesión celular vascular-1.
La IR aórtica aumentó de forma significativa las concentraciones tisulares de MDA y catalasa (p=0,001, p=0,005 frente al control, respectivamente). El tratamiento con iloprost causó una reducción significativa de las concentraciones tisulares de MDA y catalasa (p=0,001, p=0,049 frente a IR aórtica, respectivamente). En el grupo IR aórtica, la concentración tisular de SOD fue más alta que en el grupo control, pero la diferencia no fue estadísticamente significativa (p=0,109). En el grupo IR aórtica + iloprost, la concentración tisular de SOD fue menor que la del grupo IR aórtica, pero la diferencia no fue estadísticamente significativa (p=0,423).
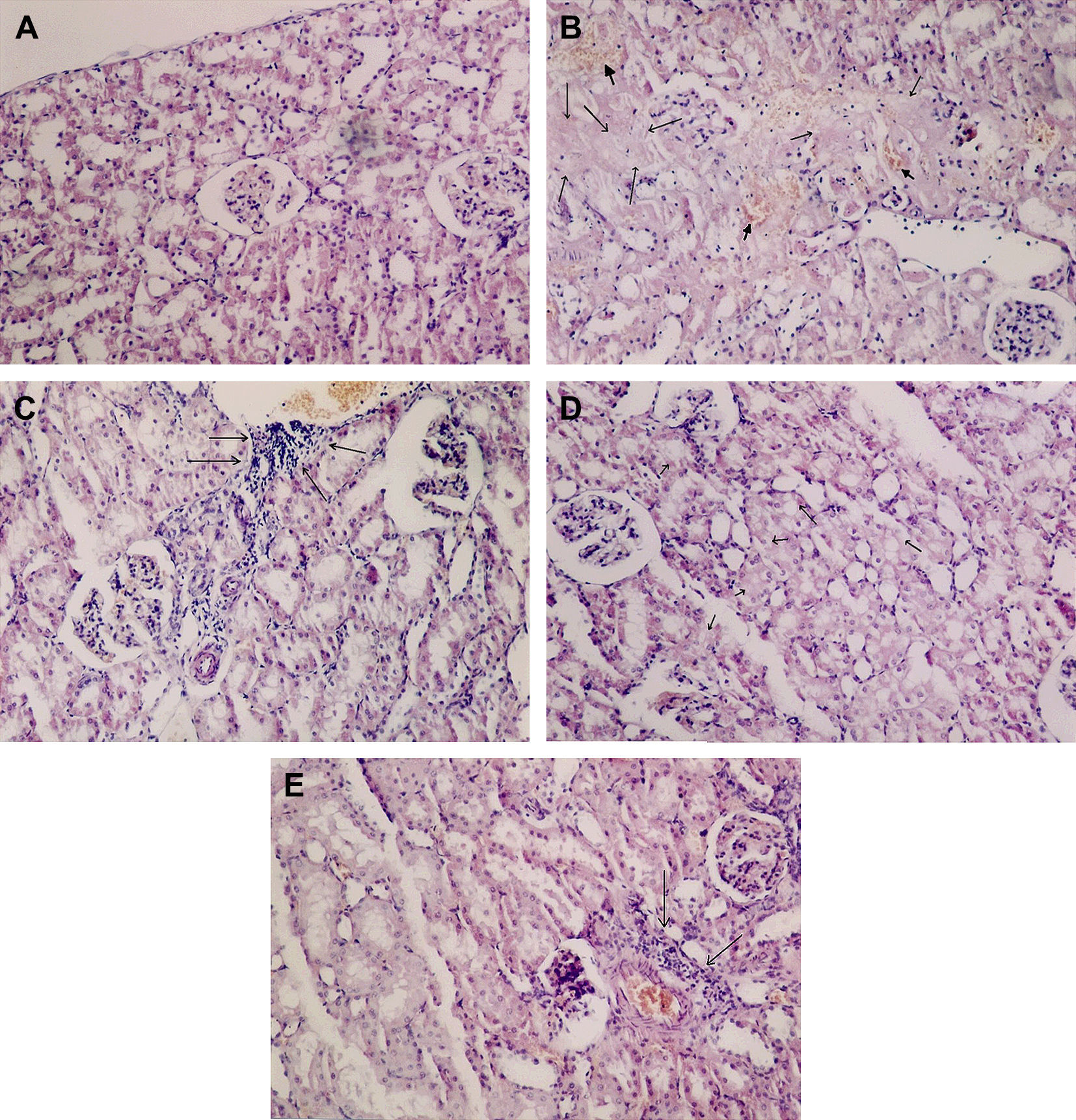
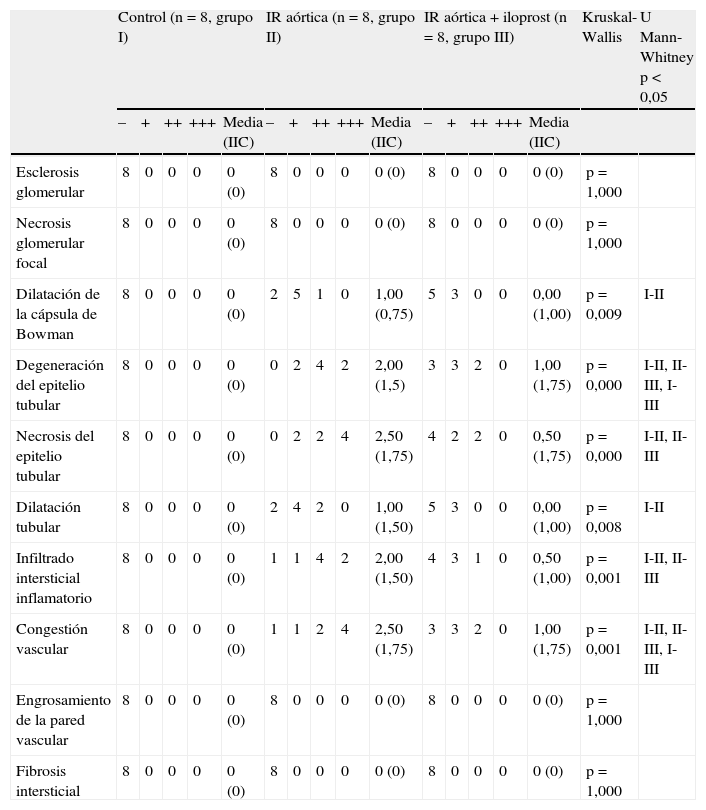
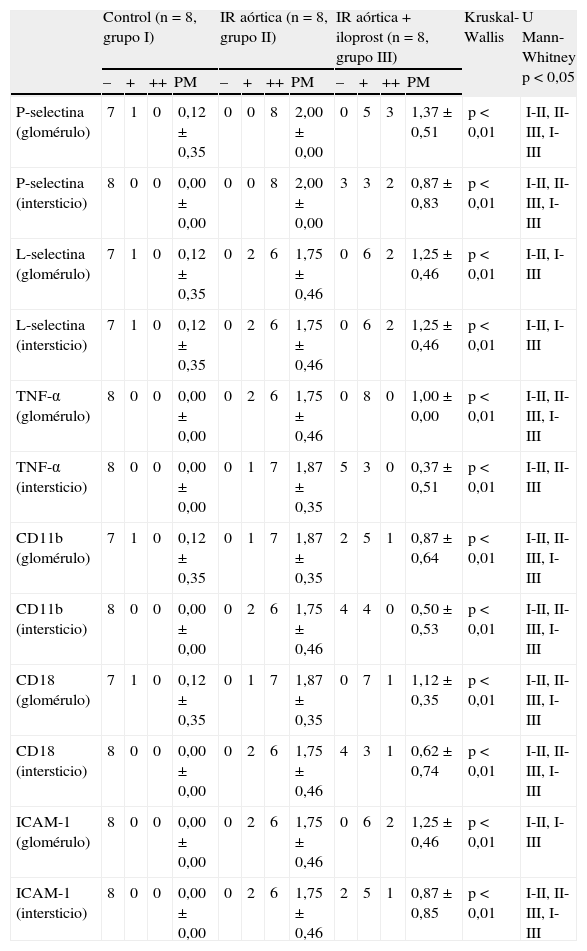
Evaluación histológicaLa evaluación histológica mediante la tinción con hematoxilina-eosina mostró que no se produjeron cambios histológicos en el grupo control (tabla II, fig. 1A). En el grupo IR aórtica, la dilatación de la cápsula de Bowman, la degeneración del epitelio tubular, la necrosis del epitelio tubular, la dilatación tubular, el infiltrado inflamatorio intersticial, y la congestión de los vasos sanguíneos fueron significativamente mayores que las del grupo control (p=0,003, p=0,000, p=0,000, p=0,003, p=0,001, y p=0,001, respectivamente) (tabla II, figs. 1B y 1C). El iloprost redujo de forma significativa la degeneración del epitelio tubular, la necrosis del epitelio tubular, el infiltrado inflamatorio intersticial, y la congestión de los vasos sanguíneos (p=0,021, p=0,009, p=0,019, y p=0,030 frente a la IR aórtica, respectivamente) (tabla II, figs. 1D y 1E). El iloprost también redujo la dilatación de la cápsula de Bowman y la dilatación tubular, pero las diferencias no fueron estadísticamente significativas (p=0,112 y p=0,084 frente a la IR aórtica, respectivamente). En ningún grupo se observó esclerosis glomerular, necrosis glomerular focal, engrosamiento de la pared vascular, o fibrosis intersticial. Los resultados de la evaluación histológica con la tinción de hematoxilina-eosina se muestran en la tabla II y la figura 1.
Resultados de la evaluación histológica con la tinción hematoxilina-eosina
| Control (n=8, grupo I) | IR aórtica (n=8, grupo II) | IR aórtica + iloprost (n=8, grupo III) | Kruskal-Wallis | U Mann-Whitney p<0,05 | |||||||||||||
| – | + | ++ | +++ | Media (IIC) | – | + | ++ | +++ | Media (IIC) | – | + | ++ | +++ | Media (IIC) | |||
| Esclerosis glomerular | 8 | 0 | 0 | 0 | 0 (0) | 8 | 0 | 0 | 0 | 0 (0) | 8 | 0 | 0 | 0 | 0 (0) | p=1,000 | |
| Necrosis glomerular focal | 8 | 0 | 0 | 0 | 0 (0) | 8 | 0 | 0 | 0 | 0 (0) | 8 | 0 | 0 | 0 | 0 (0) | p=1,000 | |
| Dilatación de la cápsula de Bowman | 8 | 0 | 0 | 0 | 0 (0) | 2 | 5 | 1 | 0 | 1,00 (0,75) | 5 | 3 | 0 | 0 | 0,00 (1,00) | p=0,009 | I-II |
| Degeneración del epitelio tubular | 8 | 0 | 0 | 0 | 0 (0) | 0 | 2 | 4 | 2 | 2,00 (1,5) | 3 | 3 | 2 | 0 | 1,00 (1,75) | p=0,000 | I-II, II-III, I-III |
| Necrosis del epitelio tubular | 8 | 0 | 0 | 0 | 0 (0) | 0 | 2 | 2 | 4 | 2,50 (1,75) | 4 | 2 | 2 | 0 | 0,50 (1,75) | p=0,000 | I-II, II-III |
| Dilatación tubular | 8 | 0 | 0 | 0 | 0 (0) | 2 | 4 | 2 | 0 | 1,00 (1,50) | 5 | 3 | 0 | 0 | 0,00 (1,00) | p=0,008 | I-II |
| Infiltrado intersticial inflamatorio | 8 | 0 | 0 | 0 | 0 (0) | 1 | 1 | 4 | 2 | 2,00 (1,50) | 4 | 3 | 1 | 0 | 0,50 (1,00) | p=0,001 | I-II, II-III |
| Congestión vascular | 8 | 0 | 0 | 0 | 0 (0) | 1 | 1 | 2 | 4 | 2,50 (1,75) | 3 | 3 | 2 | 0 | 1,00 (1,75) | p=0,001 | I-II, II-III, I-III |
| Engrosamiento de la pared vascular | 8 | 0 | 0 | 0 | 0 (0) | 8 | 0 | 0 | 0 | 0 (0) | 8 | 0 | 0 | 0 | 0 (0) | p=1,000 | |
| Fibrosis intersticial | 8 | 0 | 0 | 0 | 0 (0) | 8 | 0 | 0 | 0 | 0 (0) | 8 | 0 | 0 | 0 | 0 (0) | p=1,000 | |
IIC: intervalo intercuartil; IR: isquemia-reperfusión.
El iloprost atenúa los cambios morfológicos asociados a la lesión renal inducida por la IR aórtica. Los cortes histológicos renales se tiñeron con hematoxilina-eosina y se examinaron al microscopio óptico. A Tejido renal sano en el grupo control. Aspecto sano de las células glomerulares y tubulares (x100). B Necrosis tubular extensa (flechas finas) y hemorragia (puntas de flecha) en el intersticio renal en el grupo IR aórtica (x100). C Infiltrado inflamatorio en el intersticio renal en el grupo IR aórtica. Las flechas indican un acúmulo intenso de leucocitos neutrófilos (x100). D No existe necrosis en el epitelio tubular en el grupo IR aórtica + iloprost. Las flechas indican una leve degeneración del epitelio tubular (x100). E Las flechas indican un grado leve de infiltración intersticial por neutrófilos en el grupo IR aórtica + iloprost (x100).
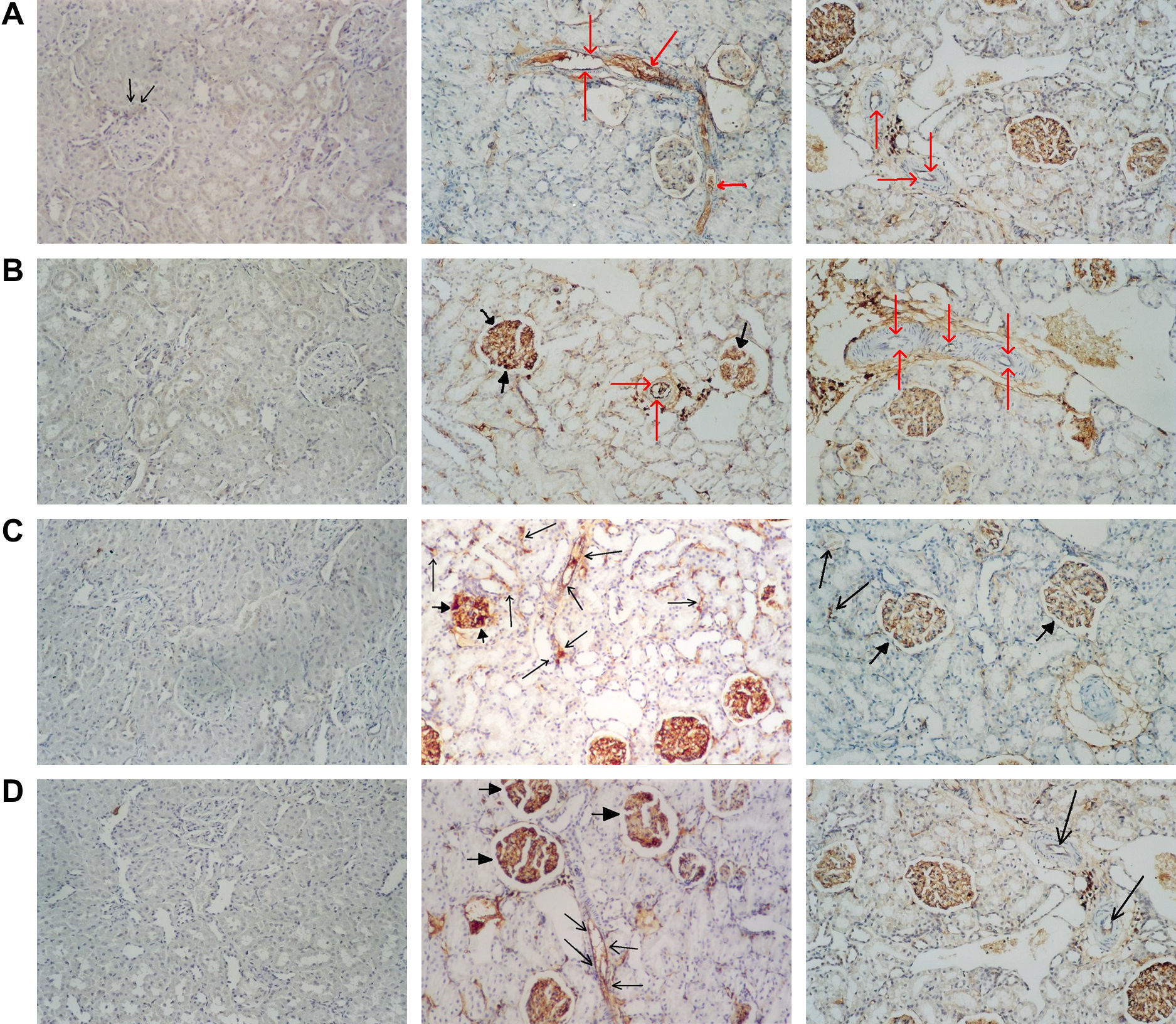
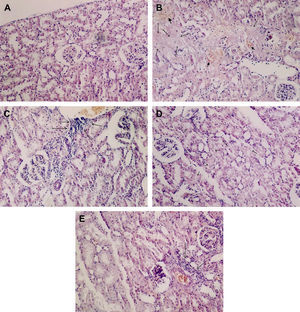
La evaluación histológica con la tinción inmunohistoquímica mostró que, en el grupo control, la P-selectina, las CD11b, y CD18 en el glomérulo y la L-selectina en el intersticio y en el glomérulo presentaron una inmunorreactividad muy débil, pero no se detectó tinción inmunohistoquímica de la P-selectina, las CD11b, y las CD 18 en el intersticio y del TNF-α y la ICAM-1 en el intersticio y el glomérulo (tabla III, fig. 2A). En el grupo IR aórtica, la tinción inmunohistoquímica de la P-selectina, la L-selectina, el TNF-α, las CD11b, las CD18, y la ICAM-1 en el intersticio y el glomérulo fuer significativamente mayor que la del grupo control (p<0,05) (tabla III, figs. 2B y 2C). El tratamiento con iloprost redujo de forma significativa la tinción inmunohistoquímica de la P-selectina, el TNF-α, las CD11b, y las CD18 en el intersticio y el glomérulo y la tinción inmunohistoquímica de la ICAM-1 en el intersticio (p<0,05 frente a IR aórtica) (tabla III, fig. 2D). El iloprost también redujo la tinción inmunohistoquímica de la L-selectina en el intersticio y el glomérulo y la tinción inmunohistoquímica de la ICAM-1 en el glomérulo, pero las diferencias no fueron estadísticamente significativas (p>0,05 frente a la IR aórtica) (tabla III). Los resultados de la tinción inmunohistoquímica se muestran en la tabla III y la figura 2.
Resultados de la evaluación histológica con tinción inmunohistoquímica
| Control (n=8, grupo I) | IR aórtica (n=8, grupo II) | IR aórtica + iloprost (n=8, grupo III) | Kruskal-Wallis | U Mann- Whitney p<0,05 | ||||||||||
| – | + | ++ | PM | – | + | ++ | PM | – | + | ++ | PM | |||
| P-selectina (glomérulo) | 7 | 1 | 0 | 0,12±0,35 | 0 | 0 | 8 | 2,00±0,00 | 0 | 5 | 3 | 1,37±0,51 | p<0,01 | I-II, II-III, I-III |
| P-selectina (intersticio) | 8 | 0 | 0 | 0,00±0,00 | 0 | 0 | 8 | 2,00±0,00 | 3 | 3 | 2 | 0,87±0,83 | p<0,01 | I-II, II-III, I-III |
| L-selectina (glomérulo) | 7 | 1 | 0 | 0,12±0,35 | 0 | 2 | 6 | 1,75±0,46 | 0 | 6 | 2 | 1,25±0,46 | p<0,01 | I-II, I-III |
| L-selectina (intersticio) | 7 | 1 | 0 | 0,12±0,35 | 0 | 2 | 6 | 1,75±0,46 | 0 | 6 | 2 | 1,25±0,46 | p<0,01 | I-II, I-III |
| TNF-α (glomérulo) | 8 | 0 | 0 | 0,00±0,00 | 0 | 2 | 6 | 1,75±0,46 | 0 | 8 | 0 | 1,00±0,00 | p<0,01 | I-II, II-III, I-III |
| TNF-α (intersticio) | 8 | 0 | 0 | 0,00±0,00 | 0 | 1 | 7 | 1,87±0,35 | 5 | 3 | 0 | 0,37±0,51 | p<0,01 | I-II, II-III |
| CD11b (glomérulo) | 7 | 1 | 0 | 0,12±0,35 | 0 | 1 | 7 | 1,87±0,35 | 2 | 5 | 1 | 0,87±0,64 | p<0,01 | I-II, II-III, I-III |
| CD11b (intersticio) | 8 | 0 | 0 | 0,00±0,00 | 0 | 2 | 6 | 1,75±0,46 | 4 | 4 | 0 | 0,50±0,53 | p<0,01 | I-II, II-III, I-III |
| CD18 (glomérulo) | 7 | 1 | 0 | 0,12±0,35 | 0 | 1 | 7 | 1,87±0,35 | 0 | 7 | 1 | 1,12±0,35 | p<0,01 | I-II, II-III, I-III |
| CD18 (intersticio) | 8 | 0 | 0 | 0,00±0,00 | 0 | 2 | 6 | 1,75±0,46 | 4 | 3 | 1 | 0,62±0,74 | p<0,01 | I-II, II-III, I-III |
| ICAM-1 (glomérulo) | 8 | 0 | 0 | 0,00±0,00 | 0 | 2 | 6 | 1,75±0,46 | 0 | 6 | 2 | 1,25±0,46 | p<0,01 | I-II, I-III |
| ICAM-1 (intersticio) | 8 | 0 | 0 | 0,00±0,00 | 0 | 2 | 6 | 1,75±0,46 | 2 | 5 | 1 | 0,87±0,85 | p<0,01 | I-II, II-III, I-III |
ICAM-1: molécula de adhesión intercelular-1; IR: isquemia-reperfusión; PM: puntuación media. TNF: factor de necrosis tumoral.
El iloprost regula a la baja la expresión de las moléculas de adhesión en la lesión renal inducida por IR aórtica. Los cortes histológicos renales se tiñeron con diaminobenzidina y se examinaron al microscopio óptico. A Inmunorreacción de la P-selectina en los grupos. (i) Grupo control. Se aprecia una inmunorreactividad leve de la P-selectina en un glomérulo (flechas) y ausencia de inmunorreactividad en el intersticio. (ii) Grupo IR aórtica. Las flechas indican una fuerte inmunorreactividad de la P-selectina en la pared capilar del intersticio. (iii) Grupo IR aórtica + iloprost. Las flechas indican una inmunorreactividad muy débil de la P-selectina en la pared capilar del intersticio. B Inmunorreactividad del TNF-α en los grupos. (i) Grupo control. No existe inmunorreactividad del TNF-α en la pared capilar del glomérulo y en el endotelio vascular. (ii) Grupo IR aórtica. Las flechas indican una fuerte inmunorreactividad del TNF-α en la pared capilar del intersticio (flechas finas) y en la pared capilar del glomérulo (puntas de flecha). (iii) Grupo IR aórtica + iloprost. Las flechas indican una inmunorreactividad muy débil del TNF-α en la pared capilar del intersticio. C Inmunorreactividad de las CD11b en los grupos. (i) Grupo control grupo. No existe inmunorreactividad de las CD11b en el intersticio. (ii) Grupo IR aórtica. Las flechas indican una fuerte inmunorreactividad de las CD11b en la pared capilar del intersticio (flechas finas) y en la pared capilar del glomérulo (puntas de flecha). (iii) Grupo IR aórtica + iloprost. Las flechas indican una inmunorreactividad débil de las CD11b en la pared capilar del intersticio (flechas finas) y en la pared capilar del glomérulo (puntas de flecha). D Inmunorreactividad de la ICAM-1 en los grupos. (i) Grupo control. No existe inmunorreactividad de la ICAM-en la pared capilar del glomérulo y en el endotelio vascular. (ii) Grupo IR aórtica. Las flechas indican una marcada inmunorreactividad frente a ICAM-1 en la pared capilar del intersticio (flechas finas) y en la pared capilar del glomérulo (puntas de flecha). (iii) Grupo IR aórtica + iloprost. Las flechas indican una inmunorreactividad débil de la ICAM-1 en la pared capilar del intersticio (flechas finas).
Los resultados de este estudio muestran que: 1) el iloprost reduce la lesión renal inducida por la IR aórtica en ratas y 2) el iloprost regula a la baja la expresión de las moléculas de adhesión tanto a nivel local como sistémico tras la IR aórtica durante este efecto protector. Las pruebas a partir del estudio actual que apoyan estas conclusiones se resumen del siguiente modo: 1) los análisis bioquímicos mostraron que el iloprost redujo la peroxidación lipídica, el estrés oxidativo, y las concentraciones plasmáticas de moléculas de adhesión y 2) la evaluación histológica mostró que el iloprost atenuó los cambios histológicos asociados a la lesión renal tras la IR aórtica y reguló a la baja la expresión local de las moléculas de adhesión en muestras de tejido renal.
Numerosas pruebas sugieren que los leucocitos desempeñan un papel clave en la mediación de las lesiones en órganos remotos tras la IR aórtica1-3,8. La lesión de IR mediada por los leucocitos es un proceso bien ordenado caracterizado por la activación leucocitaria, la quimiotaxis, la adhesión de los leucocitos a las células endoteliales, y la transmigración7-10,25. Además, los leucocitos interactúan con el endotelio vascular a través de una serie de pasos diferenciados, y todos estos pasos están facilitados en forma de cascada por las moléculas de adhesión. El paso inicial es la captura o amarre de los leucocitos circulantes, que se caracteriza por una adhesión laxa o ‘‘rodamiento'’ de los leucocitos en el endotelio. Este primer paso se produce por la activación de la L-selectina en los leucocitos y la rápida movilización de la P-selectina preformada hacia la superficie de las células endoteliales9. La IR aumenta la expresión de la P-selectina en la superficie endotelial10, y se ha descrito un aumento notable de la tinción de la P-selectina en el tejido renal de rata sometido a IR26. Coincidiendo con este informe, tanto las concentraciones plasmáticas de P-selectina como la expresión local de P-selectina y L-selectina aumentaron en el tejido renal en el grupo IR aórtica de nuestro estudio.
El segundo paso durante la adhesión de los leucocitos a las células endoteliales es la adherencia firme de los leucocitos al endotelio. Este fenómeno es consecuencia de la interacción de las integrinas leucocitarias β2 CD11a/CD18 y CD11b/CD18 con la ICAM-1 endotelial10. Por último, el tercer paso, la transmigración de los leucocitos hacia el compartimiento intersticial, está facilitado por la molécula de adhesión celular endotelial plaquetaria 110 (PECAM-1). La síntesis de ICAM-1 y VCAM-1 dependiente de la transcripción está inducida por citocinas (p. ej. TNF-α) y oxidantes8,9. Dado que se sabe que la IR aórtica aumenta la producción de especies reactivas de oxígeno y la activación de las citocinas, puede asumirse que la expresión de ICAM-1 y VCAM-1 puede estar aumentada tras la IR aórtica. Como apoyo a esta teoría, observamos que las concentraciones plasmáticas de ICAM-1 y VCAM-1 y la expresión local de ICAM-1 aumentaron en el tejido renal tras la IR aórtica. Barry et al27 también informaron que la expresión de CD11b e ICAM-1 aumentó de forma significativa en muestras plasmáticas obtenidas de pacientes sometidos a una resección programada de aneurisma aórtico infrarrenal. En nuestro estudio, la expresión local de CD11b, CD18, y TNF-α también estuvo aumentada en el tejido renal tras una IR aórtica. En conjunto, las concentraciones plasmáticas de P-selectina, ICAM-1, y VCAM-1, y los resultados de la tinción inmunohistoquímica de muestras de tejido renal en el grupo IR aórtica sugieren que la expresión de las moléculas de adhesión está regulada al alza tanto a nivel local como sistémico tras una IR aórtica.
Varios estudios experimentales han identificado la infiltración de leucocitos en el tejido renal como característica distintiva de lesión real por IR7,28-30. En el estudio aquí descrito, la IR aórtica aumentó de forma significativa el infiltrado inflamatorio intersticial de leucocitos polimorfonucleares (PMN) en el tejido renal como prueba histológica de lesión renal inducida por IR aórtica. Dado que la expresión de las moléculas de adhesión es un requerimiento fundamental para el reclutamiento de PMN en el tejido renal durante la lesión por IR8,10,27, no es sorprendente que la regulación al alza de las moléculas de adhesión acompañase al aumento de la transmigración de PMN activados hacia el tejido renal sometido a lesiones por IR aórtica.
El iloprost, un análogo estable de la prostaciclina, ha demostrado tener efectos citoprotectores frente a la lesión por IR en varios estudios experimentales7,14-16. El iloprost ejerce su efecto protector frente a la lesión por IR mediante varios mecanismos como 1) inhibición de la agregación plaquetaria y activación recíproca de las plaquetas y los PMN12, 2) reducción de la actividad migratoria de los PMN hacia el lugar de la inflamación31, y 3) inhibición de la adhesión de los PMN a las células endoteliales32. Observamos que el iloprost redujo el infiltrado inflamatorio intersticial de los PMN en el tejido renal tras la IR aórtica. El iloprost también redujo la tinción inmunohistoquímica del TNF-α en las muestras de tejido renal sometidas a IR aórtica. El TNF-α, un mediador proinflamatorio bien conocido, induce la activación leucocitaria y la quimiotaxis durante la lesión por IR3,8,28. Así pues, el iloprost pudo haber inhibido la activación leucocitaria y la quimiotaxis en parte a través del bloqueo de la liberación o la actividad del TNF-α.
En nuestro estudio, durante la inhibición de la infiltración inflamatoria de los PMN en el intersticio renal, el iloprost provocó al mismo tiempo una regulación a la baja de la expresión de las moléculas de adhesión 1) a nivel sistémico, como demuestra la reducción de las concentraciones plasmáticas de P-selectina e ICAM-1, y 2) a nivel local, como demuestra la reducción de la tinción inmunohistoquímica de la P-selectina, las CD11b, las CD18, y la ICAM-1. La reducción de la expresión de la P-selectina puede sugerir que el iloprost inhibió el ‘‘rodamiento'’ de los leucocitos a través de un mecanismo mediado por la selectina. Además, la reducción de la expresión de ICAM-1, CD11, y CD18 sugiere que el iloprost causó la inhibición de la adhesión firme de los leucocitos en las células del endotelio vascular del tejido renal. Por tanto, especulamos que el iloprost inhibió la infiltración leucocitaria a través de la regulación a la baja de la expresión de las moléculas de adhesión. Dado que las intervenciones terapéuticas que tienen como objeto las moléculas de adhesión atenuaron la lesión renal por IR en estudios experimentales, esta especulación puede ser correcta en parte. Fuller et al29 informaron que un ligando de la glicoproteína P-selectina soluble mejoró el pronóstico de los trasplantes renales con lesiones severas por IR al bloquear la adhesión leucocitaria mediada por la selectina. Tajra et al30 informaron que los anticuerpos monoclonales anti-integrina β2 (anti-CD11a, anti-CD11b, y anti-CD18) redujeron la infiltración leucocitaria en el intersticio y la lesión renal por IR. Sin embargo, para poder identificar el efecto directo del iloprost en la parte endotelial del proceso de adhesión, células endoteliales de la vena umbilical se dejaron crecer a confluencia, se estimularon con TNF-α, y se trataron con iloprost. Ese estudio elegante llevado a cabo por Lindemann et al33 demostró que 1) el iloprost redujo de forma significativa la quimiotaxis endotelial hacia los neutrófilos y la adhesión de los PMN a las células endoteliales activadas y 2) el iloprost no alteró la expresión de la molécula de adhesión estimulada por el TNF-α. Así pues, llegaron a la conclusión de que este efecto inhibidor del iloprost en la adhesión de los PMN se debe a mecanismos reguladores independientes de la molécula de adhesión. Administramos iloprost a ratas por vía sistémica a través de la vena de la cola. Así, como afirmaron Lindemann et al33, los efectos observados del iloprost podrían deberse a la inhibición directa de los neutrófilos en la circulación o a los efectos sobre el endotelio. Somos conscientes de que nuestros resultados no son suficientes para esclarecer todos los mecanismos moleculares del efecto inhibidor del iloprost en la infiltración leucocitaria. Por otro lado, proponemos que, como mínimo, un mecanismo subyacente del efecto preventivo del iloprost sobre el reclutamiento leucocitario en el tejido renal implica la inhibición de las moléculas de adhesión.
El estrés oxidativo es uno de los componentes más importantes de la lesión en órganos remotos inducida por IR aórtica. El estrés oxidativo se define como un desequilibrio en el que la formación de especies reactivas de oxígeno supera a las defensas antioxidantes endógenas y la capacidad de corrección34. Las principales especies reactivas de oxígeno son los radicales superóxido (O2–), el peróxido de hidrógeno (H2O2), y los radicales hidroxilo (OH–). El O2– es producido por la xantina oxidasa, y la enzima SOD reacciona rápidamente con el O2– para dismutarla en la forma menos reactiva H2O235. El H2O2 es convertido posteriormente en H2O y O2 por las enzimas catalasa y glutatión peroxidasa36. Hemos observado que la IR aórtica aumentó las concentraciones tanto de SOD como de catalasa, pero el aumento en las concentraciones de SOD no fue estadísticamente significativo. En consonancia con estos resultados, describimos con anterioridad que las concentraciones tisulares de SOD y catalasa aumentaron en lesiones miocárdicas inducidas por IR aórtica1. También se han descrito concentraciones elevadas de SOD en las lesiones por IR en el músculo esquelético37. En nuestro estudio, las concentraciones aumentadas de las enzimas antioxidantes SOD y catalasa tras una IR aórtica pueden indicar un aumento del O2– y la consiguiente producción de H2O2, respectivamente. Por otro lado, Liu et al38 informaron de concentraciones reducidas de SOD en lesiones pulmonares inducidas por IR intestinal. Atahan et al39 hallaron que las concentraciones de SOD y catalasa disminuyeron en las lesiones del músculo esquelético inducidas por el método del torniquete. Propusieron que el exceso de producción de especies reactivas de oxígeno durante la IR puede provocar el consumo y el agotamiento de las enzimas antioxidantes endógenas. Estamos de acuerdo con esta propuesta y especulamos que el exceso de producción de O2– podría haber saturado parcialmente la capacidad captadora de la SOD. Así pues, las concentraciones de SOD aumentaron, pero al mismo tiempo la SOD se agotó, de manera que el estrés oxidativo no pudo ser suficientemente eliminado y la enzima catalasa también intervino en el proceso. También creemos que la concentración de enzimas antioxidantes durante la lesión por IR depende de la magnitud de dicha lesión, de la duración de los períodos de IR, y del órgano específico sometido a la lesión por IR. En nuestro estudio el iloprost redujo las concentraciones de SOD y de catalasa. Este resultado indica que el iloprost redujo el estrés oxidativo inducido por la IR aórtica en el tejido renal gracias a sus propiedades antioxidantes.
Se ha sugerido que la peroxidación lipídica, un mecanismo autocatalítico que provoca la destrucción oxidativa de las membranas celulares, está estrechamente relacionado con los daños tisulares inducidos por la lesión de IR1,7,25. El MDA es el producto final de la peroxidación lipídica y se ha aceptado ampliamente como buen indicador de la tasa de peroxidación en varios estudios1,7,16,26,37,40. Se ha descrito que el iloprost reduce las concentraciones de MDA en las lesiones por IR en el riñón41,42 y en el músculo esquelético16. En concordancia con estos informes, observamos que la IR aórtica aumentó a medida que el iloprost redujo las concentraciones de MDA en el plasma y en el tejido renal. Este hallazgo también sugiere que el efecto antioxidante del iloprost contribuyó a atenuar el efecto del iloprost frente a la lesión renal inducida por la IR aórtica.
En estudios experimentales, los cambios histológicos examinados mediante tinción con hematoxilina-eosina en el tejido renal como indicadores de lesión renal por IR incluyen la congestión vascular28, la necrosis tubular29,30,41,42, la degeneración del epitelio tubular26, y la tumefacción de las células tubulares43. Emrecan et al42 informaron que el iloprost redujo la necrosis tubular y la atrofia, la atipia regenerativa, y la degeneración hidrópica en casos de IR renal en ratas. En concordancia con estos resultados, nosotros hallamos que el iloprost redujo la degeneración del epitelio tubular, la necrosis del epitelio tubular, y la congestión de los vasos sanguíneos. Esta observación indica que el iloprost atenuó los cambios morfológicos asociados a las lesiones renales inducidas por IR aórtica. Creemos que este efecto se debe predominantemente a un efecto citoprotector del iloprost en las células tubulares.
Somos conscientes de las limitaciones de este estudio. A pesar de que los resultados de nuestros análisis histológicos con la tinción de hematoxilina-eosina indican que la IR aórtica causó lesiones renales severas, no hemos observado diferencias significativas en las concentraciones de BUN y creatinina entre los grupos. Esta discrepancia puede explicarse como mínimo de dos formas. En primer lugar, la lesión por IR aórtica en nuestro estudio sería suficientemente grave para causar una lesión renal severa sin disfunción glomerular. La evaluación histológica también mostró que no se desarrolló ni necrosis glomerular focal ni esclerosis glomerular tras la IR aórtica. En los estudios realizados en animales en los que se examina la lesión renal por IR, las concentraciones de BUN y creatinina se utilizan como indicadores de la función glomerular43. En segundo lugar, examinamos los indicadores de lesión renal inmediatamente tras la isquemia de 120min y la reperfusión de 120min. Spandou et al44 hallaron un aumento significativo de las concentraciones de BUN y creatinina 48h. después de la IR renal. Así pues, en nuestro estudio, pudo haber sido necesario un periodo de tiempo más largo tras la lesión por IR renal para obtener un aumento de las concentraciones de BUN y creatinina. Sin embargo, el objetivo del estudio fue examinar el efecto del iloprost en la lesión por IR renal, pero no en la función renal tras la lesión por IR. Por tanto, un nuevo estudio experimental que determinase las concentraciones de creatinina y BUN más tarde en el tiempo permitiría conocer idealmente el efecto del iloprost en la función renal.
Otro argumento sobre el estudio aquí descrito sería el clampaje infrarrenal de la aorta. Se sabe que el clampaje suprarrenal causa lesiones más severas y directas en los riñones y, sin embargo, es requerido en la mayoría de las intervenciones por rotura de aneurisma aórtico abdominal o aneurisma yuxtarrenal. Es mucho más probable que se utilice el clampaje infrarrenal que el suprarrenal en casos de correcciones programadas de aneurismas aórticos abdominales. Por tanto, el objetivo del estudio fue examinar el efecto protector del iloprost frente a la lesión renal inducida por la IR aórtica debido al clampaje y desclampaje de la aorta abdominal infrarrenal. Dado que nuestro modelo experimental aborda específicamente el escenario clínico de la corrección programada de los aneurismas aórticos abdominales, preferimos utilizar el clampaje infrarrenal en lugar del suprarrenal.
En resumen, los resultados de este estudio indican que 1) el iloprost reduce la lesión renal inducida por la IR aórtica en ratas, y 2) durante este efecto protector, el iloprost regula a la baja la expresión de las moléculas de adhesión tanto a nivel local como sistémico tras una IR aórtica. Proponemos que en los mecanismos subyacentes a este efecto protector del iloprost interviene la regulación a la baja de la expresión de las moléculas de adhesión, la inhibición de la infiltración de PMN en los tejidos renales, la reducción del estrés oxidativo y la posterior peroxidación lipídica. Sin embargo, son necesarios estudios experimentales adicionales para esclarecer por completo los mecanismos moleculares de acción del iloprost durante la lesión renal inducida por IR aórtica.