Hemos desarrollado un dispositivo para anastomosis sin suturas que consiste en un stent biodegradable y una banda de acero inoxidable para anastomosis terminoterminales. El objetivo de este estudio fue evaluar la viabilidad de este dispositivo durante un período de 4 semanas en un modelo porcino. La aorta infrarrenal porcina fue sustituida por un implante de politetrafluoroetileno expandido. Se realizó la anastomosis proximal utilizando un método anastomósico sin suturas con un stent bioabsorbible fabricado con ácido poli L-láctico (PLLA) y una placa de acero inoxidable. La anastomosis distal suturada de forma manual sirvió como control. Se realizó una angiografía a las 4 semanas de la cirugía. Los animales fueron sacrificados entonces y se realizó el estudio histológico de las muestras. El método anastomósico sin suturas requirió significativamente menos tiempo que la técnica manual. Los angiogramas mostraron la permeabilidad de los implantes y la ausencia de signos de estenosis o filtración. Las pruebas de estanqueidad y tensión confirmaron la resistencia mecánica adecuada de las anastomosis. La anastomosis sin suturas con un stent PLLA parece factible, como mínimo durante un período de observación de 4 semanas. Este procedimiento sencillo redujo el tiempo de cirugía y contribuiría a reducir los riesgos de las complicaciones relacionadas con la intervención.
A pesar de que las anastomosis vasculares suturadas de forma manual siguen siendo el estándar en cirugía vascular, debería considerarse el uso de dispositivos anastomósicos. Existen muchos factores que pueden afectar a la calidad de las anastomosis suturadas, incluida la habilidad quirúrgica, la progresión de la patología aterosclerótica, el abordaje y la exposición del procedimiento, y las limitaciones técnicas del instrumental. Cabría esperar que los dispositivos de anastomosis sin suturas redujesen esta variabilidad en la calidad asociada a los procedimientos anastomósicos.
Así mismo es probable que los dispositivos anastomósicos permitan reducir el tiempo requerido para estos procedimientos, reduciendo así el tiempo de clampaje y de intervención, habitualmente prolongado con las técnicas convencionales. Muchos de los pacientes sometidos a procedimientos de cirugía vascular presentan aterosclerosis sistémica y, por tanto, tienen un riesgo elevado de sufrir otras patologías vasculares, como infarto cerebral y de miocardio. Un tiempo menor de intervención, por tanto, contribuiría a reducir las complicaciones relacionadas con la misma1.
Recientemente, se han descrito algunos protocolos de cirugía mínimamente invasiva, incluido un método alternativo de construcción anastomósica2-9. Estos protocolos podrían derivar en la introducción de una técnica más estandarizada que dependa menos de la calidad y requiera un tiempo menor.
Algunos estudios sobre stents luminales biodegradables destacan la viabilidad de esta estrategia. El uso de un polímero biodegradable como biomaterial luminal en lugar del metal sería preferible porque llegaría a desaparecer con el tiempo, sin dejar ningún cuerpo extraño en la luz10. Así pues, hemos desarrollado un sistema de anastomosis sin suturas que emplea un stent biodegradable. En los casos de anastomosis terminoterminales entre una arteria y un vaso artificial, éste se inserta en la arteria y se utiliza un stent biodegradable para reforzar la anastomosis en la zona de solapamiento entre el vaso y la arteria. Sin embargo, dado que el stent luminal solo no confiere suficiente resistencia mecánica, también hemos desarrollado una banda de acero inoxidable con microprotusiones en su superficie que puede utilizarse para envolver y reforzar la anastomosis y evitar así el deslizamiento del vaso artificial insertado. En la fabricación de implantes quirúrgicos se utiliza acero inoxidable cuyas especificaciones cumplen la normativa de la International Organization for Standardization (ISO) 16143-2 y del Japanese Industrial Standard (JIS) G4303.
Estudiamos de forma experimental, mediante un modelo porcino, una nueva técnica para anastomosis vasculares sin suturas, utilizando un stent bioabsorbible fabricado con ácido poli L-láctico (PLLA) y una banda de acero inoxidable. Dado que la degradación del polímero de PLLA se produce durante un período de varios años, nos centramos principalmente en la viabilidad de este sistema de anastomosis sin suturas durante el período perioperatorio inmediato y la fase aguda durante las 4 semanas posteriores a la intervención. Se evaluó la seguridad, el tiempo necesario para la intervención, la resistencia y la permeabilidad del sistema de anastomosis.
Materiales y MétodosStent biodegradableSe fabricó un stent (10mm de diámetro, 10mm de longitud) de fibra de PLLA de 0,3mm de diámetro (fig. 1A). El PLLA se degrada de forma hidrolítica10 y no presenta toxicidad celular11. El stent tiende a perder su resistencia y a expandirse debido a la degradación hidrolítica del PLLA en aproximadamente un año.
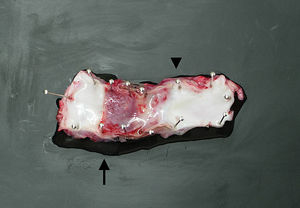
Stent de ácido poli L-láctico y placa de acero inoxidable. AStent fabricado con fibra de ácido poli L-láctico de 0,3mm que se degrada de forma hidrolítica en aproximadamente un año. B Banda de acero inoxidable (SUS316-L) cortada en forma escalonada y con protusiones minúsculas en ambas superficies.
Este stent se montó al final de la luz de un implante de politetrafluoroetileno expandido (PTFEe) (6, 7, u 8mm de diámetro) y constituyó un refuerzo para la anastomosis desde el interior de la luz.
Placa de acero inoxidableSe construyó una placa a modo de escalera de 60mm de grosor con acero inoxidable SUS316L, que es una aleación de Fe-18/Cr-12/Ni-2/Mo. Es adecuada para uso como biomaterial puesto que no induce toxicidad celular y tiene una buena resistencia a la corrosión y a la corrosión bajo tensión (ISO 16143-2, ISO 5832-1, JIS G4303, JIS T7403-1). La placa presentaba protusiones diminutas de 70mm de alto a intervalos de 300mm en ambas superficies (fig. 1B).
Esta placa se utilizó para envolver posteriormente el lugar de la anastomosis.
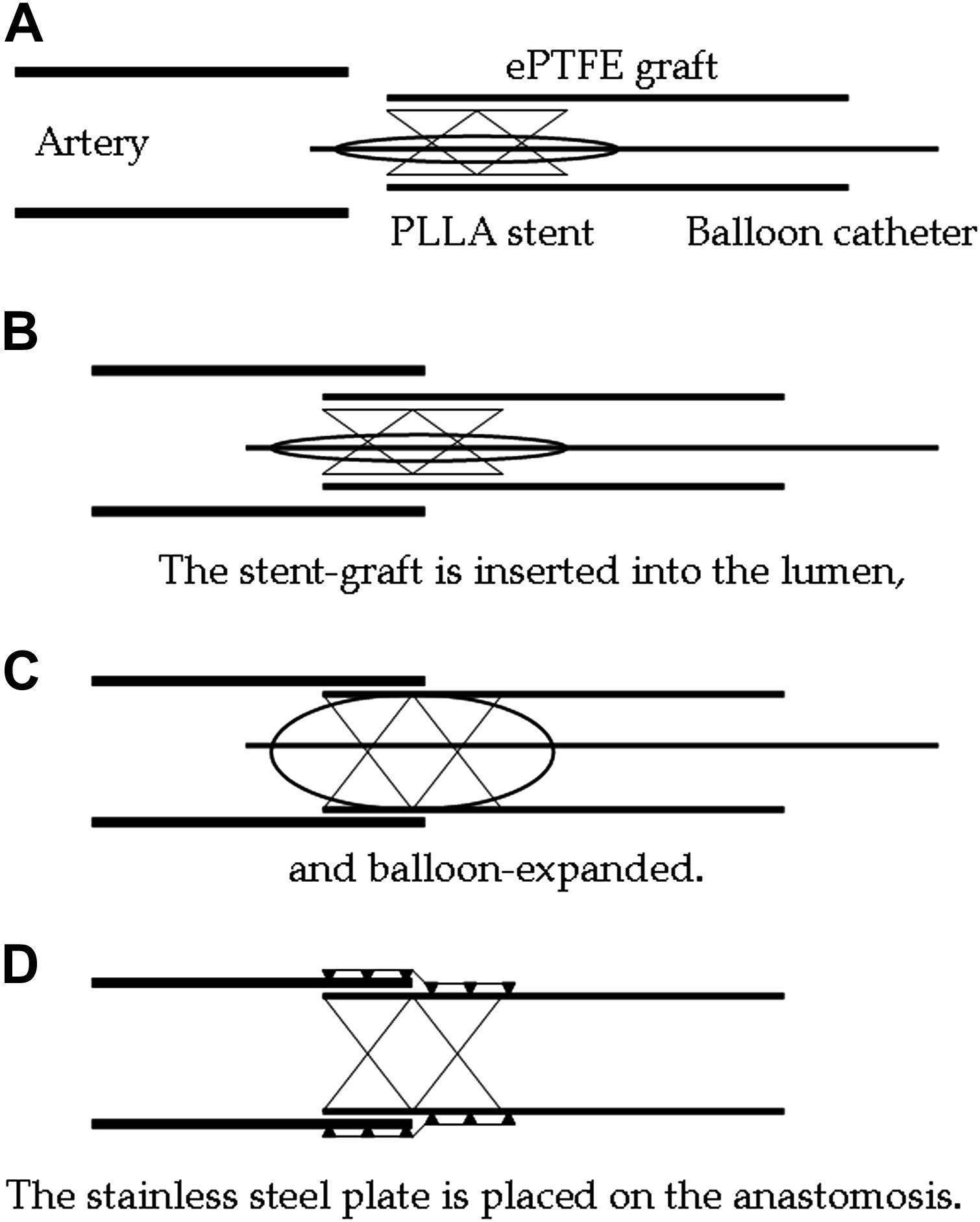
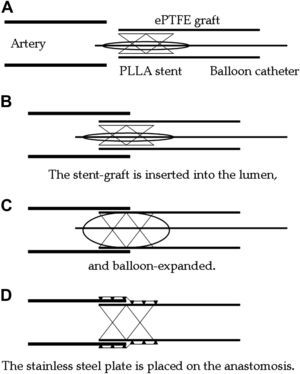
Técnica anastomósicaEl stent de PLLA se montó al final de la luz de un implante de PTFEe (fig. 2A). El implante-stent se insertó en la arteria hospedadora con una longitud de solapamiento de aproximadamente 5mm (fig. 2B) y luego se expandió mediante un catéter con balón (fig. 2C). La placa de acero inoxidable se colocó para envolver la anastomosis externamente (fig. 2D). Así pues, la anastomosis se reforzó con el stent interno de PLLA y la placa externa de acero inoxidable.
Representación esquemática de la anastomosis vascular sin sutura utilizando el stent de ácido poli L-láctico y la placa de acero inoxidable. Artery=Arteria. ePTFE graft=Implante de PTFEe. PLLA stent=Stent de PLLA. Ballon catheter=Catéter con balón. The stent-graft is inserted into the lumen, and ballon-expanded=Inserción del implante-stent en la luz y expansión mediante balón. The stainless steel plate is placed on the anastomosis=Colocación de la placa de acero inoxidable en la anastomosis
El procedimiento de la anastomosis se aplicó a la aorta infrarrenal de 6 machos Landrace White de peso comprendido entre 17,0 y 25,0kg (promedio 21,0±2,90kg). La anestesia se indujo mediante la inyección intramuscular de ketamina (20,0mg/kg; Sankyo Yell Yakuhin Co., Ltd., Tokio, Japón), xilazina (5,0mg/kg; Bayer Medical Ltd., Osaka, Japón), y sulfato de atropina (0,5mg; Tanabe Seiyaku Co., Ltd., Osaka, Japón). Todos los animales fueron intubados e intervenidos bajo anestesia general con isoflurano (Abbott Japan Co., Ltd., Tokio, Japón) utilizando ventilación mecánica. Durante la cirugía se administró famotidina (20mg; Astellas Pharma Inc., Tokio, Japón) y flomoxef sódico (1g; Shionogi & Co., Ltd., Osaka, Japón) por vía intravenosa.
Se accedió a la aorta infrarrenal de cada animal de forma transperitoneal a través de un abordaje en el abdomen medio inferior. Tras la administración intravenosa de heparina (400IU/kg) se realizó una aortotomía transversa. La aorta infrarrenal fue sustituida por un implante de PTFEe mediante anastomosis terminoterminal. La anastomosis proximal se completó utilizando el procedimiento de anastomosis sin sutura con el stent de PLLA y la banda de acero inoxidable. La anastomosis distal se completó mediante el suturado manual con polipropileno 6-0 y se utilizó como control. Se registró el tiempo necesario para realizar la anastomosis sin sutura y con sutura. Posteriormente se cerró el abordaje abdominal tras administrar una segunda inyección de heparina (150 UI/kg). No se administró medicación antitrombótica tras la cirugía.
A las 4 semanas de la intervención se realizó una angiografía y posteriormente los animales fueron sacrificados con una sobredosis de isoflurano. Se resecó la aorta abdominal incluyendo ambas zonas de anastomosis, y las muestras se evaluaron histológicamente.
Todos los animales recibieron una dieta normal y un cuidado estricto según las recomendaciones de la Guide for the Care and Use of Laboratory Animals (Institute of Laboratory Animal Resources, Commission on Life Science, National Research Council. Washington, DC: National Academies Press; 1996). El protocolo fue revisado y autorizado por el Committee of the Institute for Animal Experimentation, Graduate School of Medicine, Tohoku University.
AngiografíaA las 4 semanas de la cirugía se realizó una angiografía por sustracción digital con un sistema de imágenes de arco en C móvil (WHA-200; Shimadzu Corporation, Kyoto, Japón) bajo anestesia general con isoflurano. Se introdujo un angiocatéter desde la arteria carótida común izquierda y se colocó en la aorta abdominal por encima de la anastomosis proximal. Se inyectaron 10ml de iopamidol (Schering AG, Berlín, Alemania).
Análisis histológicoUna vez sacrificados los animales se resecó la aorta abdominal incluyendo ambas zonas de anastomosis, la aorta suprarrenal, y las arterias ilíacas y se fijaron inmediatamente en formalina tamponada con fosfato al 4% tras retirar la banda de acero inoxidable para su estudio histológico y al microscopio óptico. Se prepararon cortes longitudinales de 6mm de grosor tras incluir las muestras en parafina y teñirlas con hematoxilina-eosina y tinción elástica de Masson. Las preparaciones se observaron al microscopio óptico (Leica DM5000; Leica Microsystems GmbH, Wetzlar, Alemania).
Prueba de tensiónPara la prueba de tensión, se aplicó una fuerza tensora en la anastomosis, y la tensión se midió utilizando un tensímetro electromecánico acoplado (RTC-1250A; A&D Co., Ltd., Tokio, Japón). La fuerza tensora se fue incrementando hasta que se rompió la anastomosis, y se registró la resistencia determinada en este punto de rotura. La prueba se realizó en las muestras justo después de la intervención y también en las muestras obtenidas a las 4 semanas de la cirugía. En el caso de las muestras obtenidas justo después de la intervención, la aorta abdominal se obtuvo de otros cerdos y se examinó.
Prueba de estanqueidadPara la prueba de estanqueidad se cerraron los dos extremos del vaso de la anastomosis y ésta se infló hasta alcanzar una presión interna de 300 mmHg con suero salino mediante un infusor de presión (IN-8000; Vital Signs, Inc., Totowa, NJ).
La prueba se realizó en las muestras justo después de la intervención y en las muestras obtenidas a las 4 semanas de la cirugía. En el caso de las muestras obtenidas justo después de la intervención, la aorta abdominal se obtuvo de otros cerdos y se examinó.
Análisis estadísticoLos resultados se expresaron como la media±DE, y cada valor se analizó con la prueba t de Student, con un nivel de significancia de p<0,05.
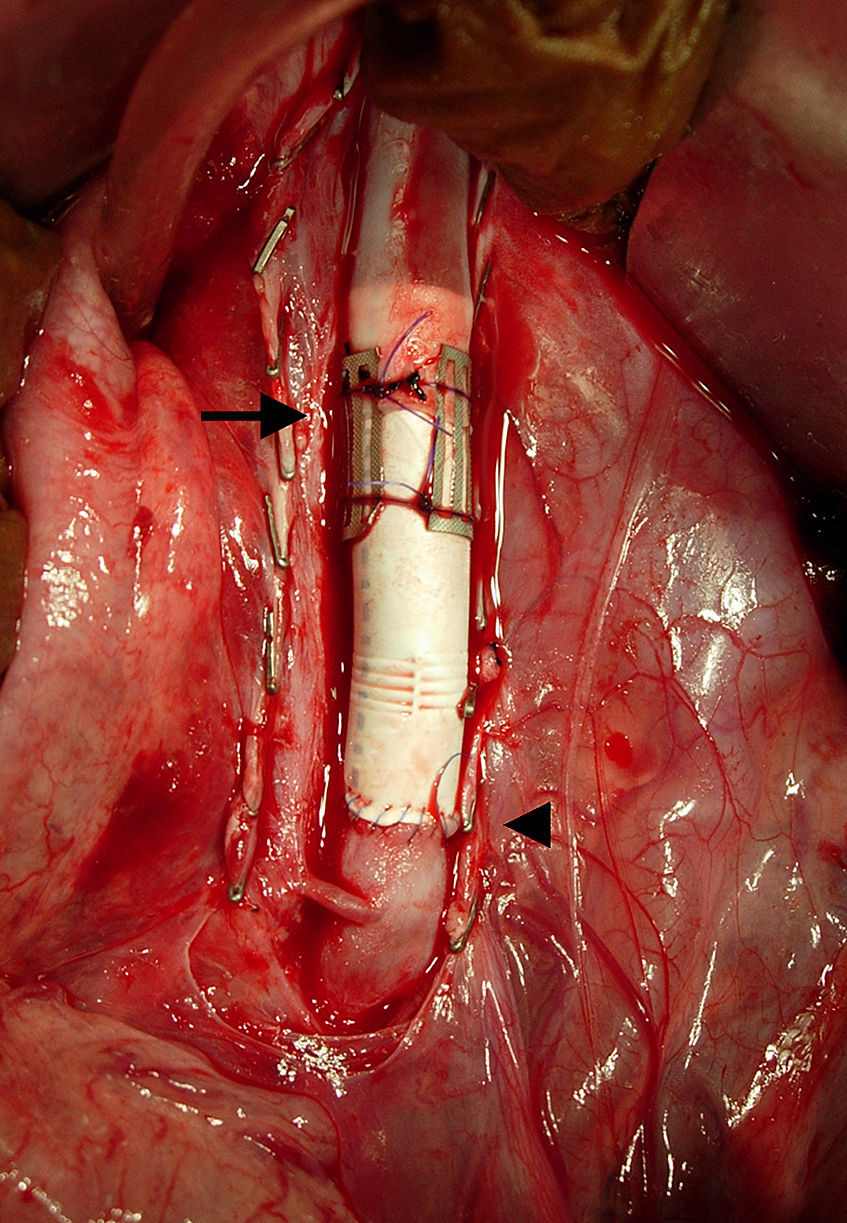
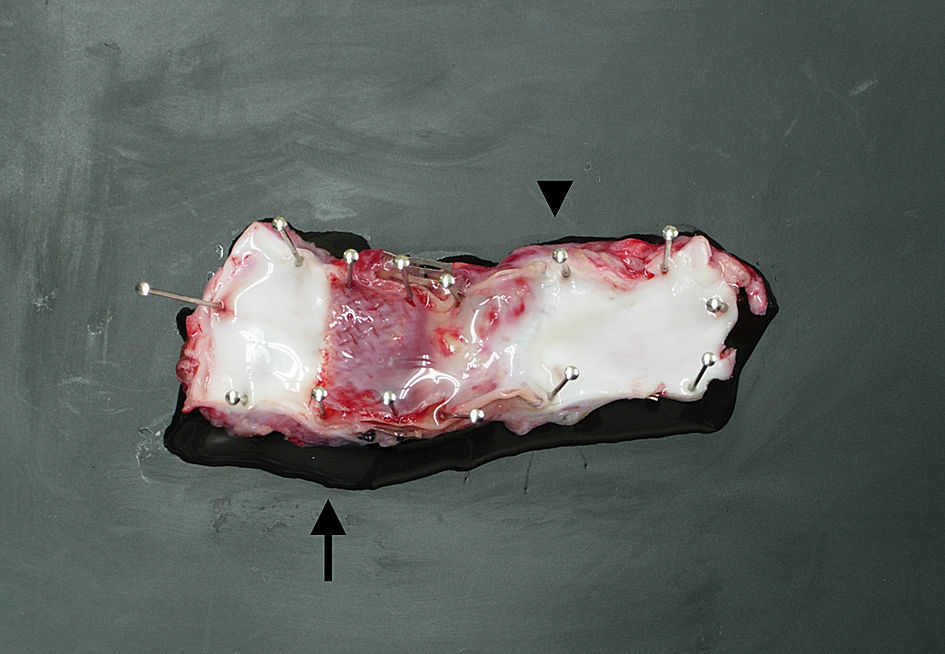
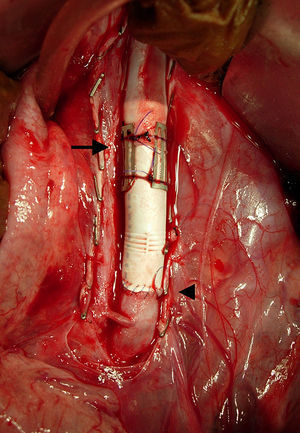
ResultadosCirugíaLa intervención se completó en los 6 casos sin fugas de sangre ni obstrucción (fig. 3).
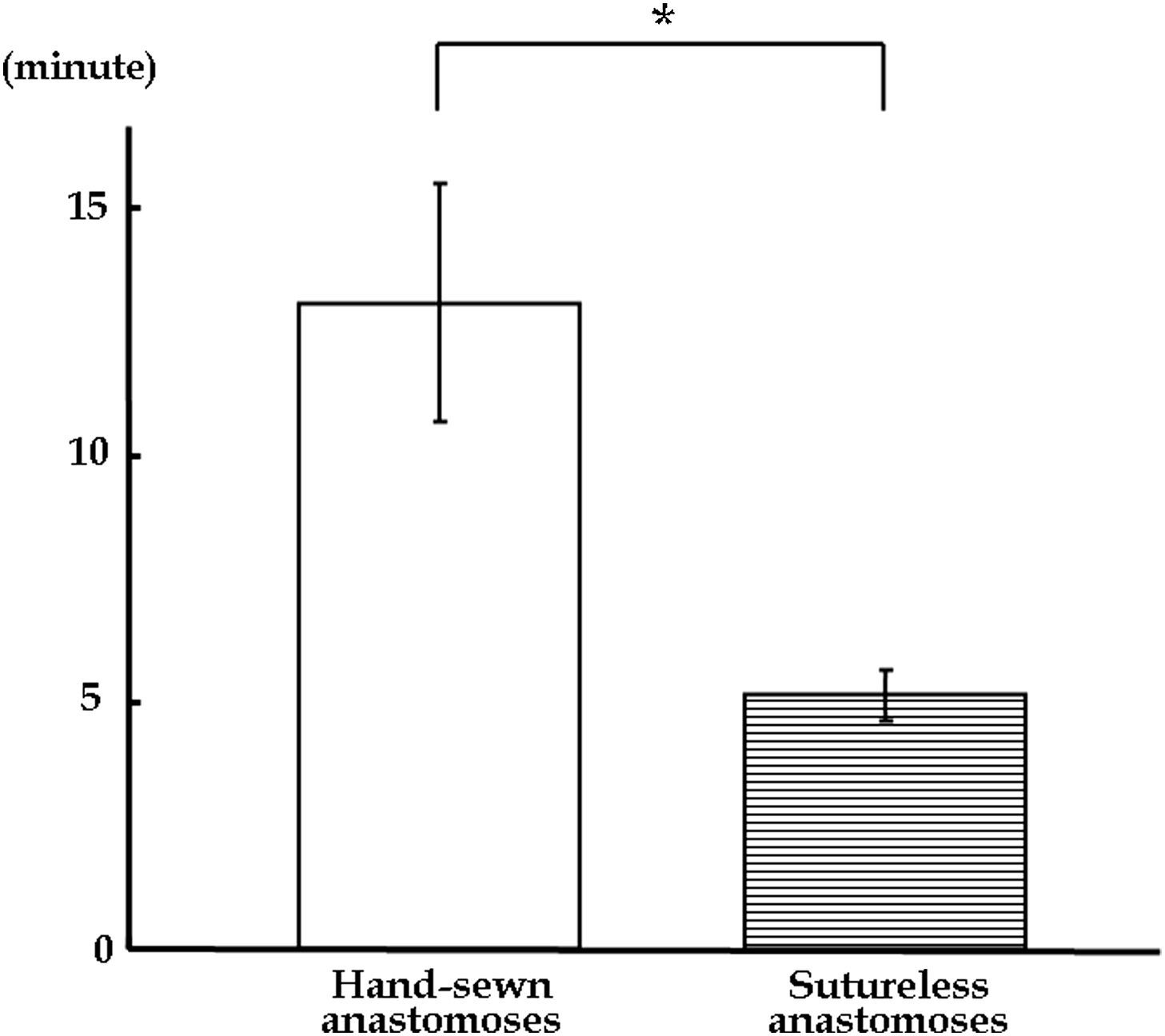
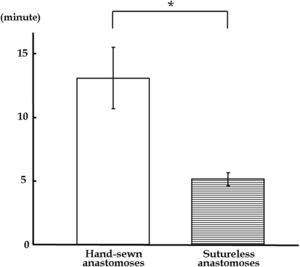
La intervención anastomósica sin suturas se completó en 6min en los 6 casos. Se tardaron 308±31,9 s para realizar la anastomosis sin suturas, en comparación con los 785±145 s de la sutura manual. Se requirió significativamente menos tiempo para la anastomosis sin suturas que para la anastomosis suturada de forma manual (fig. 4).
Cinco animales vivieron durante las 4 semanas, pero uno murió el segundo día tras la cirugía debido a una oclusión del implante. Se observó una obstrucción trombótica completa, aunque no hubo otros problemas, como disección, fuga de sangre o formación de pseudoaneurisma, en ninguna de las dos anastomosis.
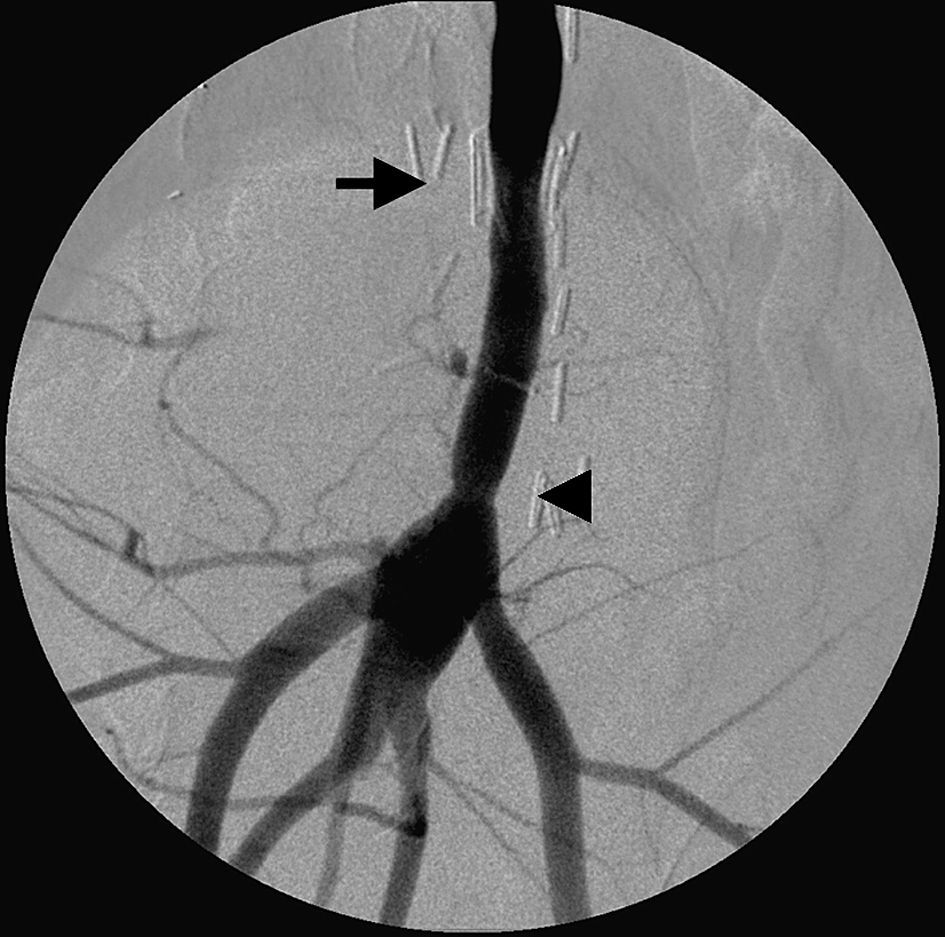
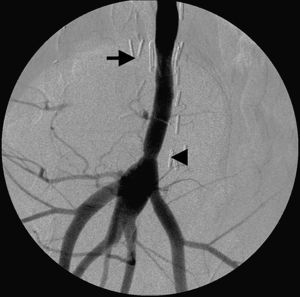
AngiografíaLos angiogramas obtenidos a las 4 semanas de la cirugía mostraron la permeabilidad de las anastomosis y la ausencia de signos de estenosis, fuga de sangre o formación de pseudoaneurisma (fig. 5).
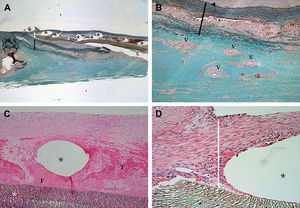
Análisis histológicoMacroscópicamente se observaron superficies luminales lisas. Tanto las anastomosis como el implante estuvieron recubiertos por neoíntima. Los stents de PLLA seguían estando en la neoíntima en este momento (fig. 6).
Aspecto macroscópico de un corte longitudinal de la aorta porcina explantada a las 4 semanas de la cirugía con la anastomosis sin suturas a la izquierda (flecha) y la anastomosis suturada a la derecha (punta de flecha). Los stents permanecen en la neoíntima y las superficies luminales son lisas.
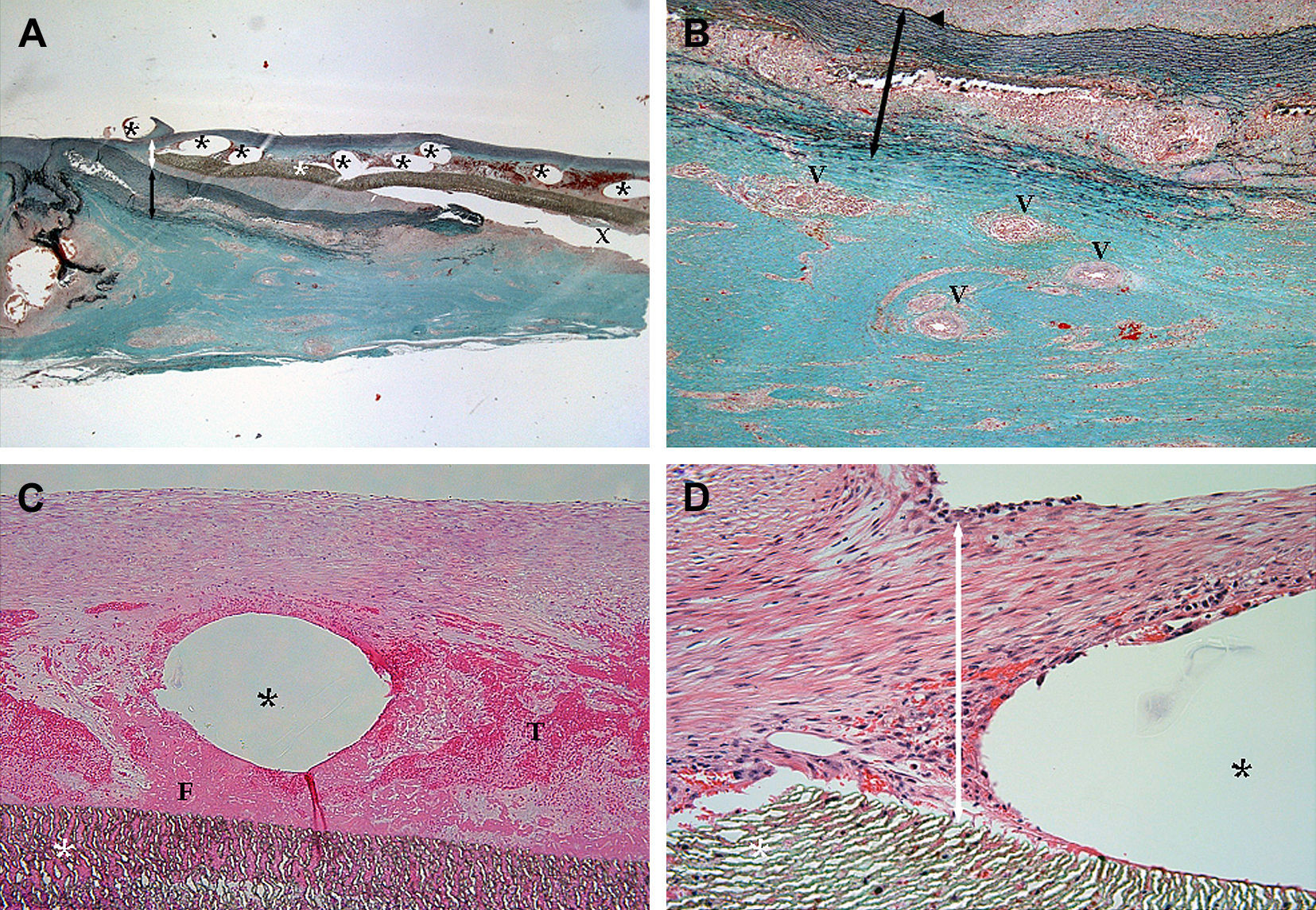
El examen microscópico confirmó la progresión de la íntima de la aorta hacia el implante, pero no se evidenció hiperplasia de la neoíntima. El stent luminal estuvo cubierto por completo por una capa significativa de células fusiformes. Se evidenciaron trombos no organizados y depósitos de fibrina entre la estructura del stent, que también estuvo cubierta por una capa significativa de células fusiformes. Se observó una leve respuesta inflamatoria en la zona con la infiltración de algunas células inflamatorias. En la zona de solapamiento entre el stent de PLLA y la banda de acero inoxidable (fig. 7) se observaron vasos vasculares intactos y la media conteniendo fibras elásticas y la lámina elástica interna.
Aspecto histológico de un corte longitudinal de una aorta porcina explantada a las 4 semanas de la cirugía. A Cortes histológicos de la zona de la anastomosis aórtica sin suturas teñidos con tinción Elastica-Masson (x12,5). La superficie luminal en la zona anastomósica es lisa. No se observan las fibras del ácido poli L-láctico porque se han disuelto durante el proceso de inclusión. La media está intacta y sin atrofia. B Cortes histológicos de la zona de la anastomosis aórtica sin suturas teñidos con tinción Elastica-Masson (x50). Los vasos vasculares intactos y la media conteniendo fibras elásticas y la lámina elástica interna se aprecian en la zona que se solapa con el stent de PLLA y la banda de acero inoxidable. C Cortes histológicos de la zona de la anastomosis aórtica sin suturas teñidos con hematoxilina-eosina (x100). Se observan trombos y depósitos de fibrina no organizados entre la estructura del stent que está cubierta por una capa significativa de células fusiformes. D Cortes histológicos de la zona de la anastomosis aórtica sin suturas teñidos con hematoxilina-eosina (x200).
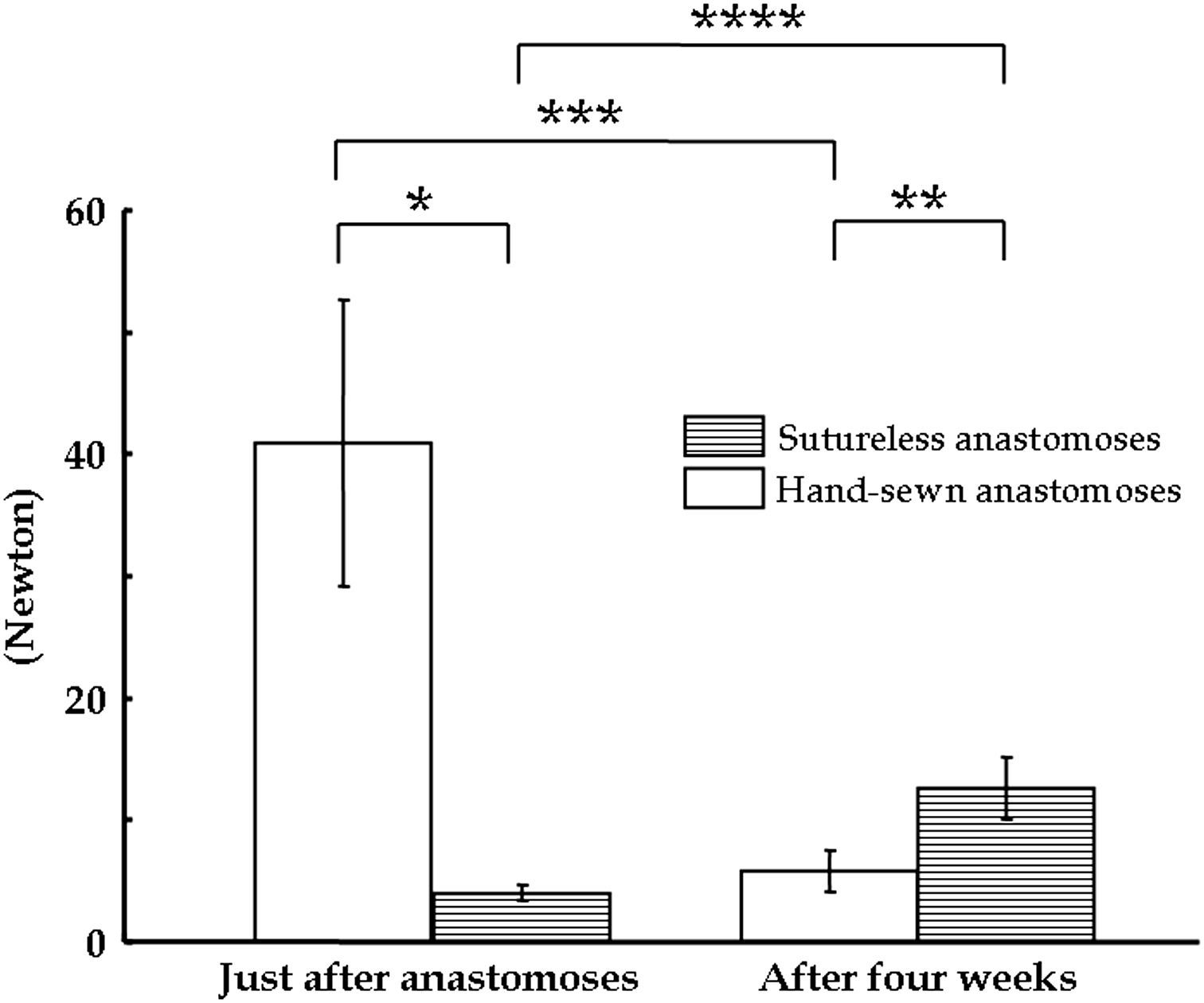
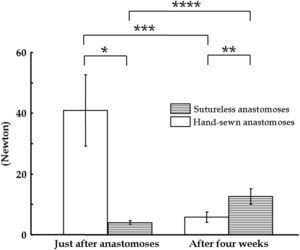
En las pruebas de tensión practicadas justo después de realizar la anastomosis, la resistencia fue de 4,02±0,62 Newton (N) en el grupo de anastomosis sin suturas, comparado con los 40,9±11,8N del grupo control. En la cuarta semana tras la cirugía, la resistencia a la tensión fue de 12,6±2,59N en el grupo de anastomosis sin suturas y de 5,83±1,74N en el grupo control (fig. 8). Las anastomosis suturadas perdieron la resistencia a la tensión durante el período de observación. Las anastomosis sin suturas fueron significativamente más fuertes que las anastomosis suturadas a mano en la cuarta semana tras la cirugía.
Carga máxima determinada de la resistencia a la tensión de las anastomosis sin suturas y de las suturadas de forma convencional (n=3, ap=5,64 x10−3, bp=1,99 x 10−2, cp=6,98 x10−3, dp=5,07 X 10−3). After four weeks: tras 4 semanas; Hand-sewn anastomoses: anastomosis suturadas manualmente; Just after anastomoses: justo después de realizar las anastomosis; Sutureless anastomoses: anastomosis sin suturas.
En las pruebas de estanqueidad, no se evidenciaron signos de filtración o fisuración con una presión interna de 300 mmHg en las 3 muestras obtenidas justo después de la intervención y las 3 muestras obtenidas 4 semanas después de la cirugía.
DiscusiónEstos resultados muestran que la anastomosis vascular sin suturas con un stent de PLLA y una banda de acero inoxidable es comparable con la anastomosis convencional en cuanto a permeabilidad y cicatrización, pero con la ventaja adicional de la rapidez de su aplicación y la mejora de la resistencia mecánica.
El principal mérito de esta técnica sin suturas es su simplicidad, que reduce el tiempo necesario para la anastomosis vascular a la vez que mantiene una calidad satisfactoria. En condiciones prácticas, esto permitiría reducir el tiempo de clampaje vascular.
La segunda ventaja de esta técnica es que el dispositivo no penetra en las paredes vasculares. Un procedimiento penetrante lesiona las paredes vasculares y reduce la durabilidad de las anastomosis, con la posibilidad de que esto derive en la formación de un aneurisma paraanastomósico12-15. En la técnica del suturado tradicional pueden incorporarse parches de Teflón o Dacrón en la línea de sutura si la pared aórtica es extremadamente frágil. Nuestros resultados confirmaron el incremento significativo de la resistencia mecánica de las anastomosis creadas mediante la técnica sin sutura al cabo de 4 semanas, a diferencia de la reducción significativa de la resistencia tras el suturado tradicional (fig. 8). Nuestra técnica supone emparedar la anastomosis entre el stent de PLLA y la banda de acero inoxidable. La amplia zona anastomósica y las múltiples protusiones en la superficie de la banda de refuerzo aseguran la fijación suficiente de la anastomosis.
Además, los cirujanos vasculares en ocasiones tienen dificultades relacionadas con la sutura de paredes vasculares gravemente calcificadas, y la hemorragia prolongada en los agujeros de sutura. Dado que nuestro sistema no penetra en la pared vascular, se obvian estas dificultades. Se observó la endotelización de la luz a las 4 semanas de la cirugía. La rápida progresión de la endotelización en la superficie luminal del dispositivo conector es esencial para evitar la oclusión precoz, puesto que el dispositivo está expuesto directamente al flujo sanguíneo. Scheltes et al16 han discutido el papel que desempeña la superficie de la neoíntima expuesta a la sangre en una anastomosis. Teóricamente, una gran cantidad de material extraño provoca un mayor grado de hiperplasia de la íntima, y se sabe que esto es un problema en los stents vasculares. Por tanto, hipotetizamos que sería preferible el uso de un material bioabsorbible para el dispositivo luminal. Nuestro dispositivo fue estudiado en modelos animales durante un período de hasta 28 días y mostró una endotelización completa sin hiperplasia de la íntima.
Escogimos el PLLA como material para el stent, entre otros materiales biodegradables, como el ácido poliglicólico (PGA), debido a su resistencia y leve reacción inflamatoria asociadas con la velocidad de degradación de estos polímeros10,11. El siguiente paso será un estudio de seguimiento a largo plazo para confirmar que las reacciones inflamatorias son mínimas durante la degradación del stent de PLLA.
En un caso se observó la oclusión trombótica del implante a pesar del aspecto normal de ambas anastomosis, aunque la intervención se completó según lo esperado en los 6 casos sin disección o fugas de sangre. Esto podría haberse producido debido a la hipercoagulabilidad descrita en los porcinos17, que requieren la administración intraoperatoria de una dosis alta de heparina. Recientemente se ha descrito que la permeabilidad de los stents de PLLA es peor que la de los stents metálicos. El PLLA en sí mismo es un factor asociado a la oclusión trombótica. De hecho, el polímero de PLLA tarda años en degradarse. Por otro lado, la oclusión trombótica se produce en el período inmediatamente posterior a la cirugía vascular y, por tanto, un anticoagulante que revistiese el stent de PLLA podría mejorar su permeabilidad. De forma alternativa, otra solución podría ser una variación en su diseño, por ejemplo, haciéndolo más delgado para reducir las alteraciones del flujo sanguíneo. También podría considerarse la aplicación de un stent metálico en lugar de un stent de PLLA en nuestro sistema.
En este estudio se realizó la anastomosis proximal con el dispositivo y la anastomosis distal se suturó de forma manual, debido al número limitado de animales que utilizamos. Por tanto, este modelo presentó un cierto sesgo inherente. Sin embargo, este estudio se diseñó simplemente como un primer paso para comprobar la viabilidad de nuestro nuevo dispositivo. A pesar de estas limitaciones, los resultados que hemos obtenido demuestran como mínimo la posibilidad de esta estrategia. El siguiente paso debe ser una evaluación más detallada con vistas a una aplicación clínica.
La anastomosis sin suturas con un stent de PLLA parece ser sencilla y viable, como mínimo durante un período de observación de 4 semanas. Esta intervención sencilla reduce el tiempo de cirugía al mismo tiempo que el riesgo de complicaciones relacionadas con la intervención. También podría mejorar la flexibilidad de una arteria altamente lesionada, como es el caso de las afectadas por una calcificación severa. Cabe esperar que la endotelización precoz de la superficie luminal y la biocompatibilidad gracias a la ausencia de reacción de cuerpo extraño contribuyan a la buena permeabilidad. En la actualidad estamos planeando estudiar la durabilidad de la anastomosis y la biodegradabilidad del PLLA en un modelo a largo plazo.
ConclusiónUna anastomosis vascular sin suturas utilizando un stent de PLLA y una banda de acero inoxidable ha demostrado ser factible y efectiva durante un período de observación de 4 semanas. La implantación de este dispositivo es rápida y atraumática, sin inducir ninguna reacción significativa en la pared arterial. Los resultados indican que este nuevo método se muestra considerablemente prometedor en las anastomosis vasculares.
Este trabajo se ha financiado con una beca para la investigación científica (JSPS-15591322) de la Japan Society for the Promotion of Science.
Agradecemos especialmente al Dr. Shojiro Matsuda, Research & Development Center, Gunze Ltd., la fabricación de los stents de PLLA, y al Dr. Masao Suzuki, Tohoku University Biomedical Engineering Research Organization (TUBERO), Tohoku University, la fabricación de la banda de acero inoxidable.