Desde diciembre de 2019, un número de casos de neumonía por síndrome respiratorio agudo severo (SARS) CoV2/COVID-19 en Wuhan, China, se identificaron como causa de insuficiencia respiratoria aguda, y se propagaron por el mundo a gran velocidad. Debido al gran número de casos y a la necesidad de entender más esta condición, surge la necesidad de identificar herramientas que gradúen la intensidad y el pronóstico vital de los pacientes. El objetivo de este estudio es determinar la relación entre el espacio muerto medido por capnografía volumétrica o por ventilatory ratio y el aumento de los niveles de dímero D en los pacientes con diagnóstico de neumonía por COVID-19 y que cumplan los criterios de Berlín para síndrome de dificultad respiratoria aguda (SDRA).
Materiales y métodosSe realizó un estudio observacional de una cohorte prospectiva, monocéntrico, sobre el uso de dímero D y la correlación con el espacio muerto. Se incluyeron adultos mayores de 18 años con diagnóstico de neumonía por COVID-19 y SDRA hospitalizados en las unidades de cuidados intensivos del Hospital Santa Clara en Bogotá, Colombia, desde agosto de 2020 hasta julio de 2021.
ResultadosEl estudio incluyó 67 pacientes, con diagnóstico de SARS-CoV-2 confirmado en todos ellos, no se encontró asociación entre dímero D y espacio muerto en el día 1 y 3 de la hospitalización en la UCI.
ConclusiónEl dímero D no se correlaciona con el aumento del espacio muerto en nuestro estudio y tampoco se asoció con los desenlaces clínicos relevantes en los pacientes con SDRA.
Since December 2019, a number of cases of CoV2/COVID-19 severe acute respiratory syndrome (SARS) pneumonia in Wuhan China have been identified as a cause of acute respiratory failure and have spread around the world at high speed. Due to the large number of cases and the need to better understand this condition, tools are required to grade the intensity and vital prognosis of patients. The objective of this study is to determine the relationship between the dead space measured by volumetric capnography or ventilatory ratio and the increase in D-dimer levels in patients diagnosed with COVID-19 pneumonia and who meet the Berlin criteria for Acute Respiratory Distress Syndrome (ARDS).
Materials and methodsA single-centre observational study of a prospective cohort on the use of D-dimer and the correlation with dead space. Adults older than 18 years with a diagnosis of pneumonia due to COVID-19 and ARDS hospitalized in the intensive care units of Hospital Santa Clara in Bogotá, Colombia, from August 2020 to July 2021 were included.
ResultsThe study included 67 patients, all with a confirmed SARS-CoV-2 diagnosis, no association was found between D-dimer and dead space on day 1 and 3 of hospitalization in the ICU.
ConclusionsD-dimer was not correlated with increased dead space in our study and was not associated with relevant outcomes in patients with ARDS.
Desde diciembre de 2019, un número de casos de neumonía por síndrome respiratorio agudo severo (SARS) CoV-2/COVID-19 en Wuhan, China se identificaron, como causa de insuficiencia respiratoria aguda1; esta infección rápidamente progreso y el 11 de marzo de 2020, debido al aumento global de la infección, la Organización Mundial de la Salud (OMS) declaró a la infección por SARS-CoV-2/COVID-19 como pandemia2. Colombia presentó una gran afectación, necesidad de la unidad de cuidados intensivos (UCI) por el aumento del SDRA y varias muertes por la infección secundaria a SARS-CoV-23.
La infección por SARS-CoV-2/COVID-19, tiene una amplia gama de síntomas que puede ir desde personas asintomáticas como presentación menos severa de la enfermedad hasta la muerte como presentación más severa4, y según las diferentes series, la mortalidad oscila entre un 10 a un 15%5–8, con aumento en la mortalidad en pacientes que requieren ventilación mecánica invasiva con una variabilidad que puede ser del 14,6% en una serie de casos de New York City6, hasta el 38% en una serie de casos de Wuhan, China7.
Por otra parte el síndrome de dificultad respiratoria aguda (SDRA) ocurrió en el 20% de 138 pacientes hospitalizados y en el 61% de los 36 pacientes admitidos a la unidad de la UCI por infección por SARS-CoV-2/COVID-19 en Wuhan4 en una de las series más grande publicadas en China, pero el SDRA puede presentarse en un rango que va desde el 17 hasta el 29% en otras series6,7, con requerimiento de ventilación mecánica invasiva y aumento en la morbimortalidad secundaria, convirtiéndola en una de las características clínicas más importantes en la unidad de cuidados intensivos, y un desafío diagnóstico y terapéutico8.
Una cualidad importante en el abordaje del paciente con síndrome de distrés respiratorio es estimar la fracción de espacio muerto fisiológico y su importancia al desestimar el volumen que no participa en el intercambio gaseoso, presentando una elevación significativa inversamente proporcional a la probabilidad de supervivencia en los pacientes críticamente enfermos9. Así mismo, representa una estrategia no invasiva de monitoria gaseosa, que en fases tempranas de la enfermedad tiene relación directa con la mortalidad global.
En este contexto surge la necesidad de identificar herramientas que gradúen la intensidad y el pronóstico vital de los pacientes con esta condición. El objetivo de este estudio es determinar la relación entre el espacio muerto medido por capnografía volumétrica o por ventilatory ratio y el aumento de los niveles de dímero D en pacientes que ingresan al servicio de cuidados intensivos en un hospital de tercer nivel en la ciudad de Bogotá, Colombia, con diagnóstico de neumonía por COVID-19, y que cumplan los criterios de Berlín para SDRA10.
Materiales y métodosSe realizó un estudio observacional de una cohorte prospectiva, en un centro a nivel nacional, sobre el uso de dímero D y su correlación con el espacio muerto. Este estudio fue aprobado por el comité de ética de investigación de la Subred Integrada de Servicios de Salud Centro Oriente. Se incluyeron pacientes mayores de 18 años, con diagnóstico de neumonía grave secundaria a infección por COVID-19 y SDRA, definido por cuadro de síntomas respiratorios superiores e inferiores más PCR para COVID-19 positiva y que cumplieran con los criterios de Berlín para SDRA (tabla 1), que ingresaran en la UCI del Hospital Santa Clara desde agosto de 2020 a julio de 2021 y requirieran ventilación mecánica invasiva. Se excluyeron aquellos pacientes con una expectativa de sobrevida menor a 12 meses según categorización de la escala Charlson o pacientes con enfermedad oncológica y otras condiciones clínicas que pueden cursar con trombosis y fibrinólisis, tales como tromboembolismo venoso agudo previa a la infección por COVID-19, traumatismos, sepsis no relacionada con neumonía grave por COVID-19, coagulación intravascular diseminada y eventos coronarios agudos no relacionados con infección por COVID-19, edema pulmonar de origen cardiogénico, historia de enfermedad hepática crónica o cirrosis Child-Pugh C y mujeres gestantes.
Definición de Berlín del síndrome de dificultad respiratoria aguda
| Tiempo | Dentro de una semana posterior a un daño clínico conocido o empeoramiento de sintomatología respiratoria. |
| Radiografía de tórax | Opacidades bilaterales no explicadas totalmente por derrames, atelectasias o nódulos. |
| Origen del edema | Falla respiratoria no explicada totalmente por falla cardíaca o sobrecarga de líquidos. Necesita evaluación objetiva (ecocardiografía) para excluir edema hidrostático en caso de que no haya factorde riesgo. |
| Oxigenación | |
| Leve | 200mmHg<PaO2/FiO2≤ 300mmHg con PEEP o CPAP≥5cmH2O |
| Moderado | 100mmHg<PaO2/FiO2≤200mmHg con PEEP≥5cmH2O |
| Severo | PaO2/FiO2≤100mmHg con PEEP≥5cmH2O |
CPAP: presión positiva continua; PaO2/FiO2: relación entre fracción inspirada de oxígeno y presión arterial de oxígeno; PEEP: presión positiva al final de la espiración.
Para efectos de esta tabla, todos los pacientes deben tener cambios agudos en la radiografía de tórax compatibles con edema pulmonar.
Se realizó un muestreo por conveniencia pues se incluyeron de forma consecutiva los registros de las historias clínicas de pacientes que cumplían con los criterios de neumonía grave secundaria a infección por COVID-19 y SDRA, que ingresaran a la USS Hospital Santa Clara entre agosto de 2020 hasta julio de 2021.
A los pacientes seleccionados se les realizó una medición de dímero D al ingreso en la UCI y al día 3 de la intubación orotraqueal. También se realizó una medición del espacio muerto por capnografía volumétrica según la disponibilidad en el centro, o por el cálculo de la ventilatory ratios según la fórmula (ventilación minuto×PaCO2 (mmHg)/peso predicho×100×37,5)27, todos los datos fueron registrados en la base de datos de la plataforma CICERO.
Partiendo de la base, en referencia a las áreas de elevado cociente V/Q causan ventilación ineficaz, que en su extremo máximo (cuando tiende a infinito) se denomina espacio muerto como causa de hipoxemia de acuerdo al gradiente de perfusión, los factores de confusión pueden estar dados por la condición clínica del paciente, en relación a la gravedad, así como a la compliancia pulmonar, que pareciera tener un comportamiento histológico como base fisiopatológica a partir de la primera semana de evolución del SDRA, debido a los procesos de formación de membranas hialinas y posteriormente de fibrosis pulmonar, por lo que hay factores no medibles, dada la condición inflamatoria del paciente.
Por lo que no se controlaron los posibles confusores que podrían alterar la medición del espacio muerto y por ende los resultados tienen un alto riesgo de sesgos.
Todos los pacientes fueron manejados con estrategias ventilatorias protectoras con volúmenes bajos y altos niveles de PEEP (titulada según la tabla FiO2/PEEP)11, con un objetivo de presión de conducción menor a 15, y presión meseta menor a 30, según protocolo institucional.
Se realizó un análisis descriptivo con las variables cuantitativas y cualitativas. A las variables cuantitativas se les calculó medidas de tendencia central y dispersión de los datos. Las variables cualitativas se presentan como frecuencias y proporciones.
Para el análisis bivariado se utilizó correlación de Pearson y para la asociación con los desenlaces clínicos más importantes se utilizó correlación de rho de Spearman (r). En todos los análisis se empleó como límite para la significancia estadística una p<0,05 y los análisis se efectuarán a 2 colas.
Se determinó la correlación entre los niveles de dímero D y espacio muerto usando los gráficos de dispersión y de Bland-Altman.
Para el análisis de los resultados se trabajó con IBM SPSS® statistics 22 (Statistical Package for the Social Sciences) y Excel®.
ResultadosDurante el periodo del estudio 89 pacientes con diagnóstico de neumonía por SARS-CoV-2 confirmada por RT-PCR y SDRA fueron identificados. Las medidas de dímero D y ventilatory ratio, no fueron medidas en 20 pacientes, resultando en un total de 67 pacientes que cumplieron con todos los criterios para el análisis definitivo.
La edad promedio de nuestro estudio fue 60±10 para los sobrevivientes y 64±10 no sobrevivientes, el 71% (71,6) fueron varones, las principales comorbilidades fueron hipertensión arterial (44,8%), obesidad (29,9%) y diabetes mellitus (17,9%), la tasa de mortalidad para la población de nuestro estudio fue del 61%, las características demográficas y los resultados de los paraclínicos son mostrados en la tabla 2. Al comparar las características de los pacientes que sobrevivieron comparado con los que fallecieron, se evidenció que los pacientes que fallecieron tenían menos plaquetas al día 7 de hospitalización comparado con los pacientes que fallecieron, por otra parte, los niveles de dímero D, ventilatory ratio, lactato u otras variables medidas no tuvieron diferencias estadísticamente significativas.
Características demográficas y paraclínicas
| VivosMedia | MuertosMedia | Valor de p | |
|---|---|---|---|
| Edad | 60,8±10 | 64,5±10 | 0,175 |
| Frecuencia respiratoria | 21,3±7 | 21,34±7 | 0,841 |
| Peso ideal | 62,25±7 | 60,9±7,3 | 0,457 |
| Peso medido | 78±21 | 72,5±13 | 0,208 |
| PAFI, día 1 | 129,83±39 | 138,65±83 | 0,872 |
| Conteo de linfocitos (valor absoluto), día 1 | 1.087±1.243 | 1.173±1.426 | 0,877 |
| Hb (g/dl), día 1 | 13,1±1,6 | 13,9±2,3 | 0,117 |
| Conteo plaquetas, día 1 | 280.961±114 | 240.097±95.142 | 0,118 |
| Creatinina (mg/dl), día 1 | 1,283±1,8 | 1,44±1,5 | 0,205 |
| Ventilatory ratio, día 1 | 1,42±0,5 | 1,49±0,5 | 0,733 |
| Sat Art O2, día 1 | 93±3 | 92±6 | 0,588 |
| DD, día 1 | 3.348±2.862 | 2.874±2.767 | 0,450 |
| Lactato, día 1 | 1,5±0,4 | 2,4±2,1 | 0,071 |
| Troponina I, día 1 | 3,4±1,3 | 1,5±5,9 | 0,280 |
| LDH, día 1 | 506±192 | 537±344 | 0,849 |
| DD, día 3 | 3.710±2.954 | 3.742±2.804 | 0,809 |
| Ventilatory ratio, día 3 | 1,4±0,4 | 1,6±0,5 | 0,212 |
| Creatinina (mg/dl), día 3 | 1,4±2,1 | 2,1±1,9 | 0,093 |
| Conteo de linfocitos (valor absoluto), día 7 | 784,8±426 | 763,4±492 | 0,677 |
| Conteo plaquetas, día 7 | 339.720±143.702 | 228.965±115.288 | 0,003 |
| Creatinina (mg/dl), día 7 | 1,2±1,1 | 1,6±1,5 | 0,18 |
| DD, día 7 | 2.999±2.447 | 2.633±2.540 | 0,404 |
DD: dímero D; Hb: hemoglobina; LDH: lactato deshidrogenasa; PAFI: relación entre fracción inspirada de oxígeno y presión arterial de oxígeno; Sat Art O2: saturación arterial de O2.
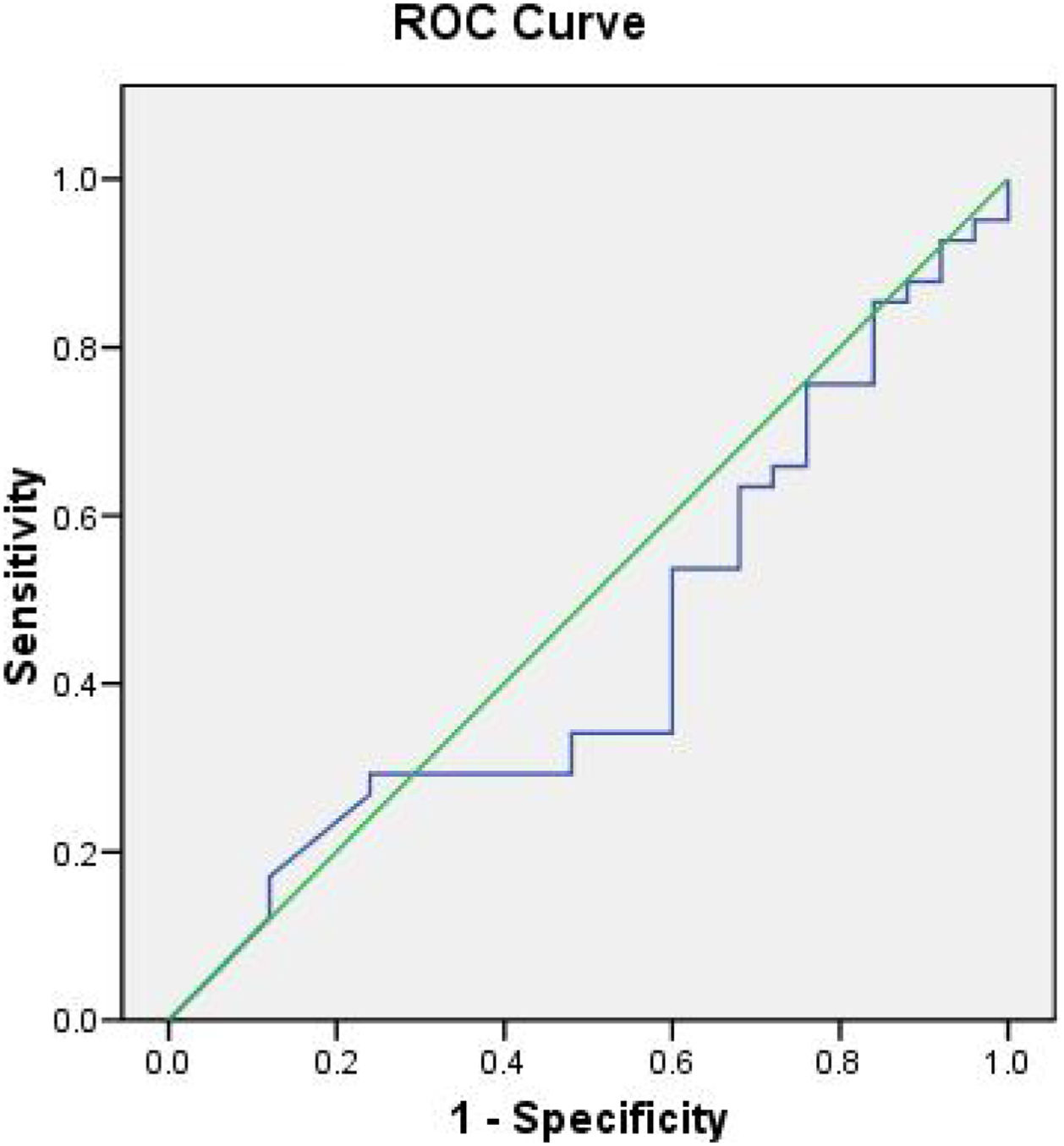
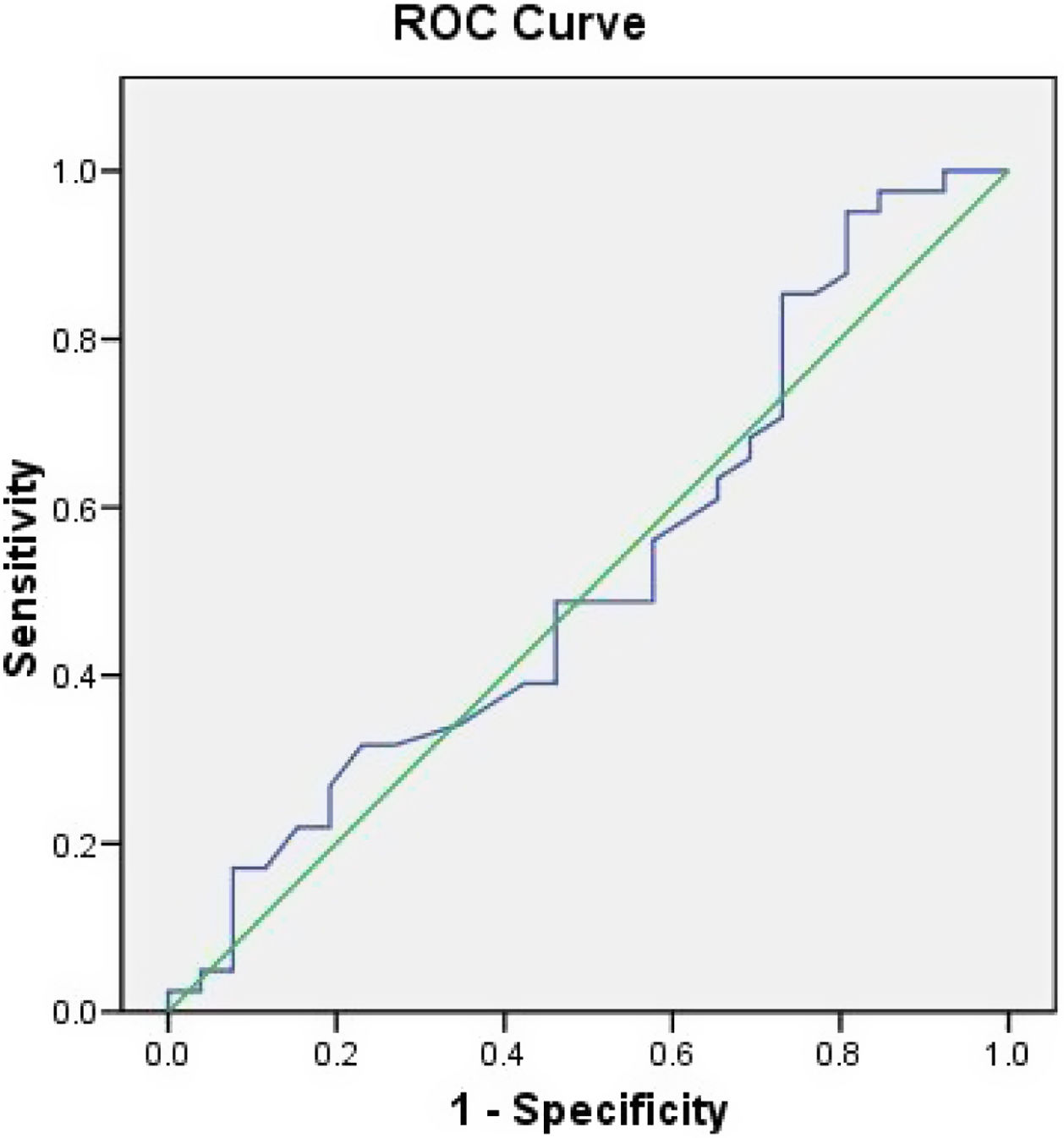
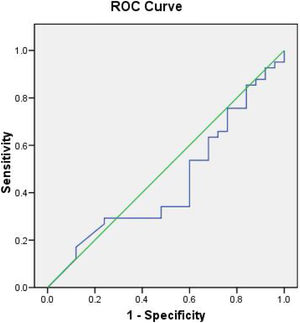
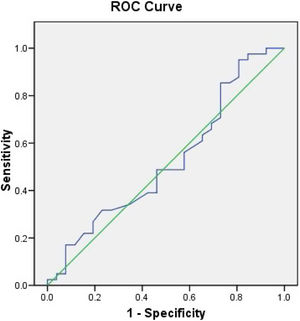
En la figura 1, el análisis del área bajo la curva (AUC) para determinar la exactitud diagnóstica del dímero D con respecto a mortalidad, mostró un AUC de 0,44, por otra parte, en la figura 2 se muestra el AUC del ventilatory ratio de 0,525 para determinar mortalidad en nuestros pacientes en el primer día, demostrando bajo rendimiento de estos 2 parámetros para predecir mortalidad.
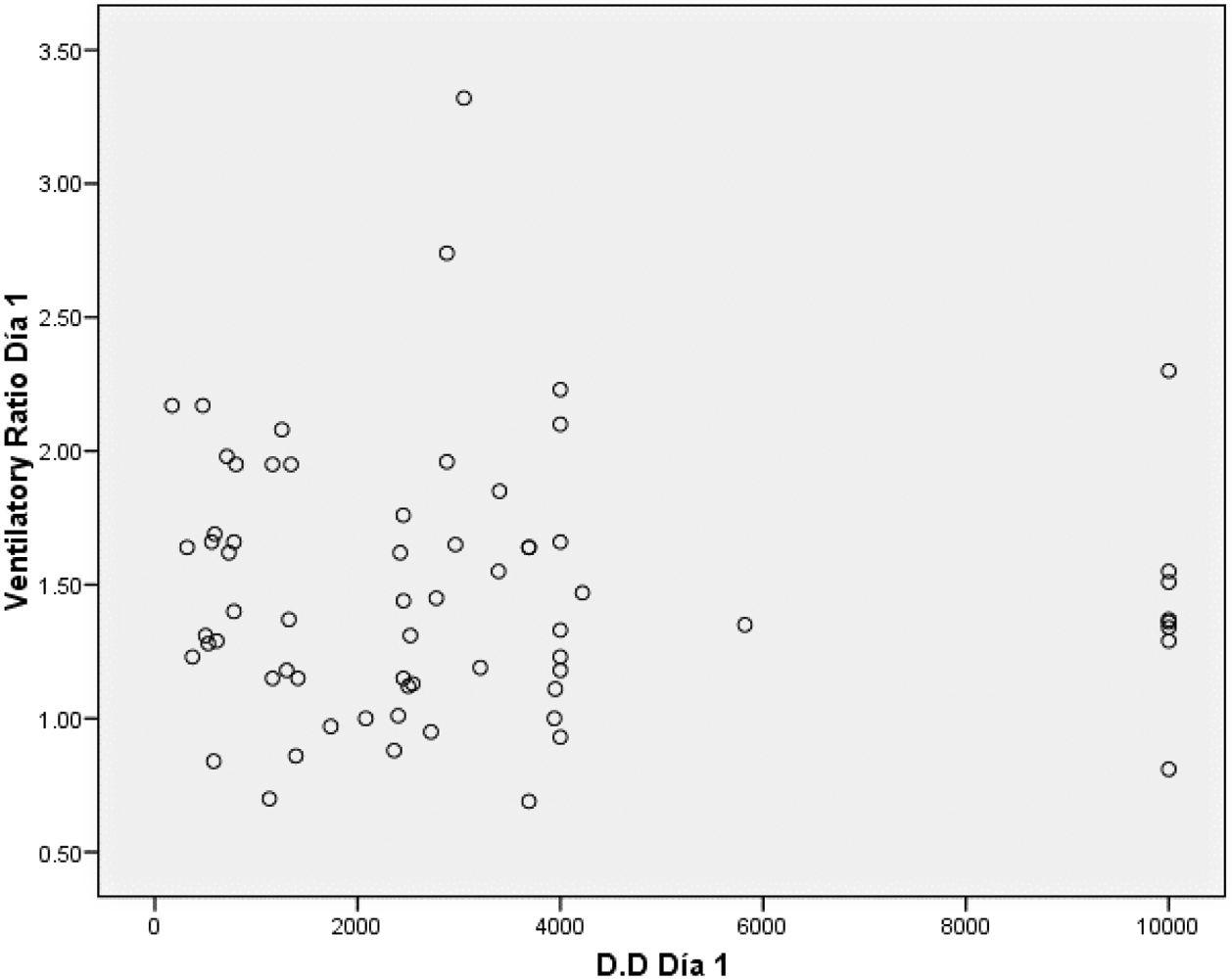
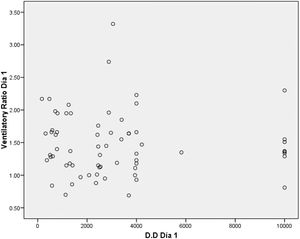
En la figura 3, el gráfico Bland-Altman para la correlación entre el ventilatory ratio y dímero D, muestra una amplia variabilidad, y ninguna correlación entre las 2 medidas.
Después de realizar el coeficiente de correlación de Spearman (rho) no se encontraron significancias con las variables de PAFII, lactato, frecuencia respiratoria, troponina I, con los niveles de dímero D medidos en los días 1, 3 y 7, y con tampoco con los valores de ventilatory ratio medidos en los días 1 y 3, en nuestro estudio (tabla 3).
Coeficiente de correlación de Spearman (rho)
| PAF, día 1 | Lactat, día 1 | FR | D.D, día 1 | Troponina I, día 1 | D.D, día 3 | D.D, día 7 | Ventilatory ratio, día 1 | Ventilatory ratio, día 3 | ||
|---|---|---|---|---|---|---|---|---|---|---|
| DD, día 1 | Coeficiente de correlación | 0,067 | 0,086 | −0,246a | 1,000 | 0,094 | 0,656b | 0,470b | −0,055 | 0,175 |
| Sig. (2-tailed) | 0,594 | 0,508 | 0,047 | — | 0,481 | 0,000 | 0,004 | 0,659 | 0,193 | |
| DD, día 3 | Coeficiente de correlación | 0,003 | 0,072 | −0,148 | 0,656b | −0,004 | 1,000 | 0,503b | −0,178 | 0,100 |
| Sig. (2-tailed) | 0,985 | 0,629 | 0,301 | 0,000 | 0,978 | — | 0,004 | 0,210 | 0,507 | |
| DD, día 7 | Coeficiente de correlación | 0,065 | 0,014 | −0,375a | 0,470b | 0,135 | 0,503b | 1,000 | −0,149 | 0,084 |
| Sig. (2-tailed) | 0,704 | 0,939 | 0,024 | 0,004 | 0,460 | 0,004 | — | 0,387 | 0,637 | |
| Ventilatory ratio, día 1 | Coeficiente de correlación | −0,043 | −0,212 | 0,159 | −0,055 | −0,053 | −0,178 | −0,149 | 1,000 | 0,333a |
| Sig. (2-tailed) | 0,727 | 0,096 | 0,200 | 0,659 | 0,694 | 0,210 | 0,387 | — | 0,011 | |
| Ventilatory ratio, día 3 | Coeficiente de correlación | −0,222 | 0,307a | −0,237 | 0,175 | 0,029 | 0,100 | 0,084 | 0,333a | 1,000 |
| Sig. (2-tailed) | 0,094 | 0,023 | 0,073 | 0,193 | 0,837 | 0,507 | 0,637 | 0,011 | — |
DD: dímero D; FR: frecuencia respiratoria; PAFI: relación entre fracción inspirada de oxígeno y presión arterial de oxígeno.
El SDRA es una forma de edema pulmonar no cardiogénico, debido a una lesión alveolar secundaria a un proceso inflamatorio, que puede ser de origen pulmonar o sistémico12, y en la infección por SARS-CoV-2/COVID-19 el SDRA representa la lesión más severa del compromiso pulmonar, y se asocia además con choque séptico, aumento en los requerimientos de ventilación mecánica invasiva y muerte 13.
El aumento del espacio muerto pulmonar está asociado en varias publicaciones como un factor predictor de muerte en SDRA14,15. Este puede ser determinado fácilmente con la capnografía volumétrica mediante la fórmula de Bohr (Vd/Vt=(PaCO2-PeCO2)/PaCO2*)16 o mediante la ventilatory ratio (relación ventilatoria) recientemente validado por el grupo de Sinha et al. (ventilación minuto×PaCO2 (mmHg)/Peso predicho×100×37,5)17.
Por otra parte, el dímero D que es un producto de degradación de la fibrina, formado como resultado de la conversión de fibrinógeno en fibrina por la trombina como agente catalítico18, se han reportado en paciente con infección por COVID-19, aumento en los niveles de dímero D como un factor pronóstico pobre dado el aumento en la mortalidad19.
Este estudio observacional de cohorte prospectiva, monocéntrico, no mostró una correlación entre los niveles de dímero D y espacio muerto medido por ventilatory ratio en pacientes con neumonía por COVID-19 y SDRA diagnosticados por criterios de Berlín.
Nuestros resultados no soportan la hipótesis que los niveles de dímero D, determinarán con exactitud el aumento de espacio muerto en los pacientes que se presentan con SDRA e infección por COVID-19. Nuestros hallazgos pueden estar asociados a las posibles diferencias de los mecanismos fisiopatológicos del SDRA por COVID y no COVID, reportado por el doctor Gattinoni en sus fenotipos L y H20, y donde en las fases iniciales, lo que observamos en una alteración en la pérdida de la vasoconstricción hipóxica.
Nuestros hallazgos difieren desde estudios previos; Lecompte-Osorio en su cohorte de validación en 2021, que incluye 124 pacientes con diagnóstico de SDRA, la medida del espacio muerto por la fórmula de Enghoff modificada fue un predictor de muerte en pacientes críticos con SDRA21, pero debe recalcarse que estos pacientes presentaron SDRA no asociado a COVID-19.
Morales-Quinteros et al. en su estudio de cohorte observacional en 2021, donde se incluyeron 927 pacientes con diagnóstico de SDRA por COVID-19, a quienes, se les realizó el cálculo del espacio muerto por el uso de la ecuación de Harris Benedict, mostró que a pesar de que se evidenció un aumento de espacio muerto en los pacientes no sobrevivientes, no fue un predictor independiente asociado con mortalidad, y se consideró como un predictor de severidad más que un predictor de resultados22.
Nosotros encontramos en nuestro estudio, que el espacio muerto en el día uno y 3 de estancia en la unidad de cuidados intensivos entre los pacientes sobrevivientes y no sobrevivientes no difiere significativamente.
Hasta la fecha solo encontramos en la literatura un estudio del grupo de Grasselli et al. observacional prospectivo del 2020, que incluye 301 pacientes, donde evidenció que los niveles de dímero D mayores a la media (1.880ng/ml), se asociaron con aumento en el espacio muerto medido por ventilatory ratios 1,90 con una p estadísticamente significativa (p=0,0001), y en el análisis de mortalidad la distensibilidad aumentada asociada a niveles de dímero D mayores a la media se asocian con un aumento en la mortalidad a los 28 días23.
Este estudio cuenta con varias fortalezas y debilidades, para nuestro conocimiento, este es el primer estudio que intenta correlacionar los valores de dímero D y espacio muerto medido por ventilatory ratio, todos los pacientes fueron confirmados con infección por COVID-19, y manejados con ventilación mecánica protectora (volúmenes bajos, presión de conducción menor o iguales a 15, y presión meseta menores a 30), con un modo ventilatorio controlado por volumen, para evitar heterogeneidad en el tratamiento. Las limitaciones de este estudio incluyen el tamaño de la muestra, el diseño monocéntrico, la definición empleada para definir el SDRA debido a que los criterios de Berlín fueron construidos empíricamente y su validación utiliza cohortes retrospectivas10; sin embargo, los estudios prospectivos de esta definición se han limitado a un pequeño número de centros y pacientes24, por otra parte, no se controlaron los posibles confusores que podrían alterar la medición del espacio muerto y por ende los resultados tienen un alto riesgo de sesgos.
ConclusionesNo se encontró correlación entre los niveles de dímero D y espacio muerto medido por ventilatory ratio en los pacientes con neumonía por COVID-19 confirmada por RT-PCR y SDRA diagnosticada por criterios de Berlín. Es necesario realizar más estudios prospectivos que incluyan más pacientes con SDRA, para validar el valor del espacio muerto y la relación con el dímero D.
FinanciaciónEste trabajo no contó con fuentes de financiación externa.
Conflicto de interesesNinguno de los autores de este artículo tiene conflicto de intereses.