La hemorragia subaracnoidea aneurismática (HSAa) tiene una alta mortalidad y riesgo elevado de discapacidad entre los sobrevivientes. Ciertos biomarcadores funcionan como predictores de mal pronóstico y muerte en estos pacientes. Sin embargo, en algunos hospitales de México estos reactivos específicos no están disponibles y se busca encontrar bioquímicos accesibles, económicos y reproducibles.
ObjetivoDeterminar si las concentraciones séricas de leucocitos, plaquetas, glucosa, fósforo, potasio y lactato se relacionan con mal pronóstico y mortalidad en pacientes con HSAa.
Material y métodosEstudio observacional, descriptivo, retrospectivo, analítico, realizado de marzo de 2022 a septiembre de 2023 en pacientes que ingresaron a la Unidad de Cuidados Intensivos con HSAa. Mediante un muestreo a conveniencia no probabilístico se registraron los valores de leucocitos, plaquetas, glucosa, fósforo, potasio y lactato al ingreso y 24h subsecuentes. Estos parámetros se correlacionaron con mal pronóstico y mortalidad.
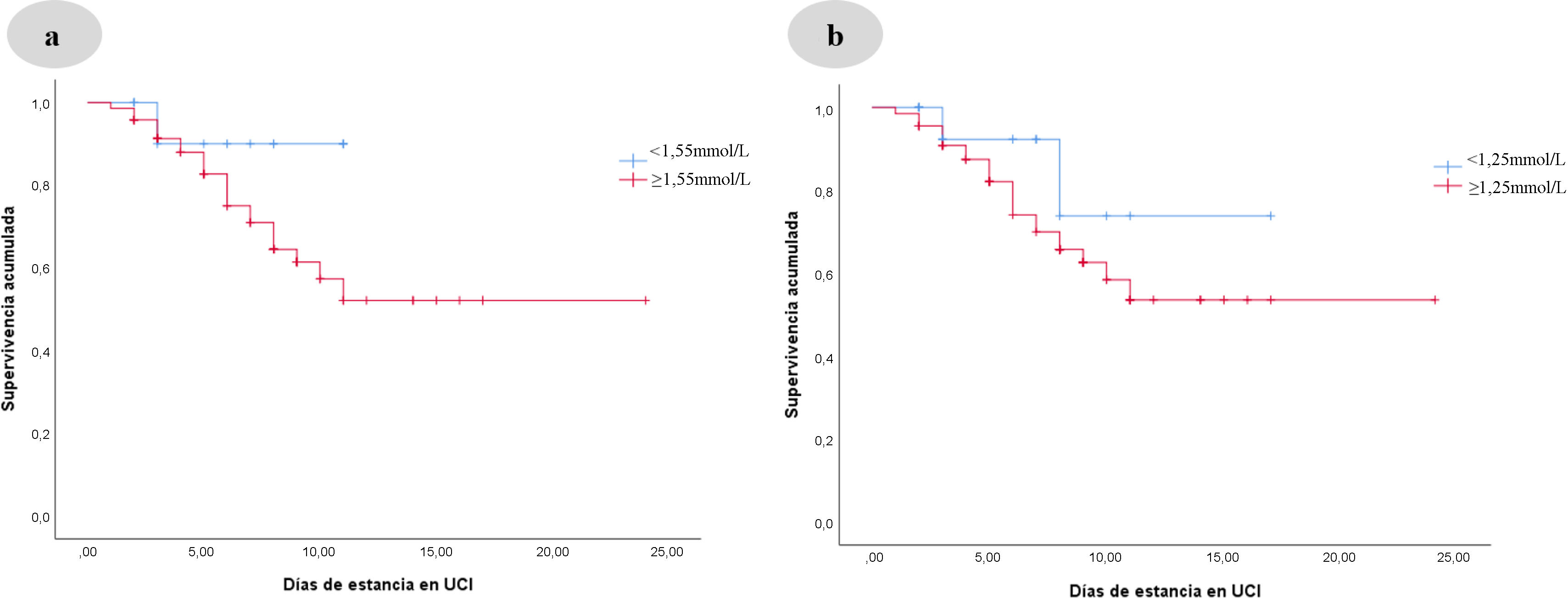
ResultadosDe 84 pacientes registrados, 18 fallecieron (21,4%), 14 presentaron infarto cerebral (16,7%) y 23 secuelas neurológicas (27,4%). El resto (n=29) permaneció sin secuelas neurológicas (34,5%). Los niveles de lactato>1,55mmol/L (AUC 0,698; p=0,005) presentaron significación estadística al ingreso, así como a las 24h con punto de corte>1,25mmol/L (AUC 0,743; p<0,001), seguido de niveles de leucocitos>8,7×10*3 (AUC 0,674; p=0,01) y plaquetas<158×10*3 (AUC 0,657; p=0,02). Ningún biomarcador presentó correlación significativa con pronóstico.
ConclusionesEn pacientes con HSAa se recomiendan los valores de lactato al ingreso y 24h posteriores para predecir mortalidad.
Aneurysmal subarachnoid hemorrhage (aSAH) has a high mortality and elevated risk of disability among survivors. Certain biomarkers function as predictors of poor prognosis and mortality in these patients. However, in most hospitals in Mexico these specific serum biomarkers are not available. The aim is to find accessible, economic and reproducible serum biomarkers.
ObjectiveTo determine whether serum concentrations of leukocytes, platelets, glucose, phosphorus, potassium and lactate are related to poor prognosis and mortality in patients with aSAH.
Material and methodsObservational, descriptive, retrospective, analytical study, conducted from March 2022 to September 2023 in patients admitted to the Intensive Care Unit with aSAH. By means of a non-probabilistic convenience sampling, levels of leukocytes, platelets, glucose, phosphorus, potassium and lactate were obtained at admission and 24h later. These parameters were correlated with poor prognosis and mortality.
ResultsOf 84 patients registered, 18 died (21.4%), 14 presented cerebral infarction (16.7%), 23 neurological sequelae (27.4%). The rest (n=29) remained without neurological sequelae (34.5%). Lactate levels>1.55mmol/L (AUC 0.698; p=0.005) presented statistical significance at admission, as well as at 24h with cutoff point>1.25mmol/L (AUC 0.743; p<0.001), followed by leukocyte levels>8.7×10*3 (AUC 0.674; p=0.01) and platelets<158×10*3 (AUC 0.657; p=0.02). No biomarker presented significant correlation with prognosis.
ConclusionsIn patients with aSAH, lactate values at admission and 24h later are recommended to predict mortality.
Artículo
Socios de la Asociación de Medicina Crítica y Cuidado Intensivo
Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la AMCI, clique aquí