El tumor calcificante en nidos epitelial-estromal (CNSET) es un tumor hepático primario excepcional1-6, descrito por primera vez por Ishak en 20011,3,4,6. Sólo 43 casos han sido publicados en la literatura2-9 (tabla 1). Presenta un curso clínico aparentemente benigno e indolente, atribuible a su bajo potencial maligno10. El tratamiento quirúrgico con márgenes libres suele ofrecer altas tasas de supervivencia a largo plazo3.
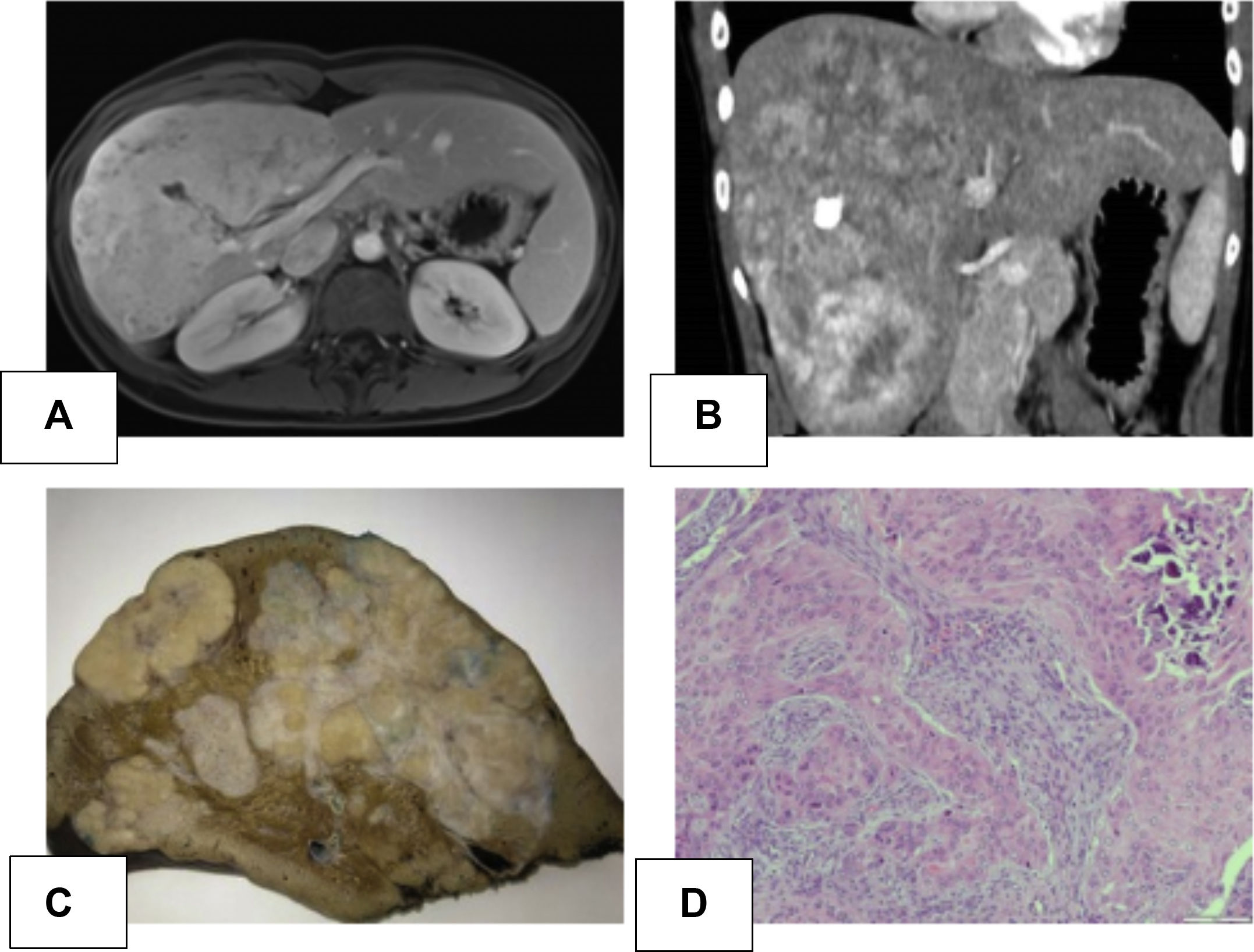
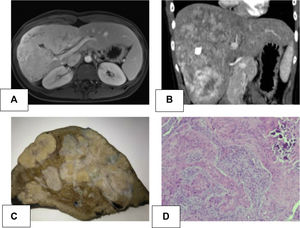
Presentamos una paciente de 21 años sin antecedentes de interés. Tras analítica de control se evidenció alteración del perfil hepático (gama glutamil transpeptidasa [GGT] 122 UI/L). En la exploración física presentaba hepatomegalia. Se realizó una ecografía abdominal que evidenció una lesión focal hiper-isoecoica, aparentemente calcificada, de contorno lobulado y escasa vascularización. La resonancia magnética (RM) y tomografía computarizada (TC) (fig. 1A-B) mostraron una gran masa heterogénea de contorno irregular con múltiples calcificaciones, con realce irregular en fase arterial y lavado en fase portal, planteando como primer diagnóstico hepatocarcinoma fibrolamelar (HCF) en los segmentos IV, V, VI, VII y VIII. Los marcadores tumorales Alfa-fetoproteina, antígeno carcinoembrionario y CA 19,9 fueron normales. La volumetría total hepática fue 1.172,83 cc. El porcentaje de los volúmenes residuales calculados fue; 42,2% para los segmentos II-III (495,59 cc) y 48% para los segmentos I-II-III (562 cc). Ante la sospecha de HCF se indicó cirugía, realizándose mediante laparotomía una triseccionectomía derecha y linfadenectomía del hilio hepático y tronco celíaco. El postoperatorio evolucionó sin incidencias, siendo dada de alta el séptimo día postoperatorio.
A) Resonancia magnética hepática: gran masa heterogénea de 11,5 × 10 × 19 cm polilobulada de los segmentos IV, V, VI, VII y VIII con captación hipervascular, sin claro lavado en fase portal y tardía, manteniendo focos no captantes a nivel central, que coincide con la calcificación del TAC. Leve restricción en la difusión. Compatible con carcinoma fibrolamelar. B) Tomografía axial computarizada abdominal: gran masa heterogénea hepática de contorno irregular y densidad heterogénea que ocupa los segmentos IV, V, VI, VII y VIII, presenta calcificaciones múltiples. Realce irregular en fase arterial y lavado del contraste en fase portal. C) Imagen macroscópica: pieza de hepatectomía de 24 × 17 × 19 cm, con 1.500 g de peso. Ocupada en su práctica totalidad por una tumoración blanquecina nodular de 21 × 13 × 8 cm que contacta con la cápsula hepática y queda alejada del borde de resección parenquimatoso. D) Imagen microscópica con hematoxilina eosina (aumento 10×): proliferación de células de tipo epitelioide y fusiforme con formación de material osteoide. Se observan nidos con aspecto epitelial central, rodeados por células de aspecto fusiforme. Área calcificada.
La anatomía patológica mostró una tumoración blanquecina nodular de 21 × 13 × 8 cm con múltiples calcificaciones, zonas de osificación y adenopatías sin neoplasia. En la inmunohistoquímica las células fueron positivas para Vimentina, Actina, WT-1, CD56, CD99, CD117 con Ki67:1% (fig. 1C-D). Todo ello compatible con CNSET con margen quirúrgico libre, sin invasión perineural ni permeación linfovascular.
El caso fue presentado en Comité Oncológico decidiéndose seguimiento en consulta externa sin quimioterapia adyuvante porque no hay claro beneficio que justifique el tratamiento adyuvante. Tras seis meses desde la intervención, la paciente permanece asintomática y libre de enfermedad. El seguimiento se ha realizado mediante analíticas con perfil hepático y TC.
Los CNSET han sido descritos en la literatura con diversas terminologías: tumor epitelial y estromal mixto maligno osificante, tumor epitelial estromal osificante y tumor desmoplásico de células fusiformes anidadas del hígado1. Fue Markhouf quien propuso el término CNSET porque incorpora todas las características del tumor.
A pesar de su carácter excepcional, conocemos que tienen una presentación más frecuente en pacientes jóvenes (≤ 20 años) o edad pediátrica (77%) y de sexo femenino (70%) (tabla 1). Suelen asentar en el lóbulo hepático derecho (64%) y el 40% de los casos su diagnóstico es incidental (tabla 1). Destaca la asociación de CNSET con alteraciones hormonales (36%): síndrome Cushing o síntomas cushingoides (25%)5,7, síndrome Klinefelter4 y toma de anticonceptivos orales. Algunos autores han intentado relacionar el desarrollo de estos tumores con alteraciones hormonales, pero sin llegar a demostrarlo. En cuatro pacientes se asoció con síndrome Beckwith-Wiedemann (síndrome de sobrecrecimiento con mayor riesgo de desarrollar cáncer)2,8. Nuestro caso no presentaba asociación con estas patologías.
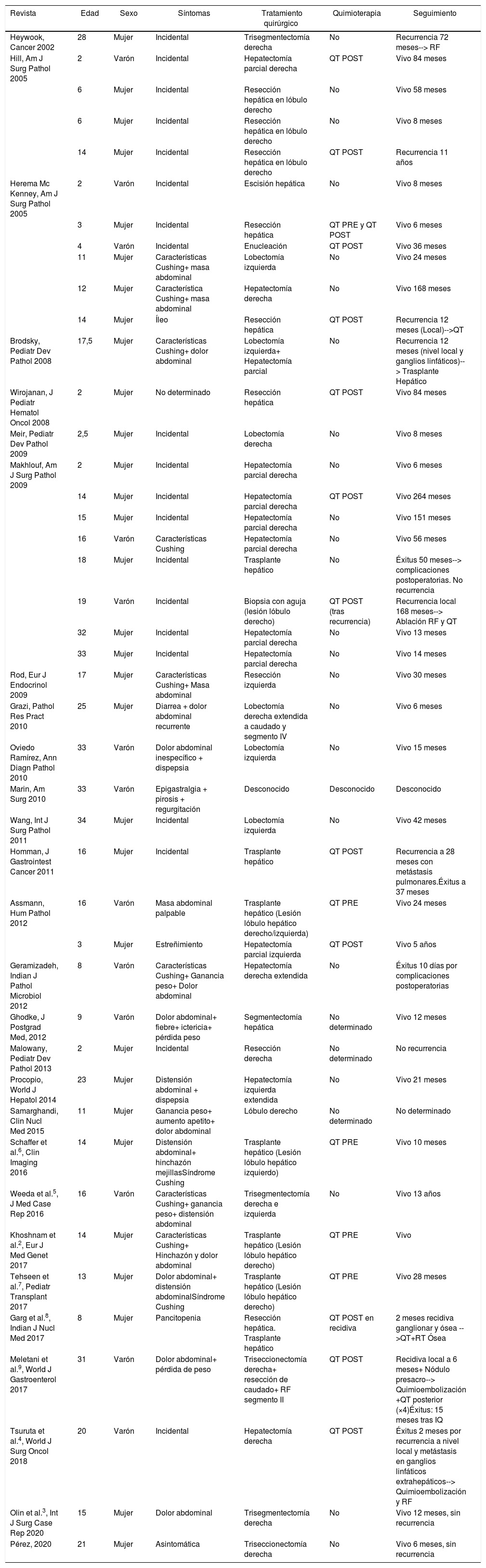
Características clinicopatológicas de 44 casos de tumor calcificante en nidos epitelial-estromal
| Revista | Edad | Sexo | Síntomas | Tratamiento quirúrgico | Quimioterapia | Seguimiento |
|---|---|---|---|---|---|---|
| Heywook, Cancer 2002 | 28 | Mujer | Incidental | Trisegmentectomía derecha | No | Recurrencia 72 meses--> RF |
| Hill, Am J Surg Pathol 2005 | 2 | Varón | Incidental | Hepatectomía parcial derecha | QT POST | Vivo 84 meses |
| 6 | Mujer | Incidental | Resección hepática en lóbulo derecho | No | Vivo 58 meses | |
| 6 | Mujer | Incidental | Resección hepática en lóbulo derecho | No | Vivo 8 meses | |
| 14 | Mujer | Incidental | Resección hepática en lóbulo derecho | QT POST | Recurrencia 11 años | |
| Herema Mc Kenney, Am J Surg Pathol 2005 | 2 | Varón | Incidental | Escisión hepática | No | Vivo 8 meses |
| 3 | Mujer | Incidental | Resección hepática | QT PRE y QT POST | Vivo 6 meses | |
| 4 | Varón | Incidental | Enucleación | QT POST | Vivo 36 meses | |
| 11 | Mujer | Características Cushing+ masa abdominal | Lobectomía izquierda | No | Vivo 24 meses | |
| 12 | Mujer | Característica Cushing+ masa abdominal | Hepatectomía derecha | No | Vivo 168 meses | |
| 14 | Mujer | Íleo | Resección hepática | QT POST | Recurrencia 12 meses (Local)-->QT | |
| Brodsky, Pediatr Dev Pathol 2008 | 17,5 | Mujer | Características Cushing+ dolor abdominal | Lobectomía izquierda+ Hepatectomía parcial | No | Recurrencia 12 meses (nivel local y ganglios linfáticos)--> Trasplante Hepático |
| Wirojanan, J Pediatr Hematol Oncol 2008 | 2 | Mujer | No determinado | Resección hepática | QT POST | Vivo 84 meses |
| Meir, Pediatr Dev Pathol 2009 | 2,5 | Mujer | Incidental | Lobectomía derecha | No | Vivo 8 meses |
| Makhlouf, Am J Surg Pathol 2009 | 2 | Mujer | Incidental | Hepatectomía parcial derecha | No | Vivo 6 meses |
| 14 | Mujer | Incidental | Hepatectomía parcial derecha | QT POST | Vivo 264 meses | |
| 15 | Mujer | Incidental | Hepatectomía parcial derecha | No | Vivo 151 meses | |
| 16 | Varón | Características Cushing | Hepatectomía parcial derecha | No | Vivo 56 meses | |
| 18 | Mujer | Incidental | Trasplante hepático | No | Éxitus 50 meses--> complicaciones postoperatorias. No recurrencia | |
| 19 | Varón | Incidental | Biopsia con aguja (lesión lóbulo derecho) | QT POST (tras recurrencia) | Recurrencia local 168 meses--> Ablación RF y QT | |
| 32 | Mujer | Incidental | Hepatectomía parcial derecha | No | Vivo 13 meses | |
| 33 | Mujer | Incidental | Hepatectomía parcial derecha | No | Vivo 14 meses | |
| Rod, Eur J Endocrinol 2009 | 17 | Mujer | Características Cushing+ Masa abdominal | Resección izquierda | No | Vivo 30 meses |
| Grazi, Pathol Res Pract 2010 | 25 | Mujer | Diarrea + dolor abdominal recurrente | Lobectomía derecha extendida a caudado y segmento IV | No | Vivo 6 meses |
| Oviedo Ramírez, Ann Diagn Pathol 2010 | 33 | Varón | Dolor abdominal inespecífico + dispepsia | Lobectomía izquierda | No | Vivo 15 meses |
| Marin, Am Surg 2010 | 33 | Varón | Epigastralgia + pirosis + regurgitación | Desconocido | Desconocido | Desconocido |
| Wang, Int J Surg Pathol 2011 | 34 | Mujer | Incidental | Lobectomía izquierda | No | Vivo 42 meses |
| Homman, J Gastrointest Cancer 2011 | 16 | Mujer | Incidental | Trasplante hepático | QT POST | Recurrencia a 28 meses con metástasis pulmonares.Éxitus a 37 meses |
| Assmann, Hum Pathol 2012 | 16 | Varón | Masa abdominal palpable | Trasplante hepático (Lesión lóbulo hepático derecho/izquierda) | QT PRE | Vivo 24 meses |
| 3 | Mujer | Estreñimiento | Hepatectomía parcial izquierda | QT POST | Vivo 5 años | |
| Geramizadeh, Indian J Pathol Microbiol 2012 | 8 | Varón | Características Cushing+ Ganancia peso+ Dolor abdominal | Hepatectomía derecha extendida | No | Éxitus 10 días por complicaciones postoperatorias |
| Ghodke, J Postgrad Med, 2012 | 9 | Varón | Dolor abdominal+ fiebre+ ictericia+ pérdida peso | Segmentectomía hepática | No determinado | Vivo 12 meses |
| Malowany, Pediatr Dev Pathol 2013 | 2 | Mujer | Incidental | Resección derecha | No determinado | No recurrencia |
| Procopio, World J Hepatol 2014 | 23 | Mujer | Distensión abdominal + dispepsia | Hepatectomía izquierda extendida | No | Vivo 21 meses |
| Samarghandi, Clin Nucl Med 2015 | 11 | Mujer | Ganancia peso+ aumento apetito+ dolor abdominal | Lóbulo derecho | No determinado | No determinado |
| Schaffer et al.6, Clin Imaging 2016 | 14 | Mujer | Distensión abdominal+ hinchazón mejillasSíndrome Cushing | Trasplante hepático (Lesión lóbulo hepático izquierdo) | QT PRE | Vivo 10 meses |
| Weeda et al.5, J Med Case Rep 2016 | 16 | Varón | Características Cushing+ ganancia peso+ distensión abdominal | Trisegmentectomía derecha e izquierda | No | Vivo 13 años |
| Khoshnam et al.2, Eur J Med Genet 2017 | 14 | Mujer | Características Cushing+ Hinchazón y dolor abdominal | Trasplante hepático (Lesión lóbulo hepático derecho) | QT PRE | Vivo |
| Tehseen et al.7, Pediatr Transplant 2017 | 13 | Mujer | Dolor abdominal+ distensión abdominalSíndrome Cushing | Trasplante hepático (Lesión lóbulo hepático derecho) | QT PRE | Vivo 28 meses |
| Garg et al.8, Indian J Nucl Med 2017 | 8 | Mujer | Pancitopenia | Resección hepática. Trasplante hepático | QT POST en recidiva | 2 meses recidiva ganglionar y ósea -->QT+RT Ósea |
| Meletani et al.9, World J Gastroenterol 2017 | 31 | Varón | Dolor abdominal+ pérdida de peso | Triseccionectomía derecha+ resección de caudado+ RF segmento II | QT POST | Recidiva local a 6 meses+ Nódulo presacro--> Quimioembolización +QT posterior (×4)Éxitus: 15 meses tras IQ |
| Tsuruta et al.4, World J Surg Oncol 2018 | 20 | Varón | Incidental | Hepatectomía derecha | QT POST | Éxitus 2 meses por recurrencia a nivel local y metástasis en ganglios linfáticos extrahepáticos--> Quimioembolización y RF |
| Olin et al.3, Int J Surg Case Rep 2020 | 15 | Mujer | Dolor abdominal | Trisegmentectomía derecha | No | Vivo 12 meses, sin recurrencia |
| Pérez, 2020 | 21 | Mujer | Asintomática | Triseccionectomía derecha | No | Vivo 6 meses, sin recurrencia |
POST: posterior a cirugía; PRE: previo a cirugía; QT: quimioterapia; RF: radiofrecuencia.
Respecto al diagnóstico, en la analítica destaca normalidad de la función hepática, así como de los marcadores tumorales habituales1,3, aunque se ha descrito elevación de la GGT en algún caso5 incluido el nuestro. En TAC y RM es característico observar una masa de gran tamaño, bien circunscrita, heterogénea, con calcificación densa y un margen macrolobulado1,3,4,6. El diagnóstico diferencial radiológico más común es el hepatoblastoma, seguido del HCF. Se ha descrito confirmación del diagnóstico mediante realización de biopsia preoperatoria3. Geramizadeh publicó una baja rentabilidad de la misma en una cohorte de 12 pacientes con CNSET, donde solo en tres casos (25%) se alcanzó el diagnostico25. Es inusual el uso de biopsia hepática en nuestro centro, solo reservada para dudas diagnósticas.
El estándar de tratamiento en los CNSET es la resección quirúrgica obteniendo márgenes libres1,3-5. La técnica usada ha variado desde resecciones parciales hasta trasplante hepático, lo que ocurrió en ocho casos, en función de la extensión y localización del tumor (tabla 1).
La quimioterapia (QT) se usó en el 38% de los casos de las series analizadas, cinco casos recibieron QT preoperatoria, sin mostrar efectos de reducción o necrosis en las pruebas de imagen o en las piezas. Doce pacientes recibieron QT postoperatoria, el 50% fue como tratamiento de la recidiva postcirugía (tabla 1). Los regímenes aplicados fueron similares a los del sarcoma o hepatoblastoma4-6. Hoy en día, no está claro su papel en la prevención ni tratamiento de la recidiva1,4,5. Tres de ellas fueron tratadas mediante radiofrecuencia (RF)4, solo Makhlouf describe un resultado exitoso con esta terapia.
El 80% (35/44) de los pacientes no presentaron recidiva de enfermedad. Esta se presentó en nueve pacientes con un intervalo desde dos meses hasta los 11 años4,8,9; preferentemente a nivel local, pero encontrándolo en múltiples localizaciones: ganglionar, pulmonar u óseas (tabla 1). El seguimiento descrito en la literatura varía desde dos meses hasta 22 años. Existe un 7% de pacientes fallecidos por la enfermedad y el 14% están vivos con recidiva (tabla 1).
El pronóstico es incierto, pero normalmente el crecimiento es lento y con bajo potencial maligno1,4,5. La mayoría de los casos tienen supervivencia a largo plazo después de la resección4 y con frecuencia permanecen libres de recidiva si los márgenes de resección son negativos3. Es necesario un seguimiento estrecho y mantenido en el tiempo, con analítica y estudios de imagen por el riesgo de recidiva a largo plazo2-5.