Estudiar el abordaje terapéutico del hipotiroidismo subclínico (HTS): frecuencia de instauración de tratamiento sustitutivo, motivos de inicio, dosis y duración, en la población mayor de 14 años del centro de salud.
Material y métodosEstudio observacional, longitudinal retrospectivo. Se incluyeron 1.156 pacientes con episodio T86 del CIAP en OMI. Excluidos: 10 duplicados, 180 sin criterios de inclusión o imposibilidad para recoger datos, 25 diagnosticados en otro laboratorio y 359 con hipotiroidismo clínico (HTC).
VariablesSexo, edad, cifra de hormona estimulante del tiroides (TSH) al diagnóstico y al iniciar tratamiento, última TSH recogida en la historia clínica (HC) si no tratado, TSH de confirmación diagnóstica, anticuerpos anti-TPO (ATA), presencia de astenia, bocio, síntomas neuropsiquiátricos, hipercolesterolemia; si hay HTS secundario; progresión a HTC; intervalo diagnóstico-inicio tratamiento, dosis de inicio y final, duración y motivos de la interrupción.
ResultadosSe incluyeron 582 pacientes: 508 mujeres. Edad media: 43,03 (de 15,97).
HTS tratado: 330 (56,7%); TSH al diagnóstico < 10: 81,6%; TSH media en tratados: 11,22 (de 10,49); ATA realizados: 315 (54%)+166 (52,7%); No consta recogido en HC. Astenia: 64%; bocio: 65%. El 67% no fueron tratados: normofunción espontánea. Dosis de inicio: 86% ≤ 50μg. Finales ≤ 50: 43%. Duración del tratamiento: 1-5 años, 41%; > 5 años, 40%. Inicio del tratamiento inmediato al diagnóstico, 38%. Permanecen tratados el 93%.
Variables que aumentan la probabilidad de instauración de tratamiento (regresión logística): cifra TSH (OR 32,5; IC 12,8-82,6); ATA+(OR 4,7; IC 2,8-7,7); astenia (OR 2,5; IC 1,5-4); Bocio (OR 3; IC 1,3-6,6).
ConclusionesLa decisión de tratar es generalmente adecuada, pero con frecuencia se cronifica un trastorno analítico instaurando tratamientos excesivamente prolongados sin intentos de retirada. Descuidamos la anamnesis y la exploración.
To study the therapeutic approach to subclinical hypothyroidism (HTS), the frequency of introducing replacement therapy, reasons for starting, doses, and duration, in the population over 14 years-old in a Primary Care Centre.
Material and methodsLongitudinal, retrospective observational study of 1156 patients with a hypothyroidism/myxedema episode (T86 in the International Classification of Primary Care (ICPC)) entered in the OMI program were studied. Excluded: 10 duplicates, 180 no inclusion criteria or inability to collect data, 25 diagnosed in another laboratory, 359 with clinical hypothyroidism (HTC).
MeasurementsSex, age, TSH value to diagnosis and initiate treatment, or latest TSH recorded in the clinical history (HC) if not treated, TSH diagnostic confirmation, antiTPO antibodies (ATAs), presence of fatigue, goitre, neuropsychiatric symptoms, raised cholesterol, if HTS secondary, progression to HTC, diagnostic-start treatment interval, initial and final dose, duration, reasons for discontinuation.
Results582 patients: 508 women. Mean age: 43.03 (sd 15.97).
HTS treated: 330 (56.7%); TSH at diagnosis < 10: 81.6%; Mean TSH treated: 11.22 (sd 10.49); Made ATAs performed: 315 (54%),+166 (52.7%); Fatigue not recorded in HC: 64%; Goitre: 65%. 67% untreated: returned to normal spontaneously. Starting dose: 86% ≤ 50μg. Final ≤ 50: 43%. Treatment duration: 1-5 years 41%; > 5 years 40%. Immediate treatment after diagnosis 38%. Remain treated 93%.
Variables that increase the likelihood of onset of treatment (Logistic Regression): TSH value (OR 32.5, CI 12.8- 82.6), ATAs+(OR 4.7, CI 2.8-7.7); Fatigue (OR 2.5, CI 1.5-4), Goitre (OR 3, CI 1.3-6.6).
ConclusionsThe decision to treat is generally adequate, but often becomes a chronic analytical disorder, because of unduly prolonged treatment without attempts to withdraw it. Clinical history and physical examination tend to be ignored.
El reemplazo hormonal en el hipotiroidismo subclínico (HTS) sigue siendo objeto de múltiples controversias, sin tener unas indicaciones claras y contrastadas ni para su inicio, ni para la dosis o duración en caso de llevarse a cabo1.
No está bien establecido el beneficio clínico de la sustitución hormonal, su relación coste-efectividad, ni sus repercusiones en la morbimortalidad1–3.
Entendemos el HTS como el estado en que se detecta un nivel sérico elevado de la hormona estimulante del tiroides (TSH), con valores normales de las hormonas tiroideas libres. Se puede acompañar de síntomas clínicos leves similares a los del hipotiroidismo clínico (HTC)1–3.
Su prevalencia puede variar entre el 3 y el 8% y en mujeres mayores de 60 años podría alcanzar el 20%4–6, aunque esta cifra se podría ver afectada por la elevación del límite superior del rango normal de TSH con la edad7. No hay estudios de prevalencia en la población española.
Hay riesgo de que progrese a HTC manifiesto, sobre todo en presencia de anticuerpos antiperoxidasa tiroidea (anti-TPO) y valores elevados de TSH5,8,9 (incidencia acumulada: 33-55%); si bien se puede dar una normalización espontánea de las cifras de TSH sin necesidad de tratamiento (37% en un estudio en población española)8–10.
Se ha estudiado ampliamente, y reafirmado con los más recientes metaanálisis, la relación del HTS con un mayor riesgo de enfermedad y mortalidad cardiovascular11–16, aunque esta última podría no estar aumentada en poblaciones de mayor edad17,18.
El HTS se asocia también con alteraciones del perfil lipídico19 y neuropsiquiátricas20.
Así pues, el tratamiento sustitutivo con L-tiroxina estaría sustentado en la mejoría de los síntomas, especialmente en caso de progresar a HTC; y el hipotético beneficio cardiovascular y sobre el perfil lipídico19,21,22, aunque también conlleva riesgo de hipertiroidismo iatrogénico (14-21%)2.
Sin embargo, los estudios de intervención en torno al beneficio y seguridad del reemplazo hormonal son escasos, con muchas limitaciones y resultados no concluyentes21–26.
Una revisión Cochrane de 200727, que incluyó 12 ensayos clínicos con 451 personas en periodos de 6 a 14 meses, concluye que la terapia de reemplazo no produjo mejoría en la supervivencia, ni reducción de la morbilidad cardiovascular. Tampoco encontró diferencias significativas en la calidad de vida ni síntomas entre los grupos de intervención, mejorando algunos parámetros del perfil lipídico y de la función ventricular izquierda.
Paneles de expertos han confeccionado recomendaciones para el tratamiento sustitutivo basadas en estudios observacionales1,2,28–30, indicándolo en caso de depresión, embarazo, infertilidad, niños, etiología autoinmunitaria, postratamientos quirúrgicos, con radioterapia o yodo radiactivo; con TSH ≥ 10, bocio, síntomas (astenia o déficit cognitivo) y dislipidemia. Con valores de TSH<10 se valoraría individualmente la presencia de síntomas, factores de riesgo cardiovascular, edad y riesgo de progresión a HTC.
La dosis de inicio sería de 1,6μg/kg/día ajustando a niños y ancianos, con incrementos progresivos no antes de 6 semanas hasta conseguir valores normales de TSH. La duración del tratamiento no está determinada, recomendándose intentar la retirada en 6-12 meses en caso de sospecha de hipotiroidismo transitorio28,29. Otros autores prefieren iniciar con dosis entre 25 y 75μg dependiendo de la edad y los valores de T4 y TSH, ajustando a las 8 semanas1.
Ante la poca evidencia, recomendaciones generales y posibilidad de actuaciones tan dispares, queríamos saber qué estábamos haciendo los médicos de familia en la consulta, cómo actuábamos en el día a día con los pacientes, cómo los tratábamos y manejábamos en general este trastorno.
Diseñamos esta investigación con el objetivo de conocer el abordaje terapéutico del HTS en nuestro medio: la frecuencia de instauración del tratamiento sustitutivo, sus características y los factores que lo determinan; evaluando el grado de adecuación a las recomendaciones actuales de práctica clínica.
Material y métodosTipo de estudio. Observacional. Longitudinal retrospectivo.
Población en estudio. Pacientes mayores de 14 años pertenecientes al Centro de Salud Cuzco, con el diagnóstico activo o inactivo en su historia clínica (HC) de hipotiroidismo subclínico (T86 del CIAP).
Criterios de inclusión. Pacientes en cuya HC se constate en el momento de establecer el diagnóstico, que presentaban valores de TSH por encima del rango superior definido por el laboratorio del Hospital Severo Ochoa (HSO) (entre 0,35 y 5,5 μU/ml) determinadas por quimioluminiscencia en un autoanalizador ABVIA-CENTUR de Siemens. Este valor de TSH se ha de acompañar necesariamente de valores normales de T4 (0,89-1,8ng/dl, en el laboratorio del HSO).
Criterios de exclusión. Pacientes que no cumplen criterios clínicos de HTS aunque conste en su HC dicho diagnóstico. Pacientes diagnosticados en laboratorios con valores de referencia diferentes. Pacientes en los que por diagnóstico en medicina privada, traslado a otros centros o fallecimiento, sea imposible recabar sus datos.
Se recogieron las siguientes variables: sexo, edad, edad en el momento del diagnóstico, HTS tratado en algún momento de su evolución, TSH en el momento del diagnóstico, tomando el valor de la segunda determinación confirmatoria en el caso de haberla; segunda TSH al diagnóstico: si se le realizó segunda determinación de TSH para confirmar el diagnóstico; TSH en el momento del tratamiento: cifras de TSH con las que se inicia el tratamiento sustitutivo, o última TSH recogida en la HC en el caso de no haber sido tratado; ATA+al diagnóstico: valores de anticuerpos anti-TPO superiores al rango normal definido en el laboratorio (0-60 UI/ml); cifras de ATA: primera cifra que conste en la HC en cualquier momento de la evolución; astenia en el momento del diagnóstico, referida en la HC espontáneamente o por anamnesis, o que conste como episodio, previa al inicio del tratamiento; síntomas neuropsiquiátricos en el momento del diagnóstico: depresión, ansiedad, nerviosismo, pérdida de memoria, referidos en la HC espontáneamente o por anamnesis, o que consten como episodio, previos al tratamiento. Hipercolesterolemia en la HC; HTS secundario: antecedentes de tratamientos con yodo radiactivo o radioterapia, o de cirugía tiroidea, como causas del HTS; bocio: presencia de bocio a la exploración física, progresión a HTC como motivo de inicio de tratamiento; dosis de levotiroxina de inicio del tratamiento, dosis finales: dosis actuales si sigue con tratamiento o finales si se suspendió, duración del tratamiento: tiempo que lleva en tratamiento o durante el cual lo tuvo, tiempo transcurrido entre el diagnóstico y el inicio del tratamiento sustitutivo, causas de interrupción del tratamiento si la hubo.
Elaboramos un Indicador de Calidad que recoge la realización de una segunda determinación de TSH junto con ATA, para confirmar el diagnóstico y su etiología autoinmune, previa al tratamiento.
Y una nueva variable que considerara adecuada la instauración de tratamiento sustitutivo cuando se iniciaba con valores de TSH ≥ 10 o < 10 pero con ATA+o presencia de astenia, o síntomas neuropsiquiátricos, o bocio, o hipercolesterolemia, o HTS secundario o progresión a HTC.
Los datos se obtuvieron de la HC informatizada (OMI-AP) y/o de la HC de papel.
Los parámetros biológicos fueron los proporcionados por nuestro laboratorio de referencia del HSO.
AnálisisSe determinaron las frecuencias relativas y absolutas de las variables cualitativas; y los estadísticos de las cuantitativas.
Se estudió la asociación entre HTS tratado y: sexo, edad, cifras de TSH al diagnóstico y al tratamiento, ATA+, cifras de ATA, astenia, síntomas neuropsiquiátricos, hipercolesterolemia, HTS secundario, progresión a HTC, bocio; y la Asociación entre las dosis de levotiroxina de inicio y las mismas variables; utilizando los tests de ji al cuadrado y de la t de Student.
Se utilizó un modelo de regresión logística para identificar las variables asociadas a la decisión de tratamiento, controlando los posibles efectos de confusión. Se trabajó con SPSS 15.0.
ResultadosNuestro centro de salud, de población urbana, sito en un municipio del sur de Madrid de unos 200.000 habitantes, atiende a 24.472 ciudadanos. La población mayor de 14 años es de 21.220 personas, 10.678 mujeres y 10.542 varones.
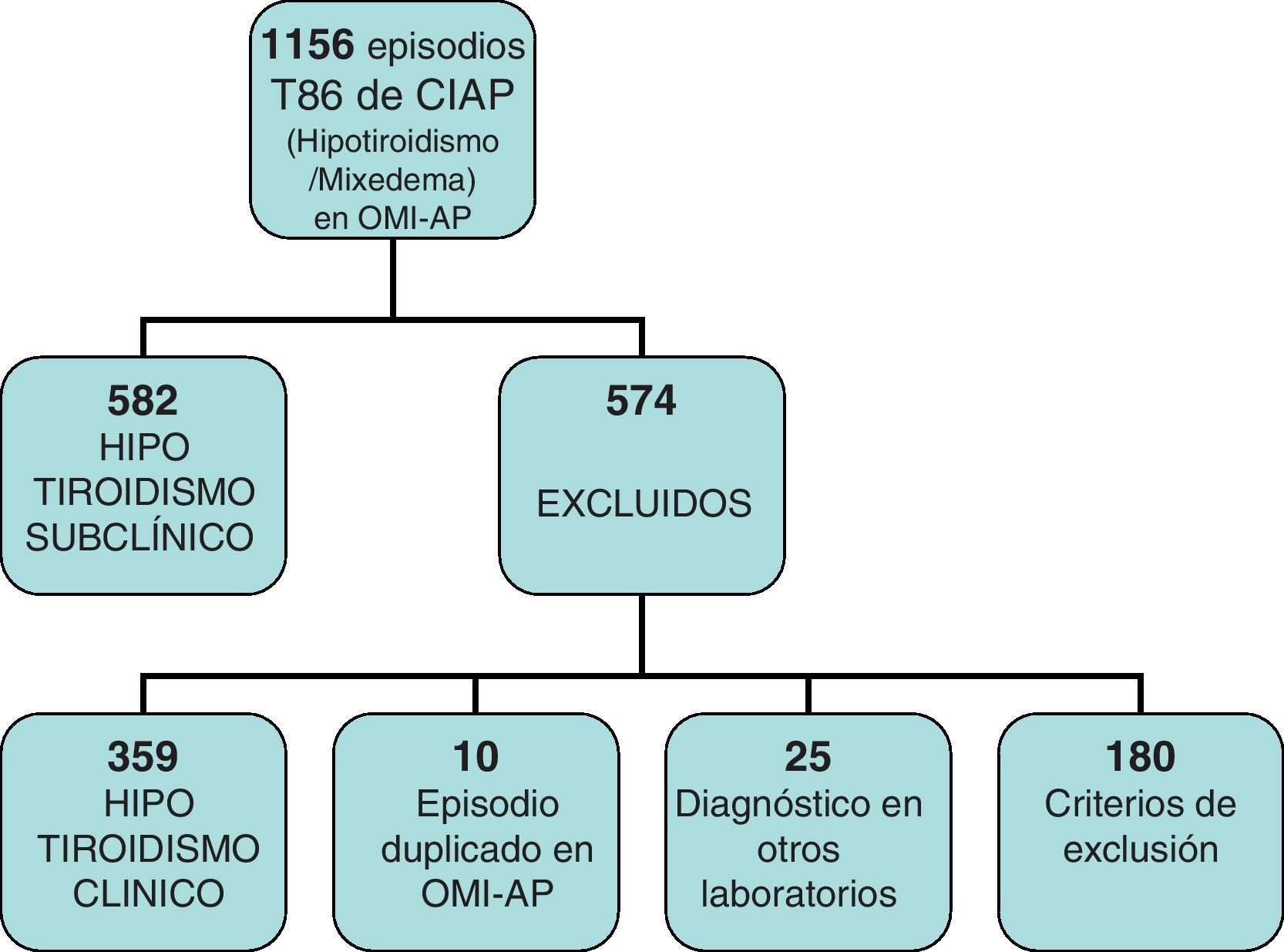
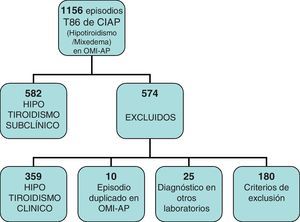
Estudiamos en total 1.186 historias en las que figuraba el episodio T86 del CIAP, bajo el que se agrupan sin diferenciar los distintos tipos de hipotiroidismo.
De ellas, 359 eran hipotiroidismos clínicos, 180 las excluimos por no cumplir criterios de inclusión o por imposibilidad para recoger los datos de su HC, 10 por episodio duplicado en OMI y 25 por ser diagnosticadas en laboratorios con otros niveles de referencia (fig. 1).
Recogimos datos de 582 historias, 508 mujeres y 74 varones, lo que vendría a suponer en nuestro centro una prevalencia del HTS del 2,74%, detectada entre la población que acude a consultar y a la que se le solicita una determinación de TSH en la analítica.
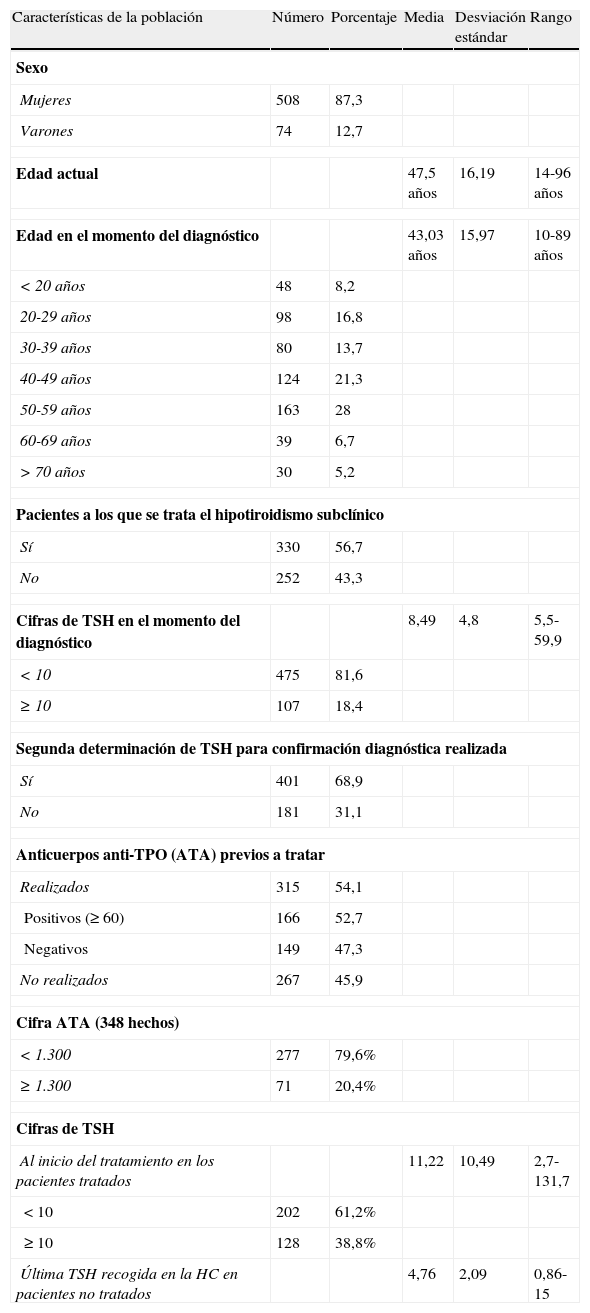
En el momento del diagnóstico, la edad media era de 43,03 (de 15,97), con un rango de 10 a 89 años. La agrupación por décadas y otras características de la población están reflejadas en la tabla 1.
Características de la población (n=582)
| Características de la población | Número | Porcentaje | Media | Desviación estándar | Rango |
| Sexo | |||||
| Mujeres | 508 | 87,3 | |||
| Varones | 74 | 12,7 | |||
| Edad actual | 47,5 años | 16,19 | 14-96 años | ||
| Edad en el momento del diagnóstico | 43,03 años | 15,97 | 10-89 años | ||
| < 20 años | 48 | 8,2 | |||
| 20-29 años | 98 | 16,8 | |||
| 30-39 años | 80 | 13,7 | |||
| 40-49 años | 124 | 21,3 | |||
| 50-59 años | 163 | 28 | |||
| 60-69 años | 39 | 6,7 | |||
| > 70 años | 30 | 5,2 | |||
| Pacientes a los que se trata el hipotiroidismo subclínico | |||||
| Sí | 330 | 56,7 | |||
| No | 252 | 43,3 | |||
| Cifras de TSH en el momento del diagnóstico | 8,49 | 4,8 | 5,5-59,9 | ||
| < 10 | 475 | 81,6 | |||
| ≥ 10 | 107 | 18,4 | |||
| Segunda determinación de TSH para confirmación diagnóstica realizada | |||||
| Sí | 401 | 68,9 | |||
| No | 181 | 31,1 | |||
| Anticuerpos anti-TPO (ATA) previos a tratar | |||||
| Realizados | 315 | 54,1 | |||
| Positivos (≥ 60) | 166 | 52,7 | |||
| Negativos | 149 | 47,3 | |||
| No realizados | 267 | 45,9 | |||
| Cifra ATA (348 hechos) | |||||
| < 1.300 | 277 | 79,6% | |||
| ≥ 1.300 | 71 | 20,4% | |||
| Cifras de TSH | |||||
| Al inicio del tratamiento en los pacientes tratados | 11,22 | 10,49 | 2,7-131,7 | ||
| < 10 | 202 | 61,2% | |||
| ≥ 10 | 128 | 38,8% | |||
| Última TSH recogida en la HC en pacientes no tratados | 4,76 | 2,09 | 0,86-15 | ||
El HTS se trató en 330 casos (56,7%) frente a 252 (43,3%) que no tuvieron tratamiento en ningún momento de su evolución.
La cifra de TSH en el momento del diagnóstico fue < 10 en 475 casos (81,6%) mientras en 107 (18,4%) fue ≥ 10, con una media de 8,49 (de 4,8; rango 5,5-59,9).
El valor medio de TSH en los casos en que se instauró tratamiento, al iniciarlo, fue de 11,22 (de 10,49; rango 2,7-131,77), tomando valores < 10 en 202 casos (61%) y ≥ 10 en 128 (39%).
La última TSH recogida en la historia en los casos en que no se decidió tratar tuvo de media 4,76 (de 2,09; rango 0,86-15,04).
De los casos no tratados (252) evolucionaron espontáneamente a normofunción el 67% (169).
Se realizaron anticuerpos anti-TPO (ATA) antes de iniciar el tratamiento a 315 pacientes (54%), siendo positivos en 166 casos, con una frecuencia, por tanto, de trastorno autoinmunitario subyacente del 52,7%.
En cualquier otro momento de la evolución se le realizaron a 33 pacientes más (348 en total), siendo ≥ 1.300 solo en 71 casos (20,4%).
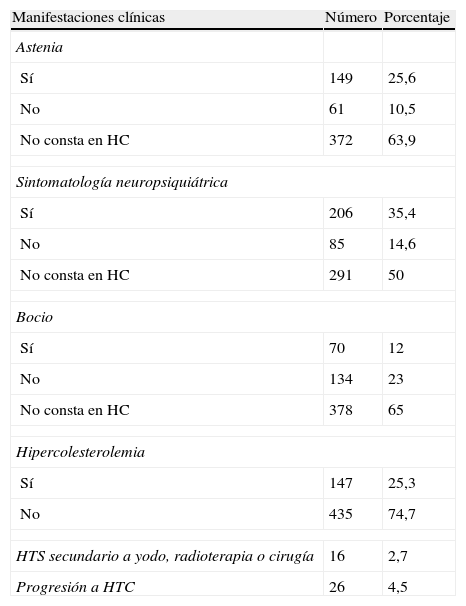
Las características clínicas de los pacientes están recogidas en la tabla 2.
Características clínicas (n=582)
| Manifestaciones clínicas | Número | Porcentaje |
| Astenia | ||
| Sí | 149 | 25,6 |
| No | 61 | 10,5 |
| No consta en HC | 372 | 63,9 |
| Sintomatología neuropsiquiátrica | ||
| Sí | 206 | 35,4 |
| No | 85 | 14,6 |
| No consta en HC | 291 | 50 |
| Bocio | ||
| Sí | 70 | 12 |
| No | 134 | 23 |
| No consta en HC | 378 | 65 |
| Hipercolesterolemia | ||
| Sí | 147 | 25,3 |
| No | 435 | 74,7 |
| HTS secundario a yodo, radioterapia o cirugía | 16 | 2,7 |
| Progresión a HTC | 26 | 4,5 |
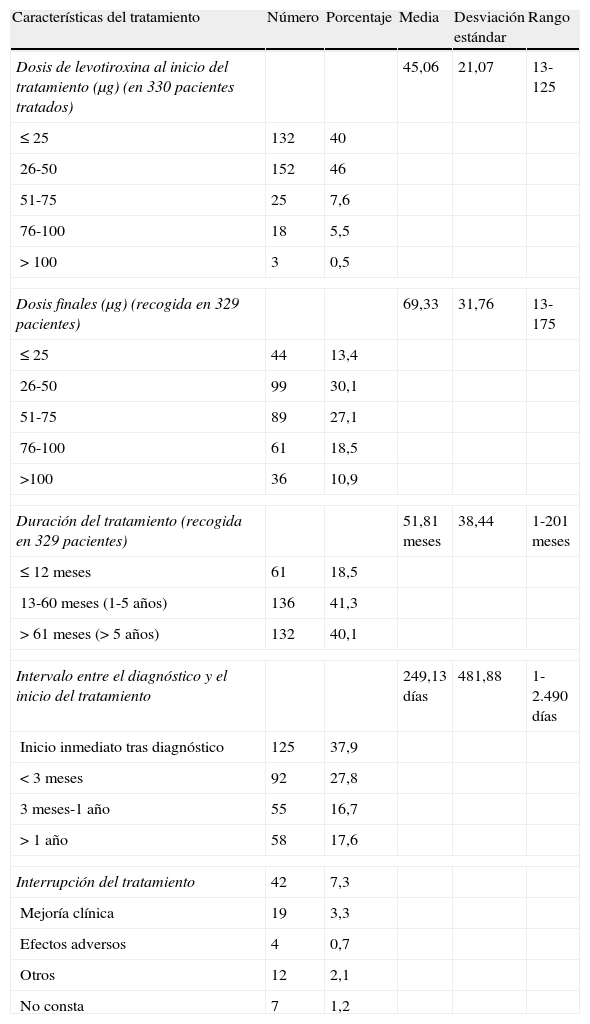
En cuanto al manejo terapéutico (tabla 3), el 86% de los 330 casos tratados se iniciaron con dosis de levotiroxina ≤ 50μg, con una media de 45,06 (de 21,07; rango 13-125), siendo la dosis más frecuente 50.
Características del tratamiento
| Características del tratamiento | Número | Porcentaje | Media | Desviación estándar | Rango |
| Dosis de levotiroxina al inicio del tratamiento (μg) (en 330 pacientes tratados) | 45,06 | 21,07 | 13-125 | ||
| ≤ 25 | 132 | 40 | |||
| 26-50 | 152 | 46 | |||
| 51-75 | 25 | 7,6 | |||
| 76-100 | 18 | 5,5 | |||
| > 100 | 3 | 0,5 | |||
| Dosis finales (μg) (recogida en 329 pacientes) | 69,33 | 31,76 | 13-175 | ||
| ≤ 25 | 44 | 13,4 | |||
| 26-50 | 99 | 30,1 | |||
| 51-75 | 89 | 27,1 | |||
| 76-100 | 61 | 18,5 | |||
| >100 | 36 | 10,9 | |||
| Duración del tratamiento (recogida en 329 pacientes) | 51,81 meses | 38,44 | 1-201 meses | ||
| ≤ 12 meses | 61 | 18,5 | |||
| 13-60 meses (1-5 años) | 136 | 41,3 | |||
| > 61 meses (> 5 años) | 132 | 40,1 | |||
| Intervalo entre el diagnóstico y el inicio del tratamiento | 249,13 días | 481,88 | 1-2.490 días | ||
| Inicio inmediato tras diagnóstico | 125 | 37,9 | |||
| < 3 meses | 92 | 27,8 | |||
| 3 meses-1 año | 55 | 16,7 | |||
| > 1 año | 58 | 17,6 | |||
| Interrupción del tratamiento | 42 | 7,3 | |||
| Mejoría clínica | 19 | 3,3 | |||
| Efectos adversos | 4 | 0,7 | |||
| Otros | 12 | 2,1 | |||
| No consta | 7 | 1,2 | |||
Las dosis finales, recogidas en 329 casos, fueron más elevadas, solo el 43% permaneció con ≤ 50, siendo la media 69,33 (de 31,76).
La duración del tratamiento, recogida en 329 casos, fue entre uno y 5 años para el 41% y superior a 5 años en el 40%.
El intervalo entre el diagnóstico y el inicio del tratamiento fue inferior al mes en el 53%, siendo inmediato al diagnóstico en 125 casos (38%); y superior al año solo en el 17,6%.
Se constató interrupción del tratamiento tan solo en 42 casos, permaneciendo en tratamiento en el momento de recoger los datos el 93% de los pacientes. Los motivos de interrupción fueron: mejoría clínica en 19, efectos adversos en 4, otros (incumplimiento terapéutico, retirada en atención especializada) en 12, y no constan en 7 casos.
El indicador de calidad que recoge la realización de una segunda determinación de TSH junto con ATA, para confirmar el diagnóstico y previa al tratamiento, se cumple en 258 casos (44,3% de las 582 historias).
La adecuación del tratamiento a las recomendaciones de práctica clínica se produjo en 301 casos (91,2%).
La dosis empleada para iniciar el tratamiento sustitutivo (agrupada en tramos de 25μg) se asoció significativamente con la cifra de TSH al diagnóstico y al tratamiento (< 10 o ≥ 10), la presencia de sintomatología neuropsiquiátrica y de bocio.
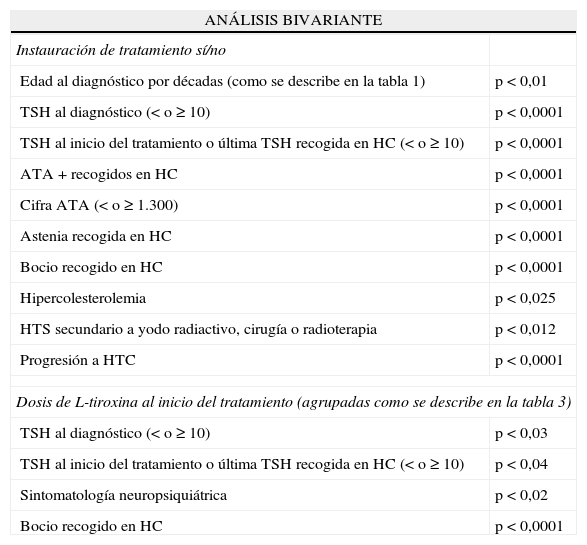
La instauración o no de tratamiento sustitutivo se asoció significativamente con la edad al diagnóstico agrupada en décadas, la cifra de TSH al diagnóstico y al tratamiento o última cifra recogida en historia (< o ≥ 10); con tener ATA+ la cifra de ATA (< o ≥ 1.300), la presencia de astenia, bocio, hipercolesterolemia, HTS secundario y progresión a HTC (tabla 4).
Análisis bivariante: significación estadística de las asociaciones con el test de ji al cuadrado
| ANÁLISIS BIVARIANTE | |
| Instauración de tratamiento sí/no | |
| Edad al diagnóstico por décadas (como se describe en la tabla 1) | p<0,01 |
| TSH al diagnóstico (< o ≥ 10) | p<0,0001 |
| TSH al inicio del tratamiento o última TSH recogida en HC (< o ≥ 10) | p<0,0001 |
| ATA+recogidos en HC | p<0,0001 |
| Cifra ATA (< o ≥ 1.300) | p<0,0001 |
| Astenia recogida en HC | p<0,0001 |
| Bocio recogido en HC | p<0,0001 |
| Hipercolesterolemia | p<0,025 |
| HTS secundario a yodo radiactivo, cirugía o radioterapia | p<0,012 |
| Progresión a HTC | p<0,0001 |
| Dosis de L-tiroxina al inicio del tratamiento (agrupadas como se describe en la tabla 3) | |
| TSH al diagnóstico (< o ≥ 10) | p<0,03 |
| TSH al inicio del tratamiento o última TSH recogida en HC (< o ≥ 10) | p<0,04 |
| Sintomatología neuropsiquiátrica | p<0,02 |
| Bocio recogido en HC | p<0,0001 |
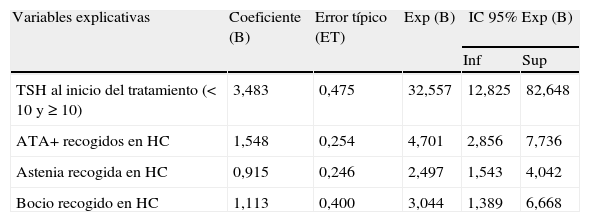
En la regresión logística las variables explicativas resultantes fueron: TSH al tratamiento, ATA+, astenia y bocio.
Una cifra de TSH ≥ 10 incrementó la posibilidad de tratamiento 32 veces. La positividad de los ATA (HTS autoinmune) 4,7 veces; la presencia de bocio recogida en la HC 3 veces; y la de astenia 2,5 veces (tabla 5).
Análisis multivariante. Regresión logística
| Variables explicativas | Coeficiente (B) | Error típico (ET) | Exp (B) | IC 95% Exp (B) | |
| Inf | Sup | ||||
| TSH al inicio del tratamiento (< 10 y ≥ 10) | 3,483 | 0,475 | 32,557 | 12,825 | 82,648 |
| ATA+recogidos en HC | 1,548 | 0,254 | 4,701 | 2,856 | 7,736 |
| Astenia recogida en HC | 0,915 | 0,246 | 2,497 | 1,543 | 4,042 |
| Bocio recogido en HC | 1,113 | 0,400 | 3,044 | 1,389 | 6,668 |
Variable dependiente: probabilidad de tratamiento (instauración de tratamiento sí/no).
N = 575.
R2 de Nagelkerke = 0,453.
Prueba de Hesmer y Lemeshow = 0,941.
Resulta llamativo que un trastorno analítico que ni siquiera tiene una clara correlación clínica acabe convirtiéndose en un trastorno crónico para un elevado porcentaje de pacientes a los que diagnosticamos (56,7% de los casos), y ponemos un tratamiento prácticamente indefinido. De hecho, el 93% de los pacientes a los que se les había iniciado, seguían en tratamiento, con una duración media de más de 4 años.
Aunque el inicio de la sustitución hormonal pueda estar correctamente indicado en la gran mayoría (91%) de nuestros pacientes, con arreglo a las recomendaciones actuales de práctica clínica1,2,28–30, lo convertimos en un tratamiento prácticamente crónico sin hacer intentos de retirada.
Esto parece aún más importante tras constatar que entre los HTS no tratados, el 67% evolucionaron espontáneamente a normofunción.
Es tranquilizador, sin embargo, que no parezca haber iatrogenia, habiéndose recogido efectos adversos en solo 4 pacientes.
No hemos encontrado apenas estudios que describan la práctica clínica en relación con el reemplazo hormonal del HTS en nuestro medio, la atención primaria, que además es donde se diagnostica preferentemente este trastorno, aunque su manejo se comparta en mayor medida con la atención especializada31. Los médicos de atención primaria de Canadá responden en un estudio a un cuestionario de actuación ante situaciones concretas32. Hay otro estudio de investigación cualitativa con grupos focales de discusión acerca del diagnóstico y manejo práctico entre médicos generales de Nueva Zelanda33. En nuestro país se ha descrito el perfil del paciente con HTS, similar al de nuestra población, y los motivos del profesional para solicitar la función tiroidea31,34.
Otro aspecto llamativo del estudio es la escasa recogida en la HC de datos que parecen relevantes para hacer una valoración clínica antes de tomar una decisión trascendente para el paciente como el hecho de instaurar un tratamiento cuyo beneficio clínico no tiene una clara evidencia. En el 64% de los pacientes no se recoge la presencia de astenia. Y hasta en un 65% de los pacientes no se ha explorado el tiroides o no consta absolutamente nada en la HC sobre la presencia o no de bocio.
Es destacable el hecho de que en más de la mitad de los casos (55,7%) no se sigan las recomendaciones para la confirmación diagnóstica, repitiendo la determinación de TSH en una segunda analítica junto con los ATA para conocer la etiología autoinmune28–30, que se da en el 52% de los casos estudiados, similar a la de otros estudios en España31.
Esta misma precipitación en el diagnóstico se refleja también en el intervalo entre el diagnóstico y el inicio del tratamiento, que en un 38% de los casos se hace en el mismo momento del diagnóstico, siendo la media de unos 8 meses.
Somos, sin embargo, prudentes en cuanto a las dosis con que lo iniciamos. Lejos de dosis iguales a las recomendadas para el HTC de 1,6μg/kg/día, empezamos con dosis ≤ 50μg en el 86% de los casos, aunque al final de nuestro registro solo el 43% permanecieran con dichos niveles.
El estudio tiene la limitación derivada de la obtención de datos a partir de la HC informatizada o de papel, pues la calidad del registro de los diferentes profesionales podría afectar a la calidad de los datos.
Para concluir, pensamos que aunque la instauración de tratamiento sustitutivo se adecua en la gran mayoría a las recomendaciones de práctica clínica más relevantes, tendemos a convertir el HTS en una enfermedad crónica, al mantener tratamientos excesivamente prolongados sin intentos de retirada.
El diagnóstico en la mitad de los casos es precipitado y el inicio del tratamiento precoz, sin esperar la evolución de un trastorno que puede remitir espontáneamente en un gran porcentaje. Y descuidamos en su manejo la anamnesis y exploración tiroidea.
Nuestra decisión de instaurar tratamiento parece estar determinada por los parámetros claves referidos en la evidencia científica de que disponemos: cifra de TSH, HTS autoinmune, clínicamente sintomático o con presencia de bocio.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declara no tener ningún conflicto de intereses.
A Marisa Rogero, que tuteló y revisó todo el desarrollo del trabajo.
A la Unidad Docente Oeste, por su ayuda en el análisis estadístico y sus observaciones.
Este trabajo ha sido aprobado por la Comisión Local de Investigación Oeste del Instituto Madrileño de Salud (IMSALUD).