INTRODUCCIÓN
La recidiva local constituye el talón de Aquiles de la cirugía conservadora por cáncer de mama.
Existe consenso acerca de que el factor pronóstico más importante de control local de la enfermedad es la realización de una correcta resección quirúrgica, y que la forma estándar de evaluarla es la valoración de los márgenes quirúrgicos. De modo que si existen células neoplásicas en el margen, la probabilidad de encontrar tumor residual en el tejido adyacente a la cavidad tumoral es mayor y sería necesaria una segunda cirugía1.
Otros elementos que podrían tener efecto en la tasa de recurrencia local del cáncer de mama tras terapia conservadora incluyen el grado tumoral, la edad y la presencia de invasión linfovascular2,3. Su importancia está por determinar y no deberían considerarse en la actualidad contraindicaciones al tratamiento conservador.
La asociación entre la afectación de los márgenes quirúrgicos y la recurrencia local no está clara, debido a que la mayoría de los numerosos estudios publicados son retrospectivos, poco homogéneos y no adoptan una definición uniforme acerca de cuál sería el margen libre adecuado4,5.
Cabe preguntarse cuál es el margen óptimo de tejido peritumoral macroscópicamente sano que debe resecarse en la cirugía y la relación existente entre los márgenes de resección y la tasa de recurrencia local de la enfermedad.
OBJETIVOS
− Análisis de los márgenes de resección tras las tumorectomías practicadas en pacientes con cáncer de mama.
− Estudio del tumor residual en estas tumorectomías.
− Definir la distancia idónea del tumor al margen, a partir de la cual la probabilidad de dejar tumor residual en la mama restante sea despreciable.
− Evitar, de esta forma, segundos procedimientos quirúrgicos.
MATERIAL Y MÉTODOS
Este análisis incluye el estudio de 163 pacientes con diagnóstico de carcinoma de mama invasivo en estadios I-II, intervenidas en el Departamento de Obstetricia y Ginecología del Hospital 12 de Octubre durante los años 2002 y 2003.
Se ha excluido a las pacientes operadas tras quimioterapia adyuvante por carcinoma localmente avanzado y aquellas con historia de cáncer de mama ipsolateral (recidivas o segundos tumores primarios).
La recogida de la información se ha realizado de forma retrospectiva, y se han obtenido datos de las historias clínicas, protocolos quirúrgicos e informes de anatomía patológica de las piezas de resección correspondientes a las 185 pacientes incluidas.
Analizamos las siguientes variables: edad, tamaño tumoral, grado y tipo histológicos, tipo de cirugía inicial, frecuencia de afectación marginal, reescisión en función de la afectación de los bordes quirúrgicos y tumor residual.
Para la confección de la base de datos y el análisis estadístico se utilizó el programa SPSS versión 11.0. Las variables incluidas en el análisis fueron de carácter categórico. Las pruebas de asociación de variables se realizaron mediante la corrección de continuidad de Yates para la prueba de χ2 o la prueba exacta de Fisher cuando el número de casos así lo requirió. Se consideró como nivel de significación estadística un valor de p < 0,05. En los casos en que el análisis no alcanzó la significación estadística, pero los datos mostraban tendencia, así se expuso.
RESULTADOS
La edad media en el diagnóstico fue de 61,6 años (intervalo, 27-85).
El tamaño tumoral, según la división establecida en la clasificación TNM:
− T1 (≤ 2 cm): 48%.
− T2 (2-5 cm): 43,2%.
− T3 (> 5 cm): 5,4%.
− No mensurable (pieza fragmentada): 3,2%.
Tipo histológico: ductal (64,9%); lobulillar (17,3%); tubular (7,6%); coloide (3,2%); medular típico (0,5%); papilar (1,1%); apocrino (0,5%); mixto, ductal-lobulillar (2,7%), y otros (2,1%).
Grado histológico (en el caso de carcinomas ductales, n = 147): GI: 37,4% (55); GII: 34% (50), y GIII: 27,9% (41).
Tipo de cirugía inicial
En este trabajo analizamos 163 casos (88,1%) con las siguientes características:
− Primeros tiempos quirúrgicos de las intervenciones con carácter diagnóstico: biopsias con arpón en lesiones no palpables y biopsias intraoperatorias (BIO) (en las cuales la ampliación se realizó en el mismo acto operatorio).
− Biopsias diferidas en nódulos palpables.
− Tumorectomías acompañadas de linfadenectomías con diagnóstico previo de carcinoma, obtenido mediante punción con aguja gruesa (PAG).
Se excluyeron del estudio 22 casos de mastectomías iniciales (con diagnóstico previo de carcinoma mediante PAG): (11,9 %), puesto que en éstas no se podía valorar los bordes quirúrgicos peritumorales, pues la cirugía final no era radical.
Todas las piezas quirúrgicas se remitieron al servicio de anatomía patológica marcadas con hilos de sutura para posibilitar la orientación de sus bordes.
Frecuencia de afectación marginal en las piezas de resección
En la tabla 1 aparecen las tasas globales de afectación marginal. En los 4 casos con márgenes no especificados por el servicio de anatomía patológica, el diagnóstico se realizó con una BIO, y se realizó mastectomía en el mismo acto quirúrgico. El tratamiento radical había sido indicado de antemano en caso de confirmarse el diagnóstico de malignidad.
Extensión de la afectación en caso de márgenes positivos. En 83 pacientes sometidas a una primera cirugía no radical, se encontró tumor en los márgenes de resección quirúrgica. La afectación tumoral del borde de la pieza fue focal en 29 pacientes (34,9%) y extensa en otras 52 (62,7%). En 2 casos (2,4%), la descripción histológica no informaba sobre el tipo de afectación.
Distancia tumoral al borde en casos con márgenes de resección libres. En 76 de estas pacientes sometidas a una primera cirugía no radical, los márgenes de resección quirúrgica resultaron libres de tumor. La distancia del tumor al margen quirúrgico se distribuyó según se muestra en la tabla 2.
Reescisiones en función de la afectación marginal
a) En los 4 casos en los que no se especificaban las dimensiones de la afectación marginal tras el análisis de la pieza obtenida en la BIO se realizó una mastectomía. Previamente, se había informado a las 4 pacientes sobre el tratamiento quirúrgico definitivo.
b) En los casos con márgenes afectados (n = 83) se completó el primer tiempo quirúrgico con una reescisión en el 94%.
En el 6% restante (5 pacientes) no se reintervino. Los motivos de no realizar una segunda cirugía para conseguir márgenes libres fueron los siguientes:
− Paciente de 66 años con margen posterior afectado. En la tumorectomía se había incluido la fascia del músculo pectoral mayor, y se comprobó la presencia de células tumorales. Así se comunicó en sesión conjunta a los servicios de oncología médica y radioterápica, y se decidió no ampliar. Se completó el tratamiento local con radioterapia.
− Paciente de 83 años con diagnóstico histológico de carcinoma lobulillar. Rechazó la reintervención. Se indicó hormonoterapia adyuvante (se trataba de un tumor con receptores positivos).
− Los casos tercero, cuarto y quinto correspondían a 3 pacientes ancianas de 84, 85 y 84 años, respectivamente. Por motivos anestésicos, a los que se sumó la decisión de las familias, se desestimó la reintervención. Se instauró hormonoterapia, puesto que se trataba, en los 3 casos, de tumores con receptores (RE y RP) positivos.
c) Cuando el margen se informó como libre (76 pacientes, 46,6%) tras el primer tiempo quirúrgico se completó la cirugía con:
− Reescisión en el 51,3% (39 casos).
− Sin reescisión en el 48,7%.
La ampliación de los márgenes siguieron, en algunos casos, a las BIO, que informaban de un margen cercano y el tipo de análisis por congelación no permitió establecer, con exactitud de milímetros, la distancia tumoral al borde de la pieza. En otras ocasiones, la reescisión se realizó a continuación de una biopsia guiada con arpón y el envío de la pieza a rayos X. Desde este servicio indicaban, tras el examen radiológico de ésta, si existía un borde quirúrgico muy cercano a la lesión, sin poder concretar más en relación con las dimensiones del borde quirúrgico.
No hay, pues, un criterio unánime a la hora de ampliar, porque muchas veces se hace in situ, sobre la marcha, tras la BIO o la biopsia con arpón en el quirófano.
Tras el estudio anatomopatológico definitivo, en ocasiones, se ampliaba con un margen menor a 0,2-0,3 cm, dependiente de las características de la paciente, del tipo y grado histológicos, y del tamaño tumoral.
Tipo de ampliación en función del estado de los márgenes. Como ya hemos comentado, en las 4 pacientes con márgenes no especificados, se completó la cirugía con una mastectomía (con linfadenectomía axilar).
Centrándonos en los márgenes con afectación tumoral, la mastectomía fue el tratamiento quirúrgico definitivo en el 53,8%. En el 46,2% restante se programó una ampliación de tumorectomía. En todos los casos con linfadenectomía axilar.
Tras unos márgenes quirúrgicos libres, realizamos cirugía conservadora en el 59% de los casos. La mastectomía fue el tratamiento final en el 41%. Se asoció linfadenectomía axilar.
La diferencia entre el número de mastectomías indicadas en el caso de márgenes afectados y libres no fue estadísticamente significativa, aunque existe tendencia al incremento en la práctica de mastectomías tras el hallazgo de un borde de resección afectado (fig. 1).
Incidencia de tumor residual en función de la afectación de los márgenes
Del total de las 121 reescisiones practicadas, en el 59% hubo ausencia de malignidad residual. En 35 (29%) se informó de la presencia de carcinoma infiltrante residual. En 15 (12%) se aisló carcinoma intraductal in situ (CDIS).
La incidencia global de carcinoma residual (infiltrante e in situ), fue del 41,3% (50 casos).
A continuación, exponemos la relación hallada en nuestro estudio entre la presencia/ausencia de tumor residual en las piezas de ampliación con la afectación marginal.
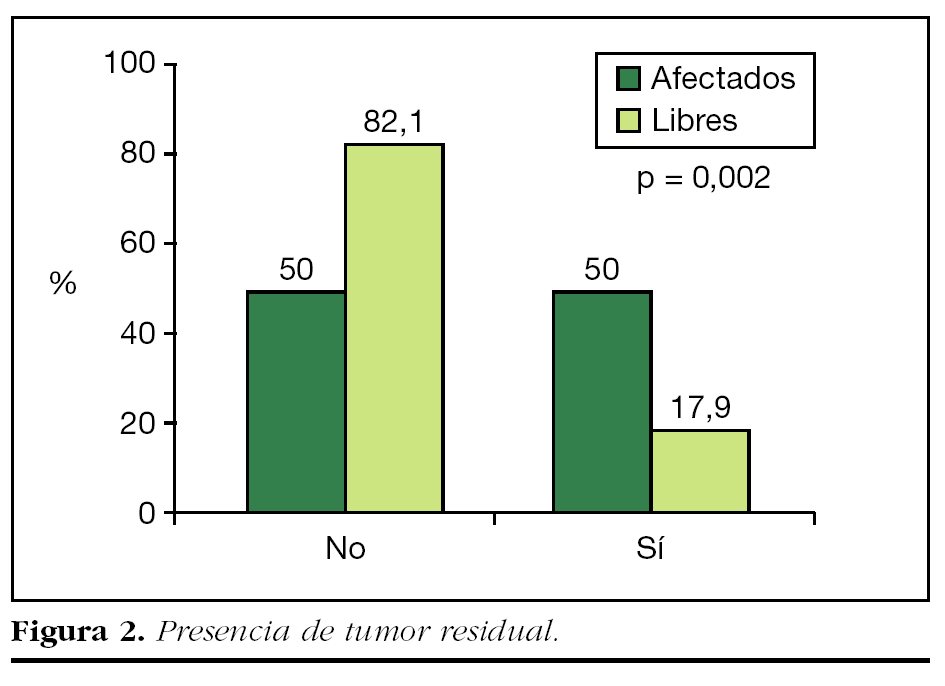
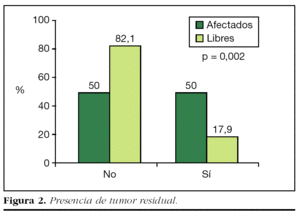
Se detectó la presencia de tumor residual en 7 (17,9%) de los 39 casos de reescisión con márgenes libres, y las restantes 32 (82,1%) piezas no presentaban tumor residual. Por el contrario, la incidencia de tumor residual en las ampliaciones realizadas tras la cirugía inicial con afectación de bordes fue del 50% (39) (fig. 2).
La diferencia observada en la incidencia de tumor residual entre las pacientes cuya primera cirugía mostró márgenes afectados y aquellas con márgenes libres resultó estadísticamente significativa (p = 0,002).
Márgenes afectados: relación entre el tumor residual hallado y el tipo de afectación. Se realizaron 78 reescisiones por márgenes afectados. De éstas, en 2 casos no se conocía el tipo de afectación. En 27 casos fue focal y se consideró extensa en los 49 restantes.
La presencia de tumor residual en el caso de una afectación extensa fue del 53,5%, y cuando fue focal, del 44%. La diferencia no alcanzó la significación estadística.
Márgenes libres: relación entre el tumor residual y la distancia tumoral al borde de la pieza. El número total de ampliaciones realizadas tras cirugía inicial con bordes libres de tumor fue de 39. De éstas, el análisis anatomopatológico detectó la presencia de tumor residual en 7 casos (17,9%), en 6 de los cuales la distancia tumoral al borde fue menor de 0,2 cm.
La tendencia de la incidencia de tumor residual en relación con la distancia tumoral al borde de la pieza quirúrgica inicial puede observarse en la tabla 3.
A pesar de que la diferencia en la incidencia de tumor residual entre los distintos rangos no resulta significativa, se observa una clara tendencia: menor incidencia de tumor residual cuanto mayor es la distancia tumoral al borde de la pieza.
Se ampliaron:
− El 63,2% en caso de márgenes < 0,1 cm.
− El 72,2% en caso de márgenes de 0,1-0,2 cm.
− El 40,7% en caso de márgenes de 0,2-0,5 cm.
− El 37,5% en caso de márgenes de 0,5-1 cm.
No se reintervino en ningún caso con márgenes mayores de 1 cm.
DISCUSIÓN
El factor pronóstico más importante para el control local de la enfermedad es la realización de una correcta resección quirúrgica, y la forma estándar de evaluarla constituye la valoración de los márgenes.
Se han propuesto diversos métodos para la valoración del estado de los márgenes quirúrgicos. El más comúnmente utilizado consiste en la tinción con tinta china de los bordes de la pieza quirúrgica y el análisis microscópico de éstos en busca de células malignas6. Este proceso solamente es posible si la pieza se remite correctamente orientada mediante suturas y puede realizarse de forma diferida o intraoperatoria en cortes obtenidos por congelación.
Todas las piezas quirúrgicas en nuestro trabajo fueron remitidas, marcadas con hilos de sutura para su mejor orientación, al servicio de anatomía patológica.
El propósito de nuestro trabajo fue correlacionar la afectación marginal en las piezas de resección quirúrgica con la presencia de tumor residual en el material obtenido tras la reescisión.
El procedimiento para la evaluación de los citados márgenes fue:
− Mediante BIO, considerada como una técnica eficaz para reducir el número de segundas cirugías en pacientes con cirugía conservadora6, ya que la ampliación se realiza en el mismo tiempo quirúrgico. Los citados autores lograron disminuir el número de reintervenciones del 20 al 9,1%, y consideraban borde libre a partir de 5 mm.
No consideramos apropiado el estudio intraoperatorio para tumores menores de 1 cm de diámetro, ya que disminuye la sensibilidad de la prueba, se incrementa el número de falsos negativos7 y se compromete el diagnóstico final al quedar poco material para el análisis diferido.
− Tras el examen radiológico de la pieza quirúrgica marcada mediante arpón en el servicio de radiología. Se reescindió ante la sospecha de un margen afectado o libre a una distancia menor de 0,2-0,3 cm.
− De forma diferida, en pacientes sometidas a tumorectomía y/o linfadenectomía con diagnóstico de carcinoma previo a la cirugía (mediante PAG).
Llevamos a cabo ampliaciones quirúrgicas en todos los casos de bordes afectados y en aquellos con bordes libres menores de 0,2-0,3 cm.
No existe consenso en la literatura médica revisada sobre la definición de un «margen negativo»; correspondería, en su acepción más simple, a la «no presencia de células neoplásicas en el borde quirúrgico»8,9. La magnitud de esta distancia varía de unos autores a otros: 1 mm10,11, pasando por 2 mm2,4,12, que es la más comúnmente aceptada, hasta 5 mm13.
Llevamos a cabo ampliaciones quirúrgicas en todos los casos de bordes afectados y en aquellos con bordes libres menores de 0,2-0,3 cm.
Al evaluar nuestras tasas globales de «afectación marginal», encontramos un 50,9% de bordes afectados (cifras superiores a las referidas en la literatura médica, que oscilan en un 30-37%)6,14, frente a un 46,6% en los que los bordes estaban libres. A priori, serían cifras muy elevadas, pero debe tenerse en cuenta que en este número se incluyen piezas con análisis intraoperatorio y biopsias de mama marcadas con arpón, en las cuales se reescindió en el mismo acto operatorio, evitando una segunda intervención.
Se amplió el 94% de estas piezas quirúrgicas con márgenes afectados. En el texto se analizan los 5 casos restantes en los que no se hizo.
La mastectomía fue el tratamiento definitivo en el 53,8% de pacientes con márgenes inicialmente afectados.
La incidencia de tumor residual en las reescisiones por bordes afectados (tras la cirugía inicial) fue del 50%. En la literatura médica, la enfermedad residual tras reescisión por bordes afectados oscila en un 30-71%15. Con esa proporción, parece clara la necesidad de ampliación quirúrgica en estos casos, porque el riesgo de recidiva podría ser elevado.
En nuestro trabajo, la presencia de tumor residual fue mayor cuando la afectación de bordes era extensa (53,5%) que cuando sólo era focal (44%).
Obtuvimos unos «márgenes libres» tras el análisis anatomopatológico en el 46,6% (76 pacientes), con reescisión secundaria en el 51,3% de los casos.
Como se mencionó anteriormente, la ampliación siguió en algunos casos a las BIO o biopsias con arpón que informaban de la presencia macroscópicamente cercana del tumor al límite quirúrgico, sin poder precisar con exactitud de milímetros la distancia al borde de la pieza, lo que aconsejaba la reescisión. Tras el análisis histológico diferido, se confirmó el margen libre inicial, y si éste no alcanzaba los 2-3 mm (según las características del tumor y de la paciente), se programaba una segunda intervención.
La cirugía conservadora fue el tratamiento definitivo en el 59% de pacientes con márgenes inicialmente libres.
El número de mastectomías indicadas en los casos de márgenes afectados fue mayor que en aquellos con bordes libres (el 53,8 frente al 41%), aunque no significativo.
Se encontró tumor residual únicamente en 7 (17,9%) de los 39 sujetos con reescisión con márgenes libres, frente al 50% en los márgenes afectados, diferencia estadísticamente significativa. Las restantes 32 (82,1%) no tenían tumor residual.
En la literatura médica revisada, las cifras de tumor residual tras ampliación en márgenes libres varían del 13 al 25%16-19, similares a las halladas en nuestro estudio.
De los citados 7 casos, en 6 la distancia tumoral al borde fue menor de 0,2 cm. Es decir, de las 39 pacientes, sólo quedaba tumor en la mama restante tras la primera cirugía en 7 de ellas. Considerando como margen quirúrgico óptimo los 2 mm, únicamente habría quedado tumor residual en una paciente.
Nuestro planteamiento inicial fue conocer cuál sería el margen óptimo de tejido peritumoral microscópicamente sano que debiera resecarse en la cirugía y en qué medida unos márgenes de resección histológicamente libres de tumor reflejan un buen control de la enfermedad20.
Por otro lado, unos márgenes positivos hacen probable, pero no segura, la presencia de tumor residual (en publicaciones consultadas, la ampliación por márgenes afectados no se vio relacionada con la persistencia de tumor residual en un 30-70%)14. El reto residiría en la correcta selección de las pacientes sometidas a una tumorectomía previa con márgenes afectados que fueran a beneficiarse de una ampliación de ésta.
Un componente intraductal extenso y una afectación masiva de márgenes parece incrementar la probabilidad de encontrar tumor residual en la ampliación por márgenes positivos.
El hallazgo de unos márgenes positivos podría
tener una segunda lectura: Barhelmes et al20 encuentran que los márgenes positivos se asocian a multifocalidad, alto grado histológico y afectación ganglionar, entre otros, y que el pronóstico de los tumores con márgenes inicialmente positivos es peor que el de los tumores con márgenes libres, aunque se consigan márgenes negativos tras la reescisión6,14.
La cuestión más importante, desde el punto de vista pronóstico, es la relación existente entre los márgenes de resección y la tasa de recurrencia local de la enfermedad.
Los datos acerca de esta cuestión son contradictorios. Algunos autores encuentran una clara relación entre los distintos grados de afectación marginal (negativa, cercana, focalmente positiva, extensamente positiva) y la tasa de recurrencias locales, pero no así otros. Singletary21 analiza la relación que guardan unos márgenes de resección cercanos (close margins) (< 2 mm) con el riesgo de recurrencia local, y halla cifras de recidiva similares a los tumores con márgenes negativos, positivos. La relación entre estos 2 factores es aún más compleja cuando las pacientes incluidas en los distintos estudios han recibido distintos regímenes de terapias adyuvantes (radioterapia, quimioterapia y hormonoterapia), tratamientos que sabemos que influyen en el control local de la enfermedad.
CONCLUSIONES
Tras el análisis de los resultados, y a pesar de la opinión de alguno de los autores consultados, nosotros concluimos que:
− En pacientes con afectación, extensa o focal de los márgenes, el riesgo de persistencia de tumor residual es lo suficientemente elevado para considerar inaceptable la no ampliación, si bien, el tratamiento final dependería de las características de la paciente.
− La reescisión quirúrgica no sería precisa en márgenes quirúrgicos iguales o superiores a 2 mm.
− El objetivo de la cirugía sería reducir el tumor lo suficiente para que pueda ser erradicado por radioterapia.
Correspondencia:
M.R. Noguero Meseguer.
Jazmín, 127. Rivas Vaciamadrid. Madrid 28529. España.
Correo electrónico: rnoguero.hdoc@salud.madrid.org
Fecha de recepción: 7/11/05.
Aceptado para su publicación: 12/12/05.