El herpes zóster (HZ) es una enfermedad relativamente común cuya incidencia aumenta con la edad y en situaciones de inmunocompromiso. El HZ presenta una baja mortalidad, pero sus complicaciones tienen un gran impacto en los aspectos físicos, psicológicos, funcionales y sociales de los pacientes, reduciendo significativamente la calidad de vida relacionada con la salud. La neuralgia posherpética es la complicación más frecuente y se caracteriza por síntomas de dolor neuropático que incluyen alodinia e hiperalgesia con sensaciones eléctricas, urentes y/o punzantes que persisten más de 90 días. Su tratamiento es complejo y tiene limitaciones, lo que aumenta la demanda de recursos sanitarios y de gastos directos e indirectos. Este artículo revisa las características epidemiológicas y clínicas del HZ, los tratamientos y vacunas disponibles, así como las recomendaciones nacionales e internacionales de vacunación. Además, se enfatiza el papel de la Atención Primaria como catalizador para la implementación de la vacunación de adultos.
Herpes zoster (HZ) is a relatively common disease whose incidence increases with age and in immunocompromising situations. Mortality caused by HZ is low, but its complications impact on physical, psychological, functional, and social aspects of patients, significantly reducing health-related quality of life. Postherpetic neuralgia is the most common complication, and is characterized by symptoms of neuropathic pain including allodynia and hyperalgesia with electrical, burning, and/or stabbing sensations that persist more than 90 days. Its management is complex and has limitations, which increases the demand for health resources and also increases direct and indirect costs. This article reviews the epidemiological and clinical features of HZ, the available treatments and vaccines against HZ, as well as national and international vaccination recommendations. In addition, the role of Primary Care is emphasized as a catalyst for the implementation of adult vaccination.
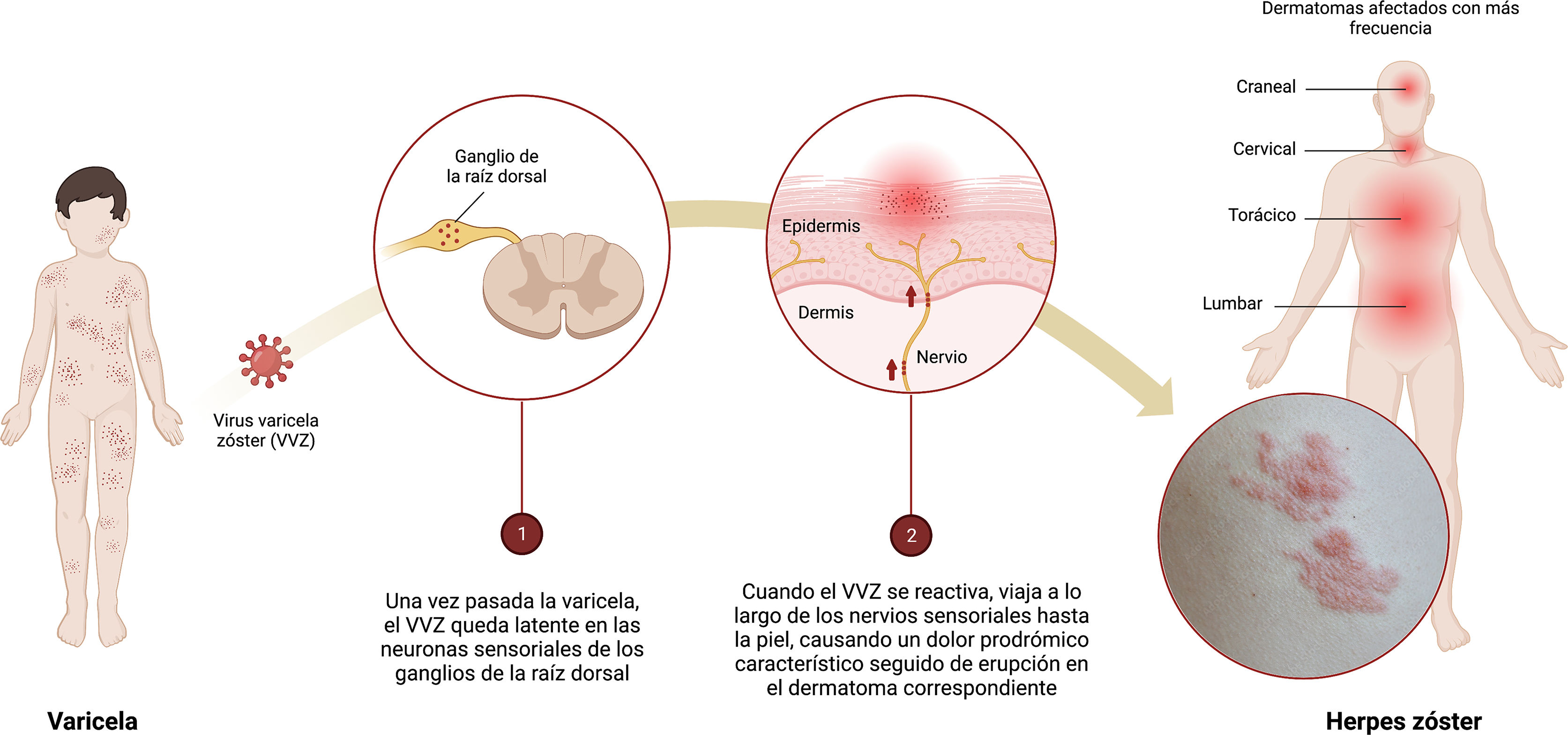
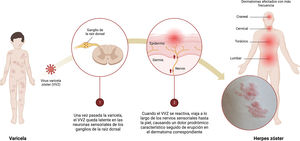
El herpes zóster (HZ) es una enfermedad común (hasta una de cada 3 personas podrían experimentarlo durante su vida) que puede afectar significativamente la calidad de vida de los pacientes1. Es la manifestación neurocutánea de una reactivación oportunista del virus varicela zóster (VVZ) (fig. 1). En la mayoría de los países, como en España, más del 90% de los adultos han sido infectados con el VVZ y, por lo tanto, podrían desarrollar HZ2.
Infografía sobre la primoinfección-latencia-reactivación del virus varicela zóster (VVZ).
1) Una vez que el episodio de varicela ha terminado, el VVZ permanece latente en las neuronas sensoriales de los ganglios de la raíz dorsal.
2) Cuando el VVZ se reactiva, viaja a lo largo de los nervios sensoriales hasta la piel causando dolor prodrómico característico seguido de erupción en el dermatoma correspondiente.
El síntoma principal del HZ es un dolor intenso, que acompaña a un eritema vesiculo-ampolloso dermatómico patognomónico que generalmente se resuelve en el plazo de un mes tras la aparición de las lesiones. Existen presentaciones atípicas, como dolor unilateral sin lesiones cutáneas (herpes zóster sine herpete) o afectación bilateral. Las recurrencias y la enfermedad diseminada son más frecuentes en las personas inmunodeprimidas.
Otras complicaciones que pueden aparecer son: 1) neuralgia posherpética (NPH), la complicación más frecuente (afecta al 5-30% de los pacientes), que se define por la persistencia del dolor en las áreas afectadas más allá de los 3 meses desde la aparición de las lesiones cutáneas o infección aguda; 2) afectación del trigémino que desencadena afectación ocular (herpes zóster oftálmico [HZO]) o del oído (síndrome de Ramsay-Hunt); 3) sobreinfección bacteriana; y 4) afectación neurológica, entre otras3–5.
El desarrollo de vacunas seguras y eficaces para prevenir el HZ también abre la puerta a la prevención de sus complicaciones, una mejora de la calidad de vida de los pacientes y al uso eficiente de los recursos sanitarios. El personal sanitario, especialmente los profesionales de Atención Primaria (AP), desempeñan un papel importante ya que informan a los pacientes y promueven las intervenciones preventivas, como la vacunación, lo que permite alcanzar un modelo de sostenibilidad social basado en un envejecimiento saludable.
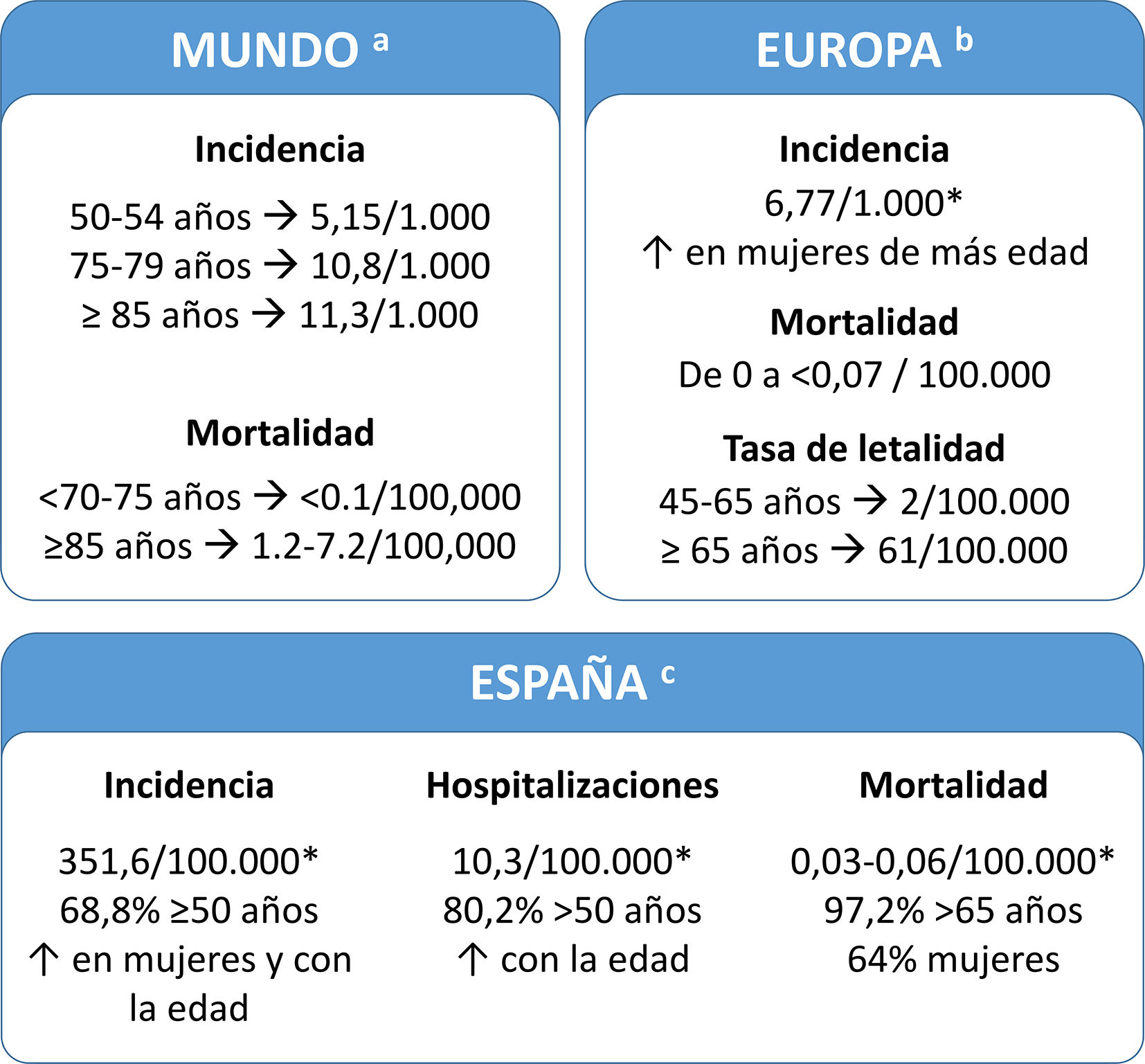
Herpes zóster como un problema de salud públicaAunque la mortalidad relacionada con HZ es baja, el dolor y las complicaciones asociadas constituyen un problema importante de salud pública en España. La incidencia de HZ y NPH aumenta a partir de los 50 años, siendo la edad el principal factor de riesgo. También aumenta considerablemente el riesgo de experimentar HZ la inmunosupresión, como resultado de enfermedades (autoinmunes, neoplasias, infección por el virus de la inmunodeficiencia humana [VIH]) o ciertos tratamientos; algunas infecciones que afectan la inmunidad celular, como la COVID-19 o enfermedades crónicas muy comunes, como la diabetes mellitus, la enfermedad pulmonar obstructiva crónica o el asma2,6.
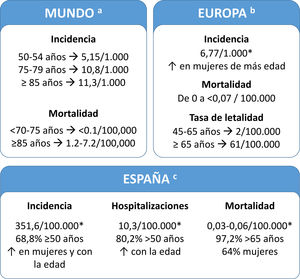
Carga de la enfermedadLa carga de HZ es parecida en todos los países desarrollados. En España, el 68,8% de los pacientes tienen ≥50 años (fig. 2). En varios estudios se ha evaluado el uso de los recursos sanitarios y la carga económica del HZ en España y estos estudios indicaron que aumentaban en las personas mayores (tabla suplementaria 1)7–11. Un estudio reciente mostró que el coste del tratamiento de HZ y NPH por paciente fue de 240 y 571 €, respectivamente (perspectiva del Sistema Nacional de Salud). Si se añaden los costes no sanitarios (perspectiva social), el coste aumenta a 296 y 712 €, respectivamente7.
Calidad de vida de los pacientesAunque la fase aguda del HZ es autolimitada, el dolor agudo y las complicaciones relacionadas con el HZ, particularmente la NPH, tienen un gran impacto en la calidad de vida relacionada con la salud de los pacientes4. El dolor puede ser constante o intermitente e insoportable y se presenta con hiperalgesia y/o alodinia. Se describe como eléctrico, ardiente, punzante, lacerante o mordiente y su duración es indeterminada. Puede desaparecer en meses o años, o permanecer para siempre17,18.
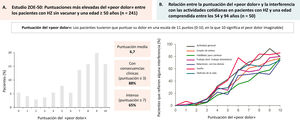
Los pacientes y familiares perciben la enfermedad como una experiencia traumática muy invalidante que causa sufrimiento e interfiere con su capacidad de vivir plenamente (fig. 3A)19, pudiendo producir alteraciones del sueño, depresión y ansiedad graves (fig. 3B)20. El riesgo de ansiedad y depresión en los pacientes con NPH y dolor intenso es mayor que en los pacientes con un dolor más leve. Incluso se han descrito casos de suicidio en algunos pacientes como consecuencia directa de la NPH21. En un estudio realizado en España, el 80,1% de los pacientes con HZ comunicaron un dolor moderado/intenso y el 46,2% comunicaron dolor intenso, ambos en el día 0, y la puntuación de dolor fue mayor en los pacientes que posteriormente desarrollaron NPH que en los que no tuvieron esta complicación7. El riesgo de tener NPH grave que requiera hospitalización aumenta con la edad. Más del 90% de estos casos aparecen en las personas mayores de 50 años2.
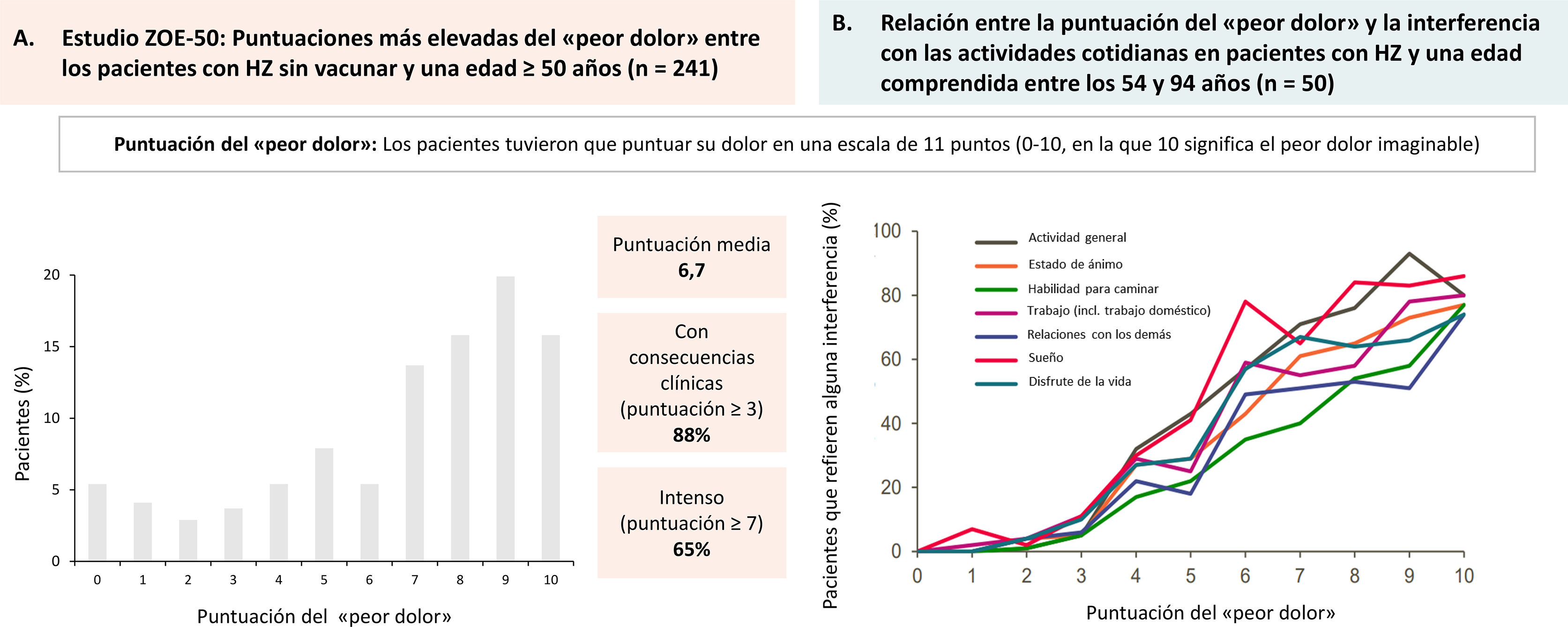
Impacto del herpes zóster (HZ) en el dolor y la calidad de vida de los pacientes.
A) Estudio ZOE-50. Puntuaciones máximas del «peor dolor» en pacientes de 50 años o más con HZ y no vacunados (n = 241). Los pacientes calificaron el dolor en una escala de 0 a 10 puntos (0 = sin dolor; 10 = peor dolor imaginable). Figura creada a partir de los resultados proporcionados por Curran D. et al.19. B) Valoración de la calidad de vida en pacientes con HZ. Relación entre la puntuación del «peor dolor» y la interferencia en la vida cotidiana en pacientes con edades comprendidas entre 54 y 94 años. Los pacientes calificaron el dolor en una escala de 0 a 10 puntos (0 = ningún dolor; 10 = peor dolor imaginable). Figura creada a partir de los resultados proporcionados por Lydick E. et al.20.
Los objetivos principales del tratamiento del HZ son atajar la extensión y duración de los síntomas cutáneos, reducir la intensidad y duración del dolor agudo y reducir la intensidad del dolor asociado con la NPH. En los pacientes inmunodeprimidos y otros pacientes vulnerables, la intención del tratamiento es reducir la frecuencia y gravedad de las complicaciones22.
Tratamiento farmacológico para la infección agudaLos 3 componentes de la farmacoterapia frente al HZ agudo son los fármacos antivíricos, la analgesia y el tratamiento local; siempre teniendo en cuenta la situación clínica de cada paciente. El tratamiento antivírico se recomienda cuando existe un mayor riesgo de complicaciones o secuelas (tabla 1)22. Actualmente, existen 4 análogos de nucleósidos eficaces por vía oral frente al HZ: aciclovir, valaciclovir, famciclovir y brivudina (tabla 2). Sin embargo, estos tratamientos aún no han demostrado ser eficaces para disminuir la incidencia de NPH23.
Situaciones en las que se recomienda el tratamiento con antivirales para herpes zóster
| Situaciones en las que se recomienda el tratamiento con antivirales |
|---|
|
|
|
|
|
|
|
| Situaciones en las que se recomienda tratamiento con antivirales |
|
|
|
|
SNC: sistema nervioso central; HZ: herpes zóster.
Fuente: Werner et al.22
Tratamiento antivírico convencional para herpes zóstera
| Agente | Dosis y pauta terapéutica | Duración |
|---|---|---|
| Valaciclovir (VO) | 1.000 mg, 3 veces al día | 7 días |
| Aciclovir (VO) | 800 mg, 5 veces al día | 7 días |
| Aciclovir (IV) | 8–10 mg/kg, 3 veces al día | 7–10 días |
| Famciclovir (VO) | 250 mg, 3 veces al día | 7 días |
| Brivudina (VO) | 125 mg, 1 vez al día | 7 días |
HZ: herpes zóster; IV: vía intravenosa; VO: vía oral.
El aciclovir IV se puede administrar a pacientes con enfermedad grave y a aquellos que tengan un alto riesgo de una evolución complicada. Estos fármacos han demostrado reducir la duración de las lesiones cutáneas, así como tener efecto en la duración y la intensidad del dolor asociado al HZ agudo. No se han encontrado diferencias estadísticamente significativas con respecto a la duración del dolor y las lesiones cutáneas cuando se compararon los fármacos. Brivudina tiene menos estudios y puede ser más útil en pacientes con insuficiencia renal23.
El dolor agudo asociado al HZ aparece en más del 95% de los pacientes mayores de 50 años23. Inicialmente, este dolor es nociceptivo, pero posteriormente puede aparecer un componente neuropático. Para su tratamiento se utilizan analgésicos, aunque la aplicación de compresas frías y húmedas sobre las ampollas puede ayudar a aliviar el dolor. En ausencia de control agudo del dolor, y ante la sospecha de un componente neuropático, los analgésicos pueden combinarse con anticonvulsivos (gabapentina o pregabalina), antidepresivos tricíclicos, venlafaxina o duloxetina como tratamiento de segunda línea23,24. No es habitual recurrir a tratamientos intervencionistas para el dolor agudo.
Para el herpes ocular, se recomienda complementar el tratamiento sistémico con preparaciones tópicas de aciclovir en el ojo afectado22,23. El HZO no tiene un tratamiento tópico específico.
Tratamiento farmacológico para el dolor crónicoLa NPH requiere un esquema terapéutico que combine analgésicos con diferentes mecanismos de acción. Ante la falta de control, se agregan antidepresivos tricíclicos. Aunque la amitriptilina es la más estudiada para la NPH, la nortriptilina y la desipramina presentan menos efectos secundarios anticolinérgicos. En primera línea también pueden emplearse anticonvulsivos (gabapentina y pregabalina), que muestran efectos similares con mejor tolerancia farmacológica. Como tratamiento de segunda línea, en casos de dolor localizado se pueden recomendar parches de lidocaína y capsaicina tópica o incluso el uso de opioides23. Ante la falta de respuesta al tratamiento farmacológico, se recurre a tratamientos intervencionistas (inyecciones de toxina botulínica, bloqueos de nervios epidurales/intratecales y paravertebrales con anestésicos locales y/o corticosteroides, o estimulación de la médula espinal)24,25. Por otro lado, el tratamiento farmacológico de la NPH en personas de edad avanzada, generalmente polimedicadas, supone un riesgo importante de interacciones farmacológicas y acontecimientos adversos de especial impacto (somnolencia, mareos, trastornos de la marcha, caídas, aumento de peso)26.
Vacunas para prevenir el herpes zósterLas vacunas frente a la varicela y el HZ pueden modificar la historia natural de la infección por VVZ. La vacunación frente a la varicela está indicada para prevenir la infección primaria por VVZ, y la del HZ para prevenir la reactivación del virus latente2. Hasta ahora, la vacunación frente al HZ es la única forma de prevenir la enfermedad y sus complicaciones.
Actualmente hay 2 vacunas autorizadas para prevenir HZ: la vacuna de virus vivos atenuados frente al HZ (ZVL), con una carga antigénica aproximadamente 15 veces superior a la vacuna frente a la varicela, que estuvo disponible en España desde 2014 pero ya no está comercializada27; y la vacuna recombinante frente al HZ (RZV), anteriormente conocida como vacuna de subunidades frente al HZ (HZ/su), compuesta por la glicoproteína E del VVZ y el sistema adyuvante AS01B (basado en liposomas con 2 inmunoestimulantes, el monofosforil lípido A [MPL], y la fracción 21 de la Quillaja saponaria Molina [QS-21], cuyo efecto sinérgico induce una respuesta humoral y celular potente y mantenida), disponible en España desde 2021 (tabla 3). El diseño de esta vacuna permite inducir respuestas inmunitarias humorales y celulares antígeno-específicas en individuos con inmunidad preexistente frente al VVZ al combinar el antígeno específico del VVZ (gE) con el sistema adyuvante AS01B28.
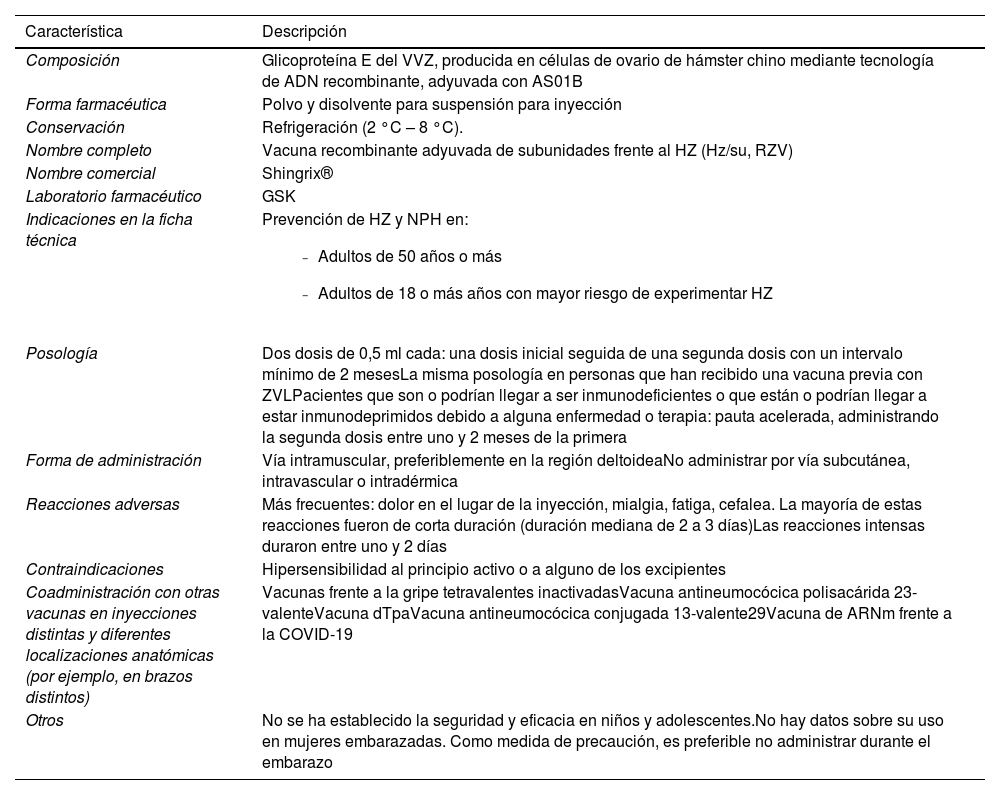
Características de la vacuna recombinante adyuvada de subunidades frente al herpes zóster
| Característica | Descripción |
|---|---|
| Composición | Glicoproteína E del VVZ, producida en células de ovario de hámster chino mediante tecnología de ADN recombinante, adyuvada con AS01B |
| Forma farmacéutica | Polvo y disolvente para suspensión para inyección |
| Conservación | Refrigeración (2 °C – 8 °C). |
| Nombre completo | Vacuna recombinante adyuvada de subunidades frente al HZ (Hz/su, RZV) |
| Nombre comercial | Shingrix® |
| Laboratorio farmacéutico | GSK |
| Indicaciones en la ficha técnica | Prevención de HZ y NPH en:
|
| Posología | Dos dosis de 0,5 ml cada: una dosis inicial seguida de una segunda dosis con un intervalo mínimo de 2 mesesLa misma posología en personas que han recibido una vacuna previa con ZVLPacientes que son o podrían llegar a ser inmunodeficientes o que están o podrían llegar a estar inmunodeprimidos debido a alguna enfermedad o terapia: pauta acelerada, administrando la segunda dosis entre uno y 2 meses de la primera |
| Forma de administración | Vía intramuscular, preferiblemente en la región deltoideaNo administrar por vía subcutánea, intravascular o intradérmica |
| Reacciones adversas | Más frecuentes: dolor en el lugar de la inyección, mialgia, fatiga, cefalea. La mayoría de estas reacciones fueron de corta duración (duración mediana de 2 a 3 días)Las reacciones intensas duraron entre uno y 2 días |
| Contraindicaciones | Hipersensibilidad al principio activo o a alguno de los excipientes |
| Coadministración con otras vacunas en inyecciones distintas y diferentes localizaciones anatómicas (por ejemplo, en brazos distintos) | Vacunas frente a la gripe tetravalentes inactivadasVacuna antineumocócica polisacárida 23-valenteVacuna dTpaVacuna antineumocócica conjugada 13-valente29Vacuna de ARNm frente a la COVID-19 |
| Otros | No se ha establecido la seguridad y eficacia en niños y adolescentes.No hay datos sobre su uso en mujeres embarazadas. Como medida de precaución, es preferible no administrar durante el embarazo |
dTpa: vacuna antidiftérica, antitetánica y antitosferina (componente acelular) de contenido antigénico reducido; HZ: herpes zóster; NPH: neuralgia posherpética; RZV: vacuna recombinante adyuvada de subunidades frente al herpes zóster; VVZ: virus varicela zóster.
Puesto que en España solo está comercializada la RZV, a continuación, solo se describirá esta vacuna. La vacuna RZV está indicada para la prevención del HZ y la NPH en adultos de 50 años o más y también en adultos de más de 18 años de edad con mayor riesgo de HZ, entre los que se incluyen las personas inmunodeprimidas donde la vacuna ZVL estaba contraindicada28.
Eficacia y efectividad de la vacuna recombinante adyuvada de subunidades frente al herpes zósterLos 2 principales ensayos clínicos aleatorizados, doble ciego, controlados con placebo, que han demostrado la eficacia de RZV son el estudio ZOE-50 (n = 16.160; ≥50 años)30 y el estudio ZOE-70 (n = 14.816; ≥70 años)31. La eficacia de la vacuna en los adultos sanos de 50 años o más fue del 97,2%30. En el análisis agrupado de ambos estudios se observó una eficacia frente al HZ del 91,3% en ≥70 años y una eficacia frente a la NPH del 91,2 y 88,8% en ≥50 años y ≥70 años, respectivamente31. No se ha descrito que la eficacia vacunal frente a HZ se vea afectada por la presencia de comorbilidades y se mantiene en línea con los datos obtenidos en los estudios ZOE-50 y ZOE-70, variando entre 84,5 y 97% en función de la enfermedad subyacente32. En la práctica clínica, se ha observado una efectividad alta en la prevención de HZ (64,1-85,5%) y NPH (76%) en ≥50 años, incluidas personas de edad muy avanzada, con enfermedades autoinmunes o inmunodeprimidos33,34.
También se han realizado ensayos clínicos controlados con placebo en mayores de 18 años receptores de trasplante de progenitores hematopoyéticos (TPH) autógeno (Zoster-002; n = 1.846) y con hemopatías malignas (Zoster-039; n = 562)28. La eficacia de RZV frente al HZ fue de 68,2% (Zoster-002) y 87,2% (Zoster-039, análisis post hoc) y frente a la NPH de 89,3% (Zoster-002). La eficacia frente a otras complicaciones fue de 77,8% y frente a las hospitalizaciones relacionadas con HZ de 84,7%28. Asimismo, se han llevado a cabo estudios de inmunogenicidad/seguridad en otros grupos de inmunodeprimidos, como pacientes que recibieron un trasplante renal (Zoster-041; n = 264), con tumores sólidos (Zoster-028; n = 237) y con VIH (Zoster-015; n = 123). En todos estos estudios, se demostró que la vacuna era inmunógena y segura para estas poblaciones35.
Los datos a largo plazo (10 años) del estudio de extensión del ZOE-50 y ZOE-70 (Zoster-049), donde se evaluó la inmunogenicidad y la eficacia de RZV frente al HZ tras recibir 2 dosis separadas 2 meses, muestran que la eficacia mantenida alcanzó el 81,6% en el período de 4 años del estudio de seguimiento, es decir, entre 5,6 y 9,6 años tras el inicio de la vacunación, y un 89% en el período desde un mes tras la segunda dosis hasta 9,6 años de seguimiento36. Otros estudios de inmunogenicidad con un seguimiento de hasta 10 años y modelos matemáticos indican que la respuesta inmunitaria podría mantenerse durante 20 años o más.
En pacientes con antecedentes de HZ hay datos limitados sobre el uso de RZV, aunque no está cuestionada su seguridad ni su inmunogenicidad en ellos y, en consecuencia, varias autoridades sanitarias recomiendan su uso. Sin embargo, existen variaciones en cuanto a qué intervalos respetar para administrar la vacuna37. A nivel nacional, el Consejo Interterritorial del Sistema Nacional de Salud recoge que la vacunación con RZV es segura en cualquier momento tras haber sufrido HZ y recuperarse de las lesiones (desaparición de las vesículas). Aunque la evidencia es limitada, se recomienda retrasar la vacunación entre 6 meses y un año tras el HZ en las personas inmunocompetentes, con la finalidad potencial de obtener una mayor respuesta a medio plazo. Sin embargo, en personas con inmunodepresión, y dado el riesgo elevado de recidiva, se puede vacunar inmediatamente tras la recuperación del HZ.
A nivel internacional, el Comité Asesor sobre Prácticas de Inmunización (ACIP, Advisory Committee on Immunization Practices) recomienda que se vacune con RZV cuando haya pasado la fase aguda del episodio de HZ y los síntomas hayan disminuido, sin distinguir entre sujetos inmunocompetentes e inmunodeprimidos2,38.
Por otra parte, en un ensayo clínico abierto multicéntrico (Zoster-048) en personas que ya estaban vacunadas con ZVL y que fueron vacunadas con RZV, la respuesta inmunitaria a RZV no se vio afectada28.
Coadministración de vacuna recombinante adyuvada de subunidades frente al herpes zóster y otras vacunasSe considera que, con base en estudios realizados y a las recomendaciones de las autoridades de Salud Pública, RZV se puede administrar con la vacuna inactivada no adyuvada de la gripe estacional, la vacuna antineumocócica polisacarídica 23-valente (VNP23), la vacuna antineumocócica conjugada 13-valente (VNC13) y las vacunas frente a difteria, tétanos y tosferina (dTpa)2,28. Además, hay estudios en marcha que evalúan la coadministración de RZV con las vacunas adyuvada y de alta carga frente a la gripe estacional y las vacunas frente a la COVID-19, aunque hoy en día algunas autoridades sanitarias contemplan la coadministración. Del mismo modo, a nivel regional, las autoridades sanitarias de Andalucía y Cataluña recogen la coadministración con la vacuna antineumocócica 20-valente (VNC20)39,40. Las vacunas deben administrarse en sitios anatómicos distintos2.
Seguridad de la vacuna vacuna recombinante adyuvada de subunidades frente al herpes zósterLa vacuna RZV es bien tolerada. Los principales acontecimientos adversos de esta vacuna son reacciones locales en el lugar de la inyección, mialgia, fatiga y cefalea28. En los primeros 30 días después de la vacunación, se notificaron acontecimientos adversos graves en el 1,1% de los receptores de RZV y el 1,3% de los receptores de placebo en la cohorte total vacunada30.
Estrategias de vacunación en el mundoLas vacunas ZVL27 y RZV28 para prevenir HZ y NPH están aprobadas en muchos países con sus propias estrategias y recomendaciones de vacunación (tabla suplementaria 2)2.
En España, las recomendaciones de vacunación frente al HZ aprobadas por la Comisión de Salud Pública indican emplear la vacuna RZV en los adultos mayores de 18 años de edad pertenecientes a los siguientes grupos de riesgo: personas con TPH, receptores de trasplante de órgano sólido, en tratamiento con fármacos anti-JAK, con infección por VIH, hemopatías malignas, con tumores sólidos en tratamiento con quimioterapia y personas con antecedentes de 2 o más episodios de HZ. Asimismo, se recomienda la vacunación en sujetos mayores de los 50 años en tratamiento con otros fármacos inmunomoduladores o inmunosupresores y la vacunación sistemática en las cohortes de población general de 65, con posibilidad de captar progresivamente cohortes de edad comprendidas entre los 65 y los 80 años, empezando por quienes cumplen 80.
A raíz de estas recomendaciones, las diferentes comunidades autónomas establecen sus propias estrategias de vacunación en base a diferentes criterios. En la actualidad, todas las regiones están vacunando a los 6 grupos de riesgo inicialmente incluidos en las recomendaciones de vacunación frente al HZ de 2021 (personas con TPH, receptores de trasplante de órgano sólido, en tratamiento con fármacos anti-JAK, con infección por VIH, hemopatías malignas y tumores sólidos en tratamiento con quimioterapia) y algunas comunidades autónomas como Asturias, Cantabria, Cataluña, Valencia y Canarias incluyen personas con antecedentes de HZ. Respecto a la vacunación sistemática en la población general, existen diferencias en cuanto a las cohortes financiadas en las distintas comunidades autónomas (se recomienda consultar la información actualizada de las diferentes consejerías de salud)41–58.
Al margen de las cohortes de edad que estén financiadas, la vacuna se encuentra disponible en farmacias bajo prescripción para toda aquella población para la que esté indicada según la ficha técnica2. Las recomendaciones nacionales también indican que aquellos que hayan recibido previamente ZVL pueden vacunarse con RZV siempre que la primera dosis se administre al menos 5 años después de ZVL, aunque se puede considerar un intervalo menor (mínimo de 8 semanas) en personas a partir de los 70 años o si retrasar la pauta con RZV supone que se administre en periodos de alta inmunosupresión2.
Papel de la Atención Primaria en la vacunación frente al herpes zósterA pesar de los progresos realizados, la vacunación en los adultos es una práctica mucho menos extendida que en la población pediátrica. Aunque la vacunación infantil se realiza de forma sistemática, la vacunación de los adultos queda frecuentemente reducida a campañas anuales de vacunación antigripal y a la administración de determinadas vacunas en situaciones muy concretas. Sin embargo, hasta el día de hoy, la vacunación sigue constituyendo una de las medidas sanitarias más coste-efectivas. En los adultos, además, la prevención de enfermedades por medio de vacunas cumple una función dual: reducir la carga de la enfermedad y preservar la calidad de vida de los pacientes durante más tiempo. Por ello, es importante dedicar esfuerzos para que su aplicación no sea una cuestión limitada por la edad, sino que sea una acción permanente concebida como parte de un modelo integral, junto con otras intervenciones sanitarias, para prevenir enfermedades y promover el envejecimiento saludable.
Aunque son muchos los actores involucrados en la vacunación del adulto, los profesionales de AP tienen un papel fundamental de educar a la población sobre la importancia de prevenir ciertas enfermedades inmunoprevenibles que pueden impactar de forma notable en su calidad de vida, como el HZ. El bajo conocimiento o la información inadecuada sobre las vacunas por parte de los pacientes, la incertidumbre en torno a las pautas de inmunización actuales, las modificaciones frecuentes de los calendarios vacunales, la escasez de tiempo en la consulta, la falta de sistemas de registro centralizados y la presión para lograr los objetivos de vacunación, entre otros aspectos, son factores reconocidos por profesionales de la salud que dificultan la vacunación.
Estos factores inciden de forma más directa sobre los profesionales de AP, principales responsables de la vacunación de la población. La mayoría de las intervenciones para fomentar la vacunación deben centrarse en sensibilizar a la población mediante la información, educación, formación y concienciación. Los profesionales, además de una formación adecuada sobre vacunas y entrenamiento en habilidades de comunicación para solventar las dudas de la inmunización a los pacientes, también requieren recursos suficientes como tiempo en la consulta, una adecuada información de las modificaciones y pautas vacunales, un sistema de ayuda mediante alertas de vacunación automatizadas vinculado a la historia clínica o el acceso a un registro centralizado nacional de vacunaciones.
ConclusionesAunque la mortalidad y hospitalizaciones asociadas al HZ son generalmente bajas, el uso de recursos sanitarios y económicos es muy elevado debido a su alta incidencia y a las complicaciones asociadas. La edad y las situaciones de inmunocompromiso son los principales factores de riesgo. Los antivíricos mejoran la evolución clínica de la fase aguda pero aún no han demostrado ser eficaces para prevenir complicaciones como la NPH. Por ahora, la vacunación es la única forma de prevenir el HZ y sus complicaciones, especialmente la NPH.
En España existen 2 vacunas autorizadas, aunque solamente hay una vacuna disponible actualmente: la RZV. Los datos publicados confirman la elevada eficacia de RZV en la prevención del HZ y de la NPH, pudiéndose usar con seguridad en inmunodeprimidos. Resulta esencial que los profesionales sanitarios de AP adquieran el liderazgo de la vacunación y del cumplimiento del calendario de vacunación a lo largo de toda la vida.
FinanciaciónGlaxoSmithKline Biologicals SA financió este estudio/investigación (identificador del estudio GSK: 214093) y participó en todas las etapas de la realización del estudio, incluido el análisis de los datos. GlaxoSmithKline Biologicals SA también se hizo cargo de todos los gastos asociados con el desarrollo y publicación de este manuscrito.
Conflicto de interesesJosé María Molero y Jesús Ortega declaran no tener relaciones ni actividades financieras o no financieras ni conflictos de intereses. Irene Montoro y Natalia McCormick son empleadas de GSK y declaran no tener otras relaciones ni actividades financieras o no financieras.
AgradecimientosLos autores agradecen a Ana Moreno Cerro y Fernando Sánchez Barbero PhD, en nombre de Springer Healthcare Ibérica S.L., su ayuda en la redacción de este manuscrito. Los autores desean agradecer a María del Rosario Cambronero PhD (GSK) sus contribuciones científicas y editoriales durante la preparación del manuscrito. Los autores también agradecen a la plataforma Business & Decision Life Sciences por la asistencia editorial y la coordinación del manuscrito, en nombre de GSK.