Se estudió el efecto de la aireación en la actividad fermentativa de Brettanomyces intermedius RIVE 2-2-2 en cultivo mixto con Saccharomyces cerevisiae RIVE 15-1-416 con el objetivo de evaluar la producción de compuestos químicos de importancia sensorial. Para ello se cultivaron ambas cepas en matraces Erlenmeyer conteniendo jugo de manzana estéril sin aroma. Los compuestos químicos producidos durante la fermentación en cultivo agitado (200min−1) o estático (sin agitación) fueron determinados por cromatografía gaseosa y líquida. Los resultados mostraron que la agitación durante el cultivo, disminuye la producción de glicerol (0.53±0.1g/L) y ácido acético (94.0±10.0mg/L) e incrementa la producción de alcoholes superiores (1.009g/L) y etil acetato (122.0±5.0mg/L). Cultivos por lote realizados adicionalmente en biorreactor con un flujo de aire de 25l/h reportaron una tasa de crecimiento (μ) y rendimiento de biomasa (Yx/s) de 0.05h−1 y 0.24 (g biomasa seca/g azúcar) respectivamente. Al término del cultivo, no se observó presencia de ácido acético y además las concentraciones de etanol y glicerol alcanzaron valores de 0.34±0.1g/L y 1.3±0.05g/L respectivamente. Los mejores resultados en términos de calidad organoléptica de la sidra en lo referente al sabor y olor se obtuvieron en la fermentación en cultivo estático. El control de la aireación es una herramienta útil para controlar la actividad fermentativa de estas dos cepas en cultivo mixto.
The influence of aeration on the fermentative activity of Brettanomyces intermedius RIVE 2-2-2 was studied in a mixed culture with Saccharomyces cerevisiae RIVE 15-1-416 in order to evaluate the production of chemical compounds of sensory importance. To achieve this, the strains were cultured in Erlenmeyer flasks containing sterilized and aroma-removed apple juice. The chemical compounds produced during fermentation under shaking (200min−1) or static cultivation were determined by gas and liquid chromatography. The results showed that the stirring during cultivation diminishes the production of glycerol (0.53±0.1g/L) and acetic acid (94.0±10.0mg/L) and, on the other hand, increases the production of higher alcohols (1.009g/L) and ethyl acetate (122.0±5.0mg/L). Additional batch cultivations carried out in a bioreactor with an air flow of 25l/h reported a growth rate (μ) and a biomass yield (Yx/s) of 0.05h−1 and 0.24 (g. dry biomass/g. sugar) respectively. At the end of cultivation, no presence of acetic acid was observed and furthermore, concentrations of ethanol and glycerol reached values of 0.34±0.1g/L and 1.3±0.05g/L respectively. The best results in terms of organoleptic quality of the cider regarding to taste and smell were obtained when fermented under static cultivation conditions. The regulation of aeration during fermentation is a useful tool to control the fermentative activity of these two strains in a mixed culture.
Brettanomyces intermedius es una levadura considerada contaminante y es frecuentemente aislada de sidrerías y vinerías1,2, así como de mostos y superficie de uvas3. B. intermedius puede estar presente en cualquier etapa de la vinificación4. Se le considera responsable del deterioro de la calidad sensorial de vinos, su actividad se hace presente luego de la fermentación alcohólica y durante el añejamiento5. En estas condiciones su crecimiento está relacionado con el consumo de etanol como fuente de energía1. La presencia de Brettanomyces no es del todo indeseable en los procesos de fermentación. Por ejemplo, especies de Brettanomyces juegan un rol importante en la producción de algunos tipos de cervezas, ya que son responsables del aroma que las caracteriza. Las cervezas Belgas “lambica”, “gueuze” y “trappist” son especialmente obtenidas mediante fermentación espontánea en donde Brettanomyces intermedius es típicamente encontrada6,7.
Metabolismo de azúcares en Brettanomyces intermediusLos azúcares fermentables son la fuente de energía más importante en el metabolismo de las levaduras. Saccharomyces cerevisiae y Brettanomyces intermedius utilizan vías metabólicas comunes para la degradación de azúcares8. Ambas son anaerobias facultativas “Crabtree positivas”9. Es decir, en medios de cultivo con altas concentraciones de azúcar como glucosa y, en condiciones aerobias, la respiración se reprime y optan por fermentar10,11. En mostos con altas concentraciones de azúcares se observa este efecto, conocido como represión por catabolito (glucosa, sucrosa y fructosa)12B. intermedius comparado con S. cerevisiae, utiliza glucosa menos eficientemente y crece mucho más lento13.
Brettanomyces intermedius a condiciones aerobias convierte glucosa en etanol, ácido acético y CO2. Mientras que en condiciones anaerobias la tasa de fermentación disminuye pero no cesa por completo, efecto conocido como “Custer”14–16. El oxígeno estimula la actividad fermentativa de Brettanomyces contrariamente a lo observado en S. cerevisiae15,17. Debido a que la fermentación suministra poca energía, su crecimiento es lento. A medida que la concentración de oxígeno incrementa, la producción de ácido acético también incrementa mientras que la de etanol disminuye18. Esta levadura es fuertemente acidogénica, ha sido reportado que produce altas concentraciones de ácido acético (por lo menos 5g/L) en condiciones aerobias17. La formación de ácido acético resulta del bloqueo de la vía oxidativa del acetaldehído debido a la insuficiente actividad de la acetil CoA sintetasa requerida para la conversión de ácido acético en acetil CoA19. Estudios realizados con B. intermedius en condiciones aerobias y de limitación de oxígeno han reportado la actividad de las principales enzimas fermentativas, como la piruvato decarboxilasa y el alcohol deshidrogenasa, estas enzimas no son afectadas por la concentración de oxígeno disuelto como lo observado en levaduras “Crabtree negativas”20. En limitación de oxígeno se ha reportado una baja actividad de la acetaldehído deshidrogenasa, enzima involucrada en la producción de ácido acético20. También se ha reportado actividad de la glicerol 3P-deshidrogenasa involucrada en la producción de glicerol durante el crecimiento en condiciones de limitación de oxígeno20. Así mismo, se ha reportado que el rendimiento en etanol es similar a lo mostrado por S. cerevisiae20.
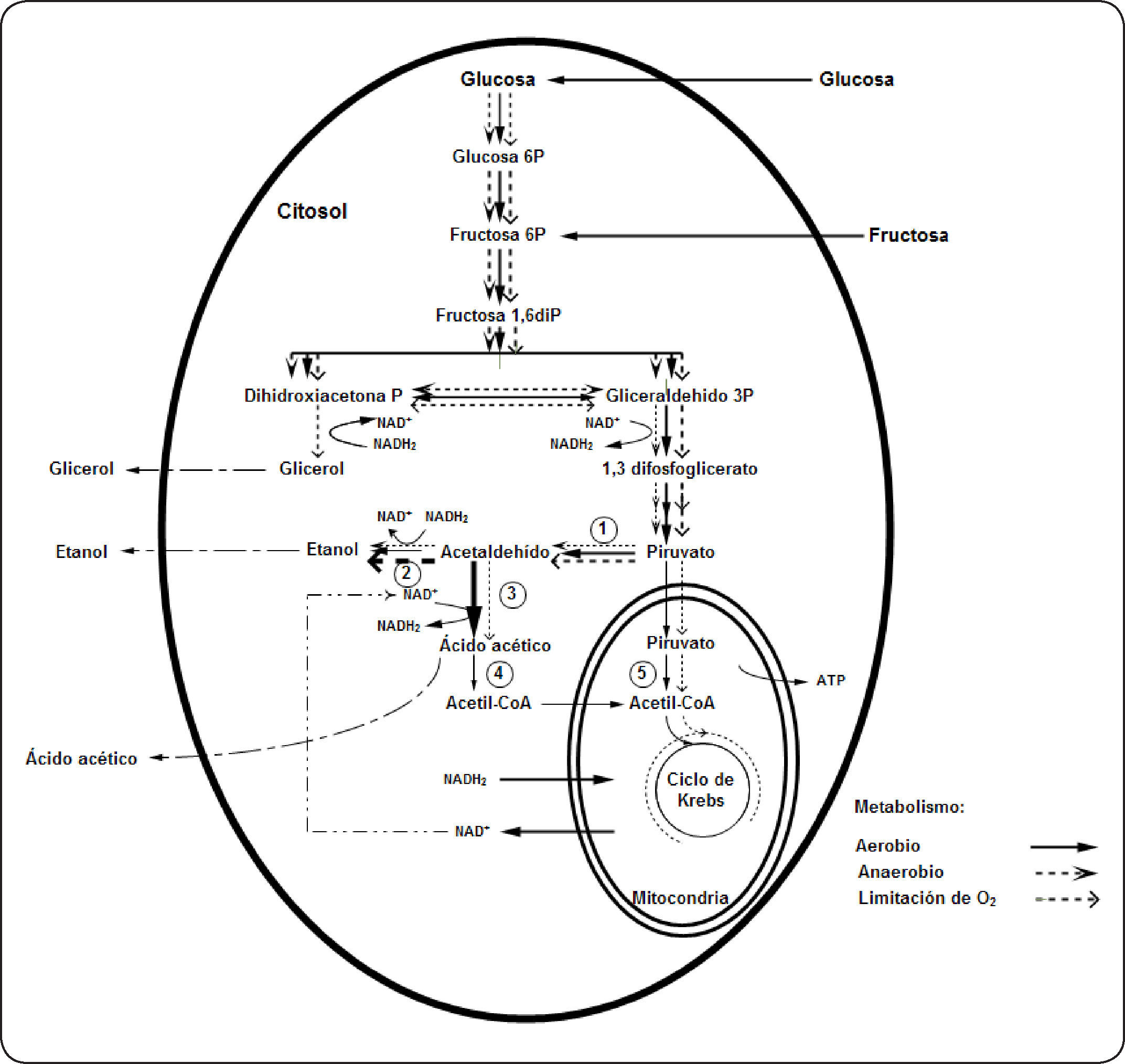
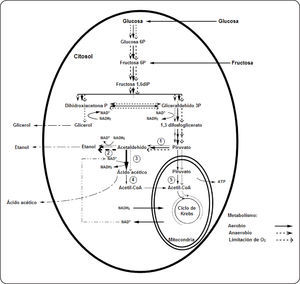
En levaduras “Crabtree positivas” cultivadas en condiciones aerobias, el piruvato se metaboliza preferentemente vía la piruvato decarboxilasa hasta acetaldehído y luego éste es convertido en etanol por la etanol deshidrogenasa; esto se debe a que presentan bajos niveles de enzimas respiratorias21. En la fermentación aerobia el funcionamiento del ciclo de Krebs es limitado y en condiciones anaerobias o de limitación de oxígeno opera como una vía ramificada. La producción de glicerol en condiciones de limitación de oxígeno está relacionada con la necesidad de reoxidar el NADH2 generado durante la glucólisis22,23. En la Figura 1 (adaptada por el autor) se presenta en forma general el metabolismo que utilizaría Brettanomyces intermedius en la degradación de glucosa15,18,20,24,25.
Metabolismo de Brettanomyces intermedius en función a la concentración de oxígeno en el medio. El grosor de las líneas indica la intensidad del metabolismo. 1: Piruvato descarboxilasa, 2: alcohol deshidrogenasa, 3: acetaldehído deshidrogenasa (constitutiva), 4: acetil CoA sintetasa (citoplasmático), represión parcial o total por glucosa, 5: piruvato deshidrogenasa (adaptada de Wijsman et al. (1984)15, Aguilar-Uscanga et al. (2003)18, Galafassi et al. (2011)20, Carrascosa et al. (1981)24, Freer (2002)25).
En general, las levaduras durante la fermentación convierten los azúcares presentes en el medio en etanol, CO2 y en una variedad de compuestos volátiles y no volátiles que contribuyen a la complejidad sensorial de las bebidas que fermentan26,27. Los ésteres representan el mayor grupo de compuestos aromáticos en bebidas alcohólicas fermentadas28 y, son producidos mediante reacción enzimática dentro de la célula. Las principales enzimas que catalizan las reacciones son las acetiltransferasas29,30. La síntesis de ésteres de acetato en S. cerevisiae ha sido atribuido a la actividad de al menos tres acetiltransferasas: alcohol acetiltransferasa (AATasa), etanol acetiltransferasa e isoamil alcohol acetiltransferasa31. El alcohol acetiltransferasa cataliza la reacción: acetil CoA + alcohol → CoA + acetil éster. La AATasa reacciona con la acetil- CoA y dependiendo del grado de afinidad, con una variedad de alcoholes32. Así, el etil acetato se produce principalmente a partir de la acetil CoA y etanol29. Por otra parte, se ha reportado que la actividad de la enzima éster sintasa (esterasa inversa) en la síntesis de ésteres en S. cerevisiae es limitada. La vía de síntesis de ésteres en levaduras no-Saccharomyces difiere de la vía usada por S. cerevisiae, así el etil acetato se sintetiza preferentemente a partir del ácido acético y etanol mediante una reacción inversa de la esterasa29,33. El incremento de la oxigenación del medio reduce la producción de etil acetato34,35. Sin embargo, Rojas et al.36 ha reportado menor producción de etil e isoamil acetato en condiciones de limitación de oxígeno comparado en condiciones aerobias. Mucho antes se reportó que la producción de etil acetato requiere de la presencia de pequeñas cantidades de oxígeno en el medio, y que su síntesis se inhibe en condiciones totalmente anaerobias34,37. En general, la biosíntesis de ésteres es afectado por diversos factores como la aireación del mosto, la temperatura de fermentación, la técnica de fermentación y la cepa de levadura.
Las levaduras también producen diferentes concentraciones de alcoholes superiores. Altas concentraciones de estos compuestos afectan negativamente la calidad organoléptica de vinos, pero sin embargo, bajas concentraciones más bien contribuyen a su complejidad38. Las levaduras no-Sacccharomyces frecuentemente producen bajas concentraciones de alcoholes superiores comparado con S. cerevisiae, pero hay una gran variabilidad entre cepas39,40. Los alcoholes superiores son formados a partir de α-cetoácidos, los cuales derivan de la desaminación de los correspondientes aminoácidos (valina, leucina, isoleucina, fenilalanina, etc.) a través de la vía de Ehrlich o a partir del metabolismo de la glucosa41. El crecimiento intenso de levaduras está relacionado con una excesiva producción de alcoholes superiores. Así, factores que influyen en el crecimiento celular como temperaturas altas de fermentación y la oxigenación del medio promueven su producción. Se ha reportado la producción de 2-feniletanol, isoamil alcohol por B. intermedius42.
El presente estudio descriptivo experimental se realizó con la finalidad de evaluar el efecto de la aireación (oxigenación) del medio de cultivo en la actividad fermentativa de Brettanomyces intermedius RIVE 2-2-2 en cultivo mixto con Saccharomyces cerevisiae RIVE 15-1-416 y la producción de compuestos volátiles de importancia sensorial. Así mismo, se cultivó Brettanomyces intermedius RIVE 2-2-2 en cultivo puro en biorreactor con el objetivo de evaluar su actividad fermentativa en condiciones de flujo de aire constante.
Material y MétodoMicroorganismosEn los experimentos se utilizaron Brettanomyces intermedius RIVE 2-2-2 y Saccharomyces cerevisiae RIVE 15-1-416 adquiridos de la colección de levaduras del Instituto de Investigación de Viticultura y Enología, Bratislava– República Eslovaca, y fue mantenido en agar extracto de malta a 7°C con renovación periódica cada tres meses. Todos los ensayos y análisis en este estudio se realizaron por triplicado.
Síntesis de compuestos de importancia sensorialPreparación de inóculo y condiciones de fermentaciónJugo de manzana reconstituido hasta una concentración de sólidos totales de 12.8% w/w y pH 3.8 y sin aroma se ha utilizado en el presente estudio como medio de fermentación. El jugo fue proporcionado por Severofrukt a.s., Terezin, República Checa. La remoción del aroma se realizó durante el proceso de concentración en un evaporador provisto de una columna de separación de volátiles. Se utilizó jugo sin aroma para evaluar la producción de compuestos volátiles por las levaduras en estudio y no interferir los resultados con aquellos compuestos volátiles propios de la materia prima. Las fermentaciones mixtas con Brettanomyces intermedius RIVE 2-2-2 y Saccharomyces cerevisiae RIVE 15-1-416 se realizaron en cultivo estático y agitado en matraces Erlenmeyer de 0.5 L conteniendo 250mL de cultivo. Las fermentaciones en cultivo agitado se realizaron a 200min−1 durante ocho días y, en cultivo estático el tiempo de fermentación fue de 15 días. Los experimentos se realizaron a 28°C y la relación de inóculo fue de 1:1 para cada cepa. Con la finalidad de comparar la producción de compuestos volátiles se realizaron fermentaciones con cultivo puro de Saccharomyces cerevisiae RIVE 15-1-416 en las mismas condiciones.
La propagación de las dos cepas de levadura (inóculo) se realizó individualmente en 100mL de jugo de manzana estéril a 28°C durante 24 horas, los frascos se agitaron a 200min−1 en un agitador orbital. Luego de centrifugar y separar las células, los medios de fermentación se inocularon con 1.0±0.1 gramos de células en peso húmedo.
Análisis sensorial y estadísticoEl análisis sensorial de las cuatro bebidas fermentadas se realizó mediante el método de rangos positivos de Buxbaum. Este método se basa en la evaluación de cuatro atributos sensoriales (color, limpidez, olor y sabor), cada uno con rangos de puntuación fijos máximos (color=2, limpidez=2, olor=4, sabor=12), que en total suman 20 puntos. Con la finalidad de evaluar solamente el olor y sabor se ha omitido evaluar el color y la limpidez otorgando a cada uno de ellos el puntaje máximo. Las muestras fueron evaluadas por un panel de 6 jueces hombres entre 25 y 30 años de edad. Se seleccionaron aquellos con experiencia en evaluación sensorial. El análisis sensorial se ha realizado según Meilgaard et al.43. Con la finalidad de determinar si existe diferencia estadísticamente significativa (P<0.01) entre las medias de los tratamientos tanto en el olor y sabor se ha utilizado el análisis de varianza (ANOVA). Para determinar cuáles tratamientos son diferentes estadísticamente significantes (P<0.05) se ha utilizado la prueba de rangos múltiples de Duncan. El software SPSS 13.0 (SPSS Inc., Chicago, IL, USA) fue utilizado para el análisis estadístico de los resultados.
Cultivo batch en biorreactorEste experimento se realizó con la finalidad de evaluar la influencia del oxígeno del aire en el metabolismo de Brettanomyces intermedius RIVE 2-2-2, para lo cual se utilizó jugo de manzana de la variedad Rubin con un contenido de sólidos totales de 13% en peso y pH 3.8. Las manzanas fueron adquiridas de la distribuidora de frutas y hortalizas Fruit-CZ, Praga, República Checa. Luego de la extracción, el jugo se colocó en frascos de 10 L y se pasteurizó en un termostato a 65–70°C durante 12 horas (incluyendo el tiempo de enfriado) con la finalidad de eliminar la flora microbiana y además todos los compuestos volátiles varietales44,45. El jugo de manzana se suplementó con KH2PO4 1,2g/L y (NH4)2SO4 1,2g/L como fuente de fósforo y amonio para promover el crecimiento de las células de levadura. Los cultivos se realizaron en un biorreactor (BIOSTAT–B. Braun International, Alemania) de 2 L conteniendo 1.5 L de medio de cultivo. El biorreactor estuvo conectado a una unidad de regulación y medición micro-DCU-300 y además estuvo equipado con un agitador, medidor de pH, termómetro y un electrodo de medición de oxígeno disuelto. Los parámetros considerados en el cultivo se mantuvieron constantes a lo largo del proceso y fueron: temperatura 18°C, frecuencia de agitación 300min−1 y flujo de aire 25l/h (0.2moles O2/h). El tiempo de cultivo se dejó hasta el incremento de la concentración de oxígeno disuelto en el medio a su valor inicial.
El inóculo se propagó en un medio sintético con la siguiente composición: glucosa 8.0g/L; peptona 10.0g/L; KH2PO4 1.2g/L; (NH4)2SO4 1.2g/L y extracto de levadura 10.0g/L, el pH se ajustó a 3.6. Un volumen de medio equivalente al 5 %v/v del medio de cultivo se utilizó para la propagación de células y se llevó a cabo en un agitador orbital a 150min−1 durante 48 horas a 28°C, luego de ello se centrifugó y las células obtenidas se inocularon en el biorreactor.
Métodos analíticosLos compuestos volátiles producidos durante la fermentación (alcoholes superiores y ésteres) se analizaron en un cromatógrafo de gases (Hewlett-Packard 5890II), equipado con una columna HP5 (30m x 0.32mm) y un detector de ionización de flama.
Las muestras fermentadas por triplicado se centrifugaron y filtraron en una membrana de microfiltración de 0.45μm de porosidad, luego se extrajeron los compuestos volátiles mediante el método de microextracción con diclorometano46. Para la cuantificación se utilizó el método del estándar interno. Se determinaron los factores de respuesta del estándar interno (1-hexanol) y de cada compuesto para la cuantificación del compuesto volátil en la muestra. 1μL de cada extracto conteniendo una concentración conocida del estándar interno se inyectó en el cromatógrafo.
El ácido acético, succínico, málico, etanol, glicerol, fructosa y glucosa se analizaron en un HPLC (Pump LCP 4000), equipado con una columna Watrex 250 x 8mm (Ostion LGKS 0800 H+) y un detector de índice de refracción. En el análisis se utilizó 0.005 M de H2SO4 como fase móvil a una tasa de flujo de 1mL/min. Las muestras fermentadas por triplicado luego de ser filtradas y centrifugadas se diluyeron con agua desmineralizada (1:3) y se inyectaron al equipo. Para la cuantificación de compuestos se utilizó el método del estándar externo.
La biomasa celular se determinó mediante gravimetría. Para ello, las células se separaron por centrifugación a 3000min−1 durante 10 minutos, se lavaron tres veces con agua destilada, luego se secaron a 110 °C durante 2 horas y finalmente se pesaron. Además, se determinaron el coeficiente global de rendimiento de biomasa YX/S y la tasa de crecimiento específico (μ) respectivamente47.
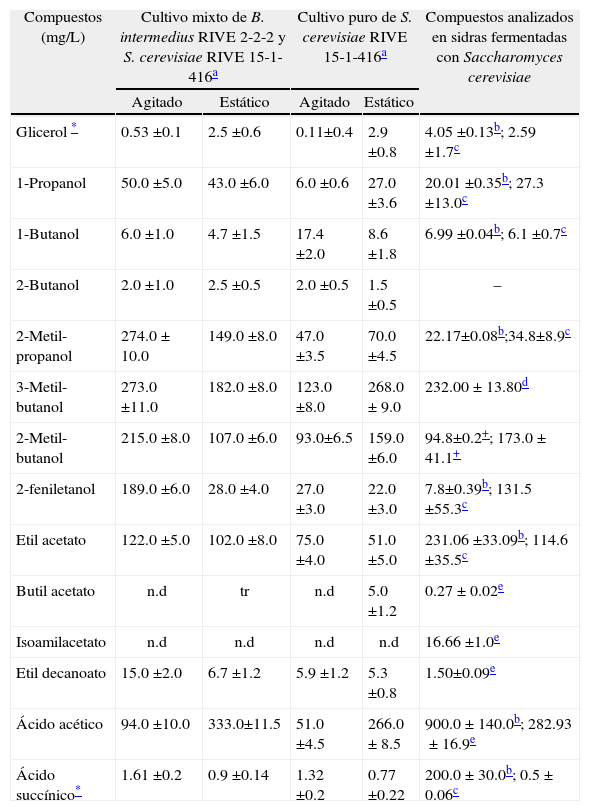
Discusión deresultadosSíntesis de compuestos de importancia sensorialDurante la fermentación alcohólica se produce etanol y otros compuestos químicos de importancia sensorial. En la Tabla I se muestran las concentraciones de los compuestos producidos en la fermentación mixta entre Brettanomyces intermedius RIVE 2-2-2 y Saccharomyces cerevisiae RIVE 15-1-416 en cultivo estático y agitado, así mismo se muestra con fines de comparación los principales compuestos encontrados en sidras reportados en la bibliografía. Se ha observado una mayor producción de glicerol en cultivo estático (2.5±0.6g/L) comparado con el cultivo agitado (0.53±0.1g/L), y una ligera menor producción comparado con el cultivo puro estático de S. cerevisiae (2.9±0.8g/L). La mayor producción de glicerol está confinada a la cepa de S. cerevisiae. Una mayor producción de glicerol es favorable para el perfil sensorial de la bebida fermentada, ya que imparte un ligero sabor dulce48.
Compuestos de importancia sensorial producidos en cultivo mixto con Brettanomyces intermedius RIVE 2-2-2 y Saccharomyces cerevisiae RIVE 15-1-416 cultivados enjugo de manzana a28°C en condiciones de cultivo estático y agitado.
| Compuestos (mg/L) | Cultivo mixto de B. intermedius RIVE 2-2-2 y S. cerevisiae RIVE 15-1-416a | Cultivo puro de S. cerevisiae RIVE 15-1-416a | Compuestos analizados en sidras fermentadas con Saccharomyces cerevisiae | ||
| Agitado | Estático | Agitado | Estático | ||
| Glicerol * | 0.53 ±0.1 | 2.5 ±0.6 | 0.11±0.4 | 2.9 ±0.8 | 4.05 ±0.13b; 2.59 ±1.7c |
| 1-Propanol | 50.0 ±5.0 | 43.0 ±6.0 | 6.0 ±0.6 | 27.0 ±3.6 | 20.01 ±0.35b; 27.3 ±13.0c |
| 1-Butanol | 6.0 ±1.0 | 4.7 ±1.5 | 17.4 ±2.0 | 8.6 ±1.8 | 6.99 ±0.04b; 6.1 ±0.7c |
| 2-Butanol | 2.0 ±1.0 | 2.5 ±0.5 | 2.0 ±0.5 | 1.5 ±0.5 | – |
| 2-Metil-propanol | 274.0±10.0 | 149.0 ±8.0 | 47.0 ±3.5 | 70.0 ±4.5 | 22.17±0.08b;34.8±8.9c |
| 3-Metil-butanol | 273.0 ±11.0 | 182.0 ±8.0 | 123.0 ±8.0 | 268.0±9.0 | 232.00±13.80d |
| 2-Metil-butanol | 215.0 ±8.0 | 107.0 ±6.0 | 93.0±6.5 | 159.0 ±6.0 | 94.8±0.2+; 173.0±41.1+ |
| 2-feniletanol | 189.0 ±6.0 | 28.0 ±4.0 | 27.0 ±3.0 | 22.0 ±3.0 | 7.8±0.39b; 131.5 ±55.3c |
| Etil acetato | 122.0 ±5.0 | 102.0 ±8.0 | 75.0 ±4.0 | 51.0 ±5.0 | 231.06 ±33.09b; 114.6 ±35.5c |
| Butil acetato | n.d | tr | n.d | 5.0 ±1.2 | 0.27±0.02e |
| Isoamilacetato | n.d | n.d | n.d | n.d | 16.66 ±1.0e |
| Etil decanoato | 15.0 ±2.0 | 6.7 ±1.2 | 5.9 ±1.2 | 5.3 ±0.8 | 1.50±0.09e |
| Ácido acético | 94.0 ±10.0 | 333.0±11.5 | 51.0 ±4.5 | 266.0±8.5 | 900.0±140.0b; 282.93±16.9e |
| Ácido succínico* | 1.61 ±0.2 | 0.9 ±0.14 | 1.32 ±0.2 | 0.77 ±0.22 | 200.0±30.0b; 0.5±0.06c |
Con respecto a la producción total de alcoholes superiores se observa que en el cultivo agitado se produjo mayor cantidad (1.009g/L) comparado con el cultivo estático (516.2mg/L); la mayor producción se debe al efecto del oxígeno incorporado al medio durante la agitación. El oxígeno promueve una mayor utilización de glucosa y aminoácidos, cuya degradación produce compuestos intermediarios (cetoácidos) de la síntesis de alcoholes superiores49. Estudios publicados anteriormente por el autor también reportaron la influencia de la agitación del medio en el incremento de alcoholes superiores por especies de levaduras no-Saccharomyces50,51. Resultados interesantes se obtuvieron en nuestro estudio al comparar el cultivo mixto con el cultivo puro (Tabla I), así se observó que, la cantidad total de alcoholes superiores producido en el cultivo estático (556.1mg/L) no difiere mucho con la cantidad producida en el cultivo mixto (516.2mg/L), sin embargo, se observó lo contrario en el cultivo mixto agitado donde se produjo hasta tres veces más la cantidad de alcoholes superiores que en el cultivo puro agitado (315.4mg/L).
Los ésteres imparten el aroma frutal en las bebidas fermentadas, por esa razón su presencia determina en parte la calidad sensorial. Etil acetato es el éster de mayor importancia por su concentración. Como se muestra en la Tabla I, la mayor producción de etil acetato se produjo en el cultivo mixto agitado (122.0±5.0mg/L). Nuestros resultados concuerdan con lo reportado por Rojas et al.36 quienes reportaron que la aireación (agitación) del medio promueve una mayor síntesis de etil acetato. Así mismo, la tasa de formación del etil acetato está relacionada con la disponibilidad del ácido acético, etanol y además de la actividad de la acetiltransferasa y éster sintasa necesarios para su formación29,33. Por el contrario, S. cerevisiae tanto en el cultivo puro estático como en el agitado produjo menores cantidades (51.0±5.0mg/L y 75.0±4.0mg/L) de etil acetato respectivamente. Se considera que el etil acetato en altas concentraciones a las deseadas afecta negativamente la calidad de los vinos confiriéndoles un olor y aroma desagradable52. Lo mismo ocurre en sidras, una alta cantidad de etil acetato otorga un intenso aroma y olor acético, lo cual se considera de baja calidad53. Estudios han reportado la producción de etil acetato y etil decanoato por B. intermedius42.
El ácido acético es otro metabolito importante para la calidad sensorial de bebidas alcohólicas fermentadas. Como se observa en la Tabla I, la mayor producción de ácido acético se produjo en el cultivo estático (333.0±11.5mg/L) comparado con el cultivo agitado (94.0±10.0mg/L). Similar comportamiento se observó en el cultivo puro donde la máxima producción de ácido acético se produjo en el cultivo estático (266.0±8.5mg/L). Estos resultados son diferentes a lo esperado ya que Brettanomyces spp., es conocido por producir altas concentraciones de ácido acético causando defectos organolépticos en bebidas fermentadas25. Sin embargo, el mismo autor también ha reportado que algunas cepas de algunas especies de Bretanomyces no producen ácido acético en condiciones de limitación de oxígeno. Por otra parte, Aguilar-Uscanga et al.18 reportó una mínima producción de ácido acético (25mg/L) en condiciones anaerobias.
Estudios realizados por otros autores con cultivos mixtos reportaron que durante los primeros diez días de la fermentación, S. cerevisiae es dominante y al final de la fermentación especies de Brettanomyces entre ellas B. intermedius se vuelven dominantes y completan la fermentación cuando la concentración de etanol es alta y el azúcar es residual54. Abbott et al.55 también reportó que durante los primeros días de la fermentación S. cerevisiae crece más rápido que B. intermedius, y sólo cuando la concentración de ácido acético es suficiente para afectar la actividad de S. cerevisiae, B. intermedius crece más rápido. Uscanga et al.56 reportó que en concentraciones relativamente altas de ácido acético disminuye el crecimiento y la actividad fermentativa de S. cerevisiae. Esto explicaría en parte el por qué en cultivo mixto no se ha observado una real influencia de Brettanomycesintermedius RIVE 2-2-2 durante la fermentación en términos de producción de ácido acético y otros metabolitos.
Las fermentaciones realizadas en matraces Erlenmeyer agitados y tapados con algodón son consideradas como microaerobias, debido a que presentan limitaciones en la transferencia de oxígeno desde el exterior hacia el interior57,58, estas condiciones crean un medio cuasi anaerobio para Saccharomyces cerevisiae y limitaría por otro lado la formación de ácido acético por Brettanomyces intermedius. Así mismo, en fermentaciones no agitadas las células que están en el fondo del matraz donde las condiciones son más anaerobias, realizan una fermentación anaerobia débil y aquellas expuestas al oxígeno de la superficie realizan una fermentación aerobia en proporción a la cantidad de oxígeno disuelto en el medio. A medida que el oxígeno es consumido, la actividad fermentativa de estas células decrece. Así, las células se adaptan lentamente a las condiciones anaerobias del medio y la fermentación anaerobia se establece paulatinamente. En estas condiciones, la producción de etanol en aerobiosis sucede a una velocidad más rápida comparada con la fermentación anaerobia.
La temperatura de fermentación influye en su duración, ya que afecta el metabolismo de la levadura. Se han reportado que fermentaciones realizadas a 30°C con especies de Brettanomyces terminaron entre 3–5 días, mientras que a 24°C requirieron de 5–7 días25.
El análisis de varianza (ANOVA) aplicado a los resultados de la prueba Buxbaum mostró diferencias estadísticamente significativas (P<0.01) en todas las medias de los cuatro tratamientos tanto en el olor y el sabor. Así mismo, los resultados de la prueba Duncan mostraron diferencias significativas (P<0.05) en el olor entre todos los tratamientos, excepto entre las bebidas fermentadas estáticamente en cultivo mixto y puro. En lo que se refiere al sabor, todos los tratamientos mostraron diferencias estadísticas significativas. Con respecto a la descripción del aroma, los jueces describieron a las bebidas con un aroma característico a manzana, excepto para la bebida fermentada con cultivo mixto en agitación, refiriéndose a ésta como a “medicinal” y algunas veces como a “condimentado”.
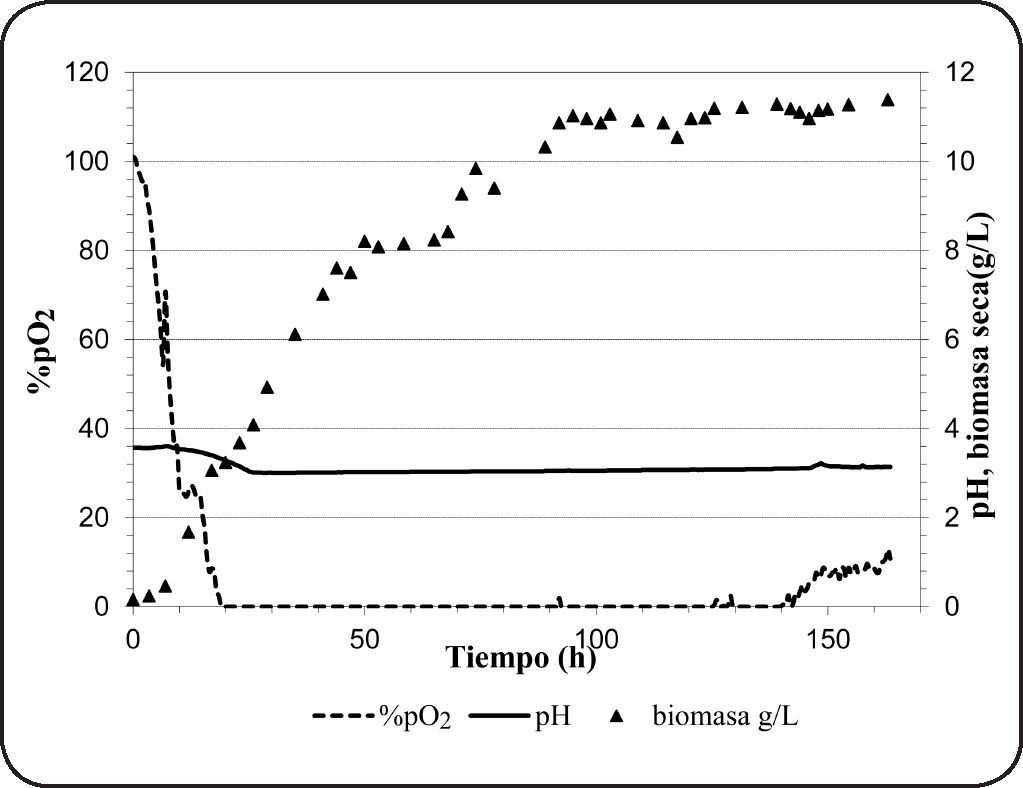
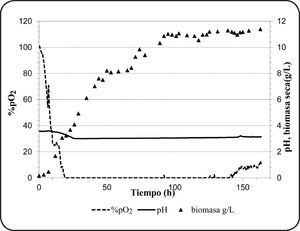
Cultivo batch en biorreactorEl oxígeno es el factor más importante que determina la actividad fermentativa en Brettanomyces spp. La Figura 2 muestra el transcurso del consumo de oxígeno, el crecimiento celular y la variación del pH durante 7 días de cultivo en condiciones aerobias. Como se observa, después de la 20ava hora la concentración de oxígeno disuelto en el medio disminuyó hasta cero y así permaneció hasta la 140ava hora. Esto significa que el oxígeno transferido al medio ha sido consumido en su totalidad, sin embargo, este valor no da información de la tasa de consumo de oxígeno. El oxígeno es poco soluble en agua pura (9.1mg/L, 20°C) y a medida que la temperatura o la viscocidad del medio se incrementa, la solubilidad disminuye. La transferencia de oxígeno al medio es crucial y depende de muchos factores, entre ellos; el flujo de aire, la velocidad de agitación, la composición del medio, la geometría del biorreactor, entre otros. Normalmente, el oxígeno consumido es utilizado en la oxidación de la glucosa, pero también en vías no respiratorias como en la síntesis de esteroles y ácidos grasos insaturados que son componentes esenciales de la membrana celular59. Además, se observó el efecto de diaúxia, que también ha sido reportado anteriomente en levaduras del género Brettanomyces60. El crecimiento diaúxico se observa cuando se cultiva en medios que contienen dos fuentes de azúcar (glucosa+sucrosa)60, siendo la glucosa consumida en primer término. Cuando la glucosa y la fructosa están presentes en el medio, existe una competencia por su utilización, sin embargo el consumo de glucosa se inicia de inmediato seguido de la fructosa para después ser utilizados ambos azúcares de manera casi simultánea61, tratando de explicar este fenómeno, se ha sugerido la competición del mismo transportador por estos dos azúcares.
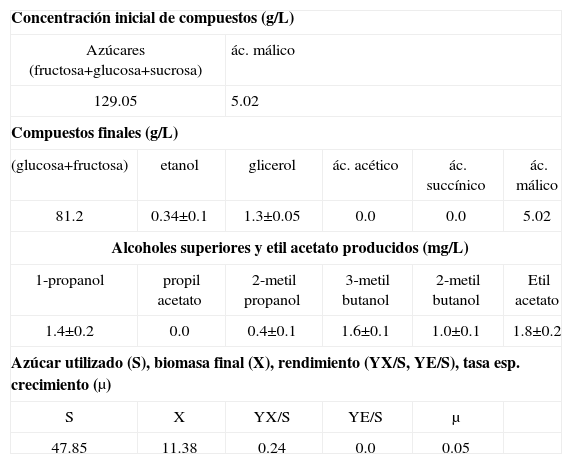
Así mismo, se ha observado el incremento gradual de biomasa alcanzando un valor de 11.38g biomasa seca/L al final del cultivo (Tabla II). El azúcar consumido es utilizado en el crecimiento celular, en procesos como “maintenance”66, o en la formación de productos de la fermentación. En los compuestos producidos se observan pequeñas cantidades de etanol (0.34±0.1g/L), y además ausencia del ácido acético. Las bajas concentraciones de etanol se deben a que el oxígeno limita su producción contrariamente a la producción del ácido acético. Sin embargo, la ausencia del ácido acético bajo estas condiciones es un fenómeno no esperado. Sin embargo, Abbott et al.55 ha reportado que algunas especies de Brettanomyces no producen ácido acético cuando son cultivados en medios con concentraciones altas de azúcar y bajo condiciones aerobias de cultivo. Por otro lado, se han observado bajas concentraciones de 1-propanol, 2-metil-propanol, 3-metil-butanol, 2-metil-butanol y etil acetato. La presencia de etil acetato (1.8±0.2mg/L) indica que se ha producido ácido acético durante el cultivo. Así mismo, los valores bajos de rendimiento de biomasa (0.24g biomasa seca/g azúcar utilizado) indicaría que el catabolismo de la glucosa ha sido fermentativo. Este resultado concuerda con lo observado por Silva et al.13 quien reportó valores similares de rendimiento.
Compuestos utilizados y producidos por Brettanomyces intermedius RIVE 2-2-2 durante el cultivo batch a 18°C.
| Concentración inicial de compuestos (g/L) | |||||
| Azúcares (fructosa+glucosa+sucrosa) | ác. málico | ||||
| 129.05 | 5.02 | ||||
| Compuestos finales (g/L) | |||||
| (glucosa+fructosa) | etanol | glicerol | ác. acético | ác. succínico | ác. málico |
| 81.2 | 0.34±0.1 | 1.3±0.05 | 0.0 | 0.0 | 5.02 |
| Alcoholes superiores y etil acetato producidos (mg/L) | |||||
| 1-propanol | propil acetato | 2-metil propanol | 3-metil butanol | 2-metil butanol | Etil acetato |
| 1.4±0.2 | 0.0 | 0.4±0.1 | 1.6±0.1 | 1.0±0.1 | 1.8±0.2 |
| Azúcar utilizado (S), biomasa final (X), rendimiento (YX/S, YE/S), tasa esp. crecimiento (μ) | |||||
| S | X | YX/S | YE/S | μ | |
| 47.85 | 11.38 | 0.24 | 0.0 | 0.05 | |
YX/S: g biomasa/g azúcar; YE/S: g etanol/g azúcar; μ: tasa específica de crecimiento (h−1); X: biomasa seca final (g/L); S: azúcar total consumido (g/L).
Además, se observó una tasa de crecimiento específico (μ) de 0.05h−1. Valores bajos de tasa de crecimiento son observados típicamente en fermentaciones, así Brettanomyces intermedius RIVE 2-2-2 en presencia de azúcar residual (81.2g/L) muestra aún crecimiento y producción de metabolitos de la fermentación. Por otro lado, no se ha observado una disminución del contenido de ácido málico, lo que significa que el oxígeno no estimula su consumo.
ConclusionesLa agitación durante el cultivo mixto con Brettanomyces intermedius RIVE 2-2-2 y Saccharomyces cerevisiae RIVE 15-1-416 disminuye la producción de glicerol e incrementa el balance total de alcoholes superiores y etil acetato. Así mismo, la agitación parece no influir en la producción de ácido acético por Brettanomyces intermedius RIVE 2-2-2, así, la mayor producción de ácido acético se observó en cultivo estático. En comparación con el cultivo puro de S. cerevisiae RIVE 15-1-15 se observó un efecto similar de la agitación en la producción de compuestos de la fermentación.
Por otra parte, en el cultivo en biorreactor no se ha observado la producción de ácido acético al final del cultivo pero sí pequeñas cantidades de etanol, alcoholes superiores y etil acetato. Los valores bajos de rendimiento (Yx/s) y tasa de crecimiento específico (μ) están correlacionados con su lento crecimiento bajo estas condiciones. Finalmente, se requieren estudios adicionales sobre la influencia de la aireación en la actividad fermentativa de Brettanomyces intermedius con la finalidad de dilucidar su comportamiento en cultivos mixtos con otras levaduras.