La vasculopatía livedoide es una enfermedad poco frecuente, caracterizada por ulceración crónica y dolorosa en los miembros inferiores, que tiende a evolucionar a lesiones de atrofia blanca, que no son patognomónicas, sino el resultado de múltiples procesos. Es mucho más frecuente en el género femenino, y en la mayoría de los casos se presenta de forma bilateral en el tercio distal de las extremidades inferiores.
Su diagnóstico no es sencillo, y en muchos casos no se obtiene hasta que el cuadro está ya evolucionado, siendo fundamental la correlación clínico-patológica. La realización de biopsia cutánea de las lesiones colabora en el diagnóstico, pero no posee hallazgos patognomónicos.
Existe un amplio arsenal terapéutico que debe valorarse individualmente en función de cada caso.
Livedoid vasculopathy is a rare disease characterized by chronic, painful ulceration of the lower limbs that tends to progress to white atrophic lesions (atrophie blanche). These lesions are not pathognomonic but are the result of multiple processes. Livedoid vasculopathy is much more common in females, and usually occurs bilaterally in the distal third of the lower extremities.
Diagnosis is not easy and is often not made until the disease has progressed. Consequently clinical and pathological correlation is required to suspect this entity. Biopsy of skin lesions aids diagnosis, but lacks pathognomonic findings. A broad therapeutic arsenal is available, which should be assessed individually according to the characteristics of each patient.
La vasculopatía livedoide (VL) es una enfermedad crónica y dolorosa localizada en los miembros inferiores, caracterizada por la presencia de máculas o pápulo-placas purpúricas con tendencia a la formación de úlceras irregulares, que evolucionan a cicatrices atróficas de morfología estrellada e hiperpigmentación periférica, clásicamente descritas como atrofia blanca1–4.
En la literatura se han utilizado múltiples sinónimos para referirse a este cuadro, como los que se recogen en la tabla 1, siendo actualmente el término más ampliamente aceptado el de vasculopatía livedoide5–7.
Términos empleados para referirse a la vasculopatía livedoide.
| Vasculopatía livedoide |
| Livedo vasculitis |
| Vasculitis de atrofia blanca |
| Vasculitis livedoide |
| Livedo reticularis con ulceraciones en verano o invierno |
| Atrofia blanca en placa de Milian |
| Vasculitis hialinizante segmentaria |
| Vasculopatía livedoide y úlceras purpúreas dolorosas con patrón reticulado de las extremidades inferiores |
| Capilaritis alba |
| PURPLE (painful Purpuric Ulcers with Reticular Patterning of the Lower Extremities) |
Desde 1998, gracias a la contribución de Jorizzo8, se considera que la VL no es el resultado de otras enfermedades, sino una entidad clínica independiente.
FrecuenciaLa VL es una enfermedad poco frecuente. Su prevalencia se estima en torno a 1/100.000 casos por año. Puede ocurrir a cualquier edad, siendo frecuente en mujeres jóvenes, con una relación de 3:1. Se localiza preferentemente en los miembros inferiores, sobre todo en los tobillos y en el dorso de los pies, y en la mayoría de los casos su distribución es bilateral9.
EtiologíaLa VL es una entidad de etiopatogenia desconocida. Se piensa que existe una alteración idiopática oclusiva, no inflamatoria de los vasos sanguíneos de pequeño calibre con daño vascular hialinizante y segmentario10.
Por lo general, la VL muestra depósitos de fibrina en la pared y el lumen de los vasos afectados. La ausencia de una leucocitoclasia importante, así como de un infiltrado perivascular, sugiere que se trata de un proceso trombooclusivo más que de una vasculitis11.
El mecanismo subyacente al desarrollo de la VL puede estar relacionado, según Maessen-Visch et al2, con el desarrollo de un manguito de fibrina, con captura de los glóbulos blancos y de microtrombos, en relación con un defecto del activador del plasminógeno de las células endoteliales, y una disfunción plaquetaria.
Browse y Burnand12 postularon la teoría del manguito de fibrina: debido al compromiso venoso crónico, se producirían fugas de fibrinógeno de los capilares. Este fibrinógeno se coagularía para formar una banda de fibrina. Dicho brazalete rodea los vasos capilares y establece una barrera que impide que el oxígeno y los nutrientes lleguen a la piel. Sin embargo, para Maessen-Visch et al los manguitos de fibrina son más un indicio de la microcirculación alterada que un factor etiológico en la insuficiencia venosa crónica, y por lo tanto, esta teoría es de precisión incierta.
Algunos autores, como Papi et al13, sugieren que existiría un desorden inmunológico y una expresión de la P-selectina que podría tener un papel importante en el desarrollo de la VL.
Se han realizado varios estudios que asocian la VL con multitud de coagulopatías de carácter protrombótico (la mutación del factor V de Leiden, la deficiencia de la proteína C, y otros estados de hipercoagulabilidad heredados), en particular la hiperhomocisteinemia, que se traduce en un aumento de la coagulabilidad. Los niveles del activador tisular del plasminógeno (tPA) parecen ser menores en los pacientes con VL. El inhibidor del activador del plasminógeno (PAI-1) es un inhibidor importante del sistema fibrinolítico. El genotipo 4G/4G del promotor del PAI-1, en el que el PAI-1 está aumentado, se ha relacionado con la VL14–19.
Otros estudios han relacionado la disfunción plaquetaria con la VL, encontrando un aumento de la agregación plaquetaria, y un éxito terapéutico con fármacos antiplaquetarios20.
Irani-Hakime et al21 aportaron casos de NL en relación con la protrombina G20210A y la heterocigosidad del factor de V (Leiden) y la homocigosis MTHFR C677T, que implican estados protrombóticos.
En conclusión, la VL parece ser principalmente un cuadro oclusivo en lugar de una condición inflamatoria, por lo que no se corresponde con un auténtico fenómeno de vasculitis.
Las alteraciones fisiopatológicas más relevantes aparecen recogidas en la tabla 2.
Alteraciones fisiopatológicas en la vasculopatía livedoide.
| Incremento | Deficiencia |
| Fibrinopéptido A | Proteína C |
| Actividad plaquetaria | Proteína S |
| Homocisteína Formación de dímeros de fibrina Mutación heterocigótica del factor V de Leiden Resistencia a la inactividad de la proteína C | Liberación del activador tisular de plasminógeno (tPA) |
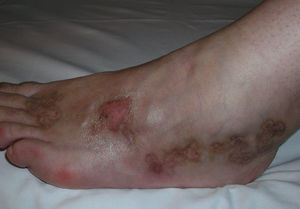
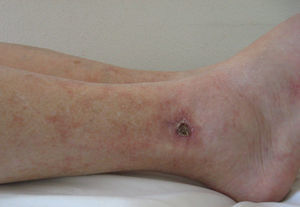
Los pacientes con VL presentan úlceras dolorosas de morfología estrellada, a menudo múltiples y agrupadas. Se localizan en las piernas, sobre todo en la región maleolar, siendo con frecuencia bilaterales. Ocasionalmente se asocian a livedo reticularis (LR), lo que es característico, aunque no constante (fig. 1). Algunos pacientes, particularmente aquellos con LR prominentes en torno a las úlceras, pueden desarrollar púrpura retiforme o estrellada. Las lesiones tienden a curar dando lugar a cicatrices atróficas blanquecinas con hiperpigmentación y telangiectasias periféricas (fig. 2)22.
Se ha descrito su asociación con el fenómeno de Raynaud, la acrocianosis, las venas varicosas (20-75% de los casos), la lipodermatoesclerosis y la mononeuritis múltiple23,24.
No hay exámenes de laboratorio específicos que permitan hacer un diagnóstico definitivo de la VL, aunque los niveles de P-selectina plaquetaria y trombomodulina endotelial pueden estar elevados. En la tabla 3 se recogen las determinaciones analíticas que pueden resultar útiles.
Pruebas complementarias de laboratorio que pueden mostrar alteraciones en pacientes con vasculopatía livedoide.
| Estudio de hemostasia (TP, TTPA) |
| Homocisteína sérica |
| Anticuerpos antinucleares (ANA) |
| Factor reumatoide (FR) |
| Complejos antígeno-anticuerpo circulantes |
| Velocidad de sedimentación globular (VSG) |
| Concentraciones del complemento (C4) |
| Crioglobulina y crioaglutininas |
| Globulinas |
| Electroforesis sérica y urinaria de proteínas |
| Actividad biológica y antígenos de proteína C y S, antitrombina III, factor V de Leiden |
| Anticuerpos anticardiolipina y anticoagulante lúpico |
| Viscosidad sanguínea |
| P-selectina plaquetaria y trombomodulina endotelial |
C4: factor 4 del complemento; TP: tiempo de protrombina; TTPA: tiempo de tromboplastina parcial activada.
La evaluación del paciente puede incluir estudios apropiados de imagen para descartar la enfermedad vascular periférica (venosa y arterial). Por ejemplo, los estudios de ecografía-Doppler venosos pueden ser útiles La microcirculación puede ser estudiada por microscopía capilar, mediciones de oxígeno transcutáneo, flujometría láser-Doppler, imágenes de perfusión láser-Doppler y microlinfografía.
La biopsia cutánea es de gran ayuda, y una prueba complementaria esencial ante la sospecha clínica de VL, aunque por sí sola no es diagnóstica25.
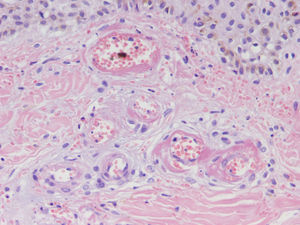
Anatomía patológicaLa histopatología de la VL no es patognomónica y posee características variables en función del estadio evolutivo de la lesión estudiada. En fases iniciales muestra un infiltrado linfocitario perivascular difuso con un infiltrado intersticial de neutrófilos, fibrina depositada en la pared vascular y trombos de fibrina en la luz de las vénulas de la dermis superior. En etapas intermedias aparece un infiltrado linfocitario perivascular superficial y profundo, con infiltrados de neutrófilos localizados en la dermis superior, depósitos de fibrina en la pared vascular y trombos de fibrina ocluyendo la luz de las vénulas, que predominan en la dermis superior. En esta fase también se observan hematíes extravasados en la dermis superior, edema en la dermis papilar, cambios de espongiosis y balonización, con formación de vesículas intraepidérmicas y necrosis epidérmica. Por último, en estadios tardíos predomina un infiltrado linfocitario perivascular superficial difuso, esclerosis y telangiectasias de la dermis superior, con un adelgazamiento epidérmico marcado (fig. 3).
Histopatología de un caso de vasculopatía livedoide. Se aprecian hematíes extravasados y un discreto infiltrado inflamatorio (linfocitos y neutrófilos) rodeando los vasos de pequeño calibre, con paredes vasculares engrosadas por depósitos eosinófilos de fibrina y vasos trombosados.
La inmunofluorescencia directa puede revelar la presencia de depósitos de inmunoglobulinas y componentes del complemento en los vasos de la dermis tanto superficial y media como profunda26,27.
Diagnóstico diferencialEl diagnóstico diferencial de la VL es amplio y debe plantearse con multitud de entidades.
Por las lesiones residuales que produce puede incluirse dentro del grupo de cuadros que cursan con atrofia blanca. Esta alteración, descrita por Milian en 1929, no es específica de la VL y puede deberse a multitud de procesos (síndrome antifosfolípido, vasculitis de pequeño vaso, úlceras por hidroxiurea, úlceras asociadas a insuficiencia venosa crónica, lupus, artritis reumatoide o síndrome de Klinefelter).
Otras muchas entidades pueden presentar LR. El síndrome de Sneddon's se caracteriza por la asociación de LR con accidentes cerebrovasculares y afecta por lo general a mujeres jóvenes con LR o livedo racemosa, hipertensión y síntomas neurológicos recurrentes. La panarteritis nudosa (PAN) es una vasculitis segmentaria que afecta fundamentalmente a las arterias de mediano calibre. Tanto la variante cutánea como la sistémica pueden presentar LR, úlceras y nódulos subcutáneos. La PAN sistémica cursa además con fiebre, artralgias, mialgias, parestesias, dolor abdominal, orquitis e hipertensión renovascular. La calcifilaxis consiste en el depósito de calcio en las paredes de los vasos sanguíneos y es más frecuente en el contexto de la insuficiencia renal crónica complicada por hiperparatiroidismo. En un principio, puede iniciarse como LR que posteriormente se convierte en púrpura y necrosis.
Otros cuadros que pueden presentar úlceras similares a las de la VL: las que aparecen en las colagenosis y en la insuficiencia arterial, y las postraumáticas1–8.
TratamientoDesde el punto de vista terapéutico es importante el control analgésico adecuado, para lo que son útiles los antiinflamatorios no esteroideos y los parches de lidocaína, así como las curas locales de las lesiones ulcerosas mediante recubrimiento y oclusión con apósitos hidrocoloides y el tratamiento de la posible sobreinfección, recomendándose la realización de cultivo y antibiograma, pautando antibioterapia tópica o sistémica, según se precise.
Clásicamente, se han utilizado como tratamiento de elección los corticoides sistémicos y otros inmunosupresores, como la azatioprina y el metotrexato, pero los recientes indicios de la probable relación del cuadro con un fenómeno de hipercoagulabilidad han orientado la terapéutica en este sentido. Por ello los antiagregantes y anticoagulantes están siendo utilizados con éxito en la actualidad, con multitud de casos comunicados de buena respuesta26–43.
Recientemente se ha comunicado la efectividad del rituximab en algún caso aislado de VL44.
En la tabla 4 se muestran los principales fármacos utilizados y sus mecanismos de acción.
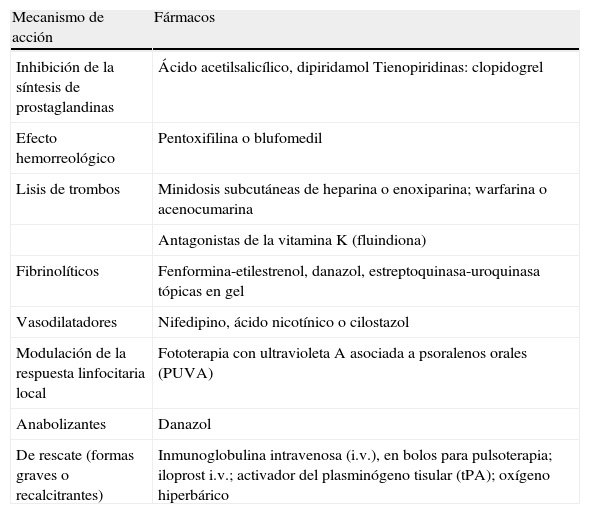
Fármacos más recientemente utilizados en el tratamiento de la vasculopatía livedoide clasificados según su mecanismo de acción.
| Mecanismo de acción | Fármacos |
| Inhibición de la síntesis de prostaglandinas | Ácido acetilsalicílico, dipiridamol Tienopiridinas: clopidogrel |
| Efecto hemorreológico | Pentoxifilina o blufomedil |
| Lisis de trombos | Minidosis subcutáneas de heparina o enoxiparina; warfarina o acenocumarina |
| Antagonistas de la vitamina K (fluindiona) | |
| Fibrinolíticos | Fenformina-etilestrenol, danazol, estreptoquinasa-uroquinasa tópicas en gel |
| Vasodilatadores | Nifedipino, ácido nicotínico o cilostazol |
| Modulación de la respuesta linfocitaria local | Fototerapia con ultravioleta A asociada a psoralenos orales (PUVA) |
| Anabolizantes | Danazol |
| De rescate (formas graves o recalcitrantes) | Inmunoglobulina intravenosa (i.v.), en bolos para pulsoterapia; iloprost i.v.; activador del plasminógeno tisular (tPA); oxígeno hiperbárico |
En general la VL es una enfermedad crónica, aunque está descrita la resolución espontánea o con tratamiento de las lesiones. Aunque se asocia a una morbilidad destacable, sobre todo en relación con el dolor localizado que se produce en las lesiones ulcerosas, la VL no se ha asociado a un incremento significativo de la mortalidad.
Conflicto de interesesLos autores comunican no tener ningún conflicto de intereses.