La artritis psoriásica (APs) se define como una artritis inflamatoria asociada a psoriasis; la presencia de artritis, entesitis, la ausencia de factor reumatoide y los hallazgos radiográficos típicos son algunas de sus principales características. El aumento de células inmunes e inflamatorias de la sinovitis articular genera citoquinas y otras moléculas que pueden influir en el remodelado óseo, produciendo una mayor frecuencia de osteoporosis y fracturas por fragilidad. Esta comorbilidad se ha documentado con más contundencia en la artritis reumatoide, mientras que en la APs ha sido menos valorada y existe menos información con respecto a la masa ósea de estos pacientes. Se ha estudiado con menor profundidad y en grupos heterogéneos de pacientes, y los resultados obtenidos son controvertidos al no existir coincidencia en mostrar una mayor frecuencia de osteoporosis.
En esta revisión repasamos los mecanismos etiopatogénicos sugeridos, las posibles estrategias en el manejo clínico y terapéutico, y realizamos una revisión de los distintos estudios publicados sobre el tema. La activación de la osteoclastogénesis por la propia enfermedad inflamatoria y el tratamiento con corticoides serían los principales mecanismos implicados en la osteoporosis de la APs.
La APs constituye una patología frecuente en nuestra práctica clínica habitual, por lo que sería conveniente disponer de más evidencias sobre la osteoporosis en estos pacientes, para tomar decisiones en su manejo.
Psoriatic arthritis (PA) is defined as an inflammatory form of arthritis associated with psoriasis. This condition is mainly characterized by the presence of arthritis, enthesitis, typical radiographic findings, and the absence of rheumatoid factor. The increase in immune and inflammatory cells of the synovitis produces cytokines and other molecules that may influence bone remodelling, increasing the frequency of osteoporosis and fragility fractures. Osteoporosis has been better documented in rheumatoid arthritis than in PA and there is less information on the bone mass of PA patients. Osteoporosis in PA has been studied less extensively and in heterogeneous groups of patients, and the results are contradictory since not all studies have shown a higher incidence of osteoporosis. The present review summarizes the suggested etiopathogenic mechanisms and possible strategies in the clinical management and treatment of this entity and provides a review of the studies published on the topic. The main mechanisms involved in osteoporosis in PA would seem to be the activation of osteoclastogenesis by the inflammatory disease itself and corticosteroid therapy. PA is a common condition in clinical practice and it more data on osteoporosis in these patients would help to improve decision making in the management of the PA.
Clásicamente la osteoporosis (OP) se ha definido como una disminución de la masa ósea por unidad de volumen, en relación con la normal para una determinada edad, sexo y raza, manteniéndose inalterada la estructura orgánica y el contenido mineral. Sin embargo, la definición de OP más aceptada en la actualidad es la de una enfermedad generalizada del esqueleto que se caracteriza por una disminución de la masa ósea y la alteración de la microarquitectura del hueso, que provoca un aumento de la fragilidad ósea y un mayor riesgo de fracturas1. En esta definición, aceptada en el Osteoporosis Consensus Development en Hong Kong en el año 1993 por un grupo de expertos, el concepto de OP pasa de ser un valor cuantificable (densidad ósea) a una situación más compleja que se concreta en un aumento de la fragilidad del hueso.
La alteración de la microarquitectura del hueso requiere estudios de biopsia ósea que no se pueden realizar de forma sistemática en la práctica clínica, y además la histomorfometría carece de suficiente reproducibilidad2, por lo que la cuantificación de la densidad mineral ósea (DMO) mediante la densitometría constituye la técnica fundamental para el diagnóstico y el manejo de la OP.
La Organización Mundial de la Salud (OMS)3 estableció una clasificación de la DMO para el diagnóstico de la OP en mujeres posmenopáusicas, en la que se establecen 4categorías según los resultados de la densitometría por absorciometría de rayos x de doble energía (DXA) de columna lumbar o cuello femoral:
- •
Normal: DMO superior a –1DE de T-score.
- •
Osteopenia: DMO entre –1 y –2,5DE de T-score.
- •
Osteoporosis: DMO inferior a –2,5DE de T-score.
- •
Osteoporosis grave (establecida): cuando a la situación anterior se añade la presencia de fracturas.
Sin embargo, estos criterios no son aplicables en mujeres premenopáusicas y hombres de menos de 50años, ya que la relación entre la disminución de la DMO y el riesgo de fractura está menos definida en estas poblaciones que en las mujeres posmenopáusicas, por lo que debería utilizarse la Z-score, considerándose que una disminución de –2,0DE se encuentra por debajo del rango esperado para su edad4, y en estos casos habría que investigar cuidadosamente otros factores que puedan ser una causa subyacente de OP, entre los que se encuentran algunas enfermedades reumáticas inflamatorias, fundamentalmente la artritis reumatoide (AR).
La artritis psoriásica (APs) se define como una artritis inflamatoria asociada a psoriasis5; la presencia de artritis y entesitis, la ausencia de factor reumatoide y hallazgos radiográficos típicos6,7 son otras de sus características.
Los cambios que ocurren en las articulaciones de los enfermos con APs son debidos a una sinovitis inflamatoria, que inicialmente se describió como similar a la que aparecía en la AR. Una de las características principales de las artritis inflamatorias crónicas es la de destruir cartílago y hueso, lo que se asocia a OP sistémica y mayor susceptibilidad de padecer fracturas por fragilidad8. También en la espondilitis anquilosante (EA) se ha encontrado una masa ósea baja, sobre todo en hombres, de etiología no suficientemente aclarada9. Sin embargo, en la APs esta comorbilidad ha sido menos valorada y existe menos información con respecto a la masa ósea de estos pacientes. La OP yuxtaarticular que existe es menor que en la AR y no se ha relacionado tan claramente con la inflamación, y la OP generalizada se ha estudiado con menor profundidad, en grupos de pacientes pequeños, utilizando técnicas y localización de densitometría ósea diferentes, lo que limita en gran medida las conclusiones que pueden extraerse de estos estudios.
Etiología y patogeniaEl hueso es una estructura dinámica, en un proceso en el que se forma durante el crecimiento (modelado) y se reconstruye en la edad adulta (remodelado). El remodelado es una combinación de la actividad osteoclástica o resorción y de la osteoblástica o formación, con la participación de osteoclastos y osteoblastos, respectivamente, en la que el hueso viejo se reemplaza por tejido óseo nuevo10. En la OP se produce un desequilibrio entre la resorción y la formación ósea que causa una pérdida ósea y mayor predisposición a la fractura11.
El hueso de la APs puede afectarse por el proceso patogénico de la enfermedad y también por los fármacos que frecuentemente utilizamos en ella, como los glucocorticoides (GC), los inmunosupresores o las terapias anti-TNF, que van a producir un desequilibrio del remodelado óseo y OP.
Osteoporosis en la artritis inflamatoriaEn la APs se produce hipertrofia e hiperplasia sinovial, aumento de la angiogénesis y un infiltrado de células inflamatorias que consiste predominantemente en células mononucleares como linfocitosT y macrófagos activados, y algunas célulasB, aunque también se pueden detectar algunas células polimorfonucleares.
Las citoquinas inflamatorias producidas por las células inmunes que estimulan la formación y la activación de los osteoclastos se han referido como el mecanismo de relación principal entre el sistema inmune y el metabolismo óseo, tanto en la psoriasis cutánea12 como en la APs13,14, y como posible causa para justificar una mayor frecuencia de OP.
La inflamación crónica de la sinovial reumatoide genera citoquinas, como son el factor de necrosis tumoral alfa (TNFα), el factor estimulante de colonias-macrofágico (M-CSF) y ligando del receptor activador del factor nuclear Kappa-β (RANKL), que aumentan la osteoclastogénesis15–17 y la destrucción del hueso artrítico.
El patrón de citoquinas producidas por las células inflamatorias de la sinovial y en el líquido sinovial en la APs muestra un perfil Th1, similar al de la AR18,19, aunque se aprecian algunas diferencias, como más IFNγ, TNFα, IL-1β, IL-2 y sobre todo IL-10 en la APs, y menos de otras como IL-4 e IL-520, circunstancias que podrían justificar distintos aspectos etiopatogénicos en estas enfermedades y ocasionar una alteración diferente en el hueso de estas artropatías crónicas. También se ha referido un número aumentado de precursores de osteoclastos en sangre periférica de pacientes con APs erosiva, en comparación con controles sanos21.
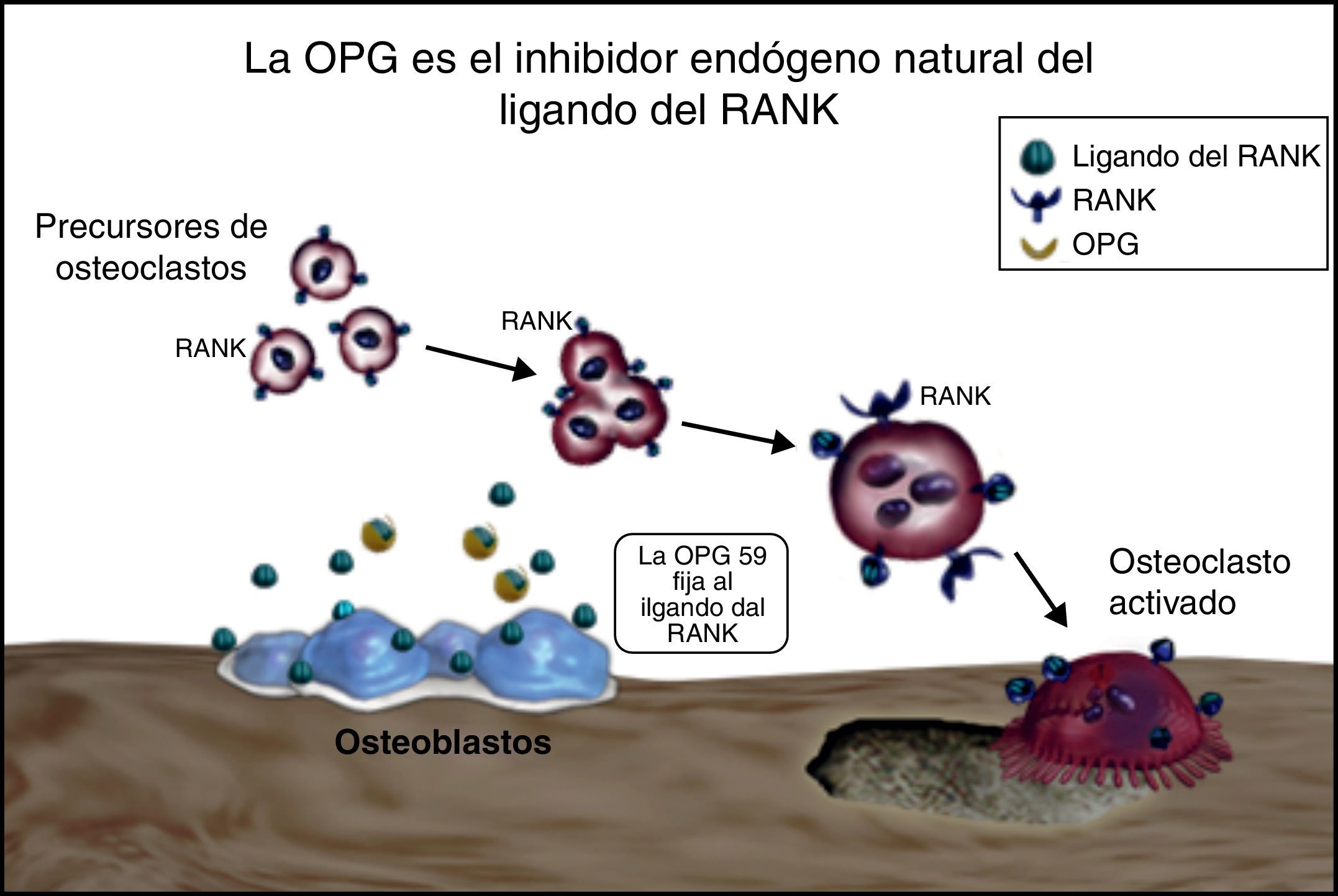
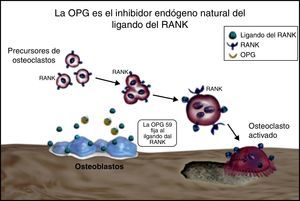
No obstante, experimentos de ablación genética realizados en ratones22 han mostrado el sistema RANKL/RANK/osteoprotegerina (OPG) (fig. 1), de la superfamilia TNF/receptor del TNF, como la base molecular fundamental de la osteoclastogénesis22,23 y, por tanto, un mecanismo primordial en la participación del remodelado óseo en la artritis crónica. Los efectos del RANKL están mediados por su unión a un receptor altamente específico: el RANK, al cual activan. Es una proteína transmembrana expresada por los osteoclastos. La unión del RANK con su ligando RANKL induce la activación de una cascada de eventos intracelulares que llevan a la diferenciación y a la activación de los osteoclastos y a una mayor resorción ósea. La OPG funciona como un factor soluble segregado por los osteoblastos, que actúa como receptor señuelo uniéndose al RANKL y neutralizándolo; ocupa e impide su unión con el RANK, inhibiendo el desarrollo de osteoclastos.
Las citoquinas inflamatorias, como TNFα, IL-1, IL-6 o IL-17, aumentan la expresión por parte de las células estromales de RANKL o reducen la expresión de OPG, promoviendo de esta forma la osteoclastogénesis y la reabsorción ósea. Entre las citoquinas proinflamatorias la que ha sido mejor estudiada es el TNFα, que gracias a sus propiedades pleotrópicas sobre multitud de células se considera la citoquina dominante para la destrucción ósea en la artritis24,25, al aumentar la diferenciación y la proliferación de los osteoclastos en presencia de RANKL.
Sin embargo, en la APs la neoformación ósea es un hecho primordial, y por datos recientes conocemos que la inflamación también disminuye la formación ósea. Así, el TNFα es un potente supresor de la formación ósea; facilita la expresión de DKK1, molécula que regula negativamente la vía de señalización Wnt26, que a su vez influye en la osteoclastogénesis facilitando la expresión de OPG que bloquea la formación de osteoclastos27.
De este modo, la actuación sobre el balance de las proteínas Wnt y sus inhibidores se convierte en una potente estrategia para el control de la homeostasis ósea: una baja actividad Wnt va a producir una baja formación ósea y una elevada resorción, mientras que niveles elevados de Wnt producirán un aumento de la formación ósea y, simultáneamente, un bloqueo de la resorción, constituyendo este último un mecanismo que justificaría la formación de sindesmofitos y neoformación ósea en la APs, al unirse las proteínas Wnt a receptores de superficie de las células mesenquimales, permitiendo la señalización a través de la β-catenina, que activaría mecanismos involucrados en la formación ósea13.
Influencia de los factores de riesgo de osteoporosisLa pérdida ósea generalizada que puede aparecer en la APs, además de la que se puede justificar por el proceso inflamatorio mediado inmunológicamente, puede tener otras múltiples etiologías que actúan de forma aislada o conjuntamente, como los factores genéticos, los niveles hormonales principalmente estrogénicos, la disminución de la actividad física, la edad, el sexo y el uso de medicación, en especial los GC. Todos estos factores han sido mejor estudiados en la AR, y el más importante para la pérdida ósea generalizada fue la actividad inflamatoria de la enfermedad28, mientras que los datos al respecto en la APs son muy escasos. En un reciente estudio, Grazio et al.29 no observan asociación entre la DMO de pacientes con APs y la actividad de la enfermedad.
Influencia de los fármacos utilizados en la artritis psoriásicaLos GC utilizados en periodos de tiempo prolongados pueden producir OP y fracturas, y esta es probablemente la forma iatrogénica más frecuente de OP. Los GC actúan sobre los osteoblastos reduciendo su número y función; la producción de colágeno tipo1 por parte de los osteoblastos maduros se reduce, originando una disminución de la matriz ósea disponible para la mineralización30. El efecto sobre el osteoclasto consiste en aumentar la supervivencia de esta célula mediante la reducción de la apoptosis osteoclástica. En los 12 primeros meses de exposición a los GC la pérdida ósea es de alrededor del 6-12%, pero puede llegar hasta el 20-30% en el hueso trabecular31.
Además de los corticoides, se ha publicado que otros agentes habitualmente utilizados en el tratamiento de la APs, como el metotrexato, pueden tener un efecto perjudicial sobre el esqueleto, aunque en un estudio transversal multicéntrico realizado en mujeres posmenopáusicas con AR el modelo de regresión logística no evidenció asociación entre el uso de metotrexato y el riesgo de OP32.
El TNFα in vitro promueve la diferenciación de osteoclastos a través o con independencia del RANKL33, mientras que los efectos del TNF en la osteoclastogénesis en condiciones fisiológicas son menos claros, y en estudios en pacientes tratados con anti TNFα34 se ha observado un aumento de la DMO tanto en AR como en espondiloartritis.
La consecuencia que el uso de estos fármacos pueda tener en la DMO y en la frecuencia de OP en pacientes con APs se desconoce en la actualidad al no existir estudios específicos diseñados con este objetivo, aunque es lógico pensar que tengan un efecto sobre el hueso similar al que producen en otras patologías.
FrecuenciaLa OP y las fracturas asociadas representan una comorbilidad en determinadas enfermedades reumáticas que suele estar frecuentemente infravalorada. Así, existen datos que ponen de manifiesto que los pacientes con AR en tratamiento con corticoides orales no son evaluados de forma rutinaria con densitometría y que solo se incluyó un fármaco para reducir la pérdida de masa ósea, sin considerar el calcio y la vitaminaD, en el 42% de estos35.
Densidad mineral ósea y osteoporosis en la artritis psoriásicaCuando revisamos la literatura, existen pocos datos que demuestren la presencia de OP u osteopenia en la APs, y los escasos estudios realizados son contradictorios y de difícil valoración, ya que no existe homogeneidad entre ellos, con diferencias en cuanto a las técnicas y regiones utilizadas para determinar la DMO, escasa uniformidad de criterios diagnósticos para la enfermedad reumática y determinación en poblaciones diferentes, generalmente con escaso número de pacientes.
En la APs, los pacientes con afectación axial se han incluido en los estudios de pacientes con otras espondiloartritis axiales y no se han comunicado diferencias de la DMO con respecto a lo observado en estas.
Osteoporosis yuxtaarticular en la artritis psoriásicaCon respecto a la afectación articular periférica, se cree que la APs se asocia a una pérdida ósea yuxtaarticular menos grave que en la AR, como se ha publicado en estudios radiológicos de APs establecida36. No obstante Harrison et al.37, utilizando DXA para medir la DMO periarticular en pacientes con enfermedad de reciente comienzo, no encontraron diferencias en la pérdida ósea periarticular de la APs en comparación con la de la AR, ni tampoco encontraron asociación entre la inflamación y la pérdida ósea periarticular en la APs, a diferencia de lo observado en la AR.
Osteoporosis generalizada en la artritis psoriásicaEn cuanto a la OP generalizada, en estudios realizados con absorciometría fotónica simple Cooper et al.38 observaron una disminución de la DMO en el antebrazo distal en 20hombres y mujeres con APs. Por el contrario, Reid et al.39 no encontraron diferencias significativas en 12hombres y mujeres con APs al compararlos con sus controles.
Taccari et al.40, utilizando la exploración ósea con parámetros de ultrasonidos en la falange proximal de la mano en 55hombres con APs (39 con afectación periférica y 16 con APs axial) y tras compararlos con los de 16AR, 20EA y 55controles, refieren una disminución significativa de los parámetros de ultrasonidos en la AR y la APs.
Más recientemente, y utilizando la DXA como técnica de medición de la DMO, hay que centrarse en los siguientes estudios:
Nolla et al.41 usaron DXA para medir la DMO de 52pacientes con APs (14mujeres premenopáusicas, 19posmenopáusicas y 19hombres), sin encontrar diferencias significativas con el grupo control.
Cortet et al.42 valoraron por DXA y ultrasonidos en talón a 12hombres y 12mujeres, 6 de ellas menopáusicas, con APs periférica, sin encontrar una disminución significativa de la DMO en la APs en comparación con sus controles con la DXA, aunque sí observaron una disminución en los parámetros de ultrasonidos.
Grisar et al.43 estudiaron el metabolismo óseo en distintas espondiloartritis: 30pacientes con EA, 23 con APs, 10 artritis reactivas y 41controles, en los que halló un aumento de los marcadores óseos de resorción en la APs, EA y artritis reactiva. Con respecto a los marcadores óseos de formación los resultados fueron diferentes, con aumento de la fosfatasa alcalina ósea y OPG en la APs. La DMO se determinó por DXA a 19pacientes con APs y 17EA, con valores en rango normal según la OMS en todas las APs mientras, que en las EA se observaron casos de osteopenia.
Dheda et al.44 determinaron la DMO por DXA a 20pacientes con APs (13hombres y 7mujeres premenopáusicas), sin encontrar diferencias significativas al compararlas con 20controles.
Borman et al.45 evaluaron la DMO por DXA en columna lumbar y cadera total en 47pacientes (24mujeres todas premenopáusicas y 23hombres con psoriasis, de los que 18 tenían APs con afectación periférica), sin encontrar diferencias en la DMO de los pacientes con y sin artritis, al igual que tampoco observaron diferencias en los marcadores óseos estudiados.
Frediani et al.46 estudiaron 186pacientes con APs periférica divididos en 3subgrupos (mujeres premenopáusicas, menopáusicas y hombres) y en 100controles sanos. La DMO se analizó por DXA en columna lumbar, cadera y cuerpo total y por ultrasonidos en talón; los pacientes con APs tuvieron valores de DMO significativamente inferiores a los de los sujetos sanos en los 3subgrupos en que se dividieron, tanto en g/cm2 como en valores de T-score y Z-score. Observaron el 47% de OP en mujeres posmenopáusicas, el 11% en premenopáusicas y el 29% en los hombres, de los pacientes con APs.
Hofbauer et al.47 analizaron 116pacientes con APs periférica (57mujeres [el 61% posmenopáusicas] y 59 hombres); ninguno de los pacientes había sido tratado con corticoides o FAME en los últimos 12meses, ni tampoco había casos de tratamiento prolongado con corticoides (más de 6meses). Observaron un solo caso de OP en las mujeres (1,75%) y en 6hombres (10,2%). Además se determinó en este estudio una citoquina pro-apoptótica (TRAIL), aumentada en la APs, que no se relacionaba con la DMO ni con los marcadores del metabolismo óseo en estos pacientes.
Attia et al.48, en un estudio más reciente, evalúan 50pacientes egipcios con psoriasis, de los cuales 16 tenían APs (10hombres y 6mujeres), y 20sujetos sanos como controles. En el grupo de APs encontraron OP en el 12,5 y el 37,5% en columna lumbar y cuello femoral, respectivamente, y osteopenia en el 50 y el 25%, con valores de T-score y Z-score significativamente más bajos en comparación con los controles. La OPG estaba aumentada en los pacientes con psoriasis tanto con o sin artritis.
Pedreira et al.49 estudian 195mujeres posmenopáusicas (45APs, 52psoriasis y 98controles sanos) en las que no observaron diferencias significativas en la DMO medida por DXA en columna lumbar, cadera total y cuerpo total entre las pacientes con psoriasis, con o sin artritis, y entre estos grupos y los controles.
Grazio et al.29, al estudiar 69pacientes con APs establecida, comunican un 7,2% de OP en columna lumbar y un 2,9% en cuello femoral, por DXA, sin encontrar un aumento de la prevalencia de OP ni tampoco una asociación entre la DMO y los signos de actividad de la APs.
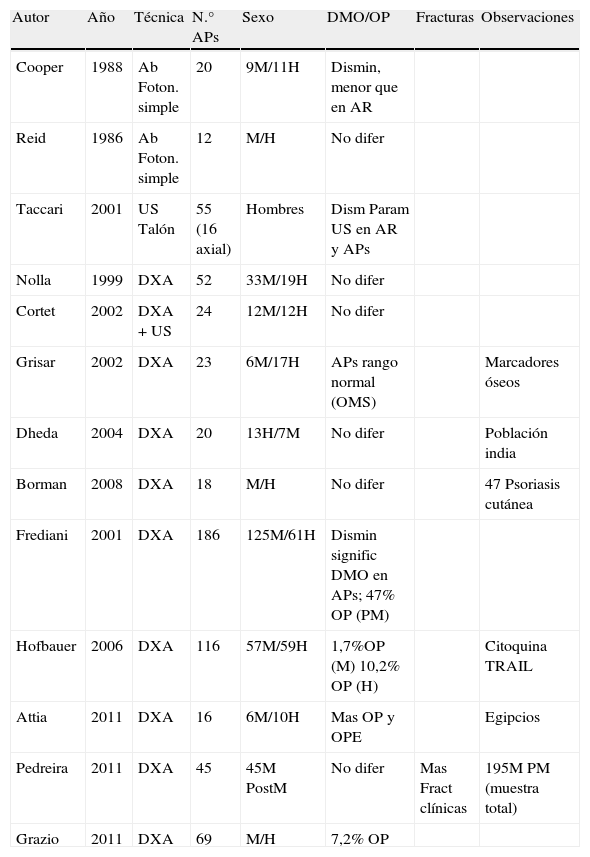
En la tabla 1 se expresan las características principales de estos estudios. En ellos observamos que los realizados con DXA para medir la DMO, en casi la totalidad no se encuentran diferencias significativas de la DMO en la APs con respecto a los controles, ni más prevalencia de OP. La muestra es mayor de 50pacientes en solo 3estudios.
Estudios que valoran la densidad mineral ósea y la osteoporosis en la artritis psoriásica
| Autor | Año | Técnica | N.° APs | Sexo | DMO/OP | Fracturas | Observaciones |
| Cooper | 1988 | Ab Foton. simple | 20 | 9M/11H | Dismin, menor que en AR | ||
| Reid | 1986 | Ab Foton. simple | 12 | M/H | No difer | ||
| Taccari | 2001 | US Talón | 55 (16 axial) | Hombres | Dism Param US en AR y APs | ||
| Nolla | 1999 | DXA | 52 | 33M/19H | No difer | ||
| Cortet | 2002 | DXA + US | 24 | 12M/12H | No difer | ||
| Grisar | 2002 | DXA | 23 | 6M/17H | APs rango normal (OMS) | Marcadores óseos | |
| Dheda | 2004 | DXA | 20 | 13H/7M | No difer | Población india | |
| Borman | 2008 | DXA | 18 | M/H | No difer | 47 Psoriasis cutánea | |
| Frediani | 2001 | DXA | 186 | 125M/61H | Dismin signific DMO en APs; 47% OP (PM) | ||
| Hofbauer | 2006 | DXA | 116 | 57M/59H | 1,7%OP (M) 10,2% OP (H) | Citoquina TRAIL | |
| Attia | 2011 | DXA | 16 | 6M/10H | Mas OP y OPE | Egipcios | |
| Pedreira | 2011 | DXA | 45 | 45M PostM | No difer | Mas Fract clínicas | 195M PM (muestra total) |
| Grazio | 2011 | DXA | 69 | M/H | 7,2% OP |
APs: artritis psoriásica; AR: artritis reumatoide; DMO: densidad mineral ósea; H: hombres; M: mujeres; OP: osteoporosis; OPE: osteopenia; PM: posmenopáusicas; US: ultrasonidos.
De los que han utilizado la DXA para la determinación de la DMO, solo Frediani et al.46 y Attia et al.48 refieren más OP en los pacientes con APs que en los controles. Attia estudió una población étnica distinta a la de nuestro medio: pacientes egipcios con psoriasis cutánea de los que solamente 16 tenían criterios de APs; una muestra de reducido tamaño, que constituye la principal limitación de este trabajo.
Frediani et al.46, en una muestra relevante de pacientes (186APs y 100controles sanos) sí encuentra mayor frecuencia de OP en la APs con valores de DMO y de T-score y Z-score significativamente más bajos que en los controles.
Así pues, el problema de la OP en la APs, a pesar de no haber sido estudiado tan ampliamente como en otras enfermedades reumáticas, sí parece que pueda ser de menor importancia que en la AR, la EA o el lupus, donde existe más coincidencia en señalar una disminución de la DMO y más frecuencia de OP en la mayoría de los estudios realizados50-54.
En la reciente tesis doctoral del autor de esta revisión55 se analizan los valores densitométricos, por DXA, de 91pacientes con APs y 91controles (31mujeres menopaúsicas, 15premenopáusicas y 45hombres en cada grupo) pareados por edad, sin observar diferencias significativas entre los valores de DMO, T-score y Z-score de la APs y el grupo control. Observamos OP en el 16,1% de las mujeres posmenopáusicas, en el 0% de las premenopáusicas y en el 2,2% de los hombres con APs, sin diferencias significativas con los controles.
Manifestaciones clínicasLa fractura es la expresión del fracaso del hueso para resistir la rotura del mismo cuando existe una sobrecarga, normalmente traumática. La fractura osteoporótica o fractura por fragilidad es la que ocurre de forma espontánea o desencadenada por un traumatismo de bajo impacto, entre los que también se incluye una caída desde la posición de bipedestación o inferior, y constituye la manifestación clínica más relevante de la OP.
Cada año se producen en Estados Unidos un millón y medio de fracturas por fragilidad, de las cuales 700.000 son vertebrales, 300.000 fracturas de cadera, 250.000 de antebrazo y 250.000 en otras localizaciones esqueléticas. En España, según el estudio Acta de Fractura Osteoporótica en España (AFOE), se produjeron unas 60.000 fracturas de cadera en el año 2002, con pérdida de la capacidad para caminar y para realizar las actividades de la vida cotidiana en el 60-75% de ellas durante el primer año después de la fractura.
Las fracturas en relación con una DMO baja ocurren en edades avanzadas de la vida; el riesgo de por vida de este tipo de fracturas se sitúa por encima del 40% en la mujer56-58 y constituye en la actualidad un importante problema de salud pública en las sociedades desarrolladas, que previsiblemente, dado el aumento de perspectiva de vida, cada vez va a adquirir más relevancia.
Fracturas vertebralesLas vértebras son la localización más frecuente de estas fracturas osteoporóticas. Aparecen en alrededor de una de cada 5mujeres mayor de 50años, en una de cada 3 de 65años o más, y casi en la mitad de las que sobrepasan los 85años59. Las consecuencias más llamativas de las fracturas vertebrales son la disminución de la talla y las deformidades de la columna vertebral. El dolor es el síntoma clínico más frecuente, aunque puede ser muy variable, desde las que cursan con un dolor intenso, en reposo, nocturno en ocasiones, con dificultad para la respiración y limitación funcional importante que dificulta la movilización y la vida normal de los pacientes, hasta las que son asintomáticas, que no son diagnosticadas a menos que se realice un estudio radiográfico. Se considera que existe una fractura vertebral «morfométrica»60 cuando se produce una pérdida superior al 20% en la altura que existe en el pilar anterior, medio o posterior del cuerpo vertebral en una radiografía de perfil, o una reducción global de más del 20% en la altura de una vértebra en comparación con la adyacente.
Todas las fracturas osteoporóticas se asocian con una morbilidad significativa, pero las fracturas vertebrales y de cadera también se asocian con una mayor mortalidad61.
Fracturas no vertebralesLas fracturas no vertebrales suelen ser consecuencia de un traumatismo o caída y son de fácil diagnóstico clínico, por la presencia de dolor agudo y signos clínicos característicos de fractura, como inflamación, hematoma, deformidad o crepitación local. Casi la totalidad de ellas son confirmadas radiográficamente.
El riesgo de por vida de padecer una fractura proximal de fémur es de alrededor del 16% en la mujer blanca56. A partir de los 50años la incidencia de tales fracturas aumenta de forma exponencial. La fractura de cadera supone la mayor carga clínica, social y económica de todas las fracturas osteoporóticas, con una mortalidad del 20% en el primer año62 y una discapacidad elevada, con el 50% de pacientes que no podrán caminar sin algún tipo de ayuda al cabo de un año63, y estos datos hacen que su prevención en pacientes con mayor riesgo de padecerlas sea una meta obligada en la medicina actual.
La fractura de antebrazo distal es la tercera que hay que considerar por su importancia y frecuencia, en relación con una disminución de la DMO, con una incidencia por 1.000personas/año de 7,3 en la mujer y de 1,7 en el hombre, según el estudio European Prospective Osteoporosis Study (EPOS)64. Las tres cuartas partes de estas fracturas alcanzan su máxima incidencia en la posmenopausia en la mujer y se estabilizan a partir de los 55años65. No se ha encontrado un aumento de la mortalidad en este tipo de fracturas.
Factores de riesgo de fracturaEl antecedente de una fractura previa aumenta el riesgo de aparición de una nueva fractura en cualquier localización del esqueleto. Este hecho ha sido estudiado sobre todo en la fractura vertebral, en que el padecer una de estas aumenta 5veces el riesgo de nuevas fracturas vertebrales66 y 2veces el riesgo de una fractura de cadera67.
Las propiedades que contribuyen a la resistencia del hueso incluyen la DMO, la geometría del hueso (tamaño y forma del mismo), el grado de mineralización, la «microarquitectura» y el remodelado óseo68. La disminución de la DMO constituye en la actualidad el factor de riesgo mejor conocido y de más importancia en relación con la aparición de fractura, como han demostrado múltiples estudios69-72, aunque se han determinado otros factores independientes de la DMO que influyen en el riesgo de fractura, como son: edad avanzada, fractura previa, caídas, corticoterapia, peso bajo, historia familiar de fractura de cadera o consumo de tabaco y/o alcohol73, que se exponen en la tabla 2.
Factores de riesgo clínico de fractura
| • Edad avanzada |
| • Fractura previa |
| • Corticoterapia |
| • Historia familiar de fractura de cadera |
| • Bajo peso (delgadez) |
| • Caídas |
| • Consumo actual de tabaco |
| • Consumo excesivo de alcohol |
| • Artritis reumatoide |
| • Osteoporosis secundaria (como hipogonadismo o menopausia prematura, malabsorción, enfermedad crónica hepática, enfermedad inflamatoria intestinal) |
La valoración de todos ellos junto con la DMO va a establecer la mejor estimación del riesgo y va a constituir un aspecto de gran importancia en la actitud que deberíamos tomar en el paciente con APs, con respecto a la prevención y el tratamiento de la OP y de fracturas por fragilidad. En este sentido, la OMS desarrolló en el año 2008 una herramienta de valoración del riesgo de fractura, el FRAX, que estima la probabilidad de padecer en los próximos 10años una fractura de cadera o una fractura osteoporótica mayor (cadera, vertebral, húmero proximal o antebrazo) en un paciente no tratado, entre los 40 y los 90años de edad, utilizando la DMO en cuello femoral y los factores clínicos de riesgo de fractura mencionados con anterioridad.
Fractura y artritis psoriásicaLa fractura osteoporótica no ha sido estudiada específicamente en pacientes con APs, como sí se ha hecho en sujetos con AR o EA, quizás porque la OP en la APs se haya considerado un problema menor y menos frecuente que en las otras enfermedades reumáticas inflamatorias. Al revisar la literatura, al margen de algún caso anecdótico de fractura de estrés en la pelvis de un paciente con APs74, solamente Pedreira et al.49 hacen referencia a que las fracturas vertebrales y no vertebrales son más prevalentes en las mujeres con APs que en el grupo control. En su estudio, la duración de la enfermedad y las caídas recurrentes fueron los factores predictores de fracturas por fragilidad en la APs.
En nuestro estudio55, en el que también recogimos las fracturas por fragilidad clínicas, los pacientes con APs tuvieron una diferencia significativa, con más fracturas por fragilidad acumuladas que los del grupo control, con 18fracturas en 13pacientes en las APs, con una prevalencia del 14,3%, versus 4fracturas en 4controles, con una prevalencia del 4,3%. En el análisis multivariante, el número de fracturas en las APs se asoció con la VSG, con ser mujer posmenopáusica y negativamente con el índice DAS28, sin poderse establecer una asociación de la actividad de la APs con el número de fracturas por fragilidad.
Estos resultados podrían evidenciar una mayor fragilidad ósea en estos pacientes como causa del mayor número de fracturas, a pesar de no haber encontrado diferencias significativas en la DMO. Esta circunstancia se explicaría por alteraciones de la microarquitectura u otros factores de los que depende la calidad ósea, como el recambio óseo, las microlesiones o la mineralización, y que podrían justificar otros factores de riesgo de fractura en esta población de APs, en relación con aspectos patogénicos, clínicos o terapéuticos de la APs, que deberían ser estudiados con mayor profundidad.
Densitometría en la artritis psoriásicaEl diagnóstico de la OP puede realizarse por radiografías en las que existan signos claros de desmineralización ósea o fracturas compresivas de los cuerpos vertebrales. Sin embargo, ya que la pérdida ósea debe estar entre el 20 y el 50% para detectar evidencia de osteopenia en las radiografías, las técnicas radiológicas convencionales son insensibles para el diagnóstico de pérdida ósea y OP.
Por otro lado, la disminución de la masa ósea es actualmente fácil de determinar desde la introducción de la densitometría ósea en la práctica clínica, que permite cuantificar la DMO de una manera simple y sin riesgo. La densitometría por DXA es en la actualidad la técnica de referencia para el diagnóstico de OP. Mide la DMO en g/cm2, y la desviación de esta expresada en desviaciones estándar (DE) se puede definir relacionándola con la población de la misma edad y sexo (Z-score) o con el pico de máxima masa ósea en la población joven (T-score). La OMS establece para el diagnóstico de OP una DMO igual o inferior a –2,5DE de T-score en mujeres posmenopáusicas, y estos puntos de corte establecidos por la OMS también se han propuesto para varones adultos75.
La densitometría es una técnica inocua, y el único inconveniente para realizarla de forma generalizada sería que la relación coste/efectividad no fuese favorable. Por ello, en los últimos años se ha realizado un esfuerzo notable para precisar las indicaciones de la densitometría en las poblaciones en que exista un mayor riesgo de fractura y se considere conveniente realizar una intervención para su prevención.
En pacientes con APs no existen recomendaciones específicas para realizar densitometría ósea, y a tenor de los resultados observados en los distintos estudios realizados en APs en los que se valoran la DMO y la OP, tampoco se puede recomendar realizar densitometría en todos ellos, sino que habrá que considerar otros factores de riesgo de disminución de la DMO y fracturas. Entre todos ellos estimamos que la toma de GC por periodos de más de 6meses, aunque sea a dosis bajas, la edad de más de 65años, una menopausia precoz y el antecedente de una fractura previa son los más relevantes para indicar una densitometría ósea en pacientes con APs y obtener la mejor rentabilidad de la misma para tomar decisiones con respecto a la prevención y el tratamiento, adoptando un nivel de intervención a ser posible antes de que aparezca la fractura.
TratamientoEl objetivo fundamental del tratamiento de la OP es la disminución del riesgo de fractura. La estrategia terapéutica comprenderá medidas farmacológicas encaminadas fundamentalmente a incrementar la resistencia ósea y las medidas no farmacológicas con el objetivo de mantener en lo posible un buen estado de salud y preservar la capacidad de respuesta a las caídas y minimizar sus consecuencias.
En los pacientes con APs no existe un criterio uniforme para el tratamiento de la OP, debido principalmente a que esta enfermedad reumática no puede considerarse como un factor de riesgo de OP ni fracturas por fragilidad, a la luz de los resultados de los estudios publicados, a diferencia de lo que ocurre en la AR. No obstante, la APs cursa con inflamación articular inmunológica, y es lógico pensar que las consecuencias de estos procesos que pueden afectar al metabolismo óseo nos obliguen a considerar la existencia de esta enfermedad en el tratamiento de la OP.
Por ello, creemos que deberíamos iniciar tratamiento en aquellos pacientes con APs que presenten uno de los siguientes factores de riesgo:
- •
DMO inferior a –2,5DE de T-score.
- •
Antecedente de fracturas por fragilidad.
- •
Tratamiento prolongado (más de 6 meses) con GC.
- •
Pérdida acelerada de masa ósea, en controles densitométricos.
En los casos de APs en mujeres posmenopáusicas, además de tener en cuenta las indicaciones anteriores deberíamos valorar el tratamiento farmacológico si existe osteopenia según la DXA y 2 factores de riesgo de fractura coincidentes.
En el hombre la OP secundaria es más frecuente76, por lo que se aconseja realizar estudios básicos para descartar enfermedades que puedan cursar con OP. En nuestro medio la causa más frecuente es el hipogonadismo77, seguido de la corticoterapia crónica y el enolismo. Recomendaríamos las mismas indicaciones de tratamiento, considerando que en España solo el risedronato, el alendronato y la teriparatida tienen indicación para la OP del varón.
En la mujer premenopáusica los criterios de diagnóstico según la DXA son diferentes y se recomienda utilizar la Z-score, que en el caso de ser inferior a –2,0DE se considera como una masa ósea baja. En estas mujeres con APs, una vez descartadas causas de OP secundaria y con una DMO baja, no tendríamos una clara indicación de intervención farmacológica, aunque sería aconsejable realizar un seguimiento de estas pacientes. El tratamiento con fármacos para la OP debería considerarse en aquellos casos con fracturas por fragilidad o que presenten factores de riesgo asociados, principalmente el tratamiento con GC o hipogonadismo.
Medidas no farmacológicasEl perfil de los pacientes con OP en España que acuden a las consultas de reumatología se caracteriza por una baja ingesta de calcio, antecedentes familiares de fracturas, historias previas de fracturas, concentración de calcitriol insuficiente, principalmente en las mujeres mayores de 70años, y una elevada incidencia de dolor de espalda78. Las medidas generales se deben recomendar a toda la población con riesgo, incluidos los pacientes con APs: práctica de ejercicio físico, eliminación de los hábitos tóxicos como alcohol y tabaco, dieta equilibrada, aporte adecuado de calcio y vitaminaD, y prevención de caídas.
Fármacos recomendadosLa intervención farmacológica se realiza con agentes terapéuticos capaces de actuar en las 2fases del remodelado óseo. En el momento actual existen 3categorías de fármacos antiosteoporóticos:
- 1.
Antirresortivos o anticatabólicos, que inhiben la resorción ósea actuando sobre los osteoclastos o sus precursores, disminuyen la tasa de activación del remodelado óseo, incrementan la DMO y preservan la microarquitectura del hueso. En este grupo se incluyen: tratamiento hormonal sustitutivo, calcitonina, raloxifeno, bazedoxifeno, bifosfonatos (etidronato, alendronato, risedronato, ibandronato, zoledronato) y denosumab. Todos ellos han demostrado su eficacia en la prevención de fracturas vertebrales, y hay evidencias en la prevención de fractura de cadera en todos los bifosfonatos (excepto el etidronato y el ibandronato) y el denosumab. Se han comunicado una serie de eventos adversos, potencialmente relacionadas con los bifosfonatos, que pueden ser graves, entre ellos casos de osteonecrosis de los maxilares y fracturas atípicas de fémur.
- 2.
Anabólicos, que al actuar sobre los osteoblastos o sus precursores producen un aumento del remodelado óseo, con un incremento de la formación de hueso en mayor medida que la resorción, lo que aumenta la masa y la resistencia del hueso. Entre los anabólicos están los análogos de parathormona (PTH), que tienen efectos osteoformadores, pueden prolongar la vida de los osteoblastos, tanto si se administran completos o solo la fracción aminoterminal. Existen comercializadas 2moléculas: la teriparatida y la PTH1-84, ambas de administración subcutánea.
- 3.
Fármacos de acción mixta. El ranelato de estroncio reduce el riesgo de fracturas vertebrales y no vertebrales y las fracturas de cadera en un subgrupo de alto riesgo (>70años y DXA de cuello femoral T≤3DE). Produce un aumento de la formación y una disminución de la resorción ósea, de forma moderada, que se traduce en un incremento real de la masa ósea y de la resistencia ósea.
La OP en la APs representa un problema cuya importancia y magnitud no están bien establecidas, y factores como la actividad inflamatoria, la disminución de la actividad física, la discapacidad y los tratamientos realizados en esta enfermedad pueden predisponer a que estos pacientes tengan un mayor riesgo de OP y fracturas que la población general.
Es conveniente identificar a los pacientes con un riesgo elevado de fractura por fragilidad y descartar OP secundaria, sobre todo en mujeres premenopáusicas y hombres, antes de instaurar un tratamiento.
La APs es una patología frecuente en nuestra práctica clínica, por lo que serían convenientes estudios con mayor número de pacientes y diseñados específicamente para valorar esta comorbilidad, que aporten al clínico evidencias útiles en la prevención y el tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.